9.2.2反应条件的控制课件(共22张ppt)2023-2024学年高一化学(苏教版2019必修第二册)
文档属性
| 名称 | 9.2.2反应条件的控制课件(共22张ppt)2023-2024学年高一化学(苏教版2019必修第二册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 28.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-15 16:27:15 | ||
图片预览







文档简介
(共22张PPT)
第二节 探究铁及其化合物的转化
课时2 反应条件的控制
专题九 金属与人类文明
授课人:
1.了解Fe(OH)2、Fe(OH)3的制备原理及化学性质。
2.通过对氢氧化亚铁制取的实验现象的分析、推理,体会控制实验条
件对完成科学实验及探究活动的作用。
3.学习认识元素及其化合物性质的视角及一般方法,能预测物质的性
质和设计物质间转化的途径。
4.能运用变量控制方法设计实验方案。
学习目标
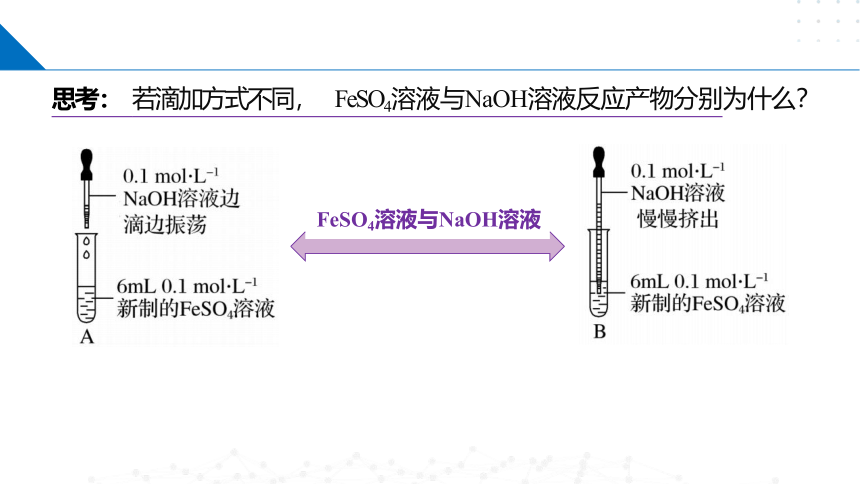
思考: 若滴加方式不同, FeSO4溶液与NaOH溶液反应产物分别为什么?
FeSO4溶液与NaOH溶液
一、探究铁的氢氧化物的制备
一、探究铁的氢氧化物的制备
实验 现象 有灰绿色和红褐色沉
淀生成,最终沉淀全 部变成红褐色。
先有白色沉淀生成,在空
气中迅速变成灰绿色,最 后变成红褐色。
一、探究铁的氢氧化物的制备
2、白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色)
一、探究铁的氢氧化物的制备
1、生成白色沉淀 Fe2++2OH===Fe(OH)2 ↓(白色)
思考: 实验B中的相关离子方程式为哪些?
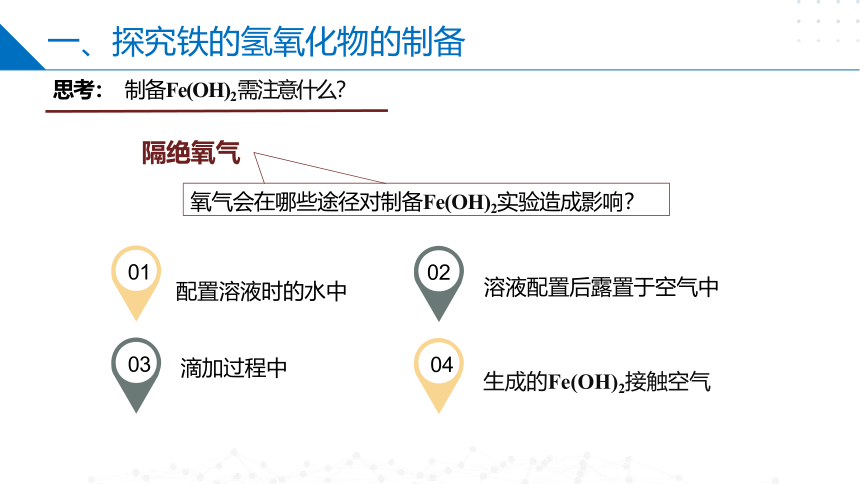
一、探究铁的氢氧化物的制备
配置溶液时的水中
滴加过程中
氧气会在哪些途径对制备Fe(OH)2实验造成影响?
思考: 制备Fe(OH)2需注意什么?
生成的Fe(OH)2接触空气
溶液配置后露置于空气中
02
04
01
03
隔绝氧气
Fe2+极易被氧化,所以FeSO4溶液要现用现配。
为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH 溶液要煮沸,尽可能除去O2。
4
为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中 加入少量的煤油或其他密度小于水而不溶于水的有机物, 以隔绝空气。
3
为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶 液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
一、探究铁的氢氧化物的制备
思考: 制备Fe(OH)2可以采取哪些措施?
1
2
一、探究铁的氢氧化物的制备
制备氢氧化亚铁的改进装置
化学反应都是在一定条件下发生的。反应条件对化学反应的方向、
速率和限度都会有不同程度的影响。在研究物质的性质和制备时, 应依据化学反应的规律和反应物、生成物的特点,合理选择并控 制好反应条件,才能达到预期的结果。
实验结论:
在不同的反应条件下, FeSO4溶液与
NaOH溶液反应的实验现象不同,得到的
产物也不同。
一、探究铁的氢氧化物的制备
例1.实验室用FeCl2和烧碱制备Fe(OH)2 ,为了使生成的产物不容易被
氧化,下列说法不正确的是( C )A.配制FeCl2和烧碱溶液所用的蒸 馏水通常要煮沸B.可在FeCl2溶液的上面加一层苯,以隔绝空气C.向
FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内D.产生
Fe( OH)2沉淀后,不能振荡试管
典例解析
Fe(OH)2
Fe(OH)3
颜色 白色 固体
红褐色 固体
溶解性 难溶于水
难溶于水
稳定性 在空气中不稳定,易被氧化: 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
不稳定,受热易分 解: 2Fe(OH)3 Fe2O3+3H2O
二、铁的氢氧化物的性质
Fe(OH)2
Fe(OH)3
盐酸 Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3+
+3H2O
稀硝酸 3Fe(OH)2+10H++NO3-=Fe3+ +8H2O+NO↑
Fe(OH)3+3H+=Fe3+
+3H2O
二、铁的氢氧化物的性质
二、铁的氢氧化物的性质
铁及其化合物之间的相互转化
人体膳食结构中的铁元素
血红素铁是与血红蛋 白、肌红蛋白中的卟 啉结合的二价铁。
血红素铁容易被人 体吸收利用。
非血红素铁则主要 以三价铁形式存在 于植物中。
非血红素铁则需要 将三价铁还原为二 价铁才能被吸收。
二、铁的氢氧化物的性质
生活向导 铁元素与人体健康
非血红素铁
血红素铁
生活向导 铁元素与人体健康
维生素C具有还原性,能将三价铁转化为二价铁。因此,营养学家建议进食含铁的
植物食品时,补充一定量的维生素C,以促进铁的吸收。
为了预防缺铁性贫血,人们应合理进食含铁食物,如动物血、肝脏、骨髓、蛋黄、
红枣、大豆、芝麻等。
二、铁的氢氧化物的性质
典例解析
例2.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2 在空气中被氧化时的颜色变化。
实验提供的试剂:铁屑、 6 mol·L- 1硫酸溶液、 NaOH溶液。下列说法错误的是(B)
A.B中盛有一定量的NaOH溶液, A中应预先加入的试剂是
铁屑B.实验开始时应先将活塞E关闭C.生成Fe(OH)2的操作 为关闭E,使A中溶液压入B瓶中D.取下装置B中的橡皮塞, 使空气进入,沉淀的颜色变化为由白色迅速变成灰绿色, 最终变成红褐色
探究铁的氢氧化物的制备 Fe(OH)2制备 反应条件的控制
铁的氢氧化物的性质
Fe(OH)2性质
Fe(OH)3制备
课堂小结
随堂练习
1.下列有关铁的化合物的说法中,错误的是( A )
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化,转
变为红褐色B.如图所示操作可制取Fe(OH)2
C.Fe3O4 、Fe(OH)3都可以由化合反应制得D.Fe(OH)3胶
体呈红褐色、透明,能发生丁达尔效应
随堂练习
2、纳米级四氧化三铁是应用最为广泛的软磁性材料之一、共沉淀法是
目前制备纳米四氧化三铁的重要方法,其流程如图所示:
FeSO4·7H2O和FeCl3·6H2O的物质的量之比最好应为2∶1C .取滤液进行焰
色反应,火焰为黄色D .其制备反应类型不属于氧化还原反应
)A .保存溶液A时,应加入少量铁粉B .
下列说法错误的是(
B
谢谢观看
T H A N K S
第二节 探究铁及其化合物的转化
课时2 反应条件的控制
专题九 金属与人类文明
授课人:
1.了解Fe(OH)2、Fe(OH)3的制备原理及化学性质。
2.通过对氢氧化亚铁制取的实验现象的分析、推理,体会控制实验条
件对完成科学实验及探究活动的作用。
3.学习认识元素及其化合物性质的视角及一般方法,能预测物质的性
质和设计物质间转化的途径。
4.能运用变量控制方法设计实验方案。
学习目标
思考: 若滴加方式不同, FeSO4溶液与NaOH溶液反应产物分别为什么?
FeSO4溶液与NaOH溶液
一、探究铁的氢氧化物的制备
一、探究铁的氢氧化物的制备
实验 现象 有灰绿色和红褐色沉
淀生成,最终沉淀全 部变成红褐色。
先有白色沉淀生成,在空
气中迅速变成灰绿色,最 后变成红褐色。
一、探究铁的氢氧化物的制备
2、白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色)
一、探究铁的氢氧化物的制备
1、生成白色沉淀 Fe2++2OH===Fe(OH)2 ↓(白色)
思考: 实验B中的相关离子方程式为哪些?
一、探究铁的氢氧化物的制备
配置溶液时的水中
滴加过程中
氧气会在哪些途径对制备Fe(OH)2实验造成影响?
思考: 制备Fe(OH)2需注意什么?
生成的Fe(OH)2接触空气
溶液配置后露置于空气中
02
04
01
03
隔绝氧气
Fe2+极易被氧化,所以FeSO4溶液要现用现配。
为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH 溶液要煮沸,尽可能除去O2。
4
为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中 加入少量的煤油或其他密度小于水而不溶于水的有机物, 以隔绝空气。
3
为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶 液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
一、探究铁的氢氧化物的制备
思考: 制备Fe(OH)2可以采取哪些措施?
1
2
一、探究铁的氢氧化物的制备
制备氢氧化亚铁的改进装置
化学反应都是在一定条件下发生的。反应条件对化学反应的方向、
速率和限度都会有不同程度的影响。在研究物质的性质和制备时, 应依据化学反应的规律和反应物、生成物的特点,合理选择并控 制好反应条件,才能达到预期的结果。
实验结论:
在不同的反应条件下, FeSO4溶液与
NaOH溶液反应的实验现象不同,得到的
产物也不同。
一、探究铁的氢氧化物的制备
例1.实验室用FeCl2和烧碱制备Fe(OH)2 ,为了使生成的产物不容易被
氧化,下列说法不正确的是( C )A.配制FeCl2和烧碱溶液所用的蒸 馏水通常要煮沸B.可在FeCl2溶液的上面加一层苯,以隔绝空气C.向
FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内D.产生
Fe( OH)2沉淀后,不能振荡试管
典例解析
Fe(OH)2
Fe(OH)3
颜色 白色 固体
红褐色 固体
溶解性 难溶于水
难溶于水
稳定性 在空气中不稳定,易被氧化: 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
不稳定,受热易分 解: 2Fe(OH)3 Fe2O3+3H2O
二、铁的氢氧化物的性质
Fe(OH)2
Fe(OH)3
盐酸 Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3+
+3H2O
稀硝酸 3Fe(OH)2+10H++NO3-=Fe3+ +8H2O+NO↑
Fe(OH)3+3H+=Fe3+
+3H2O
二、铁的氢氧化物的性质
二、铁的氢氧化物的性质
铁及其化合物之间的相互转化
人体膳食结构中的铁元素
血红素铁是与血红蛋 白、肌红蛋白中的卟 啉结合的二价铁。
血红素铁容易被人 体吸收利用。
非血红素铁则主要 以三价铁形式存在 于植物中。
非血红素铁则需要 将三价铁还原为二 价铁才能被吸收。
二、铁的氢氧化物的性质
生活向导 铁元素与人体健康
非血红素铁
血红素铁
生活向导 铁元素与人体健康
维生素C具有还原性,能将三价铁转化为二价铁。因此,营养学家建议进食含铁的
植物食品时,补充一定量的维生素C,以促进铁的吸收。
为了预防缺铁性贫血,人们应合理进食含铁食物,如动物血、肝脏、骨髓、蛋黄、
红枣、大豆、芝麻等。
二、铁的氢氧化物的性质
典例解析
例2.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2 在空气中被氧化时的颜色变化。
实验提供的试剂:铁屑、 6 mol·L- 1硫酸溶液、 NaOH溶液。下列说法错误的是(B)
A.B中盛有一定量的NaOH溶液, A中应预先加入的试剂是
铁屑B.实验开始时应先将活塞E关闭C.生成Fe(OH)2的操作 为关闭E,使A中溶液压入B瓶中D.取下装置B中的橡皮塞, 使空气进入,沉淀的颜色变化为由白色迅速变成灰绿色, 最终变成红褐色
探究铁的氢氧化物的制备 Fe(OH)2制备 反应条件的控制
铁的氢氧化物的性质
Fe(OH)2性质
Fe(OH)3制备
课堂小结
随堂练习
1.下列有关铁的化合物的说法中,错误的是( A )
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化,转
变为红褐色B.如图所示操作可制取Fe(OH)2
C.Fe3O4 、Fe(OH)3都可以由化合反应制得D.Fe(OH)3胶
体呈红褐色、透明,能发生丁达尔效应
随堂练习
2、纳米级四氧化三铁是应用最为广泛的软磁性材料之一、共沉淀法是
目前制备纳米四氧化三铁的重要方法,其流程如图所示:
FeSO4·7H2O和FeCl3·6H2O的物质的量之比最好应为2∶1C .取滤液进行焰
色反应,火焰为黄色D .其制备反应类型不属于氧化还原反应
)A .保存溶液A时,应加入少量铁粉B .
下列说法错误的是(
B
谢谢观看
T H A N K S
