7.4结晶现象达标同步练(含解析) 科粤版(2019)化学九年级下册
文档属性
| 名称 | 7.4结晶现象达标同步练(含解析) 科粤版(2019)化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 620.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-16 09:39:24 | ||
图片预览

文档简介
7.4结晶现象
学校:___________姓名:___________班级:___________考号:___________
1. 定义:结晶是指由气态、液态或固态的非晶体物质转变为晶态的过程。当溶质从溶液中析出时,如果它在固态时具有规则的几何外形,则称该过程为结晶。
2. 晶体特性:晶体通常都有规则的形状,不同的晶体具有不同的形状。
3. 结晶方法:
* 冷却结晶法(又称冷却热饱和溶液法或降温结晶法):这种方法适用于溶解度受温度变化影响相当大的固态溶质。通过降低溶液的温度,可以使溶质结晶析出。例如,将硝酸钾饱和溶液降温,可以析出硝酸钾晶体。利用这一方法,还可以分离几种可溶性固态物质的混合物。
* 蒸发溶剂结晶法(简称蒸发结晶法):这种方法适用于溶解度受温度变化影响不大的固态溶质。通过恒温蒸发使溶剂的量减少,从而得到晶体。例如,从海水中提取食盐,就是把海水引到盐滩上,利用日光和风力使水分蒸发,得到食盐。
一、选择题
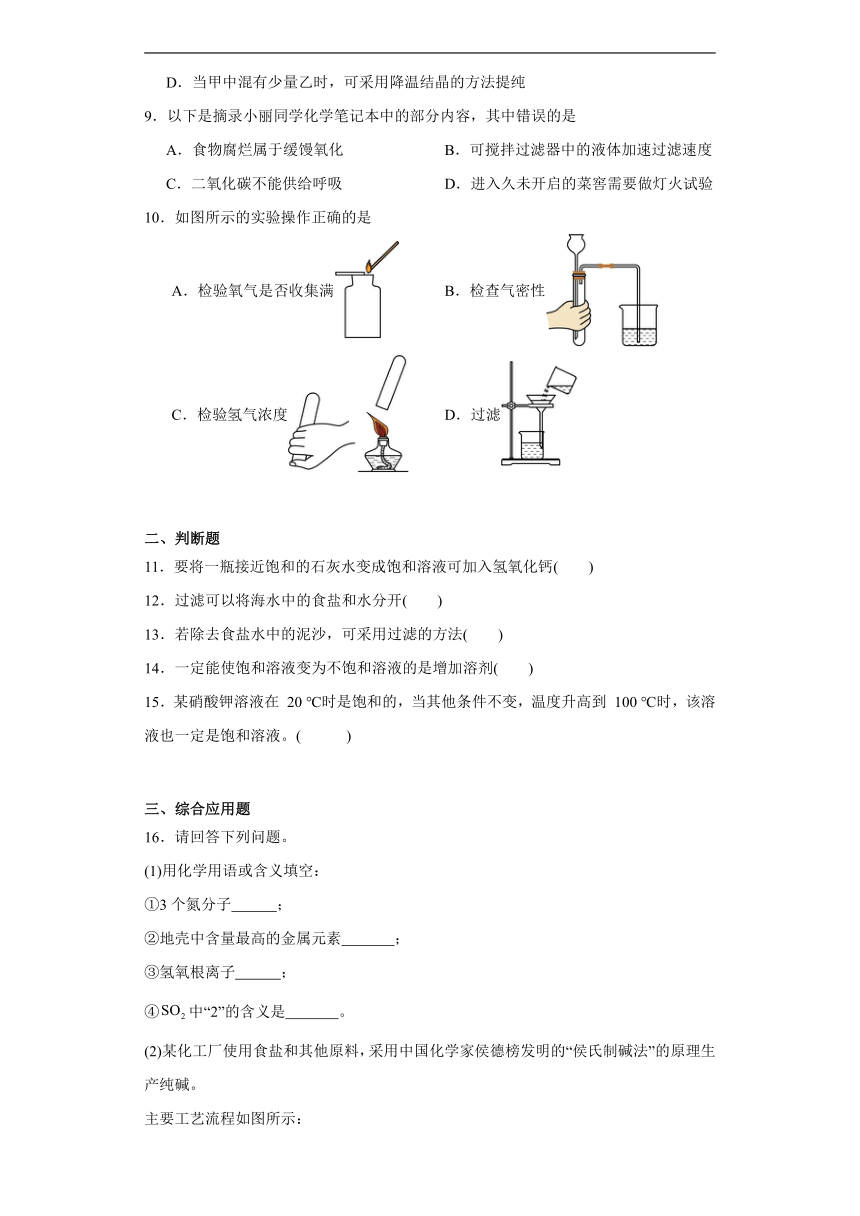
1.如图为甲、乙两种物质的溶解度曲线,下列有关说法正确的是
A.升高温度可将接近饱和的乙溶液转化为饱和溶液
B.甲中混有少量乙时,可采用蒸发溶剂的方法提纯甲
C.t2℃时,等质量的甲、乙固体配成饱和溶液得到溶液的质量甲<乙
D.t3℃时,150 g甲的饱和溶液降温至t1℃,析出40 g固体甲
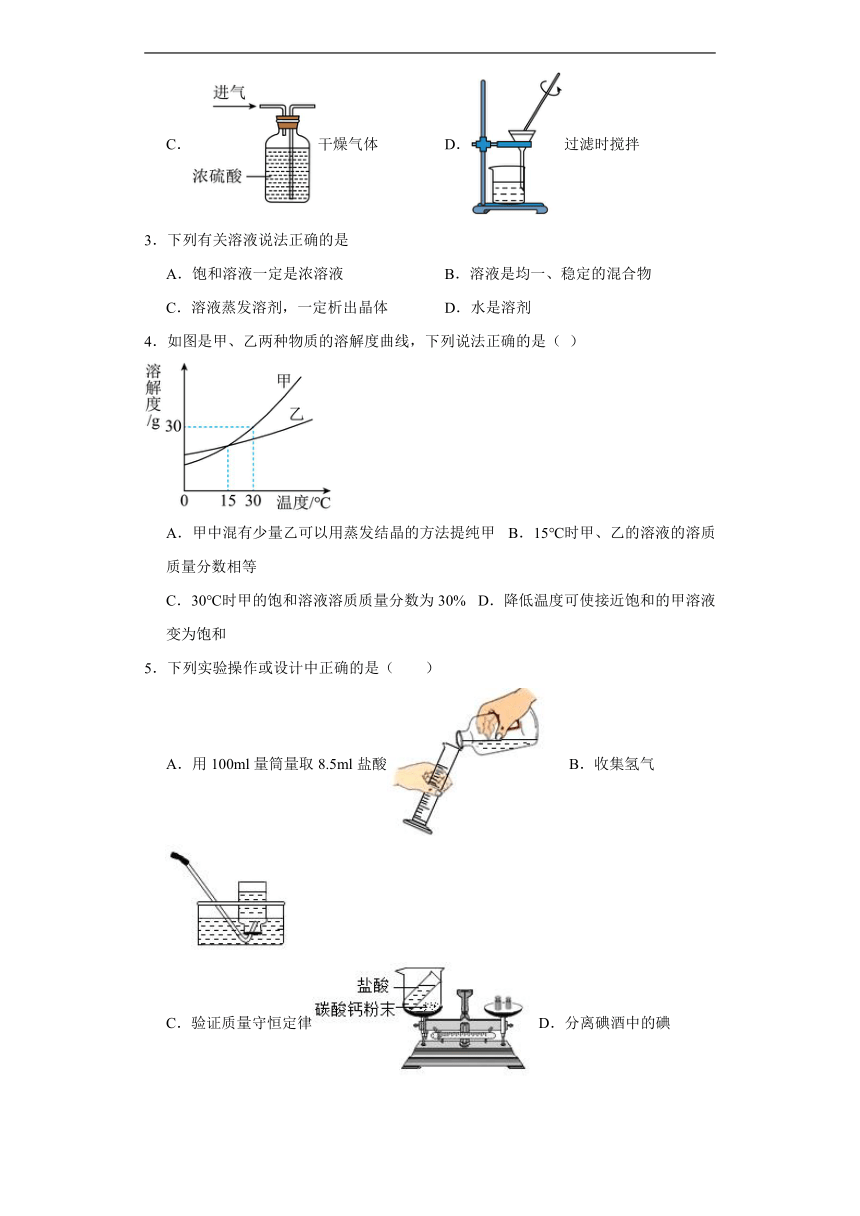
2.以下实验操作正确的是
A.倾倒液体 B.CO2验满
C.干燥气体 D.过滤时搅拌
3.下列有关溶液说法正确的是
A.饱和溶液一定是浓溶液 B.溶液是均一、稳定的混合物
C.溶液蒸发溶剂,一定析出晶体 D.水是溶剂
4.如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )
A.甲中混有少量乙可以用蒸发结晶的方法提纯甲 B.15℃时甲、乙的溶液的溶质质量分数相等
C.30℃时甲的饱和溶液溶质质量分数为30% D.降低温度可使接近饱和的甲溶液变为饱和
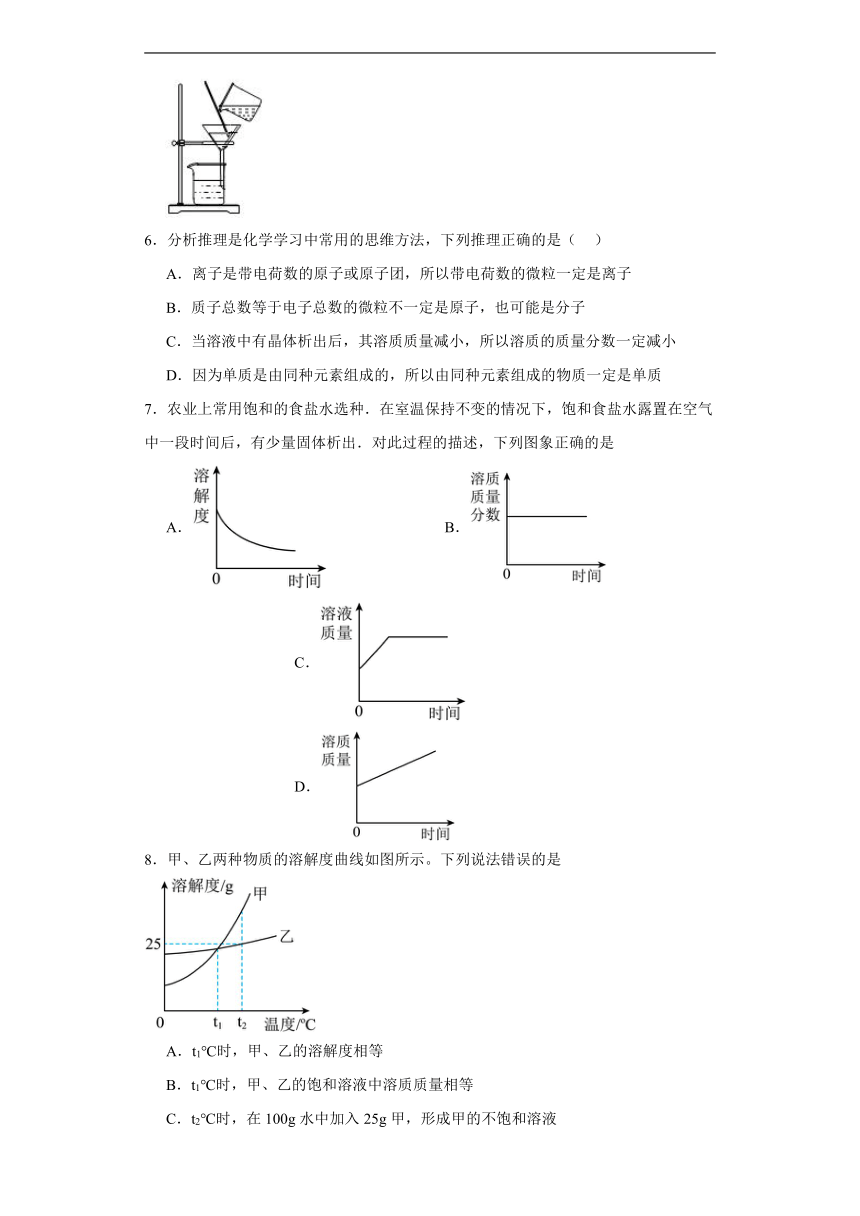
5.下列实验操作或设计中正确的是( )
A.用100ml量筒量取8.5ml盐酸 B.收集氢气
C.验证质量守恒定律 D.分离碘酒中的碘
6.分析推理是化学学习中常用的思维方法,下列推理正确的是( )
A.离子是带电荷数的原子或原子团,所以带电荷数的微粒一定是离子
B.质子总数等于电子总数的微粒不一定是原子,也可能是分子
C.当溶液中有晶体析出后,其溶质质量减小,所以溶质的质量分数一定减小
D.因为单质是由同种元素组成的,所以由同种元素组成的物质一定是单质
7.农业上常用饱和的食盐水选种.在室温保持不变的情况下,饱和食盐水露置在空气中一段时间后,有少量固体析出.对此过程的描述,下列图象正确的是
A. B. C. D.
8.甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是
A.t1℃时,甲、乙的溶解度相等
B.t1℃时,甲、乙的饱和溶液中溶质质量相等
C.t2℃时,在100g水中加入25g甲,形成甲的不饱和溶液
D.当甲中混有少量乙时,可采用降温结晶的方法提纯
9.以下是摘录小丽同学化学笔记本中的部分内容,其中错误的是
A.食物腐烂属于缓馒氧化 B.可搅拌过滤器中的液体加速过滤速度
C.二氧化碳不能供给呼吸 D.进入久未开启的菜窖需要做灯火试验
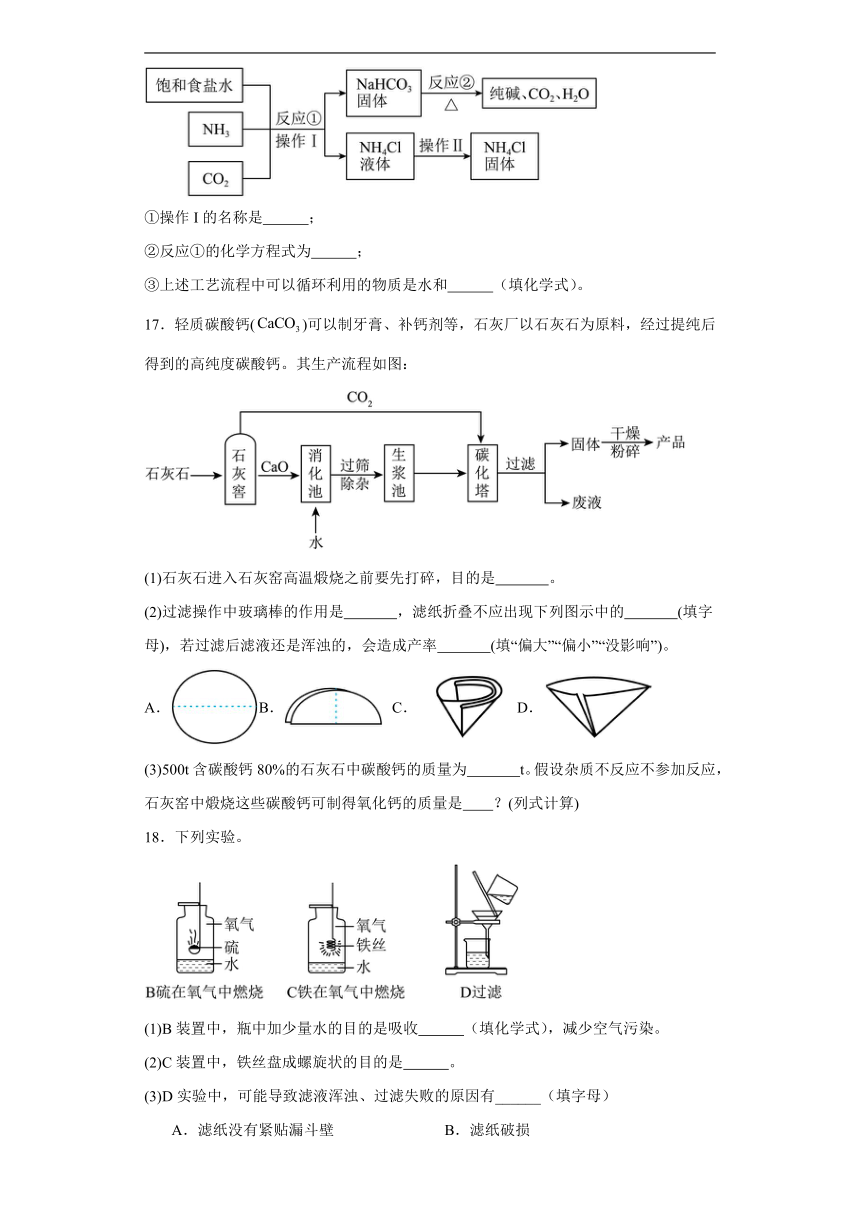
10.如图所示的实验操作正确的是
A.检验氧气是否收集满 B.检查气密性
C.检验氢气浓度 D.过滤
二、判断题
11.要将一瓶接近饱和的石灰水变成饱和溶液可加入氢氧化钙( )
12.过滤可以将海水中的食盐和水分开( )
13.若除去食盐水中的泥沙,可采用过滤的方法( )
14.一定能使饱和溶液变为不饱和溶液的是增加溶剂( )
15.某硝酸钾溶液在 20 ℃时是饱和的,当其他条件不变,温度升高到 100 ℃时,该溶液也一定是饱和溶液。( )
三、综合应用题
16.请回答下列问题。
(1)用化学用语或含义填空:
①3个氮分子 ;
②地壳中含量最高的金属元素 ;
③氢氧根离子 ;
④中“2”的含义是 。
(2)某化工厂使用食盐和其他原料,采用中国化学家侯德榜发明的“侯氏制碱法”的原理生产纯碱。
主要工艺流程如图所示:
①操作I的名称是 ;
②反应①的化学方程式为 ;
③上述工艺流程中可以循环利用的物质是水和 (填化学式)。
17.轻质碳酸钙()可以制牙膏、补钙剂等,石灰厂以石灰石为原料,经过提纯后得到的高纯度碳酸钙。其生产流程如图:
(1)石灰石进入石灰窑高温煅烧之前要先打碎,目的是 。
(2)过滤操作中玻璃棒的作用是 ,滤纸折叠不应出现下列图示中的 (填字母),若过滤后滤液还是浑浊的,会造成产率 (填“偏大”“偏小”“没影响”)。
A.B. C. D.
(3)500t含碳酸钙80%的石灰石中碳酸钙的质量为 t。假设杂质不反应不参加反应,石灰窑中煅烧这些碳酸钙可制得氧化钙的质量是 ?(列式计算)
18.下列实验。
(1)B装置中,瓶中加少量水的目的是吸收 (填化学式),减少空气污染。
(2)C装置中,铁丝盘成螺旋状的目的是 。
(3)D实验中,可能导致滤液浑浊、过滤失败的原因有______(填字母)
A.滤纸没有紧贴漏斗壁 B.滤纸破损
C.漏斗内液面高于滤纸边缘 D.漏斗下端管口未紧靠烧杯壁
参考答案:
1.D
【详解】A、乙的溶解度随温度的升高而增大,可通过降低温度的方法将其不饱和溶液转化为饱和溶液,故A错误;
B、甲、乙的溶解度均随温度的升高而增大,且甲的溶解度受温度影响更大,应采用降温结晶的方法提纯甲,故B错误;
C、t2℃时,甲的溶解度比乙小,等质量的二者配成饱和溶液,甲需要的溶剂比乙多,故甲溶液质量大于乙,故C错误;
D、t3℃时,甲的溶解度是50 g,故150 g甲的饱和溶液中溶剂是100 g,t1℃时,甲的溶解度是10 g,所以将150 g甲的饱和溶液从t3℃降温至t1℃,析出晶体的质量是50 g-10 g=40 g,故D正确;
故选D。
2.A
【详解】A、向试管中倾倒液体时,瓶塞要倒放,标签要对着手心,瓶口要紧挨,图中所示操作正确;
B、检验二氧化碳是否收集满时,应将燃着的木条放在集气瓶口,若木条熄灭,则证明已收集满二氧化碳气体,图中是将燃着的木条伸入集气瓶内, 图中所示操作错误;
C、浓硫酸具有吸水性,可用作干燥剂,用装有浓硫酸的洗气瓶干燥气体时,应遵循“长进短出”的原则,图中进气管与出气管方向反了,图中所示操作错误;
D、过滤液体时,要注意“一贴、二低、三靠”的原则,过滤时不能用玻璃棒搅拌,过滤时要用玻璃棒引流,图中所示操作错误。
故选A。
3.B
【详解】A、饱和溶液不一定是浓溶液,如氢氧化钙的饱和溶液是稀溶液,不符合题意;
B、溶液是均一、稳定的混合物,符合题意;
C、溶液蒸发溶剂,不一定析出晶体,饱和溶液蒸发溶剂,一定会析出晶体,不符合题意;
D、水是常见的溶剂,但是水不一定是溶剂,如酒精和水可以以任意比互溶,可以说水溶解了酒精,也可以说酒精溶解了水,只是我们习惯上将水看作溶剂,不符合题意。
故选B。
4.D
【详解】A、甲的溶解度受温度影响比乙的大,故甲中混有少量乙可以用降温结晶的方法提纯甲,说法错误;
B、15℃时甲、乙的溶解度相等,它们的饱和溶液的溶质质量分数相等,说法错误;
C、30℃时甲的饱和溶液溶质质量分数为30g/(30g+100g)×100%<30% ,说法错误;
D、甲的溶解度随温度的升高而增大,降低温度可使接近饱和的甲溶液变为饱和,说法正确。
故选D。
【点睛】某温度时,不同物质的溶解度相等,它们饱和溶液的溶质质量分数也相等。
5.B
【详解】A.用量筒量取一定体积的液体时,量筒选用遵守“大而近原则”,因此量取8.5ml盐酸应该选用10ml量筒比较合适,该选项不正确;
B.氢气难溶于水,可用排水法收集,该选项正确;
C.碳酸钠与盐酸反应生成二氧化碳气体,则验证质量守恒定律时,需要在密闭环境中进行,该选项不正确;
D.碘可溶于酒精,过滤是分离不出碘单质的,该选项不正确,
故选B。
6.B
【详解】A、带电荷数的微粒不一定是离子,比如电子,错误;
B、质子总数等于电子总数的微粒不一定是原子,也可能是分子,比如水分子和氨分子,正确;
C、当溶液中有晶体析出后,其溶质质量减小,但是溶质的质量分数不一定减小,比如同一温度下的饱和溶液析出晶体溶质质量分数不变,错误;
D、由同种元素组成的纯净物一定是单质,由同种元素组成的物质不一定是单质,也可能是混合物,错误;
故选:B。
7.B
【详解】A、溶解度只与温度有关,故A选项错误.
B、在相同温度下,饱和食盐水的溶质质量分数相同,故B选项正确.
C、水分蒸发导致饱和食盐水中析出食盐,由于溶剂与溶质都减少导致溶液的质量减小,故C选项错误.
D、水分蒸发导致饱和食盐水中析出食盐,溶液中溶质质量减小,故D选项错误.
故选B
【点评】此题是对饱和溶液有关问题的探讨,涉及到恒温蒸发的知识要点,只要抓住析出晶体后溶液仍是这一温度下的饱和溶液即可.
8.B
【详解】A. t1℃时甲乙两条溶解度曲线相交,溶解度相等。正确。
B. t1℃时,甲、乙的溶解度相等,则饱和溶液的溶质质量分数相等,但不知道溶液的质量,溶质质量关系无法确定。错误。
C. t2℃时,甲的溶解度大于25g,则在100g水中加入25g甲,形成甲的不饱和溶液,正确。
D. 甲乙的溶解度均随温度的升高而升高,且甲的溶解度受温度影响较大,乙的溶解度受温度影响不大,所以当甲中混有少量乙时,可采用降温结晶的方法提纯。
故选:B。
9.B
【详解】A、食物腐烂是物质与氧气的反应,且进行的很慢,属于缓慢氧化,不符合题意;
B、不能搅拌过滤器中的液体,防止损坏滤纸,符合题意;
C、二氧化碳不能供给呼吸,当空气中二氧化碳的含量超过正常含量时,会对人体健康产生影响,不符合题意;
D、久未开启的菜窖中可能含有大量的二氧化碳,二氧化碳不能供给呼吸,直接进入,会有窒息的危险,二氧化碳不燃烧、不支持燃烧,可先做灯火实验,如果灯火熄灭,说明二氧化碳含量高,不能直接进入,不符合题意。
故选B。
10.A
【详解】A、氧气具有助燃性,氧气验满:将带火星的木条放在集气瓶口,木条复燃,说明已经集满,符合题意;
B、该装置通过长颈漏斗与外界相通,无法检查装置的气密性,不符合题意;
C、该实验是检查氢气的纯度,不是检验氢气的浓度,不符合题意;
D、过滤时,应遵循“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,不符合题意。
故选A。
11.正确
【详解】将不饱和溶液转化为饱和溶液,可以通过增加溶质或蒸发溶剂的方法,故将一瓶接近饱和的石灰水变成饱和溶液可加入氢氧化钙。
12.错误
【详解】过滤只能除去不溶性杂质,不能将食盐和水分开,说法错误。
13.正确
【详解】过滤是把不溶于液体的固体与液体分离的一种方法,泥沙难溶于水,除去食盐水中的泥沙,可采用的方法是过滤,故正确。
14.正确
【详解】增加溶剂,一定能使饱和溶液变为不饱和溶液,因为溶液的总质量增加,溶质的质量不变,浓度一定减小,故正确。
15.错误
【详解】硝酸钾的溶解度随温度的升高而增大,某硝酸钾溶液在 20 ℃时是饱和的,当其他条件不变,温度升高到 100 ℃时,该溶液变为不饱和溶液,故说法错误。
16.(1) 1个二氧化硫分子中含有2个氧原子
(2) 过滤
【详解】(1)①分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字。3个氮分子表示为3N2;
②书写元素符号时应注意:由一个字母表示的元素符号要大写;由两个字母表示的元素符号,第一个字母大写,第二个字母小写。地壳中含量最多的金属元素是铝元素,表示为Al;
③离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字。氢氧根离子表示为OH-;
④标在化学式中元素符号右下角的数字表示1个分子含有的原子个数,故SO2 中“2”的含义是1个二氧化硫分子中含有2个氧原子;
(2)①操作I为分离液体和固体的操作,名称为过滤;
②反应①是氯化钠、氨气、水和二氧化碳反应生成碳酸氢钠和氯化铵,该反应的化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
③由流程图可知,二氧化碳(CO2)和水(H2O)既是反应物也是生成物,可循环利用。
17.(1)增大接触面积或提高反应速率或使反应更充分
(2) 引流,防止液体溅出 D 偏小
(3) 400 解:设可制得氧化钙的质量为。
解得:=224t
答:可制得氧化钙224t。
【详解】(1)将石灰石打碎,可以增大石灰石的接触面积,提高反应速率使反应更充分。
(2)过滤操作中玻璃棒的作用是引流,防止液体溅出;滤纸折叠不应出现下列图示中的D情况,D中有缝隙,容易使液体不经过过滤直接流入烧杯中。若过滤后滤液仍然浑浊,使固体的质量减小,从而使产品的质量减小,造成产率偏小。
(3)混合物中某物质的质量=混合物的质量该物种的质量分数,所以500t含碳酸钙80%的石灰石中碳酸钙的质量=。
详解见答案。
18.(1)SO2
(2)增大铁丝的受热面积
(3)BC
【详解】(1)B装置中,瓶中加少量水的目的是吸收生成的SO2,减少空气污染。
(2)C装置中,铁丝盘成螺旋状的目的是增大铁丝的受热面积。
(3)A. 滤纸没有紧贴漏斗壁,会减慢过滤速度,不会导致滤液浑浊,此选项不符合题意;
B. 滤纸破损,会使液体中的不溶物进入下面的烧杯,会导致滤液浑浊,此选项符合题意;
C. 漏斗内液面高于滤纸边缘,会使部分液体中的不溶物进入下面的烧杯,会导致滤液浑浊,此选项符合题意;
D. 漏斗下端管口未紧靠烧杯壁,会导致滤液飞溅,不会导致滤液浑浊,此选项不符合题意。
故选BC。
学校:___________姓名:___________班级:___________考号:___________
1. 定义:结晶是指由气态、液态或固态的非晶体物质转变为晶态的过程。当溶质从溶液中析出时,如果它在固态时具有规则的几何外形,则称该过程为结晶。
2. 晶体特性:晶体通常都有规则的形状,不同的晶体具有不同的形状。
3. 结晶方法:
* 冷却结晶法(又称冷却热饱和溶液法或降温结晶法):这种方法适用于溶解度受温度变化影响相当大的固态溶质。通过降低溶液的温度,可以使溶质结晶析出。例如,将硝酸钾饱和溶液降温,可以析出硝酸钾晶体。利用这一方法,还可以分离几种可溶性固态物质的混合物。
* 蒸发溶剂结晶法(简称蒸发结晶法):这种方法适用于溶解度受温度变化影响不大的固态溶质。通过恒温蒸发使溶剂的量减少,从而得到晶体。例如,从海水中提取食盐,就是把海水引到盐滩上,利用日光和风力使水分蒸发,得到食盐。
一、选择题
1.如图为甲、乙两种物质的溶解度曲线,下列有关说法正确的是
A.升高温度可将接近饱和的乙溶液转化为饱和溶液
B.甲中混有少量乙时,可采用蒸发溶剂的方法提纯甲
C.t2℃时,等质量的甲、乙固体配成饱和溶液得到溶液的质量甲<乙
D.t3℃时,150 g甲的饱和溶液降温至t1℃,析出40 g固体甲
2.以下实验操作正确的是
A.倾倒液体 B.CO2验满
C.干燥气体 D.过滤时搅拌
3.下列有关溶液说法正确的是
A.饱和溶液一定是浓溶液 B.溶液是均一、稳定的混合物
C.溶液蒸发溶剂,一定析出晶体 D.水是溶剂
4.如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )
A.甲中混有少量乙可以用蒸发结晶的方法提纯甲 B.15℃时甲、乙的溶液的溶质质量分数相等
C.30℃时甲的饱和溶液溶质质量分数为30% D.降低温度可使接近饱和的甲溶液变为饱和
5.下列实验操作或设计中正确的是( )
A.用100ml量筒量取8.5ml盐酸 B.收集氢气
C.验证质量守恒定律 D.分离碘酒中的碘
6.分析推理是化学学习中常用的思维方法,下列推理正确的是( )
A.离子是带电荷数的原子或原子团,所以带电荷数的微粒一定是离子
B.质子总数等于电子总数的微粒不一定是原子,也可能是分子
C.当溶液中有晶体析出后,其溶质质量减小,所以溶质的质量分数一定减小
D.因为单质是由同种元素组成的,所以由同种元素组成的物质一定是单质
7.农业上常用饱和的食盐水选种.在室温保持不变的情况下,饱和食盐水露置在空气中一段时间后,有少量固体析出.对此过程的描述,下列图象正确的是
A. B. C. D.
8.甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是
A.t1℃时,甲、乙的溶解度相等
B.t1℃时,甲、乙的饱和溶液中溶质质量相等
C.t2℃时,在100g水中加入25g甲,形成甲的不饱和溶液
D.当甲中混有少量乙时,可采用降温结晶的方法提纯
9.以下是摘录小丽同学化学笔记本中的部分内容,其中错误的是
A.食物腐烂属于缓馒氧化 B.可搅拌过滤器中的液体加速过滤速度
C.二氧化碳不能供给呼吸 D.进入久未开启的菜窖需要做灯火试验
10.如图所示的实验操作正确的是
A.检验氧气是否收集满 B.检查气密性
C.检验氢气浓度 D.过滤
二、判断题
11.要将一瓶接近饱和的石灰水变成饱和溶液可加入氢氧化钙( )
12.过滤可以将海水中的食盐和水分开( )
13.若除去食盐水中的泥沙,可采用过滤的方法( )
14.一定能使饱和溶液变为不饱和溶液的是增加溶剂( )
15.某硝酸钾溶液在 20 ℃时是饱和的,当其他条件不变,温度升高到 100 ℃时,该溶液也一定是饱和溶液。( )
三、综合应用题
16.请回答下列问题。
(1)用化学用语或含义填空:
①3个氮分子 ;
②地壳中含量最高的金属元素 ;
③氢氧根离子 ;
④中“2”的含义是 。
(2)某化工厂使用食盐和其他原料,采用中国化学家侯德榜发明的“侯氏制碱法”的原理生产纯碱。
主要工艺流程如图所示:
①操作I的名称是 ;
②反应①的化学方程式为 ;
③上述工艺流程中可以循环利用的物质是水和 (填化学式)。
17.轻质碳酸钙()可以制牙膏、补钙剂等,石灰厂以石灰石为原料,经过提纯后得到的高纯度碳酸钙。其生产流程如图:
(1)石灰石进入石灰窑高温煅烧之前要先打碎,目的是 。
(2)过滤操作中玻璃棒的作用是 ,滤纸折叠不应出现下列图示中的 (填字母),若过滤后滤液还是浑浊的,会造成产率 (填“偏大”“偏小”“没影响”)。
A.B. C. D.
(3)500t含碳酸钙80%的石灰石中碳酸钙的质量为 t。假设杂质不反应不参加反应,石灰窑中煅烧这些碳酸钙可制得氧化钙的质量是 ?(列式计算)
18.下列实验。
(1)B装置中,瓶中加少量水的目的是吸收 (填化学式),减少空气污染。
(2)C装置中,铁丝盘成螺旋状的目的是 。
(3)D实验中,可能导致滤液浑浊、过滤失败的原因有______(填字母)
A.滤纸没有紧贴漏斗壁 B.滤纸破损
C.漏斗内液面高于滤纸边缘 D.漏斗下端管口未紧靠烧杯壁
参考答案:
1.D
【详解】A、乙的溶解度随温度的升高而增大,可通过降低温度的方法将其不饱和溶液转化为饱和溶液,故A错误;
B、甲、乙的溶解度均随温度的升高而增大,且甲的溶解度受温度影响更大,应采用降温结晶的方法提纯甲,故B错误;
C、t2℃时,甲的溶解度比乙小,等质量的二者配成饱和溶液,甲需要的溶剂比乙多,故甲溶液质量大于乙,故C错误;
D、t3℃时,甲的溶解度是50 g,故150 g甲的饱和溶液中溶剂是100 g,t1℃时,甲的溶解度是10 g,所以将150 g甲的饱和溶液从t3℃降温至t1℃,析出晶体的质量是50 g-10 g=40 g,故D正确;
故选D。
2.A
【详解】A、向试管中倾倒液体时,瓶塞要倒放,标签要对着手心,瓶口要紧挨,图中所示操作正确;
B、检验二氧化碳是否收集满时,应将燃着的木条放在集气瓶口,若木条熄灭,则证明已收集满二氧化碳气体,图中是将燃着的木条伸入集气瓶内, 图中所示操作错误;
C、浓硫酸具有吸水性,可用作干燥剂,用装有浓硫酸的洗气瓶干燥气体时,应遵循“长进短出”的原则,图中进气管与出气管方向反了,图中所示操作错误;
D、过滤液体时,要注意“一贴、二低、三靠”的原则,过滤时不能用玻璃棒搅拌,过滤时要用玻璃棒引流,图中所示操作错误。
故选A。
3.B
【详解】A、饱和溶液不一定是浓溶液,如氢氧化钙的饱和溶液是稀溶液,不符合题意;
B、溶液是均一、稳定的混合物,符合题意;
C、溶液蒸发溶剂,不一定析出晶体,饱和溶液蒸发溶剂,一定会析出晶体,不符合题意;
D、水是常见的溶剂,但是水不一定是溶剂,如酒精和水可以以任意比互溶,可以说水溶解了酒精,也可以说酒精溶解了水,只是我们习惯上将水看作溶剂,不符合题意。
故选B。
4.D
【详解】A、甲的溶解度受温度影响比乙的大,故甲中混有少量乙可以用降温结晶的方法提纯甲,说法错误;
B、15℃时甲、乙的溶解度相等,它们的饱和溶液的溶质质量分数相等,说法错误;
C、30℃时甲的饱和溶液溶质质量分数为30g/(30g+100g)×100%<30% ,说法错误;
D、甲的溶解度随温度的升高而增大,降低温度可使接近饱和的甲溶液变为饱和,说法正确。
故选D。
【点睛】某温度时,不同物质的溶解度相等,它们饱和溶液的溶质质量分数也相等。
5.B
【详解】A.用量筒量取一定体积的液体时,量筒选用遵守“大而近原则”,因此量取8.5ml盐酸应该选用10ml量筒比较合适,该选项不正确;
B.氢气难溶于水,可用排水法收集,该选项正确;
C.碳酸钠与盐酸反应生成二氧化碳气体,则验证质量守恒定律时,需要在密闭环境中进行,该选项不正确;
D.碘可溶于酒精,过滤是分离不出碘单质的,该选项不正确,
故选B。
6.B
【详解】A、带电荷数的微粒不一定是离子,比如电子,错误;
B、质子总数等于电子总数的微粒不一定是原子,也可能是分子,比如水分子和氨分子,正确;
C、当溶液中有晶体析出后,其溶质质量减小,但是溶质的质量分数不一定减小,比如同一温度下的饱和溶液析出晶体溶质质量分数不变,错误;
D、由同种元素组成的纯净物一定是单质,由同种元素组成的物质不一定是单质,也可能是混合物,错误;
故选:B。
7.B
【详解】A、溶解度只与温度有关,故A选项错误.
B、在相同温度下,饱和食盐水的溶质质量分数相同,故B选项正确.
C、水分蒸发导致饱和食盐水中析出食盐,由于溶剂与溶质都减少导致溶液的质量减小,故C选项错误.
D、水分蒸发导致饱和食盐水中析出食盐,溶液中溶质质量减小,故D选项错误.
故选B
【点评】此题是对饱和溶液有关问题的探讨,涉及到恒温蒸发的知识要点,只要抓住析出晶体后溶液仍是这一温度下的饱和溶液即可.
8.B
【详解】A. t1℃时甲乙两条溶解度曲线相交,溶解度相等。正确。
B. t1℃时,甲、乙的溶解度相等,则饱和溶液的溶质质量分数相等,但不知道溶液的质量,溶质质量关系无法确定。错误。
C. t2℃时,甲的溶解度大于25g,则在100g水中加入25g甲,形成甲的不饱和溶液,正确。
D. 甲乙的溶解度均随温度的升高而升高,且甲的溶解度受温度影响较大,乙的溶解度受温度影响不大,所以当甲中混有少量乙时,可采用降温结晶的方法提纯。
故选:B。
9.B
【详解】A、食物腐烂是物质与氧气的反应,且进行的很慢,属于缓慢氧化,不符合题意;
B、不能搅拌过滤器中的液体,防止损坏滤纸,符合题意;
C、二氧化碳不能供给呼吸,当空气中二氧化碳的含量超过正常含量时,会对人体健康产生影响,不符合题意;
D、久未开启的菜窖中可能含有大量的二氧化碳,二氧化碳不能供给呼吸,直接进入,会有窒息的危险,二氧化碳不燃烧、不支持燃烧,可先做灯火实验,如果灯火熄灭,说明二氧化碳含量高,不能直接进入,不符合题意。
故选B。
10.A
【详解】A、氧气具有助燃性,氧气验满:将带火星的木条放在集气瓶口,木条复燃,说明已经集满,符合题意;
B、该装置通过长颈漏斗与外界相通,无法检查装置的气密性,不符合题意;
C、该实验是检查氢气的纯度,不是检验氢气的浓度,不符合题意;
D、过滤时,应遵循“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,不符合题意。
故选A。
11.正确
【详解】将不饱和溶液转化为饱和溶液,可以通过增加溶质或蒸发溶剂的方法,故将一瓶接近饱和的石灰水变成饱和溶液可加入氢氧化钙。
12.错误
【详解】过滤只能除去不溶性杂质,不能将食盐和水分开,说法错误。
13.正确
【详解】过滤是把不溶于液体的固体与液体分离的一种方法,泥沙难溶于水,除去食盐水中的泥沙,可采用的方法是过滤,故正确。
14.正确
【详解】增加溶剂,一定能使饱和溶液变为不饱和溶液,因为溶液的总质量增加,溶质的质量不变,浓度一定减小,故正确。
15.错误
【详解】硝酸钾的溶解度随温度的升高而增大,某硝酸钾溶液在 20 ℃时是饱和的,当其他条件不变,温度升高到 100 ℃时,该溶液变为不饱和溶液,故说法错误。
16.(1) 1个二氧化硫分子中含有2个氧原子
(2) 过滤
【详解】(1)①分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字。3个氮分子表示为3N2;
②书写元素符号时应注意:由一个字母表示的元素符号要大写;由两个字母表示的元素符号,第一个字母大写,第二个字母小写。地壳中含量最多的金属元素是铝元素,表示为Al;
③离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字。氢氧根离子表示为OH-;
④标在化学式中元素符号右下角的数字表示1个分子含有的原子个数,故SO2 中“2”的含义是1个二氧化硫分子中含有2个氧原子;
(2)①操作I为分离液体和固体的操作,名称为过滤;
②反应①是氯化钠、氨气、水和二氧化碳反应生成碳酸氢钠和氯化铵,该反应的化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
③由流程图可知,二氧化碳(CO2)和水(H2O)既是反应物也是生成物,可循环利用。
17.(1)增大接触面积或提高反应速率或使反应更充分
(2) 引流,防止液体溅出 D 偏小
(3) 400 解:设可制得氧化钙的质量为。
解得:=224t
答:可制得氧化钙224t。
【详解】(1)将石灰石打碎,可以增大石灰石的接触面积,提高反应速率使反应更充分。
(2)过滤操作中玻璃棒的作用是引流,防止液体溅出;滤纸折叠不应出现下列图示中的D情况,D中有缝隙,容易使液体不经过过滤直接流入烧杯中。若过滤后滤液仍然浑浊,使固体的质量减小,从而使产品的质量减小,造成产率偏小。
(3)混合物中某物质的质量=混合物的质量该物种的质量分数,所以500t含碳酸钙80%的石灰石中碳酸钙的质量=。
详解见答案。
18.(1)SO2
(2)增大铁丝的受热面积
(3)BC
【详解】(1)B装置中,瓶中加少量水的目的是吸收生成的SO2,减少空气污染。
(2)C装置中,铁丝盘成螺旋状的目的是增大铁丝的受热面积。
(3)A. 滤纸没有紧贴漏斗壁,会减慢过滤速度,不会导致滤液浑浊,此选项不符合题意;
B. 滤纸破损,会使液体中的不溶物进入下面的烧杯,会导致滤液浑浊,此选项符合题意;
C. 漏斗内液面高于滤纸边缘,会使部分液体中的不溶物进入下面的烧杯,会导致滤液浑浊,此选项符合题意;
D. 漏斗下端管口未紧靠烧杯壁,会导致滤液飞溅,不会导致滤液浑浊,此选项不符合题意。
故选BC。
