6.4珍惜和保护金属资源达标同步练 科粤版(2019)化学九年级下册(含解析)
文档属性
| 名称 | 6.4珍惜和保护金属资源达标同步练 科粤版(2019)化学九年级下册(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-16 09:18:36 | ||
图片预览



文档简介
6.4珍惜和保护金属资源
学校:___________姓名:___________班级:___________考号:___________
1. 金属的存在形式:金属在自然界中通常以单质或化合物的形式存在。一些化学性质不活泼的金属,如金、银等,通常以单质的形式存在。而化学性质较活泼的金属,如铁、锌、钠和钙等,则通常以化合物的形式存在,例如矿石。
2. 金属的冶炼:通过一系列物理和化学过程,将矿石中的金属元素提炼出来,使其转化为可供使用的金属。例如,铁的冶炼就是一个将铁矿石中的铁元素提炼出来,制成铁制品的过程。
3. 金属的锈蚀与防护:金属在与空气、水等环境因素接触时,容易发生锈蚀。锈蚀不仅影响金属的外观和使用性能,还会造成资源的浪费。因此,需要采取一些措施来防止金属的锈蚀,如保持金属表面的干燥、涂防锈漆、电镀等。
4. 金属资源的珍惜与保护:金属资源是有限的,而且一些金属的开采和冶炼过程还会对环境造成破坏。因此,我们需要珍惜和保护金属资源,避免浪费和过度开采。同时,还需要推广金属的再生利用,减少对新资源的需求。
5. 金属的回收与再利用:通过回收和再利用废旧金属,可以减少对新资源的需求,降低生产成本,同时减少环境污染。因此,推广金属的回收和再利用是珍惜和保护金属资源的重要措施之一。
一、选择题
1.下列关于铁的说法正确的是( )
A.铁部分锈蚀后没有回收价值
B.铁是地壳中含量最丰富的金属元素
C.铁生锈,产生的铁锈能阻止铁继续被锈蚀
D.铁生锈是铁在有氧气和水等物质存在的条件下,发生复杂化学反应的过程
2.下列自然资源的利用过程中,发生了化学变化的是( )
A.海水晒盐 B.太阳能取暖 C.铁矿石炼铁 D.风力发电
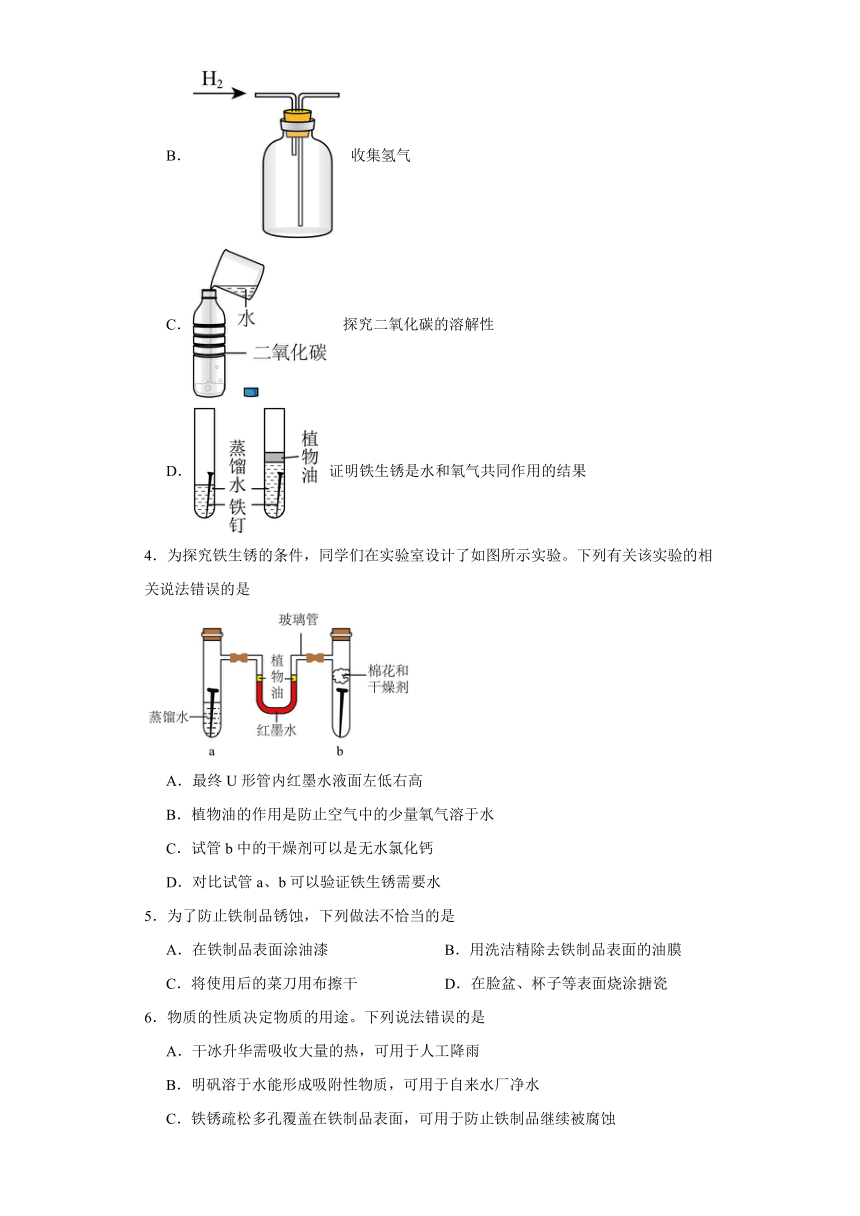
3.下列有关实验设计达不到实验目的的是
A. 鉴别二氧化碳和氧气
B. 收集氢气
C. 探究二氧化碳的溶解性
D. 证明铁生锈是水和氧气共同作用的结果
4.为探究铁生锈的条件,同学们在实验室设计了如图所示实验。下列有关该实验的相关说法错误的是
A.最终U形管内红墨水液面左低右高
B.植物油的作用是防止空气中的少量氧气溶于水
C.试管b中的干燥剂可以是无水氯化钙
D.对比试管a、b可以验证铁生锈需要水
5.为了防止铁制品锈蚀,下列做法不恰当的是
A.在铁制品表面涂油漆 B.用洗洁精除去铁制品表面的油膜
C.将使用后的菜刀用布擦干 D.在脸盆、杯子等表面烧涂搪瓷
6.物质的性质决定物质的用途。下列说法错误的是
A.干冰升华需吸收大量的热,可用于人工降雨
B.明矾溶于水能形成吸附性物质,可用于自来水厂净水
C.铁锈疏松多孔覆盖在铁制品表面,可用于防止铁制品继续被腐蚀
D.氢气具有可燃性,可用作燃料
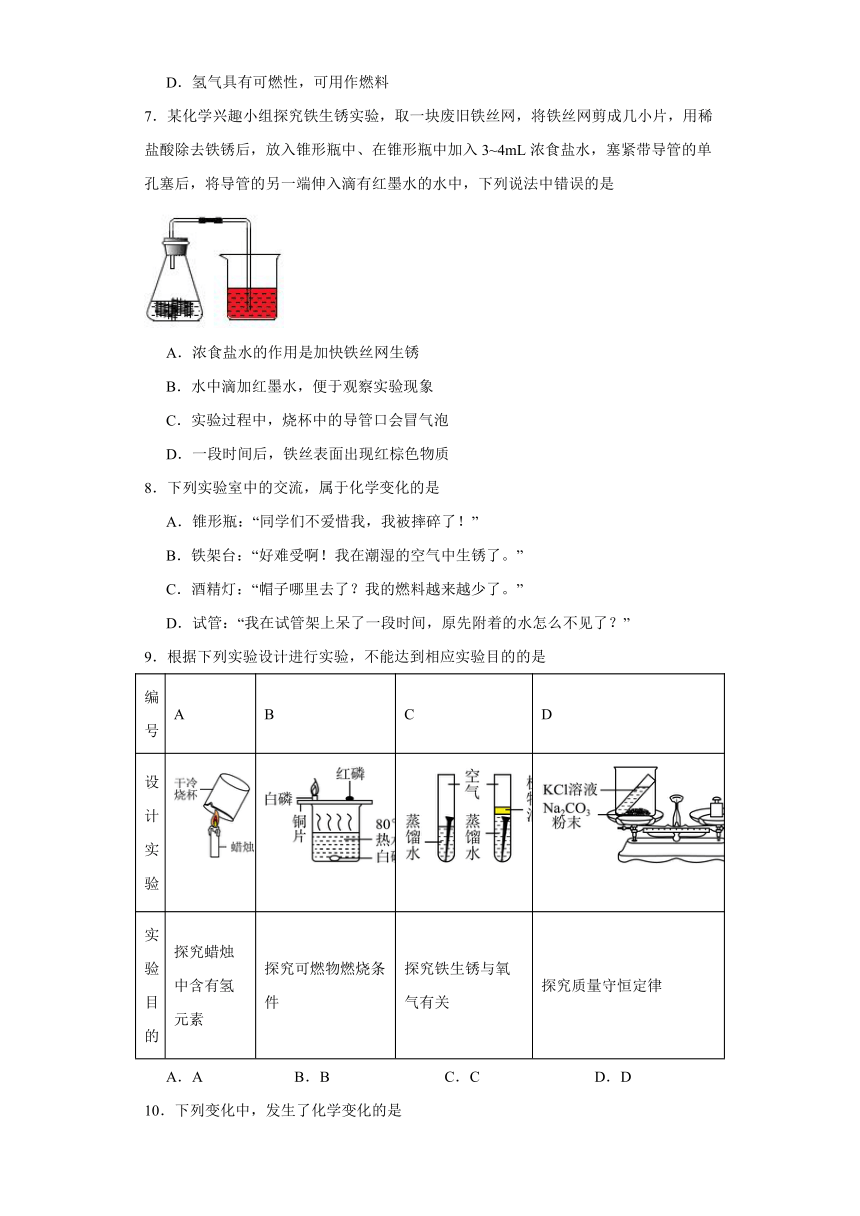
7.某化学兴趣小组探究铁生锈实验,取一块废旧铁丝网,将铁丝网剪成几小片,用稀盐酸除去铁锈后,放入锥形瓶中、在锥形瓶中加入3~4mL浓食盐水,塞紧带导管的单孔塞后,将导管的另一端伸入滴有红墨水的水中,下列说法中错误的是
A.浓食盐水的作用是加快铁丝网生锈
B.水中滴加红墨水,便于观察实验现象
C.实验过程中,烧杯中的导管口会冒气泡
D.一段时间后,铁丝表面出现红棕色物质
8.下列实验室中的交流,属于化学变化的是
A.锥形瓶:“同学们不爱惜我,我被摔碎了!”
B.铁架台:“好难受啊!我在潮湿的空气中生锈了。”
C.酒精灯:“帽子哪里去了?我的燃料越来越少了。”
D.试管:“我在试管架上呆了一段时间,原先附着的水怎么不见了?”
9.根据下列实验设计进行实验,不能达到相应实验目的的是
编号 A B C D
设计实验
实验目的 探究蜡烛中含有氢元素 探究可燃物燃烧条件 探究铁生锈与氧气有关 探究质量守恒定律
A.A B.B C.C D.D
10.下列变化中,发生了化学变化的是
A.道路结冰 B.海水蒸发 C.钢铁生锈 D.工业制氧
二、判断题
11.在金属表面刷漆的目的是隔绝氧气和水蒸气,防止锈蚀( )
12.在钢铁表面喷油漆,可防止生锈( )
13.废旧电池中含有铅、镍、镉、汞等金属,若将这些金属回收利用,不仅可以节约金属资源,而且可以减少对环境的污染。( )
14.随意丢弃废旧电池,会导致固体废弃物和重金属离子对环境的污染。( )
15.铁制品部分腐蚀后,没有回收的价值( )
三、综合应用题
16.金属是人类生活中常用的材料。请回答:
(1)天津地铁4号线预计2021年建成通车。
①地铁列车车体大量使用的铝合金属于 (填“单质”或“混合物”)。
②地铁建造过程中需要使用大量的生铁和钢,两者的主要区别是 。
(2)铁制品锈蚀的过程,实际上是铁跟空气中的 、 等发生化学反应的过程。
(3)为探究锌、铁、铜三种金属的活动性,及其与氢元素的位置关系,下列不需要进行的实验是 (填标号)
A 将铁片放入稀硫酸中 B 将铁片放入硫酸锌溶液中
C 将铜片放入稀硫酸中 D 将铁片放入硫酸铜溶液中
(4)将光亮的铜片置于潮湿空气中一段时间后,表面出现绿色铜锈(主要成分是碱式碳酸铜Cu2(OH)2CO3)。以铜锈为原料设计并完成如下图所示实验(杂质不与稀硫酸反应,且不含铜元素)。
①无色气体E的化学式是 。
②Ⅱ过程的化学方程式是 。
③若该铜锈样品的质量是20g,固体D的质量是6.4g,则铜锈中含Cu2(OH)2CO3的质量分数是 。
17.金属材料对于促进生产发展,改善人类生活发挥了重大作用。
(1)生铁和钢的性能不同,原因是 。
(2)铁锈中含有Fe、O、H元素,从元素守恒角度说明铁生锈是铁与 共同作用的结果。
(3)对于铁制品的保存,你的建议是 。(写一条)
(4)小明和小红在做金属活动性顺序的探究实验。他们将洁净的铁钉加入有硫酸铜溶液的试管中、观察到铁钉表面有无色无味的气体产生,一段时间后,在铁钉表面附着了红色的固体。
【提出问题】产生的气体是什么物质?
【做出猜想】猜想一:二氧化硫;猜想二:氧气;猜想三:氢气。
【进行实验】
①小红提出,闻一闻产生的气体,方法是 根据 ,她判断该气体不是二氧化硫。
②他们又做了实验: 从而证明了该气体不是氧气。从而判断该气体是氢气。
经过向老师咨询得知,一般配制硫酸铜溶液时都要加入适量稀硫酸以保持其稳定存在。实验中产生氢气的化学方程式是 。
③早在西汉时期的《淮南万毕术》中就记载:“曾青得铁则化为铜”成为现代湿法冶金的先驱。现有含1.6kg硫酸铜的工业废液,加入铁粉回收铜。请计算:理论上与硫酸铜反应消耗铁粉的质量 。
18.金属材料在国防建设中起着重要的作用
(1)改装前的“辽宁舰”锈迹斑斑,钢铁锈蚀主要是铁与 的结果。工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为 。
(2)为避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强的金属。小明为探究锌、铁、铜三种金属的活动性顺序,设计了下图的两个实验:
①实验1中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不合理,理由是 。
②通过实验2,可证明铁的活动性比铜强,反应的化学方程式是 。
(3)某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如下所示流程。
该回收流程中:固体A的成分是 ;含铁元素的物质(污水除外)有 (填字母序号)。
参考答案:
1.D
【详解】A铁部分锈蚀后还有回收的价值。此项错误。
B地壳中含量最丰富的金属元素是铝。此项错误。
C铁锈的结构比较疏松,能够存在水和氧气,所以不但不能阻止还会加快铁继续被锈蚀。因此铁制品生锈后要及时除去表面的锈。此选项错误。
D铁生锈是铁、氧气和水三种物质共同反应,发生复杂化学反应的过程。此选项正确。
2.C
【详解】A.海水晒盐过程中只有物质状态的变化,没有新物质生成,属于物理变化。
B.太阳能取暖过程中只有物质能量的变化,没有新物质生成,属于物理变化。
C.铁矿石炼铁过程中有新物质铁生成,属于化学变化。
D.风力发电过程中只有能量形式的变化,没有新物质生成,属于物理变化。
故选C。
3.D
【详解】A、将燃着的木条伸入集气瓶中,木条燃烧更旺的是氧气,木条熄灭的是二氧化碳,现象不同,可以鉴别,故A正确;
B、氢气的密度比空气小,应该是短进长出,故B正确;
C、二氧化碳溶于水,瓶内的气压减小,瓶子会变瘪,可以验证,故C正确;
D、实验过程中,左边试管中的铁钉生锈,右边试管中的铁钉不生锈,说明只有水时铁钉不能生锈,不能说明铁钉生锈需要氧气参加,故D错误。
故选:D。
4.A
【详解】A、a试管内的铁钉与水、氧气同时接触而生锈,氧气被消耗,试管内气压减小;b试管内铁钉只能与氧气接触不生锈,气压不变,在大气压作用下,则最终U型管内红墨水液面左高右低,说法错误;
B、植物油的作用是隔绝空气,防止空气中的少量氧气溶于水,说法正确;
C、氯化钙具有吸水性,试管b中的干燥剂可以是无水氯化钙,说法正确;
D、试管a中有铁、有水、有氧气,铁钉生锈,b试管中有铁、无水、有氧气,则对比试管a、b可以验证铁生锈需要水,说法正确。
故选A。
5.B
【详解】A、铁与氧气和水共同接触时会生锈,在铁制品表面涂油漆,能隔绝空气,防止铁制品锈蚀,该选项做法恰当;
B、铁制品表面的油膜能隔绝空气,若除去油膜,会使铁制品锈蚀,该选项做法不恰当;
C、将使用后的菜刀用布擦干,保持菜刀干燥,能防止铁制品锈蚀,该选项做法恰当;
D、在脸盆、杯子等表面烧涂搪瓷,能隔绝空气,防止铁制品锈蚀,该选项做法恰当。
故选B。
6.C
【详解】A、干冰升华需吸收大量的热,使空气中的水蒸气冷凝成水滴,故可用于人工降雨,选项正确;
B、明矾溶于水能形成吸附性物质,形成絮状物而陈降下来,故可用于自来水厂净水,选项正确;
C、铁锈疏松多孔覆盖在铁制品表面,则会吸附水分加剧铁的锈蚀,故不能防止铁制品继续被腐蚀,选项错误;
D、氢气具有可燃性,和氧气点燃生成水,可用作燃料,选项正确;
故选:C。
7.C
【详解】A.铁在食盐水中生锈速度会加快,该选项说法正确;
B.由于铁与氧气和水共同接触时会生锈,则装置中由于氧气的减少而压强较小,则烧杯中的水会倒吸入锥形瓶中,则水中滴加红墨水,便于观察实验现象,该选项说法正确;
C.实验过程中,锥形瓶中的氧气被消耗,压强减小,烧杯中的水会沿导管倒吸入锥形瓶中,该选项说法不正确;
D.铁锈是红棕色,则一段时间后,铁丝表面出现红棕色物质,该选项说法正确,
故选C。
8.B
【详解】A、锥形瓶破碎,没有生成新物质,属于物理变化,故A不符合题意;
B、铁架台生锈,生成新物质,属于化学变化,故B符合题意;
C、酒精灯燃料越来越少,是因为酒精挥发,没有生成新物质,属于物理变化,故C不符合题意;
D、试管上的水蒸发变成水蒸气,没有生成新物质,属于物理变化,故D不符合题意。
故选B。
9.D
【分析】结合给出的实验目的和对应的实验装置进行分析是否能够达到对应的目的。
【详解】A、证明蜡烛中含有氢元素,可验证蜡烛燃烧生成物中有水来证明,当干而冷的烧杯内壁上出现水雾,则证明蜡烛中含有氢元素,故A正确;B、铜片上的白磷和水中的白磷的温度都达到了着火点,铜片上的白磷能够燃烧,而水中的白磷不能燃烧,说明可燃物燃烧需要与氧气接触;铜片上的白磷和红磷都与氧气接触,而温度达到了白磷的着火点,能够燃烧,温度没有达到红磷的着火点,不能燃烧,说明温度达到可燃物着火点时才能够燃烧,故B正确;C、铁只和水接触时不生锈,与水、氧气接触时能生锈,能说明铁钉生锈与氧气有关,故C正确;D、氯化钾和碳酸钠混合不能发生反应,所以不能用来验证质量守恒定律。故D错误。故选D。
10.C
【详解】A、道路结冰,水结冰只是水的状态发生了改变,没有新物质生成,属于物理变化;
B、海水蒸发,水由液态变为气态,没有新物质生成,属于物理变化;
C、铁锈的主要成分为氧化铁,钢铁生锈有新物质生成,属于化学变化;
D、工业制氧,是根据液氧和液氮的沸点不同,先将空气除杂液化后,再将温度控制在高于液氮的沸点而低于液氧气的沸点之间,液氮蒸发出去,剩下的主要是液氧了,该过程没有新物质生成,属于物理变化;
故选C。
11.正确
【详解】金属与水、氧气充分接触时容易生锈,使金属制品与氧气和水隔绝可以防止生锈。在金属表面刷漆的目的是隔绝氧气和水蒸气,防止锈蚀,正确。
12.正确
【详解】在钢铁表面喷油漆,能够隔绝钢铁与氧气和水的接触,可防止生锈,叙述正确,钢铁正确。
13.正确
【详解】废电池随意丢弃会造成水体污染和土壤污染,不随意丢弃废电池有利于环境保护,合理回收利用废旧电池及废旧金属还节约了金属资源。
14.正确
【详解】废旧电池中的汞、铅、镉等重金属溶出会污染地下水和土壤,一块废旧的电池可以污染600t的水,可见废电池对环境的污染很大,不能随意丢弃,目前,处理废旧电池的最好办法是回收再利用。故正确。
15.错误
【详解】金属资源的保护包括废旧金属的回收利用,铁制品部分腐蚀后,里面还没有锈蚀,需要回收利用,所以题目说法错误。
故填:错误
16. 混合物 含碳量不同 氧气 水 D H2 Fe+CuSO4=FeSO4+Cu 55.5%
【详解】(1)①合金都属于混合物,故填:混合物;
②生铁和钢的主要成分是铁,两者的主要区别是含碳量不同,钢的含碳量为0.03%~2%,生铁的含碳量为2%~4.3%,故填:含碳量不同;
(2)铁制品锈蚀的过程,实际上是铁跟空气中的氧气、水等发生化学反应的过程,故填:氧气(O2);水(H2O);
(3)A中产生气泡,是因为铁和稀硫酸反应生成硫酸亚铁和氢气,说明铁排在氢的前面; B中无明显现象,说明铁不能和硫酸锌反应,即锌比铁活泼; C中无明显现象,是因为铜不能和稀硫酸反应,说明铜排在氢后面,通过ABC可以探究锌、铁、铜三种金属的活动性及其与氢元素的位置关系,不需要再比较铁与铜的活动性强弱,故填:D;
(4)由题意可知,碱式碳酸铜Cu2(OH)2CO3)与稀硫酸反应生成二氧化碳、水和硫酸铜,铁与硫酸铜反应生成铜和硫酸亚铁,过量的铁与稀硫酸反应生成硫酸亚铁和(氢气),所以A是硫酸铜溶液、B是铁和铜,C是硫酸亚铁溶液,D是铜,E是氢气;
①无色气体E是氢气,其化学式为H2,故填:H2;
②铁与硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu,故填:Fe+CuSO4= FeSO4+Cu;
③D是铜,根据反应前后铜元素的质量守恒,Cu2(OH)2CO3的质量为6.4g÷(×100%)=11.1g,铜锈中含Cu2(OH)2CO3的质量分数是×100%=55.5%,故填:55.5%。
17.(1)含碳量不同
(2)氧气和水
(3)保持铁制品洁净干燥(合理即可)
(4) 用手轻轻在瓶口扇动,使少量气体飘进鼻孔 无刺激性气味 将带火星的木条伸入试管,木条不复燃 解:设理论上与硫酸铜反应消耗铁粉的质量为x
答:理论上与硫酸铜反应消耗铁粉的质量为0.56kg。
【详解】(1)生铁和钢的性能不同,原因是含碳量不同;
(2)铁锈中含有Fe、O、H元素,从元素守恒角度说明铁生锈是铁与氧气和水共同作用的结果,因为水中含有氢、氧元素,氧气中含有氧元素;
(3)防止铁生锈的原理是隔绝空气隔绝水,对于铁制品的保存,我的建议保持铁制品洁净干燥;
(4)①小红提出,闻一闻产生的气体,方法是用手轻轻在瓶口扇动,使少量气体飘进鼻孔,根据无刺激性气味,她判断该气体不是二氧化硫,因为二氧化硫是一种有刺激性气味的气体;
②氧气具有助燃性,能使带火星的木条复燃,将带火星的木条伸入试管,木条不复燃,从而证明了该气体不是氧气。从而判断该气体是氢气。铁和硫酸溶液反应生成硫酸亚铁和氢气,该反应化学方程式:;
③解析见答案。
18. 氧气(或空气)、水 Fe2O3+6HCl=2FeCl3+3H2O 酸不同 Fe+CuSO4 =Fe SO4+Cu Cu、Fe、Zn(或铜、铁、锌) ACD
【详解】(1). 铁锈的主要成分是氧化铁,和盐酸反应生成氯化铁和水,用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为Fe2O3 + 6HCl → 2FeCl3 + 3H2O ; (2). 据控制变量原则,以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱时,所有影响反应速率的因素都应该相同。所以应该用同种酸的溶液; (3).铁与硫酸铜溶液反应可证明铁的活动性比铜的强,反应方程式为: Fe + CuSO4 → Cu + FeSO4 (4).污水中含有CuSO4、ZnSO4、FeSO4,要回收硫酸锌,需要将硫酸铜和硫酸亚铁都转化成硫酸锌,所以甲为锌,由于锌过量,所以固体A为Zn Fe Cu;加入过量的酸后,锌、铁反应称为溶液,所以滤液C中有硫酸亚铁、硫酸锌,加入适量锌置换出铁,得硫酸锌溶液。含铁元素的物质有A C D
点睛:金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。
学校:___________姓名:___________班级:___________考号:___________
1. 金属的存在形式:金属在自然界中通常以单质或化合物的形式存在。一些化学性质不活泼的金属,如金、银等,通常以单质的形式存在。而化学性质较活泼的金属,如铁、锌、钠和钙等,则通常以化合物的形式存在,例如矿石。
2. 金属的冶炼:通过一系列物理和化学过程,将矿石中的金属元素提炼出来,使其转化为可供使用的金属。例如,铁的冶炼就是一个将铁矿石中的铁元素提炼出来,制成铁制品的过程。
3. 金属的锈蚀与防护:金属在与空气、水等环境因素接触时,容易发生锈蚀。锈蚀不仅影响金属的外观和使用性能,还会造成资源的浪费。因此,需要采取一些措施来防止金属的锈蚀,如保持金属表面的干燥、涂防锈漆、电镀等。
4. 金属资源的珍惜与保护:金属资源是有限的,而且一些金属的开采和冶炼过程还会对环境造成破坏。因此,我们需要珍惜和保护金属资源,避免浪费和过度开采。同时,还需要推广金属的再生利用,减少对新资源的需求。
5. 金属的回收与再利用:通过回收和再利用废旧金属,可以减少对新资源的需求,降低生产成本,同时减少环境污染。因此,推广金属的回收和再利用是珍惜和保护金属资源的重要措施之一。
一、选择题
1.下列关于铁的说法正确的是( )
A.铁部分锈蚀后没有回收价值
B.铁是地壳中含量最丰富的金属元素
C.铁生锈,产生的铁锈能阻止铁继续被锈蚀
D.铁生锈是铁在有氧气和水等物质存在的条件下,发生复杂化学反应的过程
2.下列自然资源的利用过程中,发生了化学变化的是( )
A.海水晒盐 B.太阳能取暖 C.铁矿石炼铁 D.风力发电
3.下列有关实验设计达不到实验目的的是
A. 鉴别二氧化碳和氧气
B. 收集氢气
C. 探究二氧化碳的溶解性
D. 证明铁生锈是水和氧气共同作用的结果
4.为探究铁生锈的条件,同学们在实验室设计了如图所示实验。下列有关该实验的相关说法错误的是
A.最终U形管内红墨水液面左低右高
B.植物油的作用是防止空气中的少量氧气溶于水
C.试管b中的干燥剂可以是无水氯化钙
D.对比试管a、b可以验证铁生锈需要水
5.为了防止铁制品锈蚀,下列做法不恰当的是
A.在铁制品表面涂油漆 B.用洗洁精除去铁制品表面的油膜
C.将使用后的菜刀用布擦干 D.在脸盆、杯子等表面烧涂搪瓷
6.物质的性质决定物质的用途。下列说法错误的是
A.干冰升华需吸收大量的热,可用于人工降雨
B.明矾溶于水能形成吸附性物质,可用于自来水厂净水
C.铁锈疏松多孔覆盖在铁制品表面,可用于防止铁制品继续被腐蚀
D.氢气具有可燃性,可用作燃料
7.某化学兴趣小组探究铁生锈实验,取一块废旧铁丝网,将铁丝网剪成几小片,用稀盐酸除去铁锈后,放入锥形瓶中、在锥形瓶中加入3~4mL浓食盐水,塞紧带导管的单孔塞后,将导管的另一端伸入滴有红墨水的水中,下列说法中错误的是
A.浓食盐水的作用是加快铁丝网生锈
B.水中滴加红墨水,便于观察实验现象
C.实验过程中,烧杯中的导管口会冒气泡
D.一段时间后,铁丝表面出现红棕色物质
8.下列实验室中的交流,属于化学变化的是
A.锥形瓶:“同学们不爱惜我,我被摔碎了!”
B.铁架台:“好难受啊!我在潮湿的空气中生锈了。”
C.酒精灯:“帽子哪里去了?我的燃料越来越少了。”
D.试管:“我在试管架上呆了一段时间,原先附着的水怎么不见了?”
9.根据下列实验设计进行实验,不能达到相应实验目的的是
编号 A B C D
设计实验
实验目的 探究蜡烛中含有氢元素 探究可燃物燃烧条件 探究铁生锈与氧气有关 探究质量守恒定律
A.A B.B C.C D.D
10.下列变化中,发生了化学变化的是
A.道路结冰 B.海水蒸发 C.钢铁生锈 D.工业制氧
二、判断题
11.在金属表面刷漆的目的是隔绝氧气和水蒸气,防止锈蚀( )
12.在钢铁表面喷油漆,可防止生锈( )
13.废旧电池中含有铅、镍、镉、汞等金属,若将这些金属回收利用,不仅可以节约金属资源,而且可以减少对环境的污染。( )
14.随意丢弃废旧电池,会导致固体废弃物和重金属离子对环境的污染。( )
15.铁制品部分腐蚀后,没有回收的价值( )
三、综合应用题
16.金属是人类生活中常用的材料。请回答:
(1)天津地铁4号线预计2021年建成通车。
①地铁列车车体大量使用的铝合金属于 (填“单质”或“混合物”)。
②地铁建造过程中需要使用大量的生铁和钢,两者的主要区别是 。
(2)铁制品锈蚀的过程,实际上是铁跟空气中的 、 等发生化学反应的过程。
(3)为探究锌、铁、铜三种金属的活动性,及其与氢元素的位置关系,下列不需要进行的实验是 (填标号)
A 将铁片放入稀硫酸中 B 将铁片放入硫酸锌溶液中
C 将铜片放入稀硫酸中 D 将铁片放入硫酸铜溶液中
(4)将光亮的铜片置于潮湿空气中一段时间后,表面出现绿色铜锈(主要成分是碱式碳酸铜Cu2(OH)2CO3)。以铜锈为原料设计并完成如下图所示实验(杂质不与稀硫酸反应,且不含铜元素)。
①无色气体E的化学式是 。
②Ⅱ过程的化学方程式是 。
③若该铜锈样品的质量是20g,固体D的质量是6.4g,则铜锈中含Cu2(OH)2CO3的质量分数是 。
17.金属材料对于促进生产发展,改善人类生活发挥了重大作用。
(1)生铁和钢的性能不同,原因是 。
(2)铁锈中含有Fe、O、H元素,从元素守恒角度说明铁生锈是铁与 共同作用的结果。
(3)对于铁制品的保存,你的建议是 。(写一条)
(4)小明和小红在做金属活动性顺序的探究实验。他们将洁净的铁钉加入有硫酸铜溶液的试管中、观察到铁钉表面有无色无味的气体产生,一段时间后,在铁钉表面附着了红色的固体。
【提出问题】产生的气体是什么物质?
【做出猜想】猜想一:二氧化硫;猜想二:氧气;猜想三:氢气。
【进行实验】
①小红提出,闻一闻产生的气体,方法是 根据 ,她判断该气体不是二氧化硫。
②他们又做了实验: 从而证明了该气体不是氧气。从而判断该气体是氢气。
经过向老师咨询得知,一般配制硫酸铜溶液时都要加入适量稀硫酸以保持其稳定存在。实验中产生氢气的化学方程式是 。
③早在西汉时期的《淮南万毕术》中就记载:“曾青得铁则化为铜”成为现代湿法冶金的先驱。现有含1.6kg硫酸铜的工业废液,加入铁粉回收铜。请计算:理论上与硫酸铜反应消耗铁粉的质量 。
18.金属材料在国防建设中起着重要的作用
(1)改装前的“辽宁舰”锈迹斑斑,钢铁锈蚀主要是铁与 的结果。工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为 。
(2)为避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强的金属。小明为探究锌、铁、铜三种金属的活动性顺序,设计了下图的两个实验:
①实验1中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不合理,理由是 。
②通过实验2,可证明铁的活动性比铜强,反应的化学方程式是 。
(3)某电镀厂排放的污水中含有CuSO4、ZnSO4、FeSO4,为减少水污染及节约成本,回收重要物质硫酸锌及有关金属,设计如下所示流程。
该回收流程中:固体A的成分是 ;含铁元素的物质(污水除外)有 (填字母序号)。
参考答案:
1.D
【详解】A铁部分锈蚀后还有回收的价值。此项错误。
B地壳中含量最丰富的金属元素是铝。此项错误。
C铁锈的结构比较疏松,能够存在水和氧气,所以不但不能阻止还会加快铁继续被锈蚀。因此铁制品生锈后要及时除去表面的锈。此选项错误。
D铁生锈是铁、氧气和水三种物质共同反应,发生复杂化学反应的过程。此选项正确。
2.C
【详解】A.海水晒盐过程中只有物质状态的变化,没有新物质生成,属于物理变化。
B.太阳能取暖过程中只有物质能量的变化,没有新物质生成,属于物理变化。
C.铁矿石炼铁过程中有新物质铁生成,属于化学变化。
D.风力发电过程中只有能量形式的变化,没有新物质生成,属于物理变化。
故选C。
3.D
【详解】A、将燃着的木条伸入集气瓶中,木条燃烧更旺的是氧气,木条熄灭的是二氧化碳,现象不同,可以鉴别,故A正确;
B、氢气的密度比空气小,应该是短进长出,故B正确;
C、二氧化碳溶于水,瓶内的气压减小,瓶子会变瘪,可以验证,故C正确;
D、实验过程中,左边试管中的铁钉生锈,右边试管中的铁钉不生锈,说明只有水时铁钉不能生锈,不能说明铁钉生锈需要氧气参加,故D错误。
故选:D。
4.A
【详解】A、a试管内的铁钉与水、氧气同时接触而生锈,氧气被消耗,试管内气压减小;b试管内铁钉只能与氧气接触不生锈,气压不变,在大气压作用下,则最终U型管内红墨水液面左高右低,说法错误;
B、植物油的作用是隔绝空气,防止空气中的少量氧气溶于水,说法正确;
C、氯化钙具有吸水性,试管b中的干燥剂可以是无水氯化钙,说法正确;
D、试管a中有铁、有水、有氧气,铁钉生锈,b试管中有铁、无水、有氧气,则对比试管a、b可以验证铁生锈需要水,说法正确。
故选A。
5.B
【详解】A、铁与氧气和水共同接触时会生锈,在铁制品表面涂油漆,能隔绝空气,防止铁制品锈蚀,该选项做法恰当;
B、铁制品表面的油膜能隔绝空气,若除去油膜,会使铁制品锈蚀,该选项做法不恰当;
C、将使用后的菜刀用布擦干,保持菜刀干燥,能防止铁制品锈蚀,该选项做法恰当;
D、在脸盆、杯子等表面烧涂搪瓷,能隔绝空气,防止铁制品锈蚀,该选项做法恰当。
故选B。
6.C
【详解】A、干冰升华需吸收大量的热,使空气中的水蒸气冷凝成水滴,故可用于人工降雨,选项正确;
B、明矾溶于水能形成吸附性物质,形成絮状物而陈降下来,故可用于自来水厂净水,选项正确;
C、铁锈疏松多孔覆盖在铁制品表面,则会吸附水分加剧铁的锈蚀,故不能防止铁制品继续被腐蚀,选项错误;
D、氢气具有可燃性,和氧气点燃生成水,可用作燃料,选项正确;
故选:C。
7.C
【详解】A.铁在食盐水中生锈速度会加快,该选项说法正确;
B.由于铁与氧气和水共同接触时会生锈,则装置中由于氧气的减少而压强较小,则烧杯中的水会倒吸入锥形瓶中,则水中滴加红墨水,便于观察实验现象,该选项说法正确;
C.实验过程中,锥形瓶中的氧气被消耗,压强减小,烧杯中的水会沿导管倒吸入锥形瓶中,该选项说法不正确;
D.铁锈是红棕色,则一段时间后,铁丝表面出现红棕色物质,该选项说法正确,
故选C。
8.B
【详解】A、锥形瓶破碎,没有生成新物质,属于物理变化,故A不符合题意;
B、铁架台生锈,生成新物质,属于化学变化,故B符合题意;
C、酒精灯燃料越来越少,是因为酒精挥发,没有生成新物质,属于物理变化,故C不符合题意;
D、试管上的水蒸发变成水蒸气,没有生成新物质,属于物理变化,故D不符合题意。
故选B。
9.D
【分析】结合给出的实验目的和对应的实验装置进行分析是否能够达到对应的目的。
【详解】A、证明蜡烛中含有氢元素,可验证蜡烛燃烧生成物中有水来证明,当干而冷的烧杯内壁上出现水雾,则证明蜡烛中含有氢元素,故A正确;B、铜片上的白磷和水中的白磷的温度都达到了着火点,铜片上的白磷能够燃烧,而水中的白磷不能燃烧,说明可燃物燃烧需要与氧气接触;铜片上的白磷和红磷都与氧气接触,而温度达到了白磷的着火点,能够燃烧,温度没有达到红磷的着火点,不能燃烧,说明温度达到可燃物着火点时才能够燃烧,故B正确;C、铁只和水接触时不生锈,与水、氧气接触时能生锈,能说明铁钉生锈与氧气有关,故C正确;D、氯化钾和碳酸钠混合不能发生反应,所以不能用来验证质量守恒定律。故D错误。故选D。
10.C
【详解】A、道路结冰,水结冰只是水的状态发生了改变,没有新物质生成,属于物理变化;
B、海水蒸发,水由液态变为气态,没有新物质生成,属于物理变化;
C、铁锈的主要成分为氧化铁,钢铁生锈有新物质生成,属于化学变化;
D、工业制氧,是根据液氧和液氮的沸点不同,先将空气除杂液化后,再将温度控制在高于液氮的沸点而低于液氧气的沸点之间,液氮蒸发出去,剩下的主要是液氧了,该过程没有新物质生成,属于物理变化;
故选C。
11.正确
【详解】金属与水、氧气充分接触时容易生锈,使金属制品与氧气和水隔绝可以防止生锈。在金属表面刷漆的目的是隔绝氧气和水蒸气,防止锈蚀,正确。
12.正确
【详解】在钢铁表面喷油漆,能够隔绝钢铁与氧气和水的接触,可防止生锈,叙述正确,钢铁正确。
13.正确
【详解】废电池随意丢弃会造成水体污染和土壤污染,不随意丢弃废电池有利于环境保护,合理回收利用废旧电池及废旧金属还节约了金属资源。
14.正确
【详解】废旧电池中的汞、铅、镉等重金属溶出会污染地下水和土壤,一块废旧的电池可以污染600t的水,可见废电池对环境的污染很大,不能随意丢弃,目前,处理废旧电池的最好办法是回收再利用。故正确。
15.错误
【详解】金属资源的保护包括废旧金属的回收利用,铁制品部分腐蚀后,里面还没有锈蚀,需要回收利用,所以题目说法错误。
故填:错误
16. 混合物 含碳量不同 氧气 水 D H2 Fe+CuSO4=FeSO4+Cu 55.5%
【详解】(1)①合金都属于混合物,故填:混合物;
②生铁和钢的主要成分是铁,两者的主要区别是含碳量不同,钢的含碳量为0.03%~2%,生铁的含碳量为2%~4.3%,故填:含碳量不同;
(2)铁制品锈蚀的过程,实际上是铁跟空气中的氧气、水等发生化学反应的过程,故填:氧气(O2);水(H2O);
(3)A中产生气泡,是因为铁和稀硫酸反应生成硫酸亚铁和氢气,说明铁排在氢的前面; B中无明显现象,说明铁不能和硫酸锌反应,即锌比铁活泼; C中无明显现象,是因为铜不能和稀硫酸反应,说明铜排在氢后面,通过ABC可以探究锌、铁、铜三种金属的活动性及其与氢元素的位置关系,不需要再比较铁与铜的活动性强弱,故填:D;
(4)由题意可知,碱式碳酸铜Cu2(OH)2CO3)与稀硫酸反应生成二氧化碳、水和硫酸铜,铁与硫酸铜反应生成铜和硫酸亚铁,过量的铁与稀硫酸反应生成硫酸亚铁和(氢气),所以A是硫酸铜溶液、B是铁和铜,C是硫酸亚铁溶液,D是铜,E是氢气;
①无色气体E是氢气,其化学式为H2,故填:H2;
②铁与硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu,故填:Fe+CuSO4= FeSO4+Cu;
③D是铜,根据反应前后铜元素的质量守恒,Cu2(OH)2CO3的质量为6.4g÷(×100%)=11.1g,铜锈中含Cu2(OH)2CO3的质量分数是×100%=55.5%,故填:55.5%。
17.(1)含碳量不同
(2)氧气和水
(3)保持铁制品洁净干燥(合理即可)
(4) 用手轻轻在瓶口扇动,使少量气体飘进鼻孔 无刺激性气味 将带火星的木条伸入试管,木条不复燃 解:设理论上与硫酸铜反应消耗铁粉的质量为x
答:理论上与硫酸铜反应消耗铁粉的质量为0.56kg。
【详解】(1)生铁和钢的性能不同,原因是含碳量不同;
(2)铁锈中含有Fe、O、H元素,从元素守恒角度说明铁生锈是铁与氧气和水共同作用的结果,因为水中含有氢、氧元素,氧气中含有氧元素;
(3)防止铁生锈的原理是隔绝空气隔绝水,对于铁制品的保存,我的建议保持铁制品洁净干燥;
(4)①小红提出,闻一闻产生的气体,方法是用手轻轻在瓶口扇动,使少量气体飘进鼻孔,根据无刺激性气味,她判断该气体不是二氧化硫,因为二氧化硫是一种有刺激性气味的气体;
②氧气具有助燃性,能使带火星的木条复燃,将带火星的木条伸入试管,木条不复燃,从而证明了该气体不是氧气。从而判断该气体是氢气。铁和硫酸溶液反应生成硫酸亚铁和氢气,该反应化学方程式:;
③解析见答案。
18. 氧气(或空气)、水 Fe2O3+6HCl=2FeCl3+3H2O 酸不同 Fe+CuSO4 =Fe SO4+Cu Cu、Fe、Zn(或铜、铁、锌) ACD
【详解】(1). 铁锈的主要成分是氧化铁,和盐酸反应生成氯化铁和水,用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为Fe2O3 + 6HCl → 2FeCl3 + 3H2O ; (2). 据控制变量原则,以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱时,所有影响反应速率的因素都应该相同。所以应该用同种酸的溶液; (3).铁与硫酸铜溶液反应可证明铁的活动性比铜的强,反应方程式为: Fe + CuSO4 → Cu + FeSO4 (4).污水中含有CuSO4、ZnSO4、FeSO4,要回收硫酸锌,需要将硫酸铜和硫酸亚铁都转化成硫酸锌,所以甲为锌,由于锌过量,所以固体A为Zn Fe Cu;加入过量的酸后,锌、铁反应称为溶液,所以滤液C中有硫酸亚铁、硫酸锌,加入适量锌置换出铁,得硫酸锌溶液。含铁元素的物质有A C D
点睛:金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。
