6.1.1化学反应速率 影响化学反应速率的因素(同步课件)(共36张PPT)-2023-2024学年高一化学(苏教版2019必修第二册)
文档属性
| 名称 | 6.1.1化学反应速率 影响化学反应速率的因素(同步课件)(共36张PPT)-2023-2024学年高一化学(苏教版2019必修第二册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 44.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 00:00:00 | ||
图片预览










文档简介
(共36张PPT)
第一节 化学反应速率与反应限度 课时1 化学反应速率
影响化学反应速率的因素
专题六 化学反应与能量变化
授课人:
1.能从内因、外因两个方面认识化学反应速率。
2.学会运用控制变量方法研究影响化学反应速率的因素。
3.初步建立变化观念与平衡思想,能运用动态平衡的观点看待和分析
化学变化。
4.认识化学反应速率的研究在生产、生活中的重要作用。
学习目标
不同化学反应进行的快慢程度不同。
如何定量地判断一个化学反应的速率快慢?
可用单位时间内反应物浓度的减少或
生成物浓度的增加来表示。
表达
式 v(B) =
=
用来衡量化学反应过程进行快慢程度的 物理量。
一、化学反应速率
c(B)反应前 - c(B)反应后
概念
Δc(B)
Δt
化学反 应速率
表示 方法
Δt
mol·L-1 ·min-1或mol·L-1 ·s-1
换算: 1mol/(L min)= mol/(L s)
Δc为浓度的变化量, 一般 以mol·L- 1为单位
常用单位:
mol/(L·min) 或mol/(L·s)
Δt为时间, 一般 以s或min为单位
一、化学反应速率
Δc(B) v(B) = Δt
1mol/(L s)= 60 mol/(L min)
(BV)
Δt
Δn
=
注意1:一个确定的化学反应涉及反应物、生成物等多种物质,
因而定量表示一个化学反应的反应速率时,必须指明是用哪一种
反应物或哪一种生成物来表示。
如: v(B)是指用B表示的化学反应速率;
v(C)是指用C表示的化学反应速率。
3C(g) + 4D(l)
Δc(B)
Δt
A(s) + 2B(g)
v(B) =
一、化学反应速率
注意3: 无论是用某一反应物表示还是用某一生成物表示,
其化学反应速率都取正值,而且是某一段时间内的平均速率,
不是某一时刻的瞬时速率。
注意2: 固体或纯液体的浓度为常数,
Δc=0,因此不用固体或纯液体的浓 度表示化学反应速率。
一、化学反应速率
A(s) + 2B(g) 3C(g) + 4D(l)
Δt
= Δc(B)
v(B)
注意3: 无论是用某一反应物表示还是用某一生成物
表示,其化学反应速率都取正值,而且是某一段时 间内的平均速率,不是某一时刻的瞬时速率。
A(s) + 2B(g) 3C(g) + 4D(l)
v(B) =
一、化学反应速率
例1 在一定条件下,某双氧水放置100 min后, H2O2 的 浓度从 5× 10-2 mol/L下降到4× 10-2mol/L ,在这
100 min内H2O2 的分解反应速率为多少?
解:
v(H2O2 )= △c (H2O2 )= 5× 10-2 i × 10-2 mol/L
= 1× /L= 1× 10-4mol/(L min)
100 min
10-2 mol
t
△
n
4
100 m
mol/L-
一、化学反应速率
例2 在1L容器中发生反应: N2 + 3H2 2NH3
1min后,生成1molNH3 ,求v(NH3) , v(N2) ,v(H2).
解:△c(NH3)= =1mol/L
v(NH3) =1mol/(L min)
同理可求: v(N2)=0.5mol/(L min ), v(H2)=1.5mol/(L min )
v(N2) : v(H2) : v(NH3)
=0.5mol/(L min ): 1.5mol/(L min ): 1mol/(L min)
思考 :各物质的速率与化学计量数有什么关系?
一、化学反应速率
=1:3:2
规律:
对于同一反应,用不同的物质来表示反应速率,其 比值一定等于化学方程式中相应的化学计量数之比。
mA(g) + nB(g) pC(g)+qD(g)
v(A) ∶ v(B) ∶ v(C) ∶ v(D)
= m∶ n∶ p∶ q
= Δc(A) :Δc(B) :Δc(C) :Δc(D)
= Δn(A) :Δn(B) :Δn(C) :Δn(D)
一、化学反应速率
某温度下,浓度都是1 mol·L-1的两种气体X2和Y2 ,在
密闭容器中反应生成气体Z,经过t min后,测得各物质 的浓度分别为c(X2)=0.4 mol·L-1 ,c(Y2)=0.8 mol·L-1、 c(Z)=0.4 mol·L-1 ,则该反应的化学方程式可表示为 。 3X2+Y2===2X3Y
一、化学反应速率
例3
(1)ν(A)=0.3mol/(L·s )
(2) ν(B)=0.6mol/(L·s)
(3) ν(C)=0.4mol/(L·s)
(4) ν(D)=0.45mol/(L·s)
则该反应速率的快慢顺序为: (1)>(4)>(2)=(3)
例4 反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
注意:比较反应的快慢,应取同一参照物
一、化学反应速率
规律应用: 化学反应速率大小的比较方法
(1)归一法: 若单位不统一,则要换算成相同的单位;若为不
同物质表示的反应速率,则要换算成同一物质来表示反应速 率;再比较数值的大小。
一、化学反应速率
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下:
①v(CO)=1.5 mol·L-1 ·min-1
②v(NO2)=0.01 mol·L-1 · s-1
③v(N2)=0.4 mol·L-1 ·min-1
③_①_②_④(由大到小的顺序)。
1
慢:
in-
快
m
的
1 ·
应
L-
反
·
况
ol
情
m
种
1
4
1.
述
=
上
2)
较
CO
比
v(
请
④
② = 1
④ v(CO2) =1.1 mol·L-1 ·min-1
4 4
v(N2) 0.4 mol·L-1 ·min-1
=
1 1
v(CO) 1.5mol·L-1 ·min-1
=
4 4
一、化学反应速率
①
③
例5
规律应用: 化学反应速率大小的比较方法
(2)比值法: 比较化学反应速率与化学计量数的比值,如aA(g)
+ bB(g)===cC(g)+dD(g),比较 与 ,若 > ,
则说明用A表示的化学反应速率大于用B表示的化学反应速率。
一、化学反应速率
一定温度下,向2 L恒容密闭容器中充入0.4 mol NH3和0.5 mol
O2发生反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。2 min后, NO的浓度为0.06 mol·L-1。下列有关说法不正确的是( A )
A .2 min末,用NO表示的反应速率为0.06 mol·L-1· min-1
B .2 min末, NH3的浓度为0.14 mol·L-1 C. 0~2 min内,生 成的水的质量为3.24 g D. 0~2 min内, O2的物质的量减少了 0.15 mol
典例解析
二、影响化学反应速率的因素
灯泡为何抽成真空? 食物为何放入冰箱? 矿石为何粉碎?
能否人为控制化学反应速率?
思考
实验现象
镁最剧烈,锌较快, 铁较平缓
实验结论
反应物本身的性质是 影响化学反应速率的 主要因素
二、影响化学反应速率的因素
1、实验探究—— 内因对化学反应速率的影响
(1)反应的性质对化学反应速率的影响
镁 锌 铁 铜
加入同浓度的盐酸
2、实验探究——外因对化学反应速率的影响
(1)催化剂对化学反应速率的影响
二、影响化学反应速率的因素
FeCl3可加
速双氧水的 分解
催化剂可以加快化学反应的速率。
催化剂在化学反应前后质量不变, 化学性质不变,
物理性质可能发生改变。
催化剂中毒:催化剂的催化性能往往因接触少量的杂质 而明显下降甚至遭破坏,这种现象叫催化剂中毒。
催化剂只有在一定的温度下才能最大限度的显示其催化 作用,不同的催化剂对温度的要求不一样。
二、影响化学反应速率的因素
2、实验探究——外因对化学反应速率的影响
(2)温度对化学反应速率的影响
二、影响化学反应速率的因素
温度升高,
H2O2的分解速
率加快
其他条件不变,温度越高,化学反应速率越大。
实验测得,
温度每升高10度,化学反应速率通常会增大原来的2-4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
二、影响化学反应速率的因素
2、实验探究——外因对化学反应速率的影响
(3)浓度对化学反应速率的影响
二、影响化学反应速率的因素
增大反应物浓度
能加快化学反应 速率
固体(或纯液体)的浓度视为常数 ,不改变接触面积的
情况下,不影响化学反应速率。
二、影响化学反应速率的因素
其他条件不变,浓度越大,化学反应速率越大。
注意
2、实验探究——外因对化学反应速率的影响
(4)接触面积对化学反应速率的影响
固体反应物表
面积越大,
化学反应速率
越大
二、影响化学反应速率的因素
其他条件不变,固体反应物表面积越大,化学反应速率越大。
增大固体的表面积或将固体溶于一定溶剂,
能增大化学反应速率。
二、影响化学反应速率的因素
压强减小,
体积增大,
反应物浓度减小,
反应速率减小
压强增大,
体积减小,
反应物浓度增大,
反应速率增大
有气体参加的反应,压强改变, 化学反应速率如何变化?
二、影响化学反应速率的因素
加压
思考
减压
容器体积不变,
充入惰性气体,压强增大,
反应物浓度不变,
反应速率不变
压强的改变必须引起浓度的改变,才能影响化学反应速率。
如果容器体积不变,充入惰性气体使压强增大, 化学反应速率如何改变?
恒容: 充入惰性气 体―→总压增大―→反 应物浓度不变―→反应 速率不变。
二、影响化学反应速率的因素
思考
容器气体压强不变,
充入惰性气体,
容器的体积增大,
反应物浓度减小, 反应速率减小
保持容器内气体压强不变,向其中充入稀有气体, 反应速率如何变化?
充入惰性气体―→体积增大―→反应物浓度减小―→反应速率减小。
二、影响化学反应速率的因素
恒压:
思考
压强对反应速率影响的理解
压强对反应速率的影响,是通过改变气体的浓度来实现的,故一 般意义上的增大压强是指压缩气体的体积。
恒温时:增大压强(引起→)体积缩小(引起→)反应速率增大。
对无气体参加的化学反应,改变压强时,化学反应速率基本 不变。如MgO+2HCl===MgCl2+H2O。
二、影响化学反应速率的因素
反应C(s)+H2O(g) CO(g)+H2(g)在一容积可变的密闭容器中进行,
下列条件的改变对反应速率几乎没有影响的是( A )
A .保持体积不变,充入氮气使体系的压强增大
B .升温
C .将容器的体积缩小为一半
D .保持体积不变,增加H2O(g)的量
典例解析
化学反应速率 表达式 注意点 相关计算
影响化学反应速率的因素
内因
外因:催化剂、温度、
浓度、接触面积、压强
课堂小结
随堂练习
1 .反应: 3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不
同物质表示其反应速率,分别为①v(A) =0.6 mol·L-1·min-1;
②v(B) =0.45 mol·L-1·min-1;③v(C) =0.015 mol·L-1·min-1;
④v(D) =0.45 mol·L-1·min-1。则此反应在不同条件下进行最快的
是( D )A . ②③ B . ①③C . ②④ D . ②
随堂练习
2、在反应: C(s)+CO2(g)===2CO(g)中,可使反应速率增
大的措施是( C )①增大压强 ②升高温度 ③通入CO2 ④
增加碳的量 ⑤用等量炭粉代替焦炭A . ①②③ B .
②③④⑤C . ①②③⑤ D . ②③④
谢谢观看
T H A N K S
第一节 化学反应速率与反应限度 课时1 化学反应速率
影响化学反应速率的因素
专题六 化学反应与能量变化
授课人:
1.能从内因、外因两个方面认识化学反应速率。
2.学会运用控制变量方法研究影响化学反应速率的因素。
3.初步建立变化观念与平衡思想,能运用动态平衡的观点看待和分析
化学变化。
4.认识化学反应速率的研究在生产、生活中的重要作用。
学习目标
不同化学反应进行的快慢程度不同。
如何定量地判断一个化学反应的速率快慢?
可用单位时间内反应物浓度的减少或
生成物浓度的增加来表示。
表达
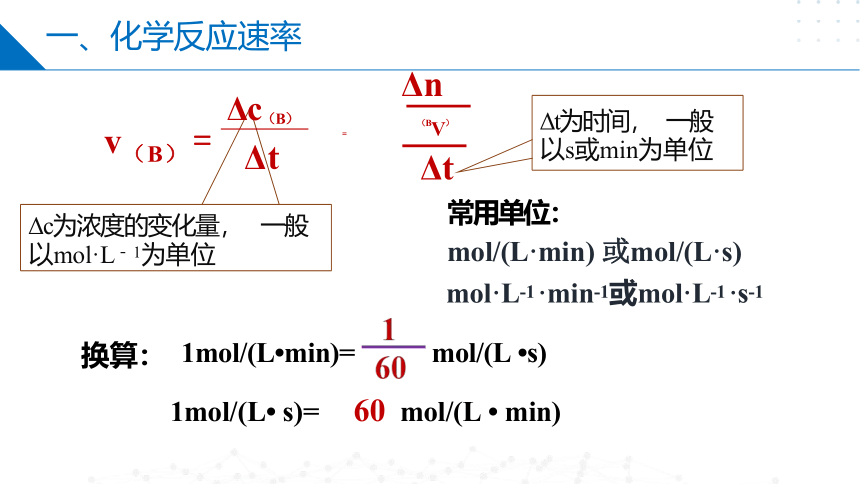
式 v(B) =
=
用来衡量化学反应过程进行快慢程度的 物理量。
一、化学反应速率
c(B)反应前 - c(B)反应后
概念
Δc(B)
Δt
化学反 应速率
表示 方法
Δt
mol·L-1 ·min-1或mol·L-1 ·s-1
换算: 1mol/(L min)= mol/(L s)
Δc为浓度的变化量, 一般 以mol·L- 1为单位
常用单位:
mol/(L·min) 或mol/(L·s)
Δt为时间, 一般 以s或min为单位
一、化学反应速率
Δc(B) v(B) = Δt
1mol/(L s)= 60 mol/(L min)
(BV)
Δt
Δn
=
注意1:一个确定的化学反应涉及反应物、生成物等多种物质,
因而定量表示一个化学反应的反应速率时,必须指明是用哪一种
反应物或哪一种生成物来表示。
如: v(B)是指用B表示的化学反应速率;
v(C)是指用C表示的化学反应速率。
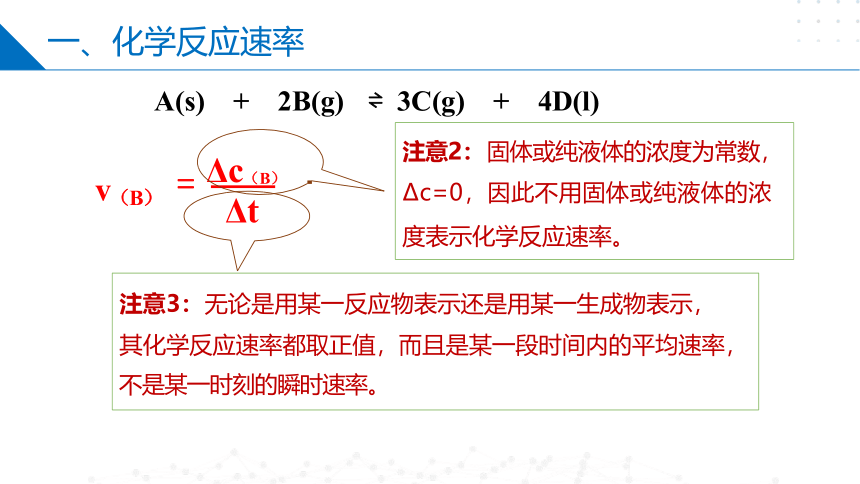
3C(g) + 4D(l)
Δc(B)
Δt
A(s) + 2B(g)
v(B) =
一、化学反应速率
注意3: 无论是用某一反应物表示还是用某一生成物表示,
其化学反应速率都取正值,而且是某一段时间内的平均速率,
不是某一时刻的瞬时速率。
注意2: 固体或纯液体的浓度为常数,
Δc=0,因此不用固体或纯液体的浓 度表示化学反应速率。
一、化学反应速率
A(s) + 2B(g) 3C(g) + 4D(l)
Δt
= Δc(B)
v(B)
注意3: 无论是用某一反应物表示还是用某一生成物
表示,其化学反应速率都取正值,而且是某一段时 间内的平均速率,不是某一时刻的瞬时速率。
A(s) + 2B(g) 3C(g) + 4D(l)
v(B) =
一、化学反应速率
例1 在一定条件下,某双氧水放置100 min后, H2O2 的 浓度从 5× 10-2 mol/L下降到4× 10-2mol/L ,在这
100 min内H2O2 的分解反应速率为多少?
解:
v(H2O2 )= △c (H2O2 )= 5× 10-2 i × 10-2 mol/L
= 1× /L= 1× 10-4mol/(L min)
100 min
10-2 mol
t
△
n
4
100 m
mol/L-
一、化学反应速率
例2 在1L容器中发生反应: N2 + 3H2 2NH3
1min后,生成1molNH3 ,求v(NH3) , v(N2) ,v(H2).
解:△c(NH3)= =1mol/L
v(NH3) =1mol/(L min)
同理可求: v(N2)=0.5mol/(L min ), v(H2)=1.5mol/(L min )
v(N2) : v(H2) : v(NH3)
=0.5mol/(L min ): 1.5mol/(L min ): 1mol/(L min)
思考 :各物质的速率与化学计量数有什么关系?
一、化学反应速率
=1:3:2
规律:
对于同一反应,用不同的物质来表示反应速率,其 比值一定等于化学方程式中相应的化学计量数之比。
mA(g) + nB(g) pC(g)+qD(g)
v(A) ∶ v(B) ∶ v(C) ∶ v(D)
= m∶ n∶ p∶ q
= Δc(A) :Δc(B) :Δc(C) :Δc(D)
= Δn(A) :Δn(B) :Δn(C) :Δn(D)
一、化学反应速率
某温度下,浓度都是1 mol·L-1的两种气体X2和Y2 ,在
密闭容器中反应生成气体Z,经过t min后,测得各物质 的浓度分别为c(X2)=0.4 mol·L-1 ,c(Y2)=0.8 mol·L-1、 c(Z)=0.4 mol·L-1 ,则该反应的化学方程式可表示为 。 3X2+Y2===2X3Y
一、化学反应速率
例3
(1)ν(A)=0.3mol/(L·s )
(2) ν(B)=0.6mol/(L·s)
(3) ν(C)=0.4mol/(L·s)
(4) ν(D)=0.45mol/(L·s)
则该反应速率的快慢顺序为: (1)>(4)>(2)=(3)
例4 反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
注意:比较反应的快慢,应取同一参照物
一、化学反应速率
规律应用: 化学反应速率大小的比较方法
(1)归一法: 若单位不统一,则要换算成相同的单位;若为不
同物质表示的反应速率,则要换算成同一物质来表示反应速 率;再比较数值的大小。
一、化学反应速率
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下:
①v(CO)=1.5 mol·L-1 ·min-1
②v(NO2)=0.01 mol·L-1 · s-1
③v(N2)=0.4 mol·L-1 ·min-1
③_①_②_④(由大到小的顺序)。
1
慢:
in-
快
m
的
1 ·
应
L-
反
·
况
ol
情
m
种
1
4
1.
述
=
上
2)
较
CO
比
v(
请
④
② = 1
④ v(CO2) =1.1 mol·L-1 ·min-1
4 4
v(N2) 0.4 mol·L-1 ·min-1
=
1 1
v(CO) 1.5mol·L-1 ·min-1
=
4 4
一、化学反应速率
①
③
例5
规律应用: 化学反应速率大小的比较方法
(2)比值法: 比较化学反应速率与化学计量数的比值,如aA(g)
+ bB(g)===cC(g)+dD(g),比较 与 ,若 > ,
则说明用A表示的化学反应速率大于用B表示的化学反应速率。
一、化学反应速率
一定温度下,向2 L恒容密闭容器中充入0.4 mol NH3和0.5 mol
O2发生反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。2 min后, NO的浓度为0.06 mol·L-1。下列有关说法不正确的是( A )
A .2 min末,用NO表示的反应速率为0.06 mol·L-1· min-1
B .2 min末, NH3的浓度为0.14 mol·L-1 C. 0~2 min内,生 成的水的质量为3.24 g D. 0~2 min内, O2的物质的量减少了 0.15 mol
典例解析
二、影响化学反应速率的因素
灯泡为何抽成真空? 食物为何放入冰箱? 矿石为何粉碎?
能否人为控制化学反应速率?
思考
实验现象
镁最剧烈,锌较快, 铁较平缓
实验结论
反应物本身的性质是 影响化学反应速率的 主要因素
二、影响化学反应速率的因素
1、实验探究—— 内因对化学反应速率的影响
(1)反应的性质对化学反应速率的影响
镁 锌 铁 铜
加入同浓度的盐酸
2、实验探究——外因对化学反应速率的影响
(1)催化剂对化学反应速率的影响
二、影响化学反应速率的因素
FeCl3可加
速双氧水的 分解
催化剂可以加快化学反应的速率。
催化剂在化学反应前后质量不变, 化学性质不变,
物理性质可能发生改变。
催化剂中毒:催化剂的催化性能往往因接触少量的杂质 而明显下降甚至遭破坏,这种现象叫催化剂中毒。
催化剂只有在一定的温度下才能最大限度的显示其催化 作用,不同的催化剂对温度的要求不一样。
二、影响化学反应速率的因素
2、实验探究——外因对化学反应速率的影响
(2)温度对化学反应速率的影响
二、影响化学反应速率的因素
温度升高,
H2O2的分解速
率加快
其他条件不变,温度越高,化学反应速率越大。
实验测得,
温度每升高10度,化学反应速率通常会增大原来的2-4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
二、影响化学反应速率的因素
2、实验探究——外因对化学反应速率的影响
(3)浓度对化学反应速率的影响
二、影响化学反应速率的因素
增大反应物浓度
能加快化学反应 速率
固体(或纯液体)的浓度视为常数 ,不改变接触面积的
情况下,不影响化学反应速率。
二、影响化学反应速率的因素
其他条件不变,浓度越大,化学反应速率越大。
注意
2、实验探究——外因对化学反应速率的影响
(4)接触面积对化学反应速率的影响
固体反应物表
面积越大,
化学反应速率
越大
二、影响化学反应速率的因素
其他条件不变,固体反应物表面积越大,化学反应速率越大。
增大固体的表面积或将固体溶于一定溶剂,
能增大化学反应速率。
二、影响化学反应速率的因素
压强减小,
体积增大,
反应物浓度减小,
反应速率减小
压强增大,
体积减小,
反应物浓度增大,
反应速率增大
有气体参加的反应,压强改变, 化学反应速率如何变化?
二、影响化学反应速率的因素
加压
思考
减压
容器体积不变,
充入惰性气体,压强增大,
反应物浓度不变,
反应速率不变
压强的改变必须引起浓度的改变,才能影响化学反应速率。
如果容器体积不变,充入惰性气体使压强增大, 化学反应速率如何改变?
恒容: 充入惰性气 体―→总压增大―→反 应物浓度不变―→反应 速率不变。
二、影响化学反应速率的因素
思考
容器气体压强不变,
充入惰性气体,
容器的体积增大,
反应物浓度减小, 反应速率减小
保持容器内气体压强不变,向其中充入稀有气体, 反应速率如何变化?
充入惰性气体―→体积增大―→反应物浓度减小―→反应速率减小。
二、影响化学反应速率的因素
恒压:
思考
压强对反应速率影响的理解
压强对反应速率的影响,是通过改变气体的浓度来实现的,故一 般意义上的增大压强是指压缩气体的体积。
恒温时:增大压强(引起→)体积缩小(引起→)反应速率增大。
对无气体参加的化学反应,改变压强时,化学反应速率基本 不变。如MgO+2HCl===MgCl2+H2O。
二、影响化学反应速率的因素
反应C(s)+H2O(g) CO(g)+H2(g)在一容积可变的密闭容器中进行,
下列条件的改变对反应速率几乎没有影响的是( A )
A .保持体积不变,充入氮气使体系的压强增大
B .升温
C .将容器的体积缩小为一半
D .保持体积不变,增加H2O(g)的量
典例解析
化学反应速率 表达式 注意点 相关计算
影响化学反应速率的因素
内因
外因:催化剂、温度、
浓度、接触面积、压强
课堂小结
随堂练习
1 .反应: 3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不
同物质表示其反应速率,分别为①v(A) =0.6 mol·L-1·min-1;
②v(B) =0.45 mol·L-1·min-1;③v(C) =0.015 mol·L-1·min-1;
④v(D) =0.45 mol·L-1·min-1。则此反应在不同条件下进行最快的
是( D )A . ②③ B . ①③C . ②④ D . ②
随堂练习
2、在反应: C(s)+CO2(g)===2CO(g)中,可使反应速率增
大的措施是( C )①增大压强 ②升高温度 ③通入CO2 ④
增加碳的量 ⑤用等量炭粉代替焦炭A . ①②③ B .
②③④⑤C . ①②③⑤ D . ②③④
谢谢观看
T H A N K S
