6.1.1化学反应与热能课件(共91张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.1化学反应与热能课件(共91张ppt)化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-16 00:00:00 | ||
图片预览











文档简介
(共91张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
6.1.1化学反应与热能
人教版高一化学必2第二学期6.1.1化学反应与热能
核心素养目标
1.宏观辨识与微观探析:能分析物质化学变化和伴随发生的能量转化与物质微观结构之
间的关系
2.变化观念与平衡思想:能认识到物质运动和变化是永恒的,能认识化学变化伴随着能量变化。
3.证据推理与模型认知:能主动关注与环境保护,资源开发等有关的社会热点问题,形成与环境和谐共处、合理利用自然资源的观念
4.科学探究与创新意识: 能根据教材中给出的有关化学反应与热能的问题设计简单的实验方案,完成操作,观察现象,对现象作出解释
5.科学精神与社会责任 :认识燃料的燃烧效率、保护环境、开发清洁燃料的必要性和重要性。
教学目标
教学重点:1.知道化学反应可以实现化学能与热能的转化,认识吸热和放热反应。
2.能用化学键解释某些吸热反应和放热反应。
教学难点:认识燃料的燃烧效率、保护环境、开发清洁燃料的必要性和重要性。
一、 化学反应与能量
1.实验探究:
实 验 操 作 试管中加入2 mL 2 mol·L-1盐酸,并用温度计测量其温度,再向试管中放入打磨过的镁条 将20 g Ba(OH)2·8H2O晶体研细后与10 g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,玻璃片盖上烧杯
实 验 装 置
实 验 现 象 ______________ ____________ _____________ _____ 有刺激性气味气体产生,用手
触摸杯壁下部,烧杯壁_____,
试着用手拿起烧杯,_______
_________
镁条逐渐溶解,
有气泡产生,
温度计的示数
升高
变凉
木片黏
在烧杯上
实验 结论 该反应_________ 该反应_________
化学反应发生时伴有_________________ 放出热量
吸收热量
热量的释放和吸收
2.放热反应和吸热反应
(1)含义:
①放热反应:_________的化学反应。
②吸热反应:_________的化学反应。
释放热量
吸收热量
(2)实例:
①放热反应:
a.镁条、铝片与盐酸的反应;
b.木炭、氢气、甲烷等在氧气中的燃烧;
c.氢气与氯气的化合。
②吸热反应:
a.氢氧化钡与氯化铵的反应;
b.盐酸与碳酸氢钠的反应;
c.灼热的炭与二氧化碳的反应。
【微思考】冬季生活中常常采用下列方法获得热量:
①烧炭取暖;
②用电暖器取暖;
③天然气壁挂炉取暖;
④空调取暖;
⑤地下水循环取暖等,都属于放热反应吗
提示:①③属于。发生化学反应时释放热量才是放热反应,①③分别属于煤炭和甲烷的燃烧反应。②④是电能转化为热能;⑤只是热量的交换。
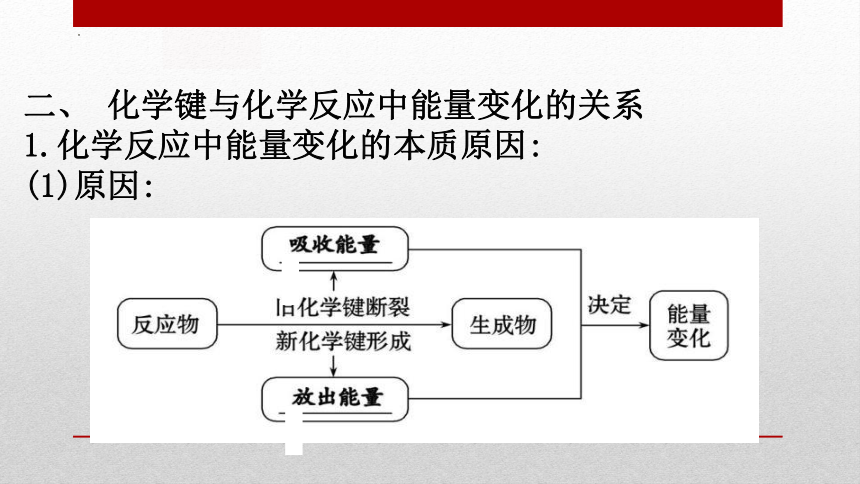
二、 化学键与化学反应中能量变化的关系
1.化学反应中能量变化的本质原因:
(1)原因:
(2)实例:
计算分析:
化学键 反应中能量变化 1 mol化学键 反应中能量变化
H—H 吸收436 kJ 共吸收679 kJ
Cl—Cl 吸收243 kJ H—Cl 放出431 kJ 共放出862 kJ
结论 679 kJ-862 kJ=-183 kJ,即反应放出 183 kJ热量 2.多角度分析化学反应的能量变化
分析 角度 放热反应 吸热反应
微观 断键吸收的热量_____ 成键放出的热量 断键吸收的热量_____
成键放出的热量
宏观 反应物的总能量_____ 生成物的总能量 反应物的总能量_____
生成物的总能量
小于
大于
大于
小于
【巧判断】
(1)吸热反应需要加热才能反应。 ( )
提示:×。如氢氧化钡与氯化铵的反应吸热,在常温下就能进行。
(2)已知Al与稀盐酸的反应为放热反应,即Al的能量大于H2的能量。 ( )
提示:×。反应放热说明反应物的总能量大于生成物的总能量,即Al与稀盐酸具有的总能量大于AlCl3与H2所具有的总能量,而Al与H2的能量大小无法比较。
(3)有能量变化的物质变化一定是化学变化。 ( )
提示:×。有能量变化的物质变化不一定是化学变化,物质发生物理变化时也伴有能量变化。如冰融化、氢氧化钠的溶解等。
三、 人类对能源的利用
1.利用的三个阶段:
2.化石燃料利用过程中亟待解决的两方面问题
(1)一是其短期内不可再生,储量有限;
(2)二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
3.在燃料利用过程中,节能的主要环节:
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能量利用率。
4.新能源
(1)特点:资源丰富、______________________。
(2)人们比较关注的新能源:_____能、___能、地热能、海洋能和___能等。
可以再生,对环境无污染
太阳
风
氢
【情境·思考】2019中国(山西)国际清洁能源博览会于2019年6月28日上午在太原开幕。
本次展会以“清洁低碳、绿色发展”为主题,聚焦煤炭清洁利用、新能源、储能、节能环保等领域,展示新技术新产品新应用,搭建中西部清洁能源及设备供需平台,促进煤改电、煤改气、煤改清洁采暖在中西部的实施,加强雾霾的治理,有效改善呼吸环境。
(1)提高燃料的燃烧效率应该从哪些方面考虑
提示:使燃料与氧气充分接触,如将煤粉碎、液化和气化;通入充足的氧气。
(2)日常生产、生活中常常采用下列能源:
①煤;②石油;③天然气;④太阳能;⑤水能;⑥氢能;
⑦核能;⑧风能;⑨地热能等,属于清洁能源的有哪些
提示:④⑤⑥⑦⑧⑨。清洁能源即绿色能源,是指不排放污染物、能够直接用于生产生活的能源,它包括核能和可再生能源。可再生能源是指原材料可以再生的能源,如水力发电、风力发电、太阳能、水能、生物能(沼气)、地热能(包括地源和水源)、海潮能等能源。
知识点一 放热反应与吸热反应的理解
【重点释疑】
1.放热反应与吸热反应的比较:
放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
形成 原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
与化 学键 强弱 的关 系 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
放热反应 吸热反应
反应 过程 图示
2.常见的放热反应和吸热反应
3.化学反应遵循的两条基本规律
(1)质量守恒定律:自然界的物质发生转化时,总质量保持不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但体系包含的总能量不变。
【思考·讨论】
(1)做实验时,吸热反应和放热反应都用到酒精灯,怎样判断该反应是吸热反应还是放热反应 放热反应加热的目的是什么
提示:持续用酒精灯加热,撤掉酒精灯反应就停止的反应是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的是放热反应。放热反应加热的目的一般是引发反应或加快反应速率。
(2)放热反应一定容易发生,吸热反应一定难发生吗
提示:不一定。反应放热和吸热与反应的条件无关,有些放热反应必须加热才能发生,如木炭的燃烧;而有些吸热反应常温下就能发生,如Ba(OH)2·8H2O与NH4Cl的反应。
【案例示范】
【典例】(2019·菏泽高一检测)下列说法正确的
是 ( )
A.Fe与S在加热条件下才能发生反应,所以该反应属于吸热反应
B.HNO3、H2SO4分别与NaOH溶液反应都放出热量
C.分解反应都是吸热反应,化合反应都是放热反应
D.合成氨的反应是放热反应,所以N2与其他物质的反应也是放热反应
【解题指南】解答本题需注意以下3点:
(1)反应放热还是吸热与反应条件无关。
(2)熟记常见的放热反应和吸热反应类型。
(3)注意知识迁移的合理性。
【解析】选B。Fe与S虽然需加热才能发生反应,但反应开始后,停止加热,反应能继续进行,加热只是为了引发反应,所以该反应是放热反应,A错误;中和反应都是放热反应,B正确;分解反应不一定是吸热反应,如H2O2的分解反应就是放热反应,化合反应也不一定是放热反应,如CO2与C的反应就是吸热反应,C错误;与N2反应的
物质不同,能量变化也不同,不能根据合成氨反应的能量变化来类推N2与其他物质反应的能量变化,如N2和O2在放电条件下生成NO就是吸热反应,D错误。
【母题追问】(1)上题B项含有等物质的量H2SO4的稀硫酸、浓硫酸分别与足量的氢氧化钠溶液反应放出的热量相等吗
提示:不相等。浓硫酸与足量的氢氧化钠溶液反应放出的热量除了中和反应放出的热量,还有浓硫酸稀释放出的热量。
(2)从物质能量的角度解释上题D项合成氨反应放热的原因
提示:合成氨反应中,参加反应的N2和H2的总能量大于生成的NH3的总能量,故反应放热。
【规律方法】放热反应和吸热反应判断“四"方法
(1)依据反应条件判断。通常需要持续加热的反应为吸热反应。
(2)依据能量变化图象判断。反应物的总能量大于生成物的总能量,则反应为放热反应;反之,则为吸热反应。
(3)依据断键和成键所吸收和释放的能量数据判断。如果旧键断裂吸收的能量大于新键形成释放的能量,则为吸热反应;反之,为放热反应。
(4)经验判断法:根据常见的放热反应、吸热反应的类型判断。
【迁移·应用】
1.(2019·邯郸高一检测)下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
【解析】选A。任何化学反应都有能量的变化,但有能量变化的过程不一定是化学变化,如物质的三态变化,虽然存在能量变化,但不存在旧化学键的断裂与新化学键的形成,故不是化学变化,B项错误;化学反应中能量变化的形式有多种,除热能外,还有光能、电能等,C项错误;由图象知,该过程中反应物的总能量大于生成物的总能量,故该过程中放出能量,D项错误。
2.(2019·济南高一检测)已知2SO2+O2 2SO3为放热反应,对该反应的下列说法正确的是 ( )
A.O2的能量一定高于SO2的能量
B.2 mol SO2和1 mol O2的总能量一定高于2 mol SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
【解析】选B。因反应2SO2+O2 2SO3为放热反应,所以2 mol SO2和1 mol O2的能量和一定高于2 mol SO3的能量,A错误,B正确,C错误;化学反应的实质是旧键的断裂和新键的形成,而断键过程需要吸收能量,故放热反应有些也需要一定条件,该反应是放热的,但需要加热才能发生,D错误。
【补偿训练】
1. 下列各图中,表示吸热反应的图是 ( )
【解析】选A。反应物的总能量小于生成物的总能量则为吸热反应。
2.(2019·廊坊高一检测)关于吸热反应的说法正确的是 ( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
【解析】选D。反应放热还是吸热与是否加热无直接的关系,与是否使用催化剂也无直接关系,多数吸热反应需要加热,但有的不需要加热,例如Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,且该反应属于复分解反应,故A、B、C三项错。放热反应的逆过程一定是吸热反应,D正确。
【素养提升】
随着人们生活节奏的加快,市场上出现了多种类型的“即食饭盒”等快速给食物加热的产品。
下面让我们探究它们的工作原理。
(1)有一“自热米饭”的广告播得很火,它介绍在食用时,将一无色液体加入一白色固体中,放上装米饭的盒子,过几分钟米饭马上就热气腾腾,可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合 ( )
A.硝酸铵和水 B.浓硫酸和水
C.氧化钙和水 D.固体酒精和水
提示:选C。硝酸铵溶于水吸热,A选项错误;浓硫酸具有腐蚀性,且操作不方便,B选项错误;氧化钙与水反应放出大量的热,C选项正确;酒精溶于水时热效应不明显,D选项错误。
(2)目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生反应:Mg+2H2O====X+H2↑。请根据以上信息回答下列各题:
①该饭盒底部“即热”存在什么能量之间的转化
提示:化学能转化为热能。
②已知X是一种碱,则X的化学式是什么 你推断X的化学式的依据是什么
提示:根据质量守恒(原子守恒)定律可知X的化学式为Mg(OH)2。
③上述化学反应属于哪种基本反应类型 由该反应可知化学反应发生时都伴随什么变化
提示:置换反应。化学反应发生时都伴随着物质的变化和能量的变化。
知识点二 利用化学键计算化学反应中的能量变化
【重点释疑】
1.化学键与能量变化的关系:
2.计算公式:
用Q(吸)表示反应物分子化学键断裂时吸收的总能量,Q(放)表示生成物分子化学键形成时放出的总能量。
公式:ΔQ=Q(吸)-Q(放)
利用化学键形成和断裂时的能量变化计算化学反应中的能量变化:
【思考·讨论】
(1)对于放热反应:2H2+O2 2H2O来说,“断裂1个H—H键和1个O=O键所吸收的能量小于形成1个H—O键所放出的能量”这种说法是否正确
点燃
====
提示:不正确。在反应2H2+O2 2H2O中,每断裂1个O=O键,同时断裂2个H—H键,形成4个H—O键;正确说法是断裂2个H—H键和1个O=O键所吸收的能量小于形成4个H—O键所放出的能量。
点燃
====
(2)如图是1 mol氢气燃烧的能量变化图,试分析a、b表示的含义。
提示:化学反应发生时首先断裂反应物中的化学键,再形成生成物中的化学键,故a表示破坏1 mol H—H键、0.5 mol O=O键所吸收的能量,b表示形成2 mol H—O键所放出的能量。
【案例示范】
【典例】断开1 mol H—H键、1 mol N—H键、
1 mol N≡N键分别需要吸收的能量为436 kJ、
391 kJ、946 kJ。
(1)1 mol N2完全反应生成NH3需________(填“吸收”或“放出”)能量________kJ。
(2)1 mol H2完全反应生成NH3需________(填“吸收”或“放出”)能量________kJ。(不考虑可逆反应)
【思维建模】解答利用键能计算热量的试题思路如下:
【解析】本题可以从断键吸收的能量数值与成键放出
的能量数值的相对大小来判断,若E(断键)>E(成键),
则为吸热反应;若E(断键)时要放出6 mol×391 kJ·mol-1=2 346 kJ的能量,拆
开1 mol N≡N键和3 mol H—H键时吸收的总能量为
946 kJ+3 mol×436 kJ·mol-1=2 254 kJ,整个过程
中的能量变化为放出能量,为 2 346 kJ-2 254 kJ=
92 kJ。(2)方法一: N2+H2 NH3,生成 mol NH3
即形成2 mol N—H键时,需放出 2 mol×391 kJ·mol-1
=782 kJ的能量,拆开 mol N≡N 键和1 mol H—H键
时吸收的总能量为 mol×946 kJ·mol-1+436 kJ≈
751.33 kJ,整个过程中的能量变化为放出能量,
为782 kJ-751.33 kJ=30.67 kJ。方法二:由(1)知
3 mol H2生成NH3需放出能量92 kJ,则1 mol H2生成
NH3需放出能量为92 kJ× ≈30.67 kJ。
答案:(1)放出 92 (2)放出 30.67
【误区警示】规避能量计算时“4”个失分点
(1)旧化学键的断裂和新化学键的形成是同时进行的,缺少任何一个过程都不是化学变化。
(2)互为可逆反应的正反应和逆反应的能量变化恰好相反。
(3)注意计算共价化合物中的共价键数目,如1 mol H2O中含有2 mol H—O键,1 mol H2O2中含有2 mol H—O键和 1 mol O—O键。
(4)计算时要注意化学计量数与共价键总数的关系,不能按1 mol计算,要根据实际配平的化学方程式计算反应物或生成物的总能量。
【迁移·应用】
1.(2019·长沙高一检测)SF6气体已有百年历史,它是法
国两位化学家Moissan和Lebeau于1900年合成的人造惰性
气体。六氟化硫具有良好的电气绝缘性能及优异的灭弧
性能,国际上称为“气体绝缘开关设备”。SF6分子结构
中只存在S—F键。已知:1 mol S(固体)转化为气态硫原
子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的
能量分别为160 kJ、330 kJ。
则S(s)+3F2(g)====SF6(g)(已知s为固体,g为气体)的能量变化为 ( )
A.放出1 780 kJ的能量
B.放出1 220 kJ的能量
C.放出450 kJ的能量
D.吸收430 kJ的能量
【解析】选B。由题意得1 mol S(s)和3 mol F2形成
气态硫原子和氟原子共需要吸收能量=280 kJ+3×
160 kJ=760 kJ,而生成1 mol SF6气体时需形成
6 mol S—F键,共放出能量: 6×330 kJ=1 980 kJ,
因此该反应共放出的能量为1 980 kJ-760 kJ=
1 220 kJ。
2.(2019·潍坊高一检测)已知断裂1 mol共价键所需
要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,
H—I:299 kJ,下列对H2(g)+I2(g) 2HI(g)的反应
类型判断错误的是 ( )
A.放出能量的反应 B.吸收能量的反应
C.氧化还原反应 D.可逆反应
【解析】选B。依题意,断裂1 mol H—H键和
1 mol I—I键吸收的能量为436 kJ+151 kJ=587 kJ,
生成2 mol H—I键放出的能量为299 kJ×2=598 kJ,
因为598 kJ>587 kJ,所以该反应是放出能量的反应;
根据反应式可知该反应是可逆反应,也是氧化还原反应。
【补偿训练】
1.(2019·孝感高一检测)化学反应A2+B2====2AB的能量变化如图所示,则下列说法正确的是 ( )
A.1 mol A2和1 mol B2完全反应吸收(y-x) kJ热量
B.断裂1 mol A—A键和1 mol B—B键放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
【解析】选C。从题图可以看出,反应物的总能量高于生成物的总能量,该反应是放热反应,1 mol A2和1 mol B2完全反应放出(y-x) kJ热量,A、D项错误;断键时需要吸收能量,B项错误,C项正确。
2.(2019·潍坊高一检测)化学反应可视为旧键断裂和
新键形成的过程。化学键的键能是形成(或断开)1 mol
化学键时释放(或吸收)的能量。已知白磷和P4O6的分
子结构如图所示,现提供断裂(或形成)1 mol以下化学
键的吸收(或放出)的能量(kJ):P—P:198,P—O:360,O
=O:498,则反应P4(白磷)+3O2====P4O6生成1 mol
P4O6 ( )
A.放出1 638 kJ热量 B.吸收1 638 kJ热量
C.放出126 kJ热量 D.吸收126 kJ热量
【解析】选A。由反应方程式知,该反应的能量变化包
括1 mol P4、3 mol O2断裂键吸收的能量和1 mol P4O6
形成键放出的能量。由各物质的分子结构知1 mol
P4含6 mol P—P键,3 mol O2含3 mol O=O键,1 mol
P4O6含12 mol P—O键,故 (198 kJ×6+498 kJ×3)-
360 kJ×12=-1 638 kJ,即放出1 638 kJ热量。
【素养提升】
据巴西政府网站公布的消息,巴西国家空间研究所的研发团队开发出了一种可作火箭和卫星引擎推动剂的新型燃料,其原料以低价的乙醇为主,大大压缩发射成本。
(1)已知乙醇的结构式为 ,1 mol C2H5OH含有共价键的物质的量是多少
提示:1 mol 乙醇含有1 mol C—C键、5 mol C—H键、1 mol C—O键、1 mol O—H键,共8 mol。
(2)乙醇燃烧是吸热反应还是放热反应
提示:燃烧均为放热反应。
(3)已知断开或生成1 mol化学键的数据如下:
化学键 C—C C—H O= O H—O C—O C=
O
键能/ (kJ·mol-1) 348 413 498 463 351 745
提示: C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g),则断
裂化学键吸收的能量为348 kJ+5×413 kJ+351 kJ+
463 kJ+3×498 kJ=4 721 kJ,生成化学键放出的
能量为2 mol×2×745 kJ·mol-1+3 mol×2×
463 kJ·mol-1=5 758 kJ,整个过程放出能量,能量
变化为5 758 kJ-4 721 kJ=1 037 kJ。
则1 mol乙醇与O2完全燃烧生成CO2和H2O放出的能量是多少
【课堂回眸】
第六章 化学反应与能量
第一节 化学反应与能量变化
6.1.1化学反应与热能
人教版高一化学必2第二学期6.1.1化学反应与热能
核心素养目标
1.宏观辨识与微观探析:能分析物质化学变化和伴随发生的能量转化与物质微观结构之
间的关系
2.变化观念与平衡思想:能认识到物质运动和变化是永恒的,能认识化学变化伴随着能量变化。
3.证据推理与模型认知:能主动关注与环境保护,资源开发等有关的社会热点问题,形成与环境和谐共处、合理利用自然资源的观念
4.科学探究与创新意识: 能根据教材中给出的有关化学反应与热能的问题设计简单的实验方案,完成操作,观察现象,对现象作出解释
5.科学精神与社会责任 :认识燃料的燃烧效率、保护环境、开发清洁燃料的必要性和重要性。
教学目标
教学重点:1.知道化学反应可以实现化学能与热能的转化,认识吸热和放热反应。
2.能用化学键解释某些吸热反应和放热反应。
教学难点:认识燃料的燃烧效率、保护环境、开发清洁燃料的必要性和重要性。
一、 化学反应与能量
1.实验探究:
实 验 操 作 试管中加入2 mL 2 mol·L-1盐酸,并用温度计测量其温度,再向试管中放入打磨过的镁条 将20 g Ba(OH)2·8H2O晶体研细后与10 g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,玻璃片盖上烧杯
实 验 装 置
实 验 现 象 ______________ ____________ _____________ _____ 有刺激性气味气体产生,用手
触摸杯壁下部,烧杯壁_____,
试着用手拿起烧杯,_______
_________
镁条逐渐溶解,
有气泡产生,
温度计的示数
升高
变凉
木片黏
在烧杯上
实验 结论 该反应_________ 该反应_________
化学反应发生时伴有_________________ 放出热量
吸收热量
热量的释放和吸收
2.放热反应和吸热反应
(1)含义:
①放热反应:_________的化学反应。
②吸热反应:_________的化学反应。
释放热量
吸收热量
(2)实例:
①放热反应:
a.镁条、铝片与盐酸的反应;
b.木炭、氢气、甲烷等在氧气中的燃烧;
c.氢气与氯气的化合。
②吸热反应:
a.氢氧化钡与氯化铵的反应;
b.盐酸与碳酸氢钠的反应;
c.灼热的炭与二氧化碳的反应。
【微思考】冬季生活中常常采用下列方法获得热量:
①烧炭取暖;
②用电暖器取暖;
③天然气壁挂炉取暖;
④空调取暖;
⑤地下水循环取暖等,都属于放热反应吗
提示:①③属于。发生化学反应时释放热量才是放热反应,①③分别属于煤炭和甲烷的燃烧反应。②④是电能转化为热能;⑤只是热量的交换。
二、 化学键与化学反应中能量变化的关系
1.化学反应中能量变化的本质原因:
(1)原因:
(2)实例:
计算分析:
化学键 反应中能量变化 1 mol化学键 反应中能量变化
H—H 吸收436 kJ 共吸收679 kJ
Cl—Cl 吸收243 kJ H—Cl 放出431 kJ 共放出862 kJ
结论 679 kJ-862 kJ=-183 kJ,即反应放出 183 kJ热量 2.多角度分析化学反应的能量变化
分析 角度 放热反应 吸热反应
微观 断键吸收的热量_____ 成键放出的热量 断键吸收的热量_____
成键放出的热量
宏观 反应物的总能量_____ 生成物的总能量 反应物的总能量_____
生成物的总能量
小于
大于
大于
小于
【巧判断】
(1)吸热反应需要加热才能反应。 ( )
提示:×。如氢氧化钡与氯化铵的反应吸热,在常温下就能进行。
(2)已知Al与稀盐酸的反应为放热反应,即Al的能量大于H2的能量。 ( )
提示:×。反应放热说明反应物的总能量大于生成物的总能量,即Al与稀盐酸具有的总能量大于AlCl3与H2所具有的总能量,而Al与H2的能量大小无法比较。
(3)有能量变化的物质变化一定是化学变化。 ( )
提示:×。有能量变化的物质变化不一定是化学变化,物质发生物理变化时也伴有能量变化。如冰融化、氢氧化钠的溶解等。
三、 人类对能源的利用
1.利用的三个阶段:
2.化石燃料利用过程中亟待解决的两方面问题
(1)一是其短期内不可再生,储量有限;
(2)二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
3.在燃料利用过程中,节能的主要环节:
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能量利用率。
4.新能源
(1)特点:资源丰富、______________________。
(2)人们比较关注的新能源:_____能、___能、地热能、海洋能和___能等。
可以再生,对环境无污染
太阳
风
氢
【情境·思考】2019中国(山西)国际清洁能源博览会于2019年6月28日上午在太原开幕。
本次展会以“清洁低碳、绿色发展”为主题,聚焦煤炭清洁利用、新能源、储能、节能环保等领域,展示新技术新产品新应用,搭建中西部清洁能源及设备供需平台,促进煤改电、煤改气、煤改清洁采暖在中西部的实施,加强雾霾的治理,有效改善呼吸环境。
(1)提高燃料的燃烧效率应该从哪些方面考虑
提示:使燃料与氧气充分接触,如将煤粉碎、液化和气化;通入充足的氧气。
(2)日常生产、生活中常常采用下列能源:
①煤;②石油;③天然气;④太阳能;⑤水能;⑥氢能;
⑦核能;⑧风能;⑨地热能等,属于清洁能源的有哪些
提示:④⑤⑥⑦⑧⑨。清洁能源即绿色能源,是指不排放污染物、能够直接用于生产生活的能源,它包括核能和可再生能源。可再生能源是指原材料可以再生的能源,如水力发电、风力发电、太阳能、水能、生物能(沼气)、地热能(包括地源和水源)、海潮能等能源。
知识点一 放热反应与吸热反应的理解
【重点释疑】
1.放热反应与吸热反应的比较:
放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
形成 原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
与化 学键 强弱 的关 系 生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量 生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
放热反应 吸热反应
反应 过程 图示
2.常见的放热反应和吸热反应
3.化学反应遵循的两条基本规律
(1)质量守恒定律:自然界的物质发生转化时,总质量保持不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但体系包含的总能量不变。
【思考·讨论】
(1)做实验时,吸热反应和放热反应都用到酒精灯,怎样判断该反应是吸热反应还是放热反应 放热反应加热的目的是什么
提示:持续用酒精灯加热,撤掉酒精灯反应就停止的反应是吸热反应;开始用酒精灯加热,反应开始后,撤去酒精灯仍能继续反应的是放热反应。放热反应加热的目的一般是引发反应或加快反应速率。
(2)放热反应一定容易发生,吸热反应一定难发生吗
提示:不一定。反应放热和吸热与反应的条件无关,有些放热反应必须加热才能发生,如木炭的燃烧;而有些吸热反应常温下就能发生,如Ba(OH)2·8H2O与NH4Cl的反应。
【案例示范】
【典例】(2019·菏泽高一检测)下列说法正确的
是 ( )
A.Fe与S在加热条件下才能发生反应,所以该反应属于吸热反应
B.HNO3、H2SO4分别与NaOH溶液反应都放出热量
C.分解反应都是吸热反应,化合反应都是放热反应
D.合成氨的反应是放热反应,所以N2与其他物质的反应也是放热反应
【解题指南】解答本题需注意以下3点:
(1)反应放热还是吸热与反应条件无关。
(2)熟记常见的放热反应和吸热反应类型。
(3)注意知识迁移的合理性。
【解析】选B。Fe与S虽然需加热才能发生反应,但反应开始后,停止加热,反应能继续进行,加热只是为了引发反应,所以该反应是放热反应,A错误;中和反应都是放热反应,B正确;分解反应不一定是吸热反应,如H2O2的分解反应就是放热反应,化合反应也不一定是放热反应,如CO2与C的反应就是吸热反应,C错误;与N2反应的
物质不同,能量变化也不同,不能根据合成氨反应的能量变化来类推N2与其他物质反应的能量变化,如N2和O2在放电条件下生成NO就是吸热反应,D错误。
【母题追问】(1)上题B项含有等物质的量H2SO4的稀硫酸、浓硫酸分别与足量的氢氧化钠溶液反应放出的热量相等吗
提示:不相等。浓硫酸与足量的氢氧化钠溶液反应放出的热量除了中和反应放出的热量,还有浓硫酸稀释放出的热量。
(2)从物质能量的角度解释上题D项合成氨反应放热的原因
提示:合成氨反应中,参加反应的N2和H2的总能量大于生成的NH3的总能量,故反应放热。
【规律方法】放热反应和吸热反应判断“四"方法
(1)依据反应条件判断。通常需要持续加热的反应为吸热反应。
(2)依据能量变化图象判断。反应物的总能量大于生成物的总能量,则反应为放热反应;反之,则为吸热反应。
(3)依据断键和成键所吸收和释放的能量数据判断。如果旧键断裂吸收的能量大于新键形成释放的能量,则为吸热反应;反之,为放热反应。
(4)经验判断法:根据常见的放热反应、吸热反应的类型判断。
【迁移·应用】
1.(2019·邯郸高一检测)下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
【解析】选A。任何化学反应都有能量的变化,但有能量变化的过程不一定是化学变化,如物质的三态变化,虽然存在能量变化,但不存在旧化学键的断裂与新化学键的形成,故不是化学变化,B项错误;化学反应中能量变化的形式有多种,除热能外,还有光能、电能等,C项错误;由图象知,该过程中反应物的总能量大于生成物的总能量,故该过程中放出能量,D项错误。
2.(2019·济南高一检测)已知2SO2+O2 2SO3为放热反应,对该反应的下列说法正确的是 ( )
A.O2的能量一定高于SO2的能量
B.2 mol SO2和1 mol O2的总能量一定高于2 mol SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
【解析】选B。因反应2SO2+O2 2SO3为放热反应,所以2 mol SO2和1 mol O2的能量和一定高于2 mol SO3的能量,A错误,B正确,C错误;化学反应的实质是旧键的断裂和新键的形成,而断键过程需要吸收能量,故放热反应有些也需要一定条件,该反应是放热的,但需要加热才能发生,D错误。
【补偿训练】
1. 下列各图中,表示吸热反应的图是 ( )
【解析】选A。反应物的总能量小于生成物的总能量则为吸热反应。
2.(2019·廊坊高一检测)关于吸热反应的说法正确的是 ( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
【解析】选D。反应放热还是吸热与是否加热无直接的关系,与是否使用催化剂也无直接关系,多数吸热反应需要加热,但有的不需要加热,例如Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,且该反应属于复分解反应,故A、B、C三项错。放热反应的逆过程一定是吸热反应,D正确。
【素养提升】
随着人们生活节奏的加快,市场上出现了多种类型的“即食饭盒”等快速给食物加热的产品。
下面让我们探究它们的工作原理。
(1)有一“自热米饭”的广告播得很火,它介绍在食用时,将一无色液体加入一白色固体中,放上装米饭的盒子,过几分钟米饭马上就热气腾腾,可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合 ( )
A.硝酸铵和水 B.浓硫酸和水
C.氧化钙和水 D.固体酒精和水
提示:选C。硝酸铵溶于水吸热,A选项错误;浓硫酸具有腐蚀性,且操作不方便,B选项错误;氧化钙与水反应放出大量的热,C选项正确;酒精溶于水时热效应不明显,D选项错误。
(2)目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生反应:Mg+2H2O====X+H2↑。请根据以上信息回答下列各题:
①该饭盒底部“即热”存在什么能量之间的转化
提示:化学能转化为热能。
②已知X是一种碱,则X的化学式是什么 你推断X的化学式的依据是什么
提示:根据质量守恒(原子守恒)定律可知X的化学式为Mg(OH)2。
③上述化学反应属于哪种基本反应类型 由该反应可知化学反应发生时都伴随什么变化
提示:置换反应。化学反应发生时都伴随着物质的变化和能量的变化。
知识点二 利用化学键计算化学反应中的能量变化
【重点释疑】
1.化学键与能量变化的关系:
2.计算公式:
用Q(吸)表示反应物分子化学键断裂时吸收的总能量,Q(放)表示生成物分子化学键形成时放出的总能量。
公式:ΔQ=Q(吸)-Q(放)
利用化学键形成和断裂时的能量变化计算化学反应中的能量变化:
【思考·讨论】
(1)对于放热反应:2H2+O2 2H2O来说,“断裂1个H—H键和1个O=O键所吸收的能量小于形成1个H—O键所放出的能量”这种说法是否正确
点燃
====
提示:不正确。在反应2H2+O2 2H2O中,每断裂1个O=O键,同时断裂2个H—H键,形成4个H—O键;正确说法是断裂2个H—H键和1个O=O键所吸收的能量小于形成4个H—O键所放出的能量。
点燃
====
(2)如图是1 mol氢气燃烧的能量变化图,试分析a、b表示的含义。
提示:化学反应发生时首先断裂反应物中的化学键,再形成生成物中的化学键,故a表示破坏1 mol H—H键、0.5 mol O=O键所吸收的能量,b表示形成2 mol H—O键所放出的能量。
【案例示范】
【典例】断开1 mol H—H键、1 mol N—H键、
1 mol N≡N键分别需要吸收的能量为436 kJ、
391 kJ、946 kJ。
(1)1 mol N2完全反应生成NH3需________(填“吸收”或“放出”)能量________kJ。
(2)1 mol H2完全反应生成NH3需________(填“吸收”或“放出”)能量________kJ。(不考虑可逆反应)
【思维建模】解答利用键能计算热量的试题思路如下:
【解析】本题可以从断键吸收的能量数值与成键放出
的能量数值的相对大小来判断,若E(断键)>E(成键),
则为吸热反应;若E(断键)
开1 mol N≡N键和3 mol H—H键时吸收的总能量为
946 kJ+3 mol×436 kJ·mol-1=2 254 kJ,整个过程
中的能量变化为放出能量,为 2 346 kJ-2 254 kJ=
92 kJ。(2)方法一: N2+H2 NH3,生成 mol NH3
即形成2 mol N—H键时,需放出 2 mol×391 kJ·mol-1
=782 kJ的能量,拆开 mol N≡N 键和1 mol H—H键
时吸收的总能量为 mol×946 kJ·mol-1+436 kJ≈
751.33 kJ,整个过程中的能量变化为放出能量,
为782 kJ-751.33 kJ=30.67 kJ。方法二:由(1)知
3 mol H2生成NH3需放出能量92 kJ,则1 mol H2生成
NH3需放出能量为92 kJ× ≈30.67 kJ。
答案:(1)放出 92 (2)放出 30.67
【误区警示】规避能量计算时“4”个失分点
(1)旧化学键的断裂和新化学键的形成是同时进行的,缺少任何一个过程都不是化学变化。
(2)互为可逆反应的正反应和逆反应的能量变化恰好相反。
(3)注意计算共价化合物中的共价键数目,如1 mol H2O中含有2 mol H—O键,1 mol H2O2中含有2 mol H—O键和 1 mol O—O键。
(4)计算时要注意化学计量数与共价键总数的关系,不能按1 mol计算,要根据实际配平的化学方程式计算反应物或生成物的总能量。
【迁移·应用】
1.(2019·长沙高一检测)SF6气体已有百年历史,它是法
国两位化学家Moissan和Lebeau于1900年合成的人造惰性
气体。六氟化硫具有良好的电气绝缘性能及优异的灭弧
性能,国际上称为“气体绝缘开关设备”。SF6分子结构
中只存在S—F键。已知:1 mol S(固体)转化为气态硫原
子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的
能量分别为160 kJ、330 kJ。
则S(s)+3F2(g)====SF6(g)(已知s为固体,g为气体)的能量变化为 ( )
A.放出1 780 kJ的能量
B.放出1 220 kJ的能量
C.放出450 kJ的能量
D.吸收430 kJ的能量
【解析】选B。由题意得1 mol S(s)和3 mol F2形成
气态硫原子和氟原子共需要吸收能量=280 kJ+3×
160 kJ=760 kJ,而生成1 mol SF6气体时需形成
6 mol S—F键,共放出能量: 6×330 kJ=1 980 kJ,
因此该反应共放出的能量为1 980 kJ-760 kJ=
1 220 kJ。
2.(2019·潍坊高一检测)已知断裂1 mol共价键所需
要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,
H—I:299 kJ,下列对H2(g)+I2(g) 2HI(g)的反应
类型判断错误的是 ( )
A.放出能量的反应 B.吸收能量的反应
C.氧化还原反应 D.可逆反应
【解析】选B。依题意,断裂1 mol H—H键和
1 mol I—I键吸收的能量为436 kJ+151 kJ=587 kJ,
生成2 mol H—I键放出的能量为299 kJ×2=598 kJ,
因为598 kJ>587 kJ,所以该反应是放出能量的反应;
根据反应式可知该反应是可逆反应,也是氧化还原反应。
【补偿训练】
1.(2019·孝感高一检测)化学反应A2+B2====2AB的能量变化如图所示,则下列说法正确的是 ( )
A.1 mol A2和1 mol B2完全反应吸收(y-x) kJ热量
B.断裂1 mol A—A键和1 mol B—B键放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
【解析】选C。从题图可以看出,反应物的总能量高于生成物的总能量,该反应是放热反应,1 mol A2和1 mol B2完全反应放出(y-x) kJ热量,A、D项错误;断键时需要吸收能量,B项错误,C项正确。
2.(2019·潍坊高一检测)化学反应可视为旧键断裂和
新键形成的过程。化学键的键能是形成(或断开)1 mol
化学键时释放(或吸收)的能量。已知白磷和P4O6的分
子结构如图所示,现提供断裂(或形成)1 mol以下化学
键的吸收(或放出)的能量(kJ):P—P:198,P—O:360,O
=O:498,则反应P4(白磷)+3O2====P4O6生成1 mol
P4O6 ( )
A.放出1 638 kJ热量 B.吸收1 638 kJ热量
C.放出126 kJ热量 D.吸收126 kJ热量
【解析】选A。由反应方程式知,该反应的能量变化包
括1 mol P4、3 mol O2断裂键吸收的能量和1 mol P4O6
形成键放出的能量。由各物质的分子结构知1 mol
P4含6 mol P—P键,3 mol O2含3 mol O=O键,1 mol
P4O6含12 mol P—O键,故 (198 kJ×6+498 kJ×3)-
360 kJ×12=-1 638 kJ,即放出1 638 kJ热量。
【素养提升】
据巴西政府网站公布的消息,巴西国家空间研究所的研发团队开发出了一种可作火箭和卫星引擎推动剂的新型燃料,其原料以低价的乙醇为主,大大压缩发射成本。
(1)已知乙醇的结构式为 ,1 mol C2H5OH含有共价键的物质的量是多少
提示:1 mol 乙醇含有1 mol C—C键、5 mol C—H键、1 mol C—O键、1 mol O—H键,共8 mol。
(2)乙醇燃烧是吸热反应还是放热反应
提示:燃烧均为放热反应。
(3)已知断开或生成1 mol化学键的数据如下:
化学键 C—C C—H O= O H—O C—O C=
O
键能/ (kJ·mol-1) 348 413 498 463 351 745
提示: C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g),则断
裂化学键吸收的能量为348 kJ+5×413 kJ+351 kJ+
463 kJ+3×498 kJ=4 721 kJ,生成化学键放出的
能量为2 mol×2×745 kJ·mol-1+3 mol×2×
463 kJ·mol-1=5 758 kJ,整个过程放出能量,能量
变化为5 758 kJ-4 721 kJ=1 037 kJ。
则1 mol乙醇与O2完全燃烧生成CO2和H2O放出的能量是多少
【课堂回眸】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
