2.1.2共价键的三个参数课件(共46张ppt)化学人教版(2019年)选择性必修2
文档属性
| 名称 | 2.1.2共价键的三个参数课件(共46张ppt)化学人教版(2019年)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-16 00:00:00 | ||
图片预览








文档简介
(共46张PPT)
第二章 分子结构与性质
第一节 共价键
第二课时 共价键的三个参数
共价键
类型
特征
σ键 “头碰头”
π键 “肩并肩”
方向性
饱和性
回顾
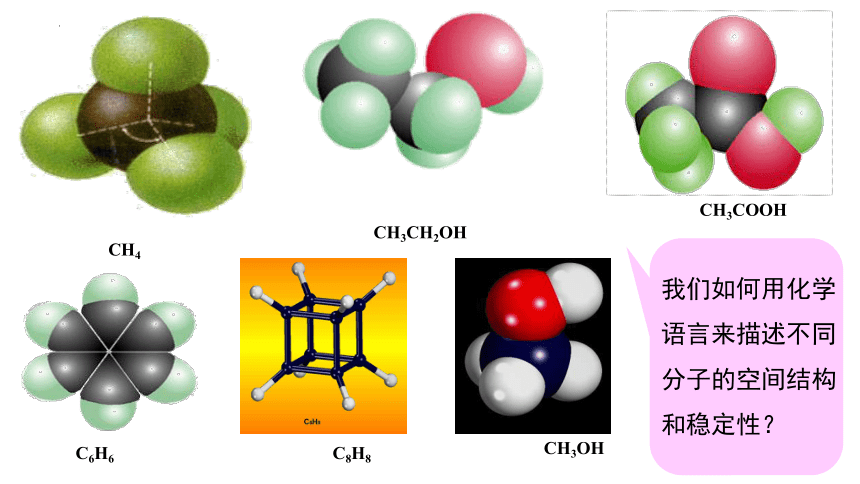
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
我们如何用化学语言来描述不同分子的空间结构和稳定性?
观察思考
卤化氢 在1000℃分解的百分数/%
HCl 0.0014
HBr 0.5
HI 33
得出:在1000℃时,卤化氢分解率大小比较为HCl<HBr<HI
说明:卤化氢的稳定性大小比较为HCl>HBr > HI
如何解释HCl、HBr 、 HI的稳定性的差异呢?
【知识铺垫】
1.甲烷分子为正四面体结构,键角是109°28'。
2.F、Cl、Br、I原子半径逐渐增大,F2、Cl2、Br2、I2与氢气反应越来
越难,HF、HI、HBr、HI的稳定性逐渐减弱。
思考讨论
1
2
3
Cl、Br和I的原子半径依次增大
H2与Cl2、Br2和I2反应放出的热量变化
HCl、HBr、HI
稳定性差异的猜想
H-Cl、H-Br和H-I的强度不同
键参数 —— 键能
定义:气态分子中1 mol化学键解离成气态原子所
吸收的能量。
通常是298.15 K、101 KPa条件下的标准值
单位:kJ·mol-1
键能越大,共价键越牢固, 由此形成的分子越稳定
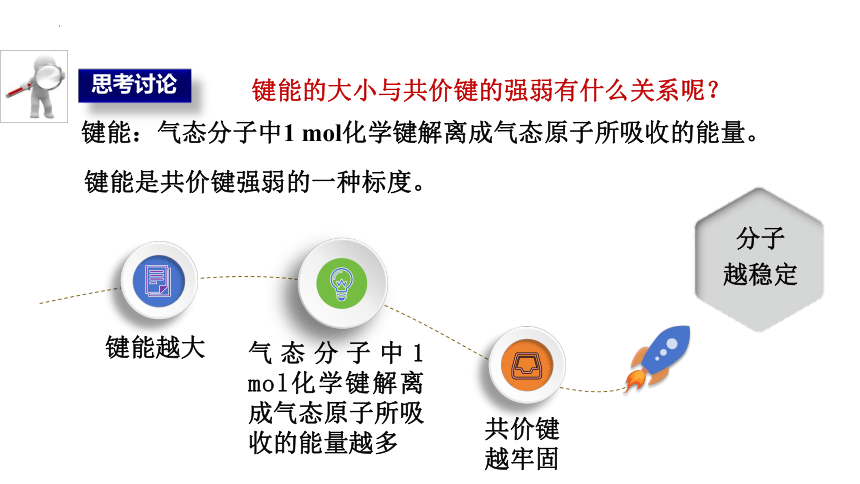
思考讨论
键能的大小与共价键的强弱有什么关系呢?
键能越大
气态分子中1 mol化学键解离成气态原子所吸收的能量越多
共价键
越牢固
分子
越稳定
键能是共价键强弱的一种标度。
键能:气态分子中1 mol化学键解离成气态原子所吸收的能量。
1.概念
气态分子中 化学键解离成气态原子所 的能量。它通常是298.15 K、100 kPa条件下的标准值,单位是 。
2.应用
(1)判断共价键的稳定性
原子间形成共价键时,原子轨道重叠程度 ,释放能量 ,所形成的共价键键能越大,共价键越 。
一、键能
1 mol
吸收
kJ·mol-1
越大
越多
稳定
(2)判断分子的稳定性
一般来说,结构相似的分子,共价键的键能越大,分子越 。
(3)利用键能计算反应热
ΔH= 总键能- 总键能
稳定
反应物
生成物
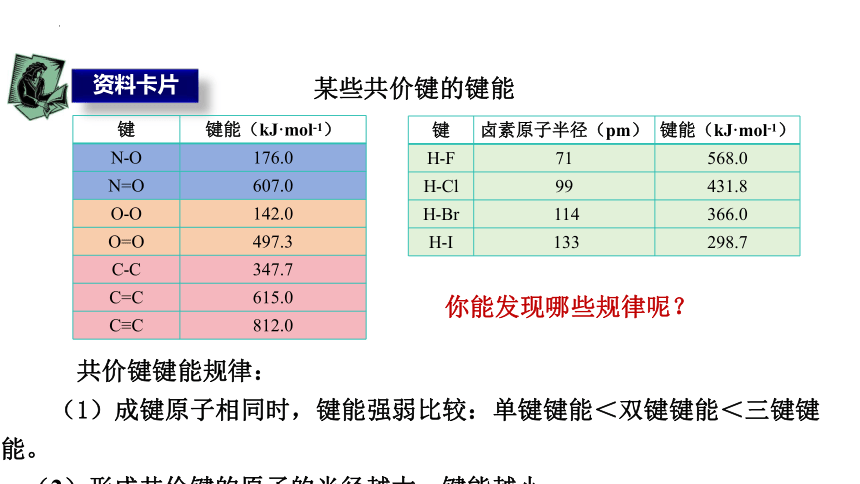
资料卡片
键 键能(kJ·mol-1)
N-O 176.0
N=O 607.0
O-O 142.0
O=O 497.3
C-C 347.7
C=C 615.0
C≡C 812.0
某些共价键的键能
键 卤素原子半径(pm) 键能(kJ·mol-1)
H-F 71 568.0
H-Cl 99 431.8
H-Br 114 366.0
H-I 133 298.7
你能发现哪些规律呢?
共价键键能规律:
(1)成键原子相同时,键能强弱比较:单键键能<双键键能<三键键能。
(2)形成共价键的原子的半径越大,键能越小。
(1)共价键的键能越大,共价键越牢固,由该键形成的分子越稳定( )
(2)N—H键能是很多分子中的N—H键能的平均值( )
(3)O—H键能是指在298.15 K、100 kPa下,1 mol气态分子中1 mol O—H键解离成气态原子所吸收的能量( )
(4)C==C键能等于C—C键能的2倍( )
判断正误
√
√
√
×
2.键长
键长是指形成共价键的两个原子之间的核间距。因此原子半径决定化学键的键长,原子半径越小,共价键的键长越短。
化学键的键长与键能是相关的。例如,C—C键、C=C键、C≡C键的键长分别为154 pm、133 pm、120 pm,键长越来越小,它们的键能分别为347.7 kJ·mol-1、615 kJ·mol-1和812 kJ·mol-1,越来越大。
共价键的键长越短,往往键能越大,表明共价键越稳定。
定义:构成化学键的两个原子之间的核间距。
单位:pm(1 pm=10-12 m)
键参数 —— 键长
Cl2中Cl-Cl键长
归纳总结
(1)键长与分子空间结构的关系:键长是影响分子空间结构的因素之一。如CH4分子的空间结构是正四面体,而CH3Cl只是四面体而不是正四面体,原因是C—H和C—Cl的键长不相等。
(2)定性判断键长的方法
①根据原子半径进行判断。在其他条件相同时,成键原子的半径越小,键长越短。
②根据共用电子对数判断。就相同的两原子形成的共价键而言,当两个原子形成双键或者三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。
返回
同种类型的共价键,成键原子的原子半径越小,键长
越小。
成键原子相同的共价键的键长:
单键键长 > 双键键长 > 三键键长
一般地,键长越短, 键能越大,共价键越牢固,由此形成的分子越稳定。
规律:
小结
资料卡片
键 键长(pm) 键能(kJ·mol-1)
H-F 92 568
H-Cl 127 431.8
H-Br 142 366
H-I 161 298.7
键 键长(pm) 键能(kJ·mol-1)
Cl-Cl 198 242.7
Br-Br 228 193.7
I-I 267 152.7
键 键长(pm) 键能(kJ·mol-1)
C-C 154 347.7
C=C 133 615
C≡C 120 812
通过观察共价键的键长和键能的数据,你能发现键长和键能之间的关系吗?
F-F不符合“键长越短,键能越大”的规律,为什么?
F-F 141
157.0
关系:键长越短,键能越大
F-F不符合“键长越短,键能越大”的规律,为什么?
想一想
键 键能 (kJ·mol-1) 键长
pm
F-F 157 141
Cl-Cl 242.7 198
Br-Br 193.7 228
某些共价键的键能和键长
F原子半径很小,因此F-F的键长短,而由于键长短,两个F原子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。键键能(kJ·mol-1)键长pm原子半径pmF-F15714164Cl-Cl242.719899Br-Br193.7228114
思考讨论
新化学键的形成
化学反应实质
旧化学键的断裂
化学键断裂吸收能量
化学键形成释放能量
键能与化学反应的能量变化存在一定的关系
如何用键能计算H2与Cl2、Br2和I2反应放出的热量呢?
原子半径: Cl < Br < I
键长:H-Cl < H-Br < H-I
键能:H-Cl > H-Br> H-I
所以,在相同的温度下,HCl最稳定,分解的百分数最小,HI最不稳定,分解的百分数最大。
如何解释HCl、HBr和HI的稳定性的差异
卤化氢 HCl HBr HI
在1 000 ℃分解的百分数/% 0.001 4 0.5 33%
氢卤键的键能(kJ·mol-1) 431.8 366 298.7
氢卤键的键长pm 127 142 161
键长:H-Cl < H-Br < H-I,键能:H-Cl > H-Br> H-I,所以,在相同的温度下,HCl最稳定,分解的百分数最小,HI最不稳定,分解的百分数最大。
键能
键长
衡量共价键的稳定性
小结
小 结
键能和键长是衡量共价键强弱和分子稳定性的重要参数。
一般来说,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,分子性质越稳定。
以上两个参数定量地对分子进行了分析,而要更好的描述分子的空间构型,还必须引入共价键的第三个键参数——键角。
3.键角
键角是指在多原子分子中,两个相邻共价键之间的夹角。如CO2的结构式为 ,键角为180°,是一种直线形分子;H2O分子中的H—O—H键角是105°,是一种V形(或称角形)分子。多原子分子中的键角一定,表明共价键具有方向性。
键长和键角的数值可以通过晶体的X射线衍射实验获得。
分子的空间结构 键角 实例
正四面体形 _________ CH4、CCl4
平面形 _____ 苯、乙烯、BF3等
三角锥形 107° NH3
V形(角形) _____ H2O
直线形 _____ CO2、CS2、CH≡CH
(3)试根据空间结构填写下列分子的键角
109°28′
120°
105°
180°
(4)部分键角图解
(1)分子中通常键能越大,键长越短,分子越稳定( )
(2)键角是描述分子空间结构的重要参数( )
(3)键长H—I>H—Br>H—Cl;C—C>C==C>C≡C( )
判断正误
√
√
√
3.如图白磷和甲烷均为正四面体结构
它们的键角是否相同,为什么?
提示 不同,白磷分子的键角是指P—P之间的夹角,为60°;而甲烷分子的键角是指C—H的夹角,为109°28′。
【自主梳理】
键参数的概念、影响和特点
类型 概念 影响 特点
键能 气态分子中1 mol化学键 解离成气态原子所吸收的能量 衡量共价键强弱 键能越大,键越稳定
键长 构成共价键的两个原子之间的核间距 衡量共价键强弱 键长越小,键能越大,键越稳定
键角 多原子分子中两个相邻共价键之间的夹角 描述分子空间结构 表明共价键有方向性,决定分子的空间结构
注:键长和键角的数值可通过晶体的X射线衍射实验获得。
键参数
键能
键长
键角
描述分子的空间结构的重要参数
衡量共价
键的稳定性
决定分子的性质
小结
【微思考2】根据元素周期律可知,NH3的稳定性强于PH3,你能利用键参数进行解释吗
提示 N原子的半径比P原子的半径小,故键长N—H比P—H小,则N—H的键能比P—H的键能大,N—H更难被破坏,NH3更稳定。
二、键参数的应用
(1)判断共价键的稳定性
键能越大,断开化学键需要吸收的能量越多,化学键越稳定。
(2)判断分子的稳定性
结构相似的分子中,共价键的键能越大,分子越稳定。
(3)判断化学反应中的能量变化
在化学反应中,断裂旧化学键吸收能量,形成新化学键释放能量,因此反应焓变与键能的关系为ΔH=反应物键能总和-生成物键能总和。ΔH<0时,为放热反应;ΔH>0时,为吸热反应。
1.键能的应用
2.键长的应用
(1)键长越小,一般键能越大,共价键越稳定,含该共价键的分子越稳定。
(2)键长的比较方法
①根据成键原子的原子半径比较。同类型的共价键,成键原子的原子半径越小,键长越小。
②根据共用电子对数比较,相同的两个原子间形成共价键时,单键键长>双键键长>三键键长。
②常见分子中的键角与分子空间结构。
3.键角的应用
①键长和键角决定分子的空间结构。
多原子分子的键角一定,表明共价键具有方向性。键角是描述分子空间结构的重要参数,分子的许多性质都与键角有关。
键长和键角的数值可通过晶体的X射线衍射实验获得。
探究
键参数对物质性质的影响
【问题探究】
已知部分键能、键长数据如下表所示:
共价键 Cl—Cl Br—Br I—I H—F H—Cl H—Br H—I H—O
242.7 193.7 152.7 568 431.8 366 298.7 462.8
键长/pm 198 228 267 96
共价键 C—C C=C C≡C C—H N—H N=O O—O O=O
347.7 615 812 413.4 390.8 607 142 497.3
键长/pm 154 133 120 109 101
分析比较回答下列问题:
(1)根据元素周期律可知,HF、HCl、HBr、HI的稳定性依次减弱,请利用键参数加以解释。
提示 键长H—FH—Cl>H—Br>H—I,故HF、HCl、HBr、HI的稳定性依次减弱。
(2)一般来说,键长越短,键能越大。但F—F键长比Cl—Cl键长小,而F—F键能却比Cl—Cl键能小,为什么
提示 氟原子的半径小导致F—F键长小,由于键长小,两个氟原子形成共价键时,原子核之间的距离较小,两原子核之间排斥力较大,导致F—F键能不大,F2的稳定性较差,容易与其他物质发生反应。
(3)N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一化学事实
提示 从表中的数据可知,N—H、O—H与H—F的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定。所以N2、O2、F2与H2的反应能力依次增强。
(4)下列有关推断是否正确
①同种元素形成的共价键的稳定性:三键>双键>单键。
②同种元素形成的双键键能一定小于单键键能的2倍。
③键长越小,键能一定越大。
④氢化物的键能越大,其稳定性一定越强。
提示 由碳碳键的数据知①正确;由O—O、O=O的键能知,②错误;C—H的键长大于N—H的键长,但是N—H的键能反而较小,③错误;由C—H、N—H的键能可知,C—H的键能较大,而CH4稳定性比NH3弱,④错误。
三、共价键强弱的判断
(1)由原子半径和共用电子对数判断:成键原子的原子半径越小,两原子间共用电子对数越多,则一般共价键越牢固,含有该共价键的分子越稳定。
(2)由键能判断:共价键的键能越大,共价键越牢固,破坏共价键消耗的能量越多。
(3)由键长判断:共价键的键长越小,共价键越牢固,破坏共价键消耗的能量越多。
(4)由电负性判断:元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键一般越稳定。
特别提醒
由分子构成的物质,其熔、沸点与共价键的键能和键长无关,而分子的稳定性由键长和键能大小决定。
1.共价键的牢固性与键能、核间距、共用电子对数的关系:
四、共价键牢固性与物质稳定性的关系
(1)共价键的牢固性与键能的关系共价键的键能越大,表示该共价键越牢固,即完全断开时消耗的能量越多。反之,键能越小,完全断开时消耗的能量越少,共价键越不牢固。
(2)共价键的牢固性与核间距、共用电子对数的关系一般来讲,形成共价键的两原子半径之和越小,共用电子对数越多,键长越短,则共价键越牢固,含有该共价键的分子越稳定。如HF、HCl、HBr、HI中,分子的共用电子对数相同(1对),因F、Cl、Br、I的原子半径依次增大,故共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定性HF>HCl>HBr>HI。
素养脉络
随堂检测
1.可以反映共价键强弱的物理量是( )
A.键角 B.键能、键长
C.键能、键长、键角 D.键长、键角
答案 B
2.从键长的角度判断,下列共价键中最稳定的是( )
A.H—F B.N—H
C.C—H D.S—H
答案 A
本 课 结 束
再见!
第二章 分子结构与性质
第一节 共价键
第二课时 共价键的三个参数
共价键
类型
特征
σ键 “头碰头”
π键 “肩并肩”
方向性
饱和性
回顾
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
我们如何用化学语言来描述不同分子的空间结构和稳定性?
观察思考
卤化氢 在1000℃分解的百分数/%
HCl 0.0014
HBr 0.5
HI 33
得出:在1000℃时,卤化氢分解率大小比较为HCl<HBr<HI
说明:卤化氢的稳定性大小比较为HCl>HBr > HI
如何解释HCl、HBr 、 HI的稳定性的差异呢?
【知识铺垫】
1.甲烷分子为正四面体结构,键角是109°28'。
2.F、Cl、Br、I原子半径逐渐增大,F2、Cl2、Br2、I2与氢气反应越来
越难,HF、HI、HBr、HI的稳定性逐渐减弱。
思考讨论
1
2
3
Cl、Br和I的原子半径依次增大
H2与Cl2、Br2和I2反应放出的热量变化
HCl、HBr、HI
稳定性差异的猜想
H-Cl、H-Br和H-I的强度不同
键参数 —— 键能
定义:气态分子中1 mol化学键解离成气态原子所
吸收的能量。
通常是298.15 K、101 KPa条件下的标准值
单位:kJ·mol-1
键能越大,共价键越牢固, 由此形成的分子越稳定
思考讨论
键能的大小与共价键的强弱有什么关系呢?
键能越大
气态分子中1 mol化学键解离成气态原子所吸收的能量越多
共价键
越牢固
分子
越稳定
键能是共价键强弱的一种标度。
键能:气态分子中1 mol化学键解离成气态原子所吸收的能量。
1.概念
气态分子中 化学键解离成气态原子所 的能量。它通常是298.15 K、100 kPa条件下的标准值,单位是 。
2.应用
(1)判断共价键的稳定性
原子间形成共价键时,原子轨道重叠程度 ,释放能量 ,所形成的共价键键能越大,共价键越 。
一、键能
1 mol
吸收
kJ·mol-1
越大
越多
稳定
(2)判断分子的稳定性
一般来说,结构相似的分子,共价键的键能越大,分子越 。
(3)利用键能计算反应热
ΔH= 总键能- 总键能
稳定
反应物
生成物
资料卡片
键 键能(kJ·mol-1)
N-O 176.0
N=O 607.0
O-O 142.0
O=O 497.3
C-C 347.7
C=C 615.0
C≡C 812.0
某些共价键的键能
键 卤素原子半径(pm) 键能(kJ·mol-1)
H-F 71 568.0
H-Cl 99 431.8
H-Br 114 366.0
H-I 133 298.7
你能发现哪些规律呢?
共价键键能规律:
(1)成键原子相同时,键能强弱比较:单键键能<双键键能<三键键能。
(2)形成共价键的原子的半径越大,键能越小。
(1)共价键的键能越大,共价键越牢固,由该键形成的分子越稳定( )
(2)N—H键能是很多分子中的N—H键能的平均值( )
(3)O—H键能是指在298.15 K、100 kPa下,1 mol气态分子中1 mol O—H键解离成气态原子所吸收的能量( )
(4)C==C键能等于C—C键能的2倍( )
判断正误
√
√
√
×
2.键长
键长是指形成共价键的两个原子之间的核间距。因此原子半径决定化学键的键长,原子半径越小,共价键的键长越短。
化学键的键长与键能是相关的。例如,C—C键、C=C键、C≡C键的键长分别为154 pm、133 pm、120 pm,键长越来越小,它们的键能分别为347.7 kJ·mol-1、615 kJ·mol-1和812 kJ·mol-1,越来越大。
共价键的键长越短,往往键能越大,表明共价键越稳定。
定义:构成化学键的两个原子之间的核间距。
单位:pm(1 pm=10-12 m)
键参数 —— 键长
Cl2中Cl-Cl键长
归纳总结
(1)键长与分子空间结构的关系:键长是影响分子空间结构的因素之一。如CH4分子的空间结构是正四面体,而CH3Cl只是四面体而不是正四面体,原因是C—H和C—Cl的键长不相等。
(2)定性判断键长的方法
①根据原子半径进行判断。在其他条件相同时,成键原子的半径越小,键长越短。
②根据共用电子对数判断。就相同的两原子形成的共价键而言,当两个原子形成双键或者三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。
返回
同种类型的共价键,成键原子的原子半径越小,键长
越小。
成键原子相同的共价键的键长:
单键键长 > 双键键长 > 三键键长
一般地,键长越短, 键能越大,共价键越牢固,由此形成的分子越稳定。
规律:
小结
资料卡片
键 键长(pm) 键能(kJ·mol-1)
H-F 92 568
H-Cl 127 431.8
H-Br 142 366
H-I 161 298.7
键 键长(pm) 键能(kJ·mol-1)
Cl-Cl 198 242.7
Br-Br 228 193.7
I-I 267 152.7
键 键长(pm) 键能(kJ·mol-1)
C-C 154 347.7
C=C 133 615
C≡C 120 812
通过观察共价键的键长和键能的数据,你能发现键长和键能之间的关系吗?
F-F不符合“键长越短,键能越大”的规律,为什么?
F-F 141
157.0
关系:键长越短,键能越大
F-F不符合“键长越短,键能越大”的规律,为什么?
想一想
键 键能 (kJ·mol-1) 键长
pm
F-F 157 141
Cl-Cl 242.7 198
Br-Br 193.7 228
某些共价键的键能和键长
F原子半径很小,因此F-F的键长短,而由于键长短,两个F原子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。键键能(kJ·mol-1)键长pm原子半径pmF-F15714164Cl-Cl242.719899Br-Br193.7228114
思考讨论
新化学键的形成
化学反应实质
旧化学键的断裂
化学键断裂吸收能量
化学键形成释放能量
键能与化学反应的能量变化存在一定的关系
如何用键能计算H2与Cl2、Br2和I2反应放出的热量呢?
原子半径: Cl < Br < I
键长:H-Cl < H-Br < H-I
键能:H-Cl > H-Br> H-I
所以,在相同的温度下,HCl最稳定,分解的百分数最小,HI最不稳定,分解的百分数最大。
如何解释HCl、HBr和HI的稳定性的差异
卤化氢 HCl HBr HI
在1 000 ℃分解的百分数/% 0.001 4 0.5 33%
氢卤键的键能(kJ·mol-1) 431.8 366 298.7
氢卤键的键长pm 127 142 161
键长:H-Cl < H-Br < H-I,键能:H-Cl > H-Br> H-I,所以,在相同的温度下,HCl最稳定,分解的百分数最小,HI最不稳定,分解的百分数最大。
键能
键长
衡量共价键的稳定性
小结
小 结
键能和键长是衡量共价键强弱和分子稳定性的重要参数。
一般来说,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,分子性质越稳定。
以上两个参数定量地对分子进行了分析,而要更好的描述分子的空间构型,还必须引入共价键的第三个键参数——键角。
3.键角
键角是指在多原子分子中,两个相邻共价键之间的夹角。如CO2的结构式为 ,键角为180°,是一种直线形分子;H2O分子中的H—O—H键角是105°,是一种V形(或称角形)分子。多原子分子中的键角一定,表明共价键具有方向性。
键长和键角的数值可以通过晶体的X射线衍射实验获得。
分子的空间结构 键角 实例
正四面体形 _________ CH4、CCl4
平面形 _____ 苯、乙烯、BF3等
三角锥形 107° NH3
V形(角形) _____ H2O
直线形 _____ CO2、CS2、CH≡CH
(3)试根据空间结构填写下列分子的键角
109°28′
120°
105°
180°
(4)部分键角图解
(1)分子中通常键能越大,键长越短,分子越稳定( )
(2)键角是描述分子空间结构的重要参数( )
(3)键长H—I>H—Br>H—Cl;C—C>C==C>C≡C( )
判断正误
√
√
√
3.如图白磷和甲烷均为正四面体结构
它们的键角是否相同,为什么?
提示 不同,白磷分子的键角是指P—P之间的夹角,为60°;而甲烷分子的键角是指C—H的夹角,为109°28′。
【自主梳理】
键参数的概念、影响和特点
类型 概念 影响 特点
键能 气态分子中1 mol化学键 解离成气态原子所吸收的能量 衡量共价键强弱 键能越大,键越稳定
键长 构成共价键的两个原子之间的核间距 衡量共价键强弱 键长越小,键能越大,键越稳定
键角 多原子分子中两个相邻共价键之间的夹角 描述分子空间结构 表明共价键有方向性,决定分子的空间结构
注:键长和键角的数值可通过晶体的X射线衍射实验获得。
键参数
键能
键长
键角
描述分子的空间结构的重要参数
衡量共价
键的稳定性
决定分子的性质
小结
【微思考2】根据元素周期律可知,NH3的稳定性强于PH3,你能利用键参数进行解释吗
提示 N原子的半径比P原子的半径小,故键长N—H比P—H小,则N—H的键能比P—H的键能大,N—H更难被破坏,NH3更稳定。
二、键参数的应用
(1)判断共价键的稳定性
键能越大,断开化学键需要吸收的能量越多,化学键越稳定。
(2)判断分子的稳定性
结构相似的分子中,共价键的键能越大,分子越稳定。
(3)判断化学反应中的能量变化
在化学反应中,断裂旧化学键吸收能量,形成新化学键释放能量,因此反应焓变与键能的关系为ΔH=反应物键能总和-生成物键能总和。ΔH<0时,为放热反应;ΔH>0时,为吸热反应。
1.键能的应用
2.键长的应用
(1)键长越小,一般键能越大,共价键越稳定,含该共价键的分子越稳定。
(2)键长的比较方法
①根据成键原子的原子半径比较。同类型的共价键,成键原子的原子半径越小,键长越小。
②根据共用电子对数比较,相同的两个原子间形成共价键时,单键键长>双键键长>三键键长。
②常见分子中的键角与分子空间结构。
3.键角的应用
①键长和键角决定分子的空间结构。
多原子分子的键角一定,表明共价键具有方向性。键角是描述分子空间结构的重要参数,分子的许多性质都与键角有关。
键长和键角的数值可通过晶体的X射线衍射实验获得。
探究
键参数对物质性质的影响
【问题探究】
已知部分键能、键长数据如下表所示:
共价键 Cl—Cl Br—Br I—I H—F H—Cl H—Br H—I H—O
242.7 193.7 152.7 568 431.8 366 298.7 462.8
键长/pm 198 228 267 96
共价键 C—C C=C C≡C C—H N—H N=O O—O O=O
347.7 615 812 413.4 390.8 607 142 497.3
键长/pm 154 133 120 109 101
分析比较回答下列问题:
(1)根据元素周期律可知,HF、HCl、HBr、HI的稳定性依次减弱,请利用键参数加以解释。
提示 键长H—F
(2)一般来说,键长越短,键能越大。但F—F键长比Cl—Cl键长小,而F—F键能却比Cl—Cl键能小,为什么
提示 氟原子的半径小导致F—F键长小,由于键长小,两个氟原子形成共价键时,原子核之间的距离较小,两原子核之间排斥力较大,导致F—F键能不大,F2的稳定性较差,容易与其他物质发生反应。
(3)N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一化学事实
提示 从表中的数据可知,N—H、O—H与H—F的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定。所以N2、O2、F2与H2的反应能力依次增强。
(4)下列有关推断是否正确
①同种元素形成的共价键的稳定性:三键>双键>单键。
②同种元素形成的双键键能一定小于单键键能的2倍。
③键长越小,键能一定越大。
④氢化物的键能越大,其稳定性一定越强。
提示 由碳碳键的数据知①正确;由O—O、O=O的键能知,②错误;C—H的键长大于N—H的键长,但是N—H的键能反而较小,③错误;由C—H、N—H的键能可知,C—H的键能较大,而CH4稳定性比NH3弱,④错误。
三、共价键强弱的判断
(1)由原子半径和共用电子对数判断:成键原子的原子半径越小,两原子间共用电子对数越多,则一般共价键越牢固,含有该共价键的分子越稳定。
(2)由键能判断:共价键的键能越大,共价键越牢固,破坏共价键消耗的能量越多。
(3)由键长判断:共价键的键长越小,共价键越牢固,破坏共价键消耗的能量越多。
(4)由电负性判断:元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键一般越稳定。
特别提醒
由分子构成的物质,其熔、沸点与共价键的键能和键长无关,而分子的稳定性由键长和键能大小决定。
1.共价键的牢固性与键能、核间距、共用电子对数的关系:
四、共价键牢固性与物质稳定性的关系
(1)共价键的牢固性与键能的关系共价键的键能越大,表示该共价键越牢固,即完全断开时消耗的能量越多。反之,键能越小,完全断开时消耗的能量越少,共价键越不牢固。
(2)共价键的牢固性与核间距、共用电子对数的关系一般来讲,形成共价键的两原子半径之和越小,共用电子对数越多,键长越短,则共价键越牢固,含有该共价键的分子越稳定。如HF、HCl、HBr、HI中,分子的共用电子对数相同(1对),因F、Cl、Br、I的原子半径依次增大,故共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定性HF>HCl>HBr>HI。
素养脉络
随堂检测
1.可以反映共价键强弱的物理量是( )
A.键角 B.键能、键长
C.键能、键长、键角 D.键长、键角
答案 B
2.从键长的角度判断,下列共价键中最稳定的是( )
A.H—F B.N—H
C.C—H D.S—H
答案 A
本 课 结 束
再见!
