四川省绵阳南山中学2023-2024学年高一下学期期中模拟考试化学试题(含答案)
文档属性
| 名称 | 四川省绵阳南山中学2023-2024学年高一下学期期中模拟考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 532.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-16 07:15:29 | ||
图片预览


文档简介
南山中学2023-2024学年高一下学期期中模拟考试
化学试题
(考试时间:75分钟 试卷满分:100分)
一、选择题(本题共 15小题,每小题 3分,共 45分。在每小题给出的四个选项中,只有
一项是符合题目要求的)
1.下列有关说法不正确的是
A.水泥和普通玻璃的制取都要用石灰石做原料
B.工业上常用焦炭还原石英砂制备粗硅
C.碱性溶液保存不能用玻璃塞,氢氟酸保存在塑料瓶中
D.常温下,硅的化学性质稳定,故自然界中的硅大部分以游离态的形式存在
2.下列说法正确的是
A.SO2能使品红、溴水、酸性高锰酸钾溶液等物质褪色,体现了SO2的漂白性
B.硝酸应保存在棕色、细口、带玻璃塞的试剂瓶中
C.常温下浓硫酸可以用铝罐贮存,说明常温下铝与浓硫酸不反应
D.N2→NH3,NH3→NO均属于氮的固定
3.下列有关化学用语正确的是
A.氯离子的结构示意图:
B.氯化铵的电子式:
C.N2的结构式:N≡N
D.质子数为6,中子数为8的微粒:C
4.下列各组离子在给定条件下能大量共存的是
A.在常温pH=1的溶液中:NH、Fe2+、、
B.有存在的溶液中:Na+、Mg2+、Ca2+、Br-
C.能使酚酞溶液变红的溶液中:Na+、Ba2+、Cl-、
D.无色透明的水溶液中:K+、Fe3+、Cl-、
5.设NA为阿伏加德罗常数的值,下列说法正确的是
A.25℃ 、1.01×105Pa条件下,22.4L SO2中含有的原子数等于3NA
B.6.4g Cu与足量的浓硝酸或稀硝酸发生氧化还原反应时,转移的电子数一定是0.2NA
C.1 L 0.1 mol/L硫酸钠溶液中含有的氧原子数为0.4NA
D.32g O2和O3混合物中含有的氧原子数目为NA
6. 在四个不同的容器中,不同条件下进行的合成氨反应N2+3H22NH3,其中生成氨气速率最快的是
A.v(N2)=0.3 mol·L-1·min-1
B.v(NH3)=0.5 mol·L-1·min-1
C.v(H2)=0.01 mol·L-1·s-1
D.v(N2)=0.2 mol·L-1·min-1
7.宏观辨识与微观探析是化学学科核心素养之一、下列离子方程式书写正确的是
A.实验室用氯化铵和熟石灰共热制氨气: + OH- NH3↑ + H2O
B.用足量的NaOH溶液吸收SO2尾气:2OH-+ SO2 = + H2O
C.SO2气体通入溴水中:SO2 + Br2 + H2O = 2H+ + 2Br-+
D.溶液中通入少量:
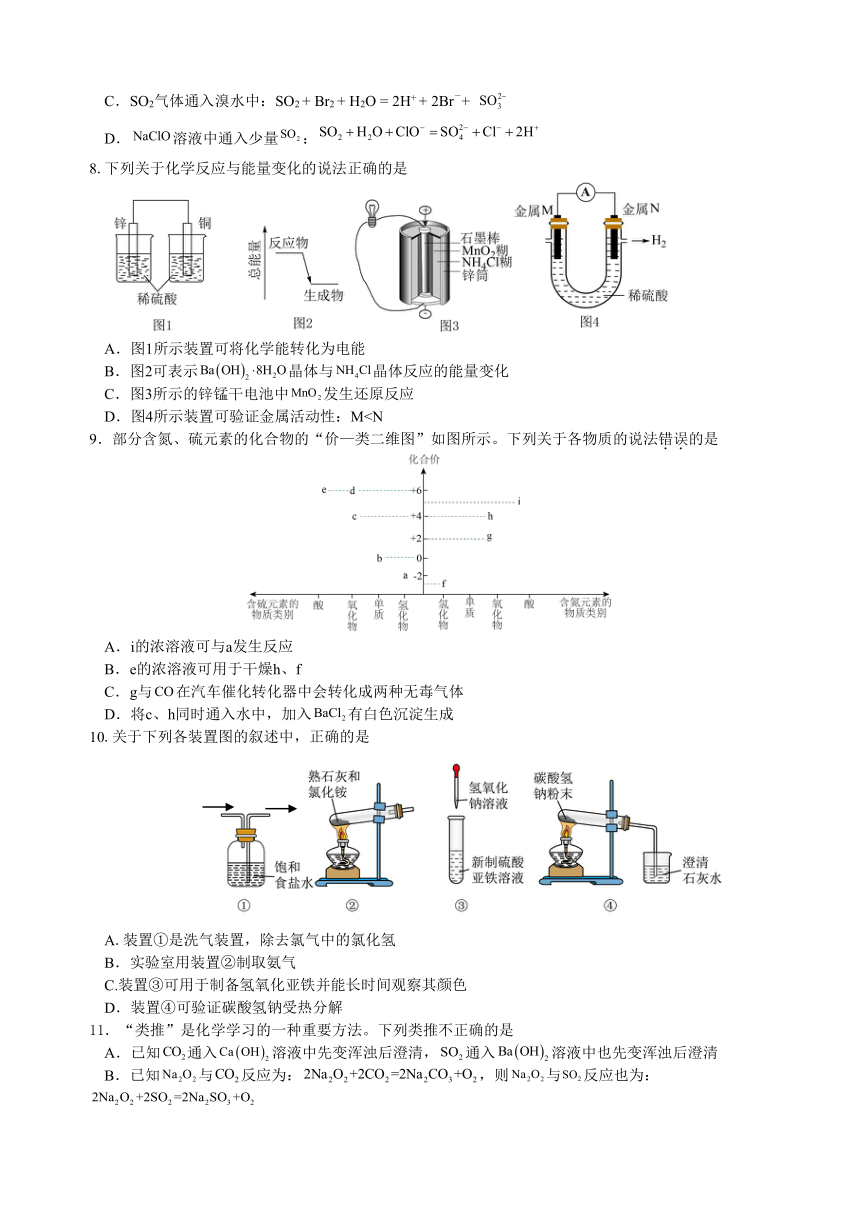
8.下列关于化学反应与能量变化的说法正确的是
A.图1所示装置可将化学能转化为电能
B.图2可表示晶体与晶体反应的能量变化
C.图3所示的锌锰干电池中发生还原反应
D.图4所示装置可验证金属活动性:M9.部分含氮、硫元素的化合物的“价—类二维图”如图所示。下列关于各物质的说法错误的是
A.i的浓溶液可与a发生反应
B.e的浓溶液可用于干燥h、f
C.g与在汽车催化转化器中会转化成两种无毒气体
D.将c、h同时通入水中,加入有白色沉淀生成
10.关于下列各装置图的叙述中,正确的是
A.装置①是洗气装置,除去氯气中的氯化氢
B.实验室用装置②制取氨气
C.装置③可用于制备氢氧化亚铁并能长时间观察其颜色
D.装置④可验证碳酸氢钠受热分解
11.“类推”是化学学习的一种重要方法。下列类推不正确的是
A.已知通入溶液中先变浑浊后澄清,通入溶液中也先变浑浊后澄清
B.已知与反应为:,则与反应也为:
C.已知能溶于盐酸且溶液变澄清,也能溶于硝酸且溶液变澄清
D.已知Na能与反应生成NaOH,K也能与反应生成KOH
X Y
W Z
T
12. 短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X显+2价的一种氧化物是汽车尾气的主要成分之一,能与氧气反应生成显+4价的氧化物。W的氧化物既能和某种酸反应,同时也能和某种碱反应,下列说法正确的是
A. Z的单质与Fe反应一定生成FeZ3
B. Y一定没有最高正价
C. W的氧化物一定是两性氧化物
D. T在常温下可能为固体
13.一定条件下,向绝热恒容密闭容器中通入 SO2和 NO2,使反应 SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图。下列说法正确的是 ( )
A .c点之后容器内气体颜色不再改变
B .生成物的总能量低于反应物的总能量
C .反应物浓度:a点小于b点反应物浓度
D .在 cd 段,该反应的逆反应速率逐渐减小
14. 某学习小组为了探究酸性高锰酸钾溶液与NaHSO3溶液反应速率的影响因素,该小组设计如下实验方案。
实验 0.2mol·L-1NaHSO3溶液/mL 0.1mol·L-1.KMnO4溶液/mL 0.6mol·L-1H2SO4溶液/mL 0. 1mol·L-1MnSO4溶液/mL V(H2O)/mL 混合溶液褪色时间/min
1 3.0 2.0 1.0 0 2.0 8
2 3.0 2.0 2.0 0 a 6
3 4.0 2.0 2.0 0 0 4
4 3.0 2.0 1.0 0.5 b 3
下列说法错误的是
A.该反应的离子方程式为
B.实验3从反应开始到反应结束这段时间内反应速率v(MnO4-)=0.0625mol·L-1·min-1
C.a=1.0、b=1.5
D.实验4与实验1相比,说明Mn2+可能是该反应的催化剂
15.某无色溶液Y可能含有Na+、Fe3+、Ba2+、、Cl-、、、中的几种,且阳离子数目相同,为确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)
下列说法不正确的是
A.溶液Y中一定存在Ba2+、、、
B.溶液Y中一定不存在Fe3+、
C.溶液Y中可能存在Na+、Cl-,若存在 Na+,则Na+数目大于Cl-
D.若向溶液Y中加入0.4g NaOH,可使溶液中的Ba2+完全沉淀
二、非选择题(本题共 4小题,共 55分)
16 .(16分) A 、B 、C、D、E 、F、G 为六种短周期元素,且原子序数依次增大。A与 B、C 、D均能形成10电子化合物,C的气态氢化物能使紫色石蕊溶液变蓝,A 、D能形成两种液态化合物 A2D和A2D2,F元素的周期序数与主族序数相等,A 、G和 C 、E的原子序数之和相等。
(1)D与 E组成的某种化合物呈淡黄色,写出其电子式 ,所含的化学键类型为 。
(2)D 、E 、F 、G简单离子半径由大到小的顺序为 。 (用离子符号表示)
(3)比较 B和 C最简气态氢化物稳定性强弱 > 。(用化学式表示)
(4)在一定条件下,E元素的单质能与 A元素的单质化合生成 EA , EA能与水反应放氢气,则其化学方程式为 ,若将 1mol EA和 2mol F单质混合加入足量的水,充分反应后生成气体的体积是 L(标准状况下)。
(5)CD2是常见的大气污染物,工业生产中可用 C的气态氢化物通过催化还原消除其污染,写出相关化学方程式 。
17.(14分)某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。
(1)有同学认为制得的SO2中可能混有杂质,其化学式为 。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。
①为验证并吸收SO2,装置B中加入的试剂为 ;装置C中品红溶液的作用是 。
②装置H的作用为 。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
①能验证SO2具有氧化性的实验现象为 ;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是 (填Ⅰ、Ⅱ或Ⅲ);试管b中发生反应的离子方程式为 。
18.(12分)I.化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是 (填序号)。
a.生石灰溶于水 b.氢氧化钠固体溶于水 c.氢气与氯气化合
d.氯化铵固体与氢氧化钡晶体混合搅拌 e.过氧化钠溶于水
(2)下列图像分别表示有关反应的反应过程与能量变化的关 据此判断下列说法中正确的是 (填序号)。
a.等质量的石墨和金刚石完全燃烧释放的热量相同
b.白磷和红磷互为同素异形体,相同条件下白磷比红磷稳定
c.1mol (g)和1mol (g)具有的总能量小于2mol NO(g)具有的总能量
II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(3)当电极a为Zn,电极b为Cu,电解质溶液为溶液时,正极的电极反应式为 。若初始时两电极质量相等,当电路中有2mol 通过时,两极的质量差为 g。
(4)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为 。当反应中收集到标准状况下336m气体时,消耗负极的物质的量为 mol。
19. (12分) 工业上利用含铬不锈钢废渣(含 SiO2 、Cr2O3 、Fe2O3 、Al2O3等)制取 Cr2O3(铬绿)的工艺流 程如图所示:
(1) K2CrO4 中铬元素的价态为 ,“碱熔”过程中 Cr2O3 和 KOH 、O2 反应生成 K2CrO4 的化学
方程式为 。
(2)若在实验室进行“碱熔”过程,可选用下列哪种坩埚 。
A.石英坩埚 B.氧化铝坩埚 C.铁坩埚 D.瓷坩埚
(3)为检验“还原 ”前的滤液中是否含有微量的 Fe3+,可选用的化学试剂中有 。
(4)“过滤”后的溶液中铬元素的存在形式为 Cr2O- ,则“还原”反应涉及到的离子方程式为 。
(5)为得到较为纯净的 Cr(OH)3 需对所得产品进行多次洗涤操作,请简要描述洗涤 Cr(OH)3 的基本操
作 。
参考答案
1-5:DBCCB 6-10:ABCBD 11-15:BDBBC
(1) 离子键、非极性共价键
(2) r(Cl-)> r(O2-)> r(Na+)> r(Al3+)
(3) NH3 CH4
(4) NaH+H2O=NaOH+H2 ↑ 56 (5)
17. (1)CO2、H2
(2)酸性KMnO4溶液 验证SO2是否吸收完全 防止空气中H2O进入干燥管而影响杂质气体的检验 (3)a试管中有淡黄色沉淀生成 Ⅱ Cl2+SO2+2H2O=4H++2Cl-+SO
18. (1)ace
(2)c
(3) Cu2++2e-=Cu 129
(4) Al 3e-+4OH-=AlO+2H2O 0.01
19.(1) +6 (条件不为扣分点) (2) C
(3) KSCN 溶液
(4) Cr2O +3SO +8H+=2Cr3++3SO +4H2O
(5) 待过滤完毕,向 Cr(OH)3滤渣中加入蒸馏水,直至完全浸没沉淀,待水自然流下后,重复操作两三次
化学试题
(考试时间:75分钟 试卷满分:100分)
一、选择题(本题共 15小题,每小题 3分,共 45分。在每小题给出的四个选项中,只有
一项是符合题目要求的)
1.下列有关说法不正确的是
A.水泥和普通玻璃的制取都要用石灰石做原料
B.工业上常用焦炭还原石英砂制备粗硅
C.碱性溶液保存不能用玻璃塞,氢氟酸保存在塑料瓶中
D.常温下,硅的化学性质稳定,故自然界中的硅大部分以游离态的形式存在
2.下列说法正确的是
A.SO2能使品红、溴水、酸性高锰酸钾溶液等物质褪色,体现了SO2的漂白性
B.硝酸应保存在棕色、细口、带玻璃塞的试剂瓶中
C.常温下浓硫酸可以用铝罐贮存,说明常温下铝与浓硫酸不反应
D.N2→NH3,NH3→NO均属于氮的固定
3.下列有关化学用语正确的是
A.氯离子的结构示意图:
B.氯化铵的电子式:
C.N2的结构式:N≡N
D.质子数为6,中子数为8的微粒:C
4.下列各组离子在给定条件下能大量共存的是
A.在常温pH=1的溶液中:NH、Fe2+、、
B.有存在的溶液中:Na+、Mg2+、Ca2+、Br-
C.能使酚酞溶液变红的溶液中:Na+、Ba2+、Cl-、
D.无色透明的水溶液中:K+、Fe3+、Cl-、
5.设NA为阿伏加德罗常数的值,下列说法正确的是
A.25℃ 、1.01×105Pa条件下,22.4L SO2中含有的原子数等于3NA
B.6.4g Cu与足量的浓硝酸或稀硝酸发生氧化还原反应时,转移的电子数一定是0.2NA
C.1 L 0.1 mol/L硫酸钠溶液中含有的氧原子数为0.4NA
D.32g O2和O3混合物中含有的氧原子数目为NA
6. 在四个不同的容器中,不同条件下进行的合成氨反应N2+3H22NH3,其中生成氨气速率最快的是
A.v(N2)=0.3 mol·L-1·min-1
B.v(NH3)=0.5 mol·L-1·min-1
C.v(H2)=0.01 mol·L-1·s-1
D.v(N2)=0.2 mol·L-1·min-1
7.宏观辨识与微观探析是化学学科核心素养之一、下列离子方程式书写正确的是
A.实验室用氯化铵和熟石灰共热制氨气: + OH- NH3↑ + H2O
B.用足量的NaOH溶液吸收SO2尾气:2OH-+ SO2 = + H2O
C.SO2气体通入溴水中:SO2 + Br2 + H2O = 2H+ + 2Br-+
D.溶液中通入少量:
8.下列关于化学反应与能量变化的说法正确的是
A.图1所示装置可将化学能转化为电能
B.图2可表示晶体与晶体反应的能量变化
C.图3所示的锌锰干电池中发生还原反应
D.图4所示装置可验证金属活动性:M
A.i的浓溶液可与a发生反应
B.e的浓溶液可用于干燥h、f
C.g与在汽车催化转化器中会转化成两种无毒气体
D.将c、h同时通入水中,加入有白色沉淀生成
10.关于下列各装置图的叙述中,正确的是
A.装置①是洗气装置,除去氯气中的氯化氢
B.实验室用装置②制取氨气
C.装置③可用于制备氢氧化亚铁并能长时间观察其颜色
D.装置④可验证碳酸氢钠受热分解
11.“类推”是化学学习的一种重要方法。下列类推不正确的是
A.已知通入溶液中先变浑浊后澄清,通入溶液中也先变浑浊后澄清
B.已知与反应为:,则与反应也为:
C.已知能溶于盐酸且溶液变澄清,也能溶于硝酸且溶液变澄清
D.已知Na能与反应生成NaOH,K也能与反应生成KOH
X Y
W Z
T
12. 短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X显+2价的一种氧化物是汽车尾气的主要成分之一,能与氧气反应生成显+4价的氧化物。W的氧化物既能和某种酸反应,同时也能和某种碱反应,下列说法正确的是
A. Z的单质与Fe反应一定生成FeZ3
B. Y一定没有最高正价
C. W的氧化物一定是两性氧化物
D. T在常温下可能为固体
13.一定条件下,向绝热恒容密闭容器中通入 SO2和 NO2,使反应 SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图。下列说法正确的是 ( )
A .c点之后容器内气体颜色不再改变
B .生成物的总能量低于反应物的总能量
C .反应物浓度:a点小于b点反应物浓度
D .在 cd 段,该反应的逆反应速率逐渐减小
14. 某学习小组为了探究酸性高锰酸钾溶液与NaHSO3溶液反应速率的影响因素,该小组设计如下实验方案。
实验 0.2mol·L-1NaHSO3溶液/mL 0.1mol·L-1.KMnO4溶液/mL 0.6mol·L-1H2SO4溶液/mL 0. 1mol·L-1MnSO4溶液/mL V(H2O)/mL 混合溶液褪色时间/min
1 3.0 2.0 1.0 0 2.0 8
2 3.0 2.0 2.0 0 a 6
3 4.0 2.0 2.0 0 0 4
4 3.0 2.0 1.0 0.5 b 3
下列说法错误的是
A.该反应的离子方程式为
B.实验3从反应开始到反应结束这段时间内反应速率v(MnO4-)=0.0625mol·L-1·min-1
C.a=1.0、b=1.5
D.实验4与实验1相比,说明Mn2+可能是该反应的催化剂
15.某无色溶液Y可能含有Na+、Fe3+、Ba2+、、Cl-、、、中的几种,且阳离子数目相同,为确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)
下列说法不正确的是
A.溶液Y中一定存在Ba2+、、、
B.溶液Y中一定不存在Fe3+、
C.溶液Y中可能存在Na+、Cl-,若存在 Na+,则Na+数目大于Cl-
D.若向溶液Y中加入0.4g NaOH,可使溶液中的Ba2+完全沉淀
二、非选择题(本题共 4小题,共 55分)
16 .(16分) A 、B 、C、D、E 、F、G 为六种短周期元素,且原子序数依次增大。A与 B、C 、D均能形成10电子化合物,C的气态氢化物能使紫色石蕊溶液变蓝,A 、D能形成两种液态化合物 A2D和A2D2,F元素的周期序数与主族序数相等,A 、G和 C 、E的原子序数之和相等。
(1)D与 E组成的某种化合物呈淡黄色,写出其电子式 ,所含的化学键类型为 。
(2)D 、E 、F 、G简单离子半径由大到小的顺序为 。 (用离子符号表示)
(3)比较 B和 C最简气态氢化物稳定性强弱 > 。(用化学式表示)
(4)在一定条件下,E元素的单质能与 A元素的单质化合生成 EA , EA能与水反应放氢气,则其化学方程式为 ,若将 1mol EA和 2mol F单质混合加入足量的水,充分反应后生成气体的体积是 L(标准状况下)。
(5)CD2是常见的大气污染物,工业生产中可用 C的气态氢化物通过催化还原消除其污染,写出相关化学方程式 。
17.(14分)某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。
(1)有同学认为制得的SO2中可能混有杂质,其化学式为 。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。
①为验证并吸收SO2,装置B中加入的试剂为 ;装置C中品红溶液的作用是 。
②装置H的作用为 。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
①能验证SO2具有氧化性的实验现象为 ;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是 (填Ⅰ、Ⅱ或Ⅲ);试管b中发生反应的离子方程式为 。
18.(12分)I.化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是 (填序号)。
a.生石灰溶于水 b.氢氧化钠固体溶于水 c.氢气与氯气化合
d.氯化铵固体与氢氧化钡晶体混合搅拌 e.过氧化钠溶于水
(2)下列图像分别表示有关反应的反应过程与能量变化的关 据此判断下列说法中正确的是 (填序号)。
a.等质量的石墨和金刚石完全燃烧释放的热量相同
b.白磷和红磷互为同素异形体,相同条件下白磷比红磷稳定
c.1mol (g)和1mol (g)具有的总能量小于2mol NO(g)具有的总能量
II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(3)当电极a为Zn,电极b为Cu,电解质溶液为溶液时,正极的电极反应式为 。若初始时两电极质量相等,当电路中有2mol 通过时,两极的质量差为 g。
(4)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为 。当反应中收集到标准状况下336m气体时,消耗负极的物质的量为 mol。
19. (12分) 工业上利用含铬不锈钢废渣(含 SiO2 、Cr2O3 、Fe2O3 、Al2O3等)制取 Cr2O3(铬绿)的工艺流 程如图所示:
(1) K2CrO4 中铬元素的价态为 ,“碱熔”过程中 Cr2O3 和 KOH 、O2 反应生成 K2CrO4 的化学
方程式为 。
(2)若在实验室进行“碱熔”过程,可选用下列哪种坩埚 。
A.石英坩埚 B.氧化铝坩埚 C.铁坩埚 D.瓷坩埚
(3)为检验“还原 ”前的滤液中是否含有微量的 Fe3+,可选用的化学试剂中有 。
(4)“过滤”后的溶液中铬元素的存在形式为 Cr2O- ,则“还原”反应涉及到的离子方程式为 。
(5)为得到较为纯净的 Cr(OH)3 需对所得产品进行多次洗涤操作,请简要描述洗涤 Cr(OH)3 的基本操
作 。
参考答案
1-5:DBCCB 6-10:ABCBD 11-15:BDBBC
(1) 离子键、非极性共价键
(2) r(Cl-)> r(O2-)> r(Na+)> r(Al3+)
(3) NH3 CH4
(4) NaH+H2O=NaOH+H2 ↑ 56 (5)
17. (1)CO2、H2
(2)酸性KMnO4溶液 验证SO2是否吸收完全 防止空气中H2O进入干燥管而影响杂质气体的检验 (3)a试管中有淡黄色沉淀生成 Ⅱ Cl2+SO2+2H2O=4H++2Cl-+SO
18. (1)ace
(2)c
(3) Cu2++2e-=Cu 129
(4) Al 3e-+4OH-=AlO+2H2O 0.01
19.(1) +6 (条件不为扣分点) (2) C
(3) KSCN 溶液
(4) Cr2O +3SO +8H+=2Cr3++3SO +4H2O
(5) 待过滤完毕,向 Cr(OH)3滤渣中加入蒸馏水,直至完全浸没沉淀,待水自然流下后,重复操作两三次
同课章节目录
