福建省永安市第三中学高中校2023-2024学年高一下学期第一次月考化学试题(选考班)(含答案)
文档属性
| 名称 | 福建省永安市第三中学高中校2023-2024学年高一下学期第一次月考化学试题(选考班)(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 481.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-16 08:04:00 | ||
图片预览


文档简介
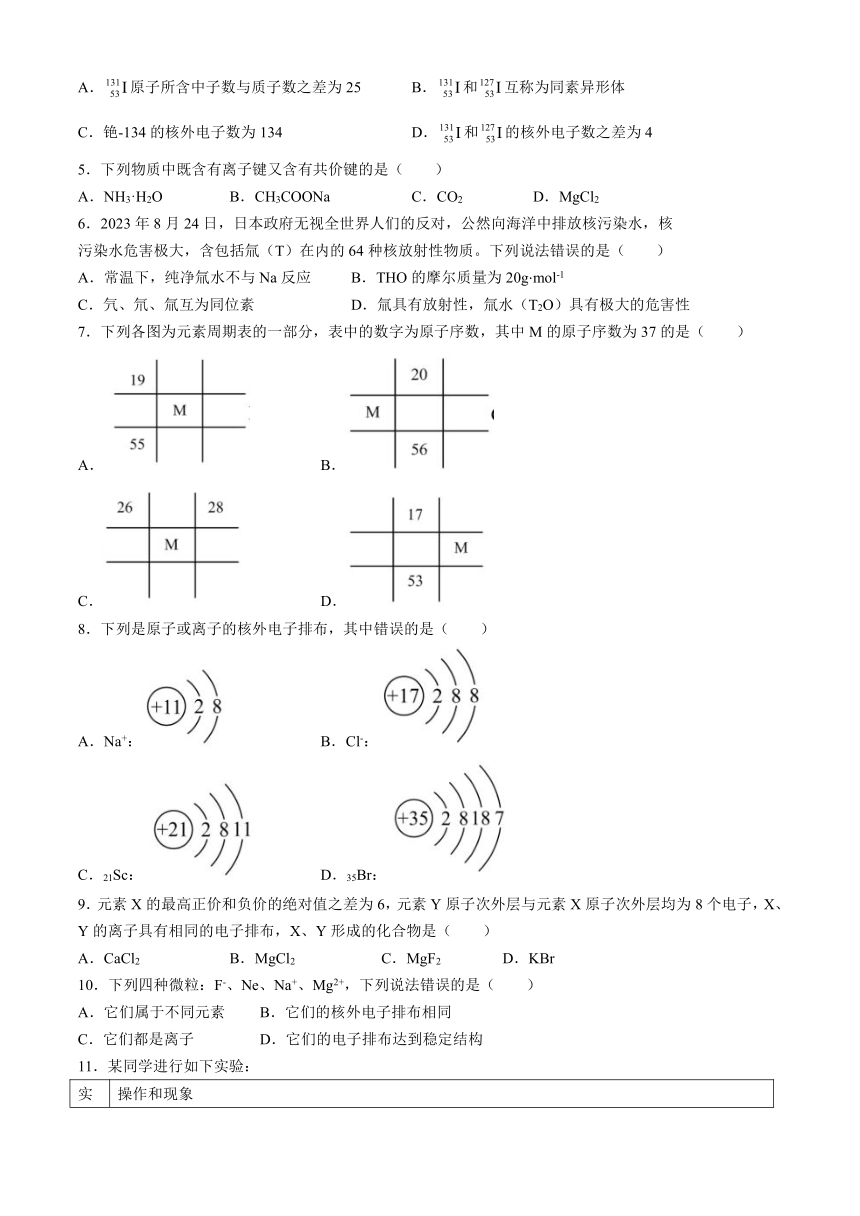
永安市第三中学高中校2023-2024学年高一下学期第一次月考
化学试卷(选考班)
考试时间:70分钟
一、单选题(每小题3分,共45分)
1.已知Te为第五周期第ⅥA族元素。下列结论错误的是( )
A.粒子半径: B.氧化性:
C.酸性: D.金属性:
2.下列化学用语正确的是( )
A.Cl的原子结构示意图:
B.18O2和16O3互为同位素
C.H2O2的电子式:
D.用电子式表示MgCl2的形成过程:
3.完成下列实验所需选择的装置或仪器都正确的是( )
选项 A B C D
实验 用乙醇萃取碘水中的I2 分离苯与溴单质 除去NaCl溶液中含有的泥沙 检验样品溶液中是否含有钾元素
装置
A.A B.B C.C D.D
4.日本福岛核废水排海引起舆论风波,核废水中不只含有放射性氚,真正具有伤害性的,还有6种放射性元素,分别是碘-131、铯-134和铯-137、碳-14、钴-60和锶-90。下列叙述正确的是( )
A.原子所含中子数与质子数之差为25 B.和互称为同素异形体
C.铯-134的核外电子数为134 D.和的核外电子数之差为4
5.下列物质中既含有离子键又含有共价键的是( )
A.NH3·H2O B.CH3COONa C.CO2 D.MgCl2
6.2023年8月24日,日本政府无视全世界人们的反对,公然向海洋中排放核污染水,核
污染水危害极大,含包括氚(T)在内的64种核放射性物质。下列说法错误的是( )
A.常温下,纯净氚水不与Na反应 B.THO的摩尔质量为20g mol-1
C.氕、氘、氚互为同位素 D.氚具有放射性,氚水(T2O)具有极大的危害性
7.下列各图为元素周期表的一部分,表中的数字为原子序数,其中M的原子序数为37的是( )
A. B.
C. D.
8.下列是原子或离子的核外电子排布,其中错误的是( )
A.Na+: B.Cl-:
C.21Sc: D.35Br:
9.元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是( )
A.CaCl2 B.MgCl2 C.MgF2 D.KBr
10.下列四种微粒:F-、Ne、Na+、Mg2+,下列说法错误的是( )
A.它们属于不同元素 B.它们的核外电子排布相同
C.它们都是离子 D.它们的电子排布达到稳定结构
11.某同学进行如下实验:
实验 操作和现象
Ⅰ 向溴水中滴加少量CCl4,振荡,CCl4层显橙色
Ⅱ 向碘水中滴加少量CCl4,振荡,CCl4层显紫色
Ⅲ 向KBr、KI的混合液中加入CCl4。滴加少量氯水,振荡后CCl4层显紫色;再滴加一定量的氯水,振荡后紫色褪去;继续滴加过量氯水,振荡后CCl4层变为橙色
下列分析不正确的是( )
A.Ⅰ中溴水为黄色,振荡后CCl4层显橙色,说明Br2在CCl4中的溶解性大于在水中的溶解性
B.由Ⅲ中现象可知还原性:I->Br-
C.Ⅲ中CCl4层变为橙色时,水层中仍含有大量I-
D.由上述实验可以推断出非金属性:Cl>Br>I
12.下列反应是氧化还原反应且反应过程中的能量变化符合下图的是( )
A. B.
C. D.
13.过氧化钠和氢化钙与水的反应分别为:①;②。下列说法错误的是( )
A.①中水发生氧化反应,②中水发生还原反应
B.Na2O2中存在离子键和非极性键,CaH2中只存在离子键不存在非极性键
C.Na2O2中阴、阳离子个数比为1:2,CaH2中阴、阳离子个数比为2:1
D.当反应①和②中转移的电子数相同时,产生的O2和H2的物质的量之比为1:2
14.下表为几种短周期元素的性质:
元素编号 ① ② ③ ④ ⑤ ⑥
原子半径/pm 66 160 110 99 70 88
最高化合价 +2 +5 +7 +5 +3
最低化合价 -2 -3 -1 -3
下列有关上述元素的说法正确的是( )
A.元素④的氢化物的沸点高于元素①的氢化物的沸点
B.②⑤形成的化合物为共价化合物
C.上述六种元素中,最高价氧化物对应水化物的酸性最强的是元素④
D.元素⑥位于周期表中第三周期ⅢA族
15.水煤气变换反应的过程示意图如下:
下列说法正确的是( )
A.在图示过程中有1分子水未参加反应
B.过程Ⅰ、Ⅱ、Ⅲ中均有O-H键断裂
C.H2O和CO2分子中均含有非极性键
D.该反应的化学方程式是
二、填空题(共55分)
16(5分).根据下列反应和信息回答下列问题:
在25℃和101kPa条件下,
已知:
化学键 H-H F-F H-F
键能(/kJmol) 436 157 568
(1)该反应中反应物断裂化学键需要吸收的能量E吸收=___________kJ,生成物形成化学键放出的能量E放出=___________kJ,该反应属于___________反应(填“放热”或“吸热”),放出(或吸收)___________kJ的热量。
(2)该反应的能量变化图是___________
17(14分).下表列出了A~R10种元素在周期表中的位置:
族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 E J F
3 A C D G R
4 B H
请填空:
(1)这10种元素中,化学性质最不活泼的是___________(填元素名称)。
(2)D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___________。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为___________(填元素符号)。
(4)EF2的电子式为___________,F元素的最简单氢化物在常温下跟B发生反应的化学方程式是___________。
(5)G元素和H元素两者核电荷数之差是___________。
(6)A2F2所含的化学键类型有___________。
18(12分).海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤③和⑤的实验操作名称分别是___________、___________。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是___________,该装置的操作名称为___________。
(3)步骤④反应的离子方程式是___________。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:___________。
19(14分).某校化学学习小组分别设计了一组实验来探究元素周期律。第一小组根据元素非金属性与其对应最高价含氧酸之间的关系,设计了如图所示装置来完成元素非金属性强弱比较的实验探究。
图1 图2
已知:I.稀硝酸具有挥发性。
Ⅱ.H2SiO3是难溶于水的胶状沉淀。
Ⅲ.常温下浓盐酸能与高锰酸钾反应生成氯气。
回答下列问题:
(1)第一小组为比较C、N、Si的非金属性强弱,用图1装置进行实验。
①烧杯中的现象为___________,其中CO2与Na2SiO3溶液发生反应的离子方程式为___________。
②根据实验现象,第一小组得出的结论是:元素的非金属性由强到弱的顺序为___________。但其中存在的问题是___________。
(2)第二小组设计了图2装置来验证卤素单质的氧化性强弱和潮湿的氯气具有漂白性,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉-碘化钾试纸、湿润的红色纸条。
①写出A处发生反应的离子方程式:___________。
②第二小组通过实验___________(“能”或“不能”)得出实验结论:氧化性:Cl2>Br2>I2;原因是___________。
20(10分).1869年俄国化学家门捷列夫制出第一张元素周期表。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。回答下列问题:
(1)汞是80号元素,原子结构示意图如图,汞在第___________周期。
(2)Ge是32号元素,那么它的最高正价为___________,氮的最高价氧化物为___________(填化学式)。
(3)根据元素周期律推断:
①氢化物稳定性最强的卤族元素是___________(填元素符号)。
②镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是___________(填序号)。
A.原子半径:Ga>N B.N的非金属性比O强
C.Ga的金属性比Al弱 D.Al和Be的氧化物可能是两性氧化物
参考答案:
1-5ADCAB 6-10ABCAC 11-15CCACB
16(5分).(1)593 1136 放热 543 (2)b
17(14分).氩 K>Na>Mg 18 离子键和共价键
18(12分).过滤 萃取(分液) C 蒸馏 取少量溶液于试管中,滴加少量淀粉溶液,若溶液变蓝,说明原溶液中含有单质碘,反之则无
19.(14分)(1)溶液变浑浊(或产生不溶于水的胶状沉淀)
(或)
N>C>Si 稀硝酸有一定的挥发性,影响C和Si非金属性强弱的判断
(2) 不能 无法判断生成的I2是过量氯气与碘化钾溶液反应还是Br2与碘化钾溶液反应生成的,故无法判断Br2和I2的氧化性强弱
20(10分).(1)六
(2)+4 N2O5
(3)F AD
化学试卷(选考班)
考试时间:70分钟
一、单选题(每小题3分,共45分)
1.已知Te为第五周期第ⅥA族元素。下列结论错误的是( )
A.粒子半径: B.氧化性:
C.酸性: D.金属性:
2.下列化学用语正确的是( )
A.Cl的原子结构示意图:
B.18O2和16O3互为同位素
C.H2O2的电子式:
D.用电子式表示MgCl2的形成过程:
3.完成下列实验所需选择的装置或仪器都正确的是( )
选项 A B C D
实验 用乙醇萃取碘水中的I2 分离苯与溴单质 除去NaCl溶液中含有的泥沙 检验样品溶液中是否含有钾元素
装置
A.A B.B C.C D.D
4.日本福岛核废水排海引起舆论风波,核废水中不只含有放射性氚,真正具有伤害性的,还有6种放射性元素,分别是碘-131、铯-134和铯-137、碳-14、钴-60和锶-90。下列叙述正确的是( )
A.原子所含中子数与质子数之差为25 B.和互称为同素异形体
C.铯-134的核外电子数为134 D.和的核外电子数之差为4
5.下列物质中既含有离子键又含有共价键的是( )
A.NH3·H2O B.CH3COONa C.CO2 D.MgCl2
6.2023年8月24日,日本政府无视全世界人们的反对,公然向海洋中排放核污染水,核
污染水危害极大,含包括氚(T)在内的64种核放射性物质。下列说法错误的是( )
A.常温下,纯净氚水不与Na反应 B.THO的摩尔质量为20g mol-1
C.氕、氘、氚互为同位素 D.氚具有放射性,氚水(T2O)具有极大的危害性
7.下列各图为元素周期表的一部分,表中的数字为原子序数,其中M的原子序数为37的是( )
A. B.
C. D.
8.下列是原子或离子的核外电子排布,其中错误的是( )
A.Na+: B.Cl-:
C.21Sc: D.35Br:
9.元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是( )
A.CaCl2 B.MgCl2 C.MgF2 D.KBr
10.下列四种微粒:F-、Ne、Na+、Mg2+,下列说法错误的是( )
A.它们属于不同元素 B.它们的核外电子排布相同
C.它们都是离子 D.它们的电子排布达到稳定结构
11.某同学进行如下实验:
实验 操作和现象
Ⅰ 向溴水中滴加少量CCl4,振荡,CCl4层显橙色
Ⅱ 向碘水中滴加少量CCl4,振荡,CCl4层显紫色
Ⅲ 向KBr、KI的混合液中加入CCl4。滴加少量氯水,振荡后CCl4层显紫色;再滴加一定量的氯水,振荡后紫色褪去;继续滴加过量氯水,振荡后CCl4层变为橙色
下列分析不正确的是( )
A.Ⅰ中溴水为黄色,振荡后CCl4层显橙色,说明Br2在CCl4中的溶解性大于在水中的溶解性
B.由Ⅲ中现象可知还原性:I->Br-
C.Ⅲ中CCl4层变为橙色时,水层中仍含有大量I-
D.由上述实验可以推断出非金属性:Cl>Br>I
12.下列反应是氧化还原反应且反应过程中的能量变化符合下图的是( )
A. B.
C. D.
13.过氧化钠和氢化钙与水的反应分别为:①;②。下列说法错误的是( )
A.①中水发生氧化反应,②中水发生还原反应
B.Na2O2中存在离子键和非极性键,CaH2中只存在离子键不存在非极性键
C.Na2O2中阴、阳离子个数比为1:2,CaH2中阴、阳离子个数比为2:1
D.当反应①和②中转移的电子数相同时,产生的O2和H2的物质的量之比为1:2
14.下表为几种短周期元素的性质:
元素编号 ① ② ③ ④ ⑤ ⑥
原子半径/pm 66 160 110 99 70 88
最高化合价 +2 +5 +7 +5 +3
最低化合价 -2 -3 -1 -3
下列有关上述元素的说法正确的是( )
A.元素④的氢化物的沸点高于元素①的氢化物的沸点
B.②⑤形成的化合物为共价化合物
C.上述六种元素中,最高价氧化物对应水化物的酸性最强的是元素④
D.元素⑥位于周期表中第三周期ⅢA族
15.水煤气变换反应的过程示意图如下:
下列说法正确的是( )
A.在图示过程中有1分子水未参加反应
B.过程Ⅰ、Ⅱ、Ⅲ中均有O-H键断裂
C.H2O和CO2分子中均含有非极性键
D.该反应的化学方程式是
二、填空题(共55分)
16(5分).根据下列反应和信息回答下列问题:
在25℃和101kPa条件下,
已知:
化学键 H-H F-F H-F
键能(/kJmol) 436 157 568
(1)该反应中反应物断裂化学键需要吸收的能量E吸收=___________kJ,生成物形成化学键放出的能量E放出=___________kJ,该反应属于___________反应(填“放热”或“吸热”),放出(或吸收)___________kJ的热量。
(2)该反应的能量变化图是___________
17(14分).下表列出了A~R10种元素在周期表中的位置:
族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 E J F
3 A C D G R
4 B H
请填空:
(1)这10种元素中,化学性质最不活泼的是___________(填元素名称)。
(2)D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___________。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为___________(填元素符号)。
(4)EF2的电子式为___________,F元素的最简单氢化物在常温下跟B发生反应的化学方程式是___________。
(5)G元素和H元素两者核电荷数之差是___________。
(6)A2F2所含的化学键类型有___________。
18(12分).海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤③和⑤的实验操作名称分别是___________、___________。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是___________,该装置的操作名称为___________。
(3)步骤④反应的离子方程式是___________。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:___________。
19(14分).某校化学学习小组分别设计了一组实验来探究元素周期律。第一小组根据元素非金属性与其对应最高价含氧酸之间的关系,设计了如图所示装置来完成元素非金属性强弱比较的实验探究。
图1 图2
已知:I.稀硝酸具有挥发性。
Ⅱ.H2SiO3是难溶于水的胶状沉淀。
Ⅲ.常温下浓盐酸能与高锰酸钾反应生成氯气。
回答下列问题:
(1)第一小组为比较C、N、Si的非金属性强弱,用图1装置进行实验。
①烧杯中的现象为___________,其中CO2与Na2SiO3溶液发生反应的离子方程式为___________。
②根据实验现象,第一小组得出的结论是:元素的非金属性由强到弱的顺序为___________。但其中存在的问题是___________。
(2)第二小组设计了图2装置来验证卤素单质的氧化性强弱和潮湿的氯气具有漂白性,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉-碘化钾试纸、湿润的红色纸条。
①写出A处发生反应的离子方程式:___________。
②第二小组通过实验___________(“能”或“不能”)得出实验结论:氧化性:Cl2>Br2>I2;原因是___________。
20(10分).1869年俄国化学家门捷列夫制出第一张元素周期表。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。回答下列问题:
(1)汞是80号元素,原子结构示意图如图,汞在第___________周期。
(2)Ge是32号元素,那么它的最高正价为___________,氮的最高价氧化物为___________(填化学式)。
(3)根据元素周期律推断:
①氢化物稳定性最强的卤族元素是___________(填元素符号)。
②镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是___________(填序号)。
A.原子半径:Ga>N B.N的非金属性比O强
C.Ga的金属性比Al弱 D.Al和Be的氧化物可能是两性氧化物
参考答案:
1-5ADCAB 6-10ABCAC 11-15CCACB
16(5分).(1)593 1136 放热 543 (2)b
17(14分).氩 K>Na>Mg 18 离子键和共价键
18(12分).过滤 萃取(分液) C 蒸馏 取少量溶液于试管中,滴加少量淀粉溶液,若溶液变蓝,说明原溶液中含有单质碘,反之则无
19.(14分)(1)溶液变浑浊(或产生不溶于水的胶状沉淀)
(或)
N>C>Si 稀硝酸有一定的挥发性,影响C和Si非金属性强弱的判断
(2) 不能 无法判断生成的I2是过量氯气与碘化钾溶液反应还是Br2与碘化钾溶液反应生成的,故无法判断Br2和I2的氧化性强弱
20(10分).(1)六
(2)+4 N2O5
(3)F AD
同课章节目录
