四川省绵阳南山中学2023-2024学年高一下学期期中模拟考试(二)化学试卷(含答案)
文档属性
| 名称 | 四川省绵阳南山中学2023-2024学年高一下学期期中模拟考试(二)化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 483.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-16 08:48:05 | ||
图片预览



文档简介
南山中学2023 2024学年高一下学期期中模拟考试(二)
化学试卷
时间:75分钟 满分:100分 测试范围:第五、六章
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
第Ⅰ卷(选择题 共42分)
选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
化学与生产、 生活密切相关, 下列说法正确的是
A .碳酸钡可用于肠胃 X射线造影检查
B .葡萄酒中常添加一定量的 SO2用来抗氧化和杀菌
C .为增强 84 消毒液的杀菌消毒效果,可与洁厕灵混合使用
D .用于制作轴承的金刚砂属于传统的硅酸盐材料,具有优异的高温抗氧化性
2.下列有硫及化合物的说法中,正确的是
A.将足量SO2和CO2分别通入NaClO溶液中,均生成HClO
B.标准状况下,1的体积小于22.4L
C.浓硫酸与食盐共热,浓硫酸表现的性质为强酸性
D.2mol与足量O2反应,转移电子的物质的量为4 mol
3.已知 X为一种常见酸的浓溶液。A与 X反应的转化关系如图所示,其中反应条件及部分产物均已略去,
则下列有关说法正确的是( )
A .X可使蔗糖变黑, 体现了其吸水性
B .将 B通入紫色石蕊试液中,可观察到溶液先变红后褪色
C .若 A为 Al,则在常温条件下不能发生图示的转化过程
D .工业上, 2mol B 和足量 O2充分反应,可得到 2mol D
4.氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。实验室可选用下列装置和试剂制备氨气,并干燥、收集和处理尾气,下列说法正确的是
A.①和②均可用于实验室制备氨气
B.③中盛有碱石灰或无水氯化钙可用于干燥氨气
C.④可用于收集氨气,气流方向为a进b出
D.⑤中盛有稀硫酸可用于氨气的尾气处理
5. 能正确表示下列反应的离子方程式的是
A.向澄清的石灰水中通入SO2气体:+SO2=CaSO3↓
B.过量SO2气体通入氢氧化钠溶液中:SO2+OH-=HSO
C.SO2气体通入溴水中:SO2+Br2+H2O=2H++2Br-+SO
D.向氢硫酸(H2S)中通入氯气:
6.探究铜和浓硫酸的反应,下列装置或操作错误的是
A.上下移动装置甲中的铜丝体现绿色化学的思想
B.装置乙可用于收集SO2气体
C.将试管中的液体倒入装置丙中稀释,观察颜色可确定CuSO4的生成
D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4 5H2O
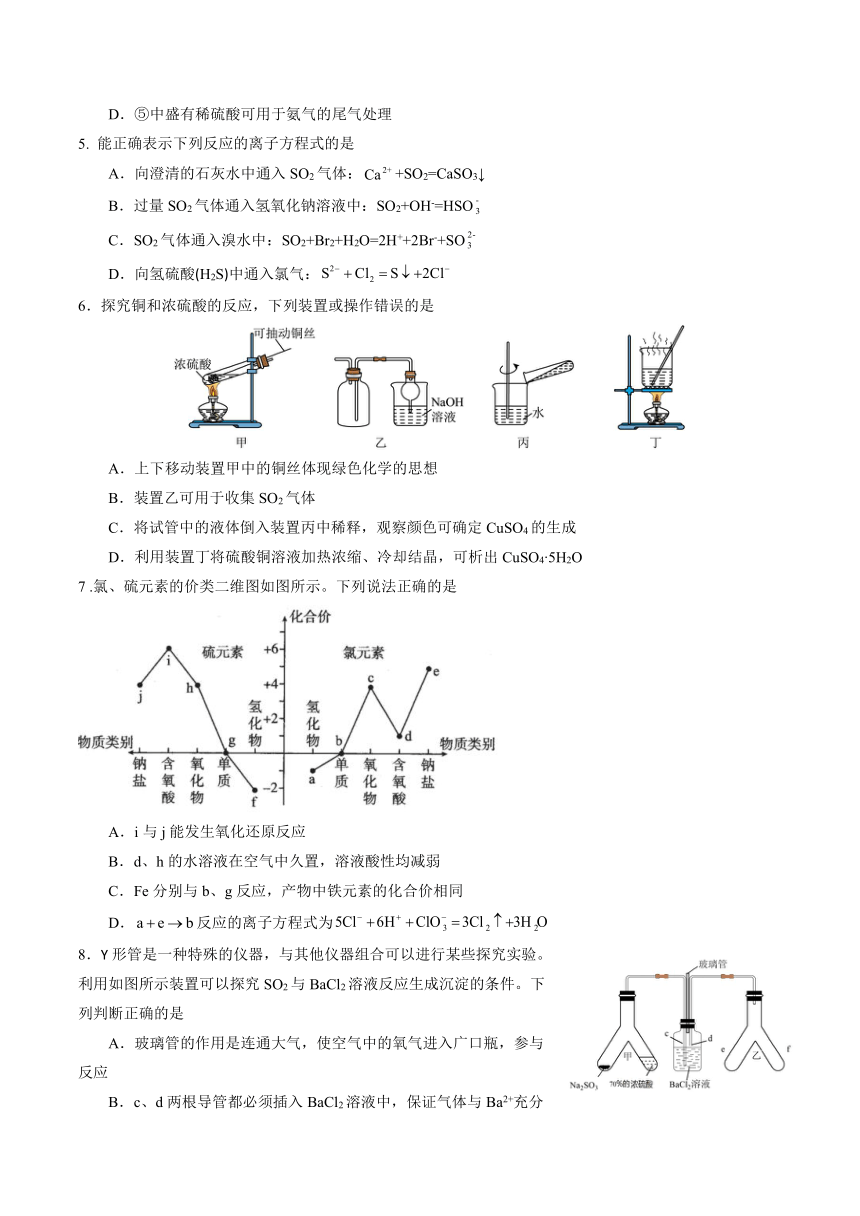
7 .氯、硫元素的价类二维图如图所示。下列说法正确的是
A.i与j能发生氧化还原反应
B.d、h的水溶液在空气中久置,溶液酸性均减弱
C.Fe分别与b、g反应,产物中铁元素的化合价相同
D.反应的离子方程式为
8.Y形管是一种特殊的仪器,与其他仪器组合可以进行某些探究实验。利用如图所示装置可以探究SO2与BaCl2溶液反应生成沉淀的条件。下列判断正确的是
A.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
C.Y形管乙中产生的氧化性气体将BaSO3氧化为BaSO4
D.e、f两管中的试剂可以分别是KMnO4和浓盐酸
9.下列关于化学反应速率的说法正确的是( )
A .生铁与稀盐酸的反应速率一般小于纯铁与稀盐酸的反应速率
B .对于任何化学反应来说,反应速率越大,反应现象就越明显
C .在恒压密闭容器中发生如下反应: N2+3H2 2NH3 ,充入 Ar,反应速率不变
D .100mL 2mol/L的盐酸与锌片反应,加入适量的氯化钠溶液,反应速率变慢
10.下列由实验现象得到的结论中错误的是
A.将两片打磨过的铝片分别放入3mL 20%的盐酸和氢氧化钠溶液中,均有气泡产生,能说明铝片既可与酸反应又可与某些碱反应
B.分别取3%、6%的双氧水2~3mL于两支试管中,再分别向两支试管中各加入少量等量的粉末,6%的双氧水产生气泡的速率明显快于3%的双氧水,能说明催化剂对浓溶液的作用更有效
C.将铁丝插入装有硫酸铜溶液的试管中,一段时间后取出,可以看到铁丝表面有红色附着物,能说明铁比铜更活泼
D.取15%的双氧水2~3mL于试管中,只有少量气泡产生,如果将试管置于75℃的热水中,气泡会明显增多,能说明温度升高反应会加快
11.化学反应常常伴随能量的变化,以下是 H2 与 Cl2 反应的能量变化示意图,下列说法正确的
A.氯化氢分子的电子式:
B.该反应既是氧化还原反应又是放热反应
C.形成 1 mol H—Cl 键要吸收 431 kJ 的能量
D.反应物断键时吸收的能量大于产物形成化学键时释放 的能量
12.为有效降低含氮化物的排放量,又能充分利用化学能,合作小组利用反应设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。下列说法错误的是
A.电流可以通过离子交换膜
B.电池工作一段时间后,左侧电极室溶液的碱性增强
C.电子由电极A经负载流向电极B
D.同温同压时,左右两侧电极室中产生的气体体积比为4∶3
13.一定温度下,10mL 0.8溶液发生催化分解。不同时刻测得生成的的体积(已折算为标准状况下)如表。
t/min 0 2 4 6 8 10
0.0 9.9 17.2 22.4 26.5 29.9
下列叙述正确的是(溶液体积变化忽略不计)
A.反应到6min时,
B.第4min时的瞬时速率小于第6min时的瞬时速率
C.反应至6min时,分解率为50%
D.0~6min的平均反应速率:
14. 向 200 mL稀 H2SO4与稀 HNO3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积
(标准状况)之间的关系如图所示, 且每一段只对应一个反应。下列说法正确的是( )
A .原混合溶液中 c(H2SO4) =1mol/ L
B .m2 =11.2
C . 产生 H2的体积为 2.24 L
D . C点溶液中溶质有 2 种
第II卷(非选择题 共58分)
非选择题:本题共4个大题,共58分。
15.(12分)A 、B 、C、D、E 、F、G 为六种短周期元素, 且原子序数依次增大。 A 与 B、C 、D 均能 形成 10 电子化合物, C 的气态氢化物能使紫色石蕊溶液变蓝, A 、D 能形成两种液态化合物 A2D 和 A2D2 ,F 元素的周期序数与主族序数相等,A 、G 和 C 、E 的原子序数之和相等。
(1)D 与 E 组成的某种化合物呈淡黄色, 写出其电子式 ,所含的化学键类型为 。
(2)D 、E 、F 、G 简单离子半径由大到小的顺序为 。 (用离子符号表示)
(3)比较 B 和 C 最简气态氢化物稳定性强弱 > 。(用化学式表示)
(4)在一定条件下, E 元素的单质能与 A 元素的单质化合生成 EA ,EA 能与水反应放氢气, 则其化学 方程式为 ,若将 1molEA 和 2molF 单质混合加入足量的水, 充分 反应后生成气体的体积是 L(标准状况下)。
(5)CD2 是常见的大气污染物, 工业生产中可用 C的气态氢化物通过催化还原消除其污染,写出相关 化学方程式 。
16.(18分)是硫元素中一种重要物质。在生产生活中有容重要用途。
(1)某研究小组用如图装置进行与溶液反应的相关实验(夹持装置已略去)
①B装置的作用为: ;通入足量时C中观察到的现象为 。
②根据以上现象,该小组同学认为与溶液发生氧化还原反应。
a.写出与溶液反应的离子方程式: 。
b.该小组同学向C试管反应后的溶液中加入硝酸酸化的溶液,若出现白色沉淀,即可证明反应生成了。该做法 (填“合理”或“不合理”),理由是 。
③为了验证具有还原性,实验中可以代替溶液的试剂有 (填字母)。
A.浓硫酸 B.酸性溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究的性质:(熔点:为,为16.8℃,沸点:为,为45℃)
①装置I模拟工业生产中催化氧化的反应,其化学方程式是 。
②甲同学按I、Ⅱ、Ⅲ、IV的顺序连接装置,Ⅱ中的实验现象为 装置Ⅲ中反应的离子方程式是(忽略的影响) 。
③乙同学按I、Ⅱ、IV顺序连接装置,若装置IV中有溶液,反应后增重4.8g,则装置IV中发生反应的化学方程式是 。
17.(12分)减少氮的氧化物在大气中的排放是环境保护的重要内容。合理应用和处理氮及其化合物, 在生产生活中有重要意义。
Ⅰ. 雾霾严重影响人们的生活,雾霾的形成与汽车排放的 NOx等有毒气体有关。
(1)通过活性炭对汽车尾气进行处理,相关原理为 C(s)+2NO(g) N2(g)+CO2(g) 。下列情况能说明该 反应达到平衡状态的是 。
A .2v 正(NO) = v 逆(CO2)
B. 混合气体中 N2 的体积分数保持不变
C .单位时间内断裂 1个 N≡N 同时生成 1个 C =O
D .恒温、恒容条件下,混合气体的密度保持不变
E .恒温、恒压条件下, 混合气体的平均摩尔质量保持不变
(2)在催化转化器中,汽车尾气中的 CO和 NO可发生反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) ,若在容积为 10L 的密闭容器中进行该反应, 起始时充入 0.4mol CO 、0.2mol NO,反应在不同条件下进行, 反应体系总压强随时间的变化如图所示。
①实验 b从开始至平衡时的反应速率 v(CO)= ;
②实验 a中 NO的平衡转化率为 。
③与实验 b 相比,实验 c改变的条件是 。
18.(16分)实验小组研究铜与过量硝酸的反应,实验如下(加持装置和尾气处理装置略)。
装置 编号 试剂a 现象
Ⅰ 4 mL浓硝酸(过量) 铜片完全溶解,溶液变绿,出现大量红棕色气体
Ⅱ 4 mL稀硝酸(过量) 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色
(1)氮在元素周期表中的位置为__________________
(2) 实验Ⅰ、Ⅱ中的红棕色气体均是NO2。实验Ⅰ产生NO2的化学方程式是________________。
对实验Ⅰ产生NO2,实验Ⅱ产生NO的原因提出解释。
①硝酸浓度越稀,溶液中单位体积内的NO数目越少。被还原时,每个NO从铜片处获得较多电子的机会越_______(填“大”或“小”),因此越易被还原为较低价态的含氮物质。
②浓硝酸具有较强的_______性,可将NO转化为NO2。
有同学针对I中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;假设2:溶解了生成的NO2。
探究如下:取I中绿色溶液,分为两等份。
①取一份于如图所示装置中,向上拉动活塞a,________(填现象),证实I中溶解了NO2。
②向另一份溶液加入________(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
硝酸与金属反应会产生氮氧化物。
①下列环境问题与氮的氧化物排放无关的是 。
A.酸雨 B.光化学烟雾 C温室效应. D.白色污染
②在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有0.25a g HNO3被还原,则可能为 。
A.2:1 B.3:1 C.4:1 D.9:2
③ 为避免氮氧化物污染环境,人们开发了溶液吸收法。比如用碱性的Na2CO3溶液吸收NO2,请写出相关的化学反应方程式:__________________。
参考答案
1-5BBCCB 6-10 BDDDB 11-14CBDA
15 .(12分)((1) 离子键、 非极性共价键
(2) r(Cl-)> r(O2-)> r(Na+)> r(Al3+)
(3) NH3(1 分) CH4(1 分)
(4) NaH+H2O=NaOH+H2 ↑ 56
(5)
16. (18分)(1) ①作安全瓶,防倒吸;溶液由棕黄色变成浅绿色
② 不合理 可以将氧化成,干扰实验 ③BC
(2) ① ②U形管中有固体出现 ③
17.(12分)Ⅰ. (1) BDE
(2) ①2.5×10-4mol·L- 1·min- 1 ②60% ③使用催化剂
(16分)
(1) 第二周期第VA族(1分)
(2) Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(2分)
(3) ①大(1分) ② 氧化(1分) (
(4)①试管内液面上方出现红棕色气体 ②Cu2O或者Cu(OH)2
(5) ①. CD ②. BCD ③ 2NO2+Na2CO3 ===NaNO3+CO2+NaNO2
化学试卷
时间:75分钟 满分:100分 测试范围:第五、六章
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
第Ⅰ卷(选择题 共42分)
选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
化学与生产、 生活密切相关, 下列说法正确的是
A .碳酸钡可用于肠胃 X射线造影检查
B .葡萄酒中常添加一定量的 SO2用来抗氧化和杀菌
C .为增强 84 消毒液的杀菌消毒效果,可与洁厕灵混合使用
D .用于制作轴承的金刚砂属于传统的硅酸盐材料,具有优异的高温抗氧化性
2.下列有硫及化合物的说法中,正确的是
A.将足量SO2和CO2分别通入NaClO溶液中,均生成HClO
B.标准状况下,1的体积小于22.4L
C.浓硫酸与食盐共热,浓硫酸表现的性质为强酸性
D.2mol与足量O2反应,转移电子的物质的量为4 mol
3.已知 X为一种常见酸的浓溶液。A与 X反应的转化关系如图所示,其中反应条件及部分产物均已略去,
则下列有关说法正确的是( )
A .X可使蔗糖变黑, 体现了其吸水性
B .将 B通入紫色石蕊试液中,可观察到溶液先变红后褪色
C .若 A为 Al,则在常温条件下不能发生图示的转化过程
D .工业上, 2mol B 和足量 O2充分反应,可得到 2mol D
4.氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。实验室可选用下列装置和试剂制备氨气,并干燥、收集和处理尾气,下列说法正确的是
A.①和②均可用于实验室制备氨气
B.③中盛有碱石灰或无水氯化钙可用于干燥氨气
C.④可用于收集氨气,气流方向为a进b出
D.⑤中盛有稀硫酸可用于氨气的尾气处理
5. 能正确表示下列反应的离子方程式的是
A.向澄清的石灰水中通入SO2气体:+SO2=CaSO3↓
B.过量SO2气体通入氢氧化钠溶液中:SO2+OH-=HSO
C.SO2气体通入溴水中:SO2+Br2+H2O=2H++2Br-+SO
D.向氢硫酸(H2S)中通入氯气:
6.探究铜和浓硫酸的反应,下列装置或操作错误的是
A.上下移动装置甲中的铜丝体现绿色化学的思想
B.装置乙可用于收集SO2气体
C.将试管中的液体倒入装置丙中稀释,观察颜色可确定CuSO4的生成
D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4 5H2O
7 .氯、硫元素的价类二维图如图所示。下列说法正确的是
A.i与j能发生氧化还原反应
B.d、h的水溶液在空气中久置,溶液酸性均减弱
C.Fe分别与b、g反应,产物中铁元素的化合价相同
D.反应的离子方程式为
8.Y形管是一种特殊的仪器,与其他仪器组合可以进行某些探究实验。利用如图所示装置可以探究SO2与BaCl2溶液反应生成沉淀的条件。下列判断正确的是
A.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
C.Y形管乙中产生的氧化性气体将BaSO3氧化为BaSO4
D.e、f两管中的试剂可以分别是KMnO4和浓盐酸
9.下列关于化学反应速率的说法正确的是( )
A .生铁与稀盐酸的反应速率一般小于纯铁与稀盐酸的反应速率
B .对于任何化学反应来说,反应速率越大,反应现象就越明显
C .在恒压密闭容器中发生如下反应: N2+3H2 2NH3 ,充入 Ar,反应速率不变
D .100mL 2mol/L的盐酸与锌片反应,加入适量的氯化钠溶液,反应速率变慢
10.下列由实验现象得到的结论中错误的是
A.将两片打磨过的铝片分别放入3mL 20%的盐酸和氢氧化钠溶液中,均有气泡产生,能说明铝片既可与酸反应又可与某些碱反应
B.分别取3%、6%的双氧水2~3mL于两支试管中,再分别向两支试管中各加入少量等量的粉末,6%的双氧水产生气泡的速率明显快于3%的双氧水,能说明催化剂对浓溶液的作用更有效
C.将铁丝插入装有硫酸铜溶液的试管中,一段时间后取出,可以看到铁丝表面有红色附着物,能说明铁比铜更活泼
D.取15%的双氧水2~3mL于试管中,只有少量气泡产生,如果将试管置于75℃的热水中,气泡会明显增多,能说明温度升高反应会加快
11.化学反应常常伴随能量的变化,以下是 H2 与 Cl2 反应的能量变化示意图,下列说法正确的
A.氯化氢分子的电子式:
B.该反应既是氧化还原反应又是放热反应
C.形成 1 mol H—Cl 键要吸收 431 kJ 的能量
D.反应物断键时吸收的能量大于产物形成化学键时释放 的能量
12.为有效降低含氮化物的排放量,又能充分利用化学能,合作小组利用反应设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。下列说法错误的是
A.电流可以通过离子交换膜
B.电池工作一段时间后,左侧电极室溶液的碱性增强
C.电子由电极A经负载流向电极B
D.同温同压时,左右两侧电极室中产生的气体体积比为4∶3
13.一定温度下,10mL 0.8溶液发生催化分解。不同时刻测得生成的的体积(已折算为标准状况下)如表。
t/min 0 2 4 6 8 10
0.0 9.9 17.2 22.4 26.5 29.9
下列叙述正确的是(溶液体积变化忽略不计)
A.反应到6min时,
B.第4min时的瞬时速率小于第6min时的瞬时速率
C.反应至6min时,分解率为50%
D.0~6min的平均反应速率:
14. 向 200 mL稀 H2SO4与稀 HNO3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积
(标准状况)之间的关系如图所示, 且每一段只对应一个反应。下列说法正确的是( )
A .原混合溶液中 c(H2SO4) =1mol/ L
B .m2 =11.2
C . 产生 H2的体积为 2.24 L
D . C点溶液中溶质有 2 种
第II卷(非选择题 共58分)
非选择题:本题共4个大题,共58分。
15.(12分)A 、B 、C、D、E 、F、G 为六种短周期元素, 且原子序数依次增大。 A 与 B、C 、D 均能 形成 10 电子化合物, C 的气态氢化物能使紫色石蕊溶液变蓝, A 、D 能形成两种液态化合物 A2D 和 A2D2 ,F 元素的周期序数与主族序数相等,A 、G 和 C 、E 的原子序数之和相等。
(1)D 与 E 组成的某种化合物呈淡黄色, 写出其电子式 ,所含的化学键类型为 。
(2)D 、E 、F 、G 简单离子半径由大到小的顺序为 。 (用离子符号表示)
(3)比较 B 和 C 最简气态氢化物稳定性强弱 > 。(用化学式表示)
(4)在一定条件下, E 元素的单质能与 A 元素的单质化合生成 EA ,EA 能与水反应放氢气, 则其化学 方程式为 ,若将 1molEA 和 2molF 单质混合加入足量的水, 充分 反应后生成气体的体积是 L(标准状况下)。
(5)CD2 是常见的大气污染物, 工业生产中可用 C的气态氢化物通过催化还原消除其污染,写出相关 化学方程式 。
16.(18分)是硫元素中一种重要物质。在生产生活中有容重要用途。
(1)某研究小组用如图装置进行与溶液反应的相关实验(夹持装置已略去)
①B装置的作用为: ;通入足量时C中观察到的现象为 。
②根据以上现象,该小组同学认为与溶液发生氧化还原反应。
a.写出与溶液反应的离子方程式: 。
b.该小组同学向C试管反应后的溶液中加入硝酸酸化的溶液,若出现白色沉淀,即可证明反应生成了。该做法 (填“合理”或“不合理”),理由是 。
③为了验证具有还原性,实验中可以代替溶液的试剂有 (填字母)。
A.浓硫酸 B.酸性溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究的性质:(熔点:为,为16.8℃,沸点:为,为45℃)
①装置I模拟工业生产中催化氧化的反应,其化学方程式是 。
②甲同学按I、Ⅱ、Ⅲ、IV的顺序连接装置,Ⅱ中的实验现象为 装置Ⅲ中反应的离子方程式是(忽略的影响) 。
③乙同学按I、Ⅱ、IV顺序连接装置,若装置IV中有溶液,反应后增重4.8g,则装置IV中发生反应的化学方程式是 。
17.(12分)减少氮的氧化物在大气中的排放是环境保护的重要内容。合理应用和处理氮及其化合物, 在生产生活中有重要意义。
Ⅰ. 雾霾严重影响人们的生活,雾霾的形成与汽车排放的 NOx等有毒气体有关。
(1)通过活性炭对汽车尾气进行处理,相关原理为 C(s)+2NO(g) N2(g)+CO2(g) 。下列情况能说明该 反应达到平衡状态的是 。
A .2v 正(NO) = v 逆(CO2)
B. 混合气体中 N2 的体积分数保持不变
C .单位时间内断裂 1个 N≡N 同时生成 1个 C =O
D .恒温、恒容条件下,混合气体的密度保持不变
E .恒温、恒压条件下, 混合气体的平均摩尔质量保持不变
(2)在催化转化器中,汽车尾气中的 CO和 NO可发生反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) ,若在容积为 10L 的密闭容器中进行该反应, 起始时充入 0.4mol CO 、0.2mol NO,反应在不同条件下进行, 反应体系总压强随时间的变化如图所示。
①实验 b从开始至平衡时的反应速率 v(CO)= ;
②实验 a中 NO的平衡转化率为 。
③与实验 b 相比,实验 c改变的条件是 。
18.(16分)实验小组研究铜与过量硝酸的反应,实验如下(加持装置和尾气处理装置略)。
装置 编号 试剂a 现象
Ⅰ 4 mL浓硝酸(过量) 铜片完全溶解,溶液变绿,出现大量红棕色气体
Ⅱ 4 mL稀硝酸(过量) 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色
(1)氮在元素周期表中的位置为__________________
(2) 实验Ⅰ、Ⅱ中的红棕色气体均是NO2。实验Ⅰ产生NO2的化学方程式是________________。
对实验Ⅰ产生NO2,实验Ⅱ产生NO的原因提出解释。
①硝酸浓度越稀,溶液中单位体积内的NO数目越少。被还原时,每个NO从铜片处获得较多电子的机会越_______(填“大”或“小”),因此越易被还原为较低价态的含氮物质。
②浓硝酸具有较强的_______性,可将NO转化为NO2。
有同学针对I中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;假设2:溶解了生成的NO2。
探究如下:取I中绿色溶液,分为两等份。
①取一份于如图所示装置中,向上拉动活塞a,________(填现象),证实I中溶解了NO2。
②向另一份溶液加入________(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
硝酸与金属反应会产生氮氧化物。
①下列环境问题与氮的氧化物排放无关的是 。
A.酸雨 B.光化学烟雾 C温室效应. D.白色污染
②在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有0.25a g HNO3被还原,则可能为 。
A.2:1 B.3:1 C.4:1 D.9:2
③ 为避免氮氧化物污染环境,人们开发了溶液吸收法。比如用碱性的Na2CO3溶液吸收NO2,请写出相关的化学反应方程式:__________________。
参考答案
1-5BBCCB 6-10 BDDDB 11-14CBDA
15 .(12分)((1) 离子键、 非极性共价键
(2) r(Cl-)> r(O2-)> r(Na+)> r(Al3+)
(3) NH3(1 分) CH4(1 分)
(4) NaH+H2O=NaOH+H2 ↑ 56
(5)
16. (18分)(1) ①作安全瓶,防倒吸;溶液由棕黄色变成浅绿色
② 不合理 可以将氧化成,干扰实验 ③BC
(2) ① ②U形管中有固体出现 ③
17.(12分)Ⅰ. (1) BDE
(2) ①2.5×10-4mol·L- 1·min- 1 ②60% ③使用催化剂
(16分)
(1) 第二周期第VA族(1分)
(2) Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(2分)
(3) ①大(1分) ② 氧化(1分) (
(4)①试管内液面上方出现红棕色气体 ②Cu2O或者Cu(OH)2
(5) ①. CD ②. BCD ③ 2NO2+Na2CO3 ===NaNO3+CO2+NaNO2
同课章节目录
