【中考满分练】2024中考化学二轮复习 第7讲 盐 化学肥料 梯级训练(含答案)
文档属性
| 名称 | 【中考满分练】2024中考化学二轮复习 第7讲 盐 化学肥料 梯级训练(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 500.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-18 23:08:31 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024中化学复习
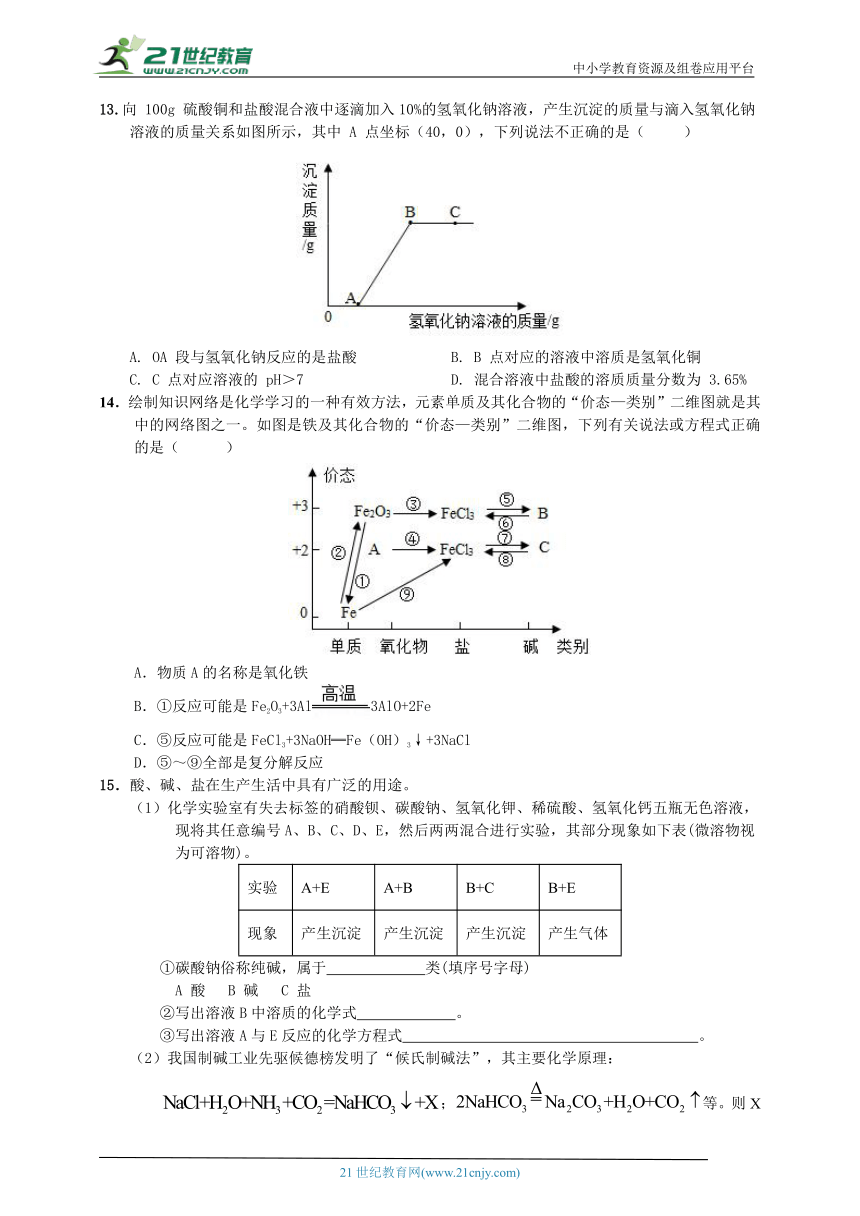
第7讲 盐 化学肥料 梯级训练
1.实验室中的药品要求分类存放。某实验室1号柜存放的是单质,2号柜存放的是酸,3号柜存放的是碱,4号柜存放的是盐。纯碱应存放的实验柜是( )
A.1号柜 B.2号柜 C.3号柜 D.4号柜
2.荔枝生长过程中,需要施肥为果树补充营养。下列属于复合肥的是( )
A. NH4H2PO4 B. CO(NH2)2 C. NH4NO3 D. KCl
3.工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
4.下列对物质用途的描述错误的是( )
A.用生石灰作发热剂 B.干冰用于人工降雨
C.用氢氧化钠治疗胃酸过多 D.碳酸氢钠用于焙制糕点
5.在粗盐初步提纯实验中,下列有关装置和操作正确的是( )
A. 溶解粗盐 B. 过滤粗盐水
C. 蒸发结晶 D. 趁热取下蒸发皿
6.某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。小洁同学将该融雪剂加水溶解,得到无色溶液,向该溶液中加入K2CO3溶液,有白色沉淀生成。由此可知,该融雪剂的组成可能是( )
A.CuSO4 NaCl B.Na2CO3 NaCl C.CaCl2 NaCl D.CuSO4 CaCl2
7.物质X和Ba(OH)2在溶液中反应的化学方程式为:,下列说法正确的是( )
A.X可能为氯化铁 B.X只能为硫酸
C.Y可以为氢氧化铜 D.Y不一定是水
8.下列试剂分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,会出现三种不同现象的是
( )
A.Na2CO3溶液 B.MgCl2 溶液
C.Ba(OH)2溶液 D .酚酞溶液
9.下列有关鉴别和除杂的方法错误的是( )
实验目的 实验方法
A 鉴别Na2SO4固体和BaSO4固体 加足量的水观察
B 鉴别木炭粉和二氧化锰粉末 加入过氧化氢溶液,观察现象
C 除去FeSO4溶液中的CuSO4 加入过量铁粉,过滤
D 除去NaCl溶液中的CaCl2 加入过量的Na2CO3溶液,过滤
A.A B.B C.C D.D
10.如图为Fe元素的化合价和物质类别的二维图。下列说法正确的是( )
A.物质C的化学式为Fe(OH)3 B.物质E的化学式为FeSO4
C.物质A在氧气中燃烧生成物质B D.物质A与稀硫酸反应生成物质D
11.某无色水溶液中可能含有以下离子中的几种:H+、Mg2+、Cu2+、C1-、、,为确定其成分,小芳进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生,过滤;
③取②的部分滤液加入BaC12溶液,有白色沉淀产生。
分析上述实验,下列收对溶液中含有离子的判断正确的是( )
A. 一定含有H+、Mg2+,可能含有 B. 一定含有H+、Mg2+,,可能含有C1-
C. 一定含有H+、Mg2+,可能含有Cu2+ D. 一定含有H+、Mg2+、、可能含有Cu2+、C1-
12.某无色混合溶液中大量存在四种离子,其个数比为A13+:::M=1:1:3:2,则M为( )
A. Cu2+ B. Na+ C. C1- D. Mg2+
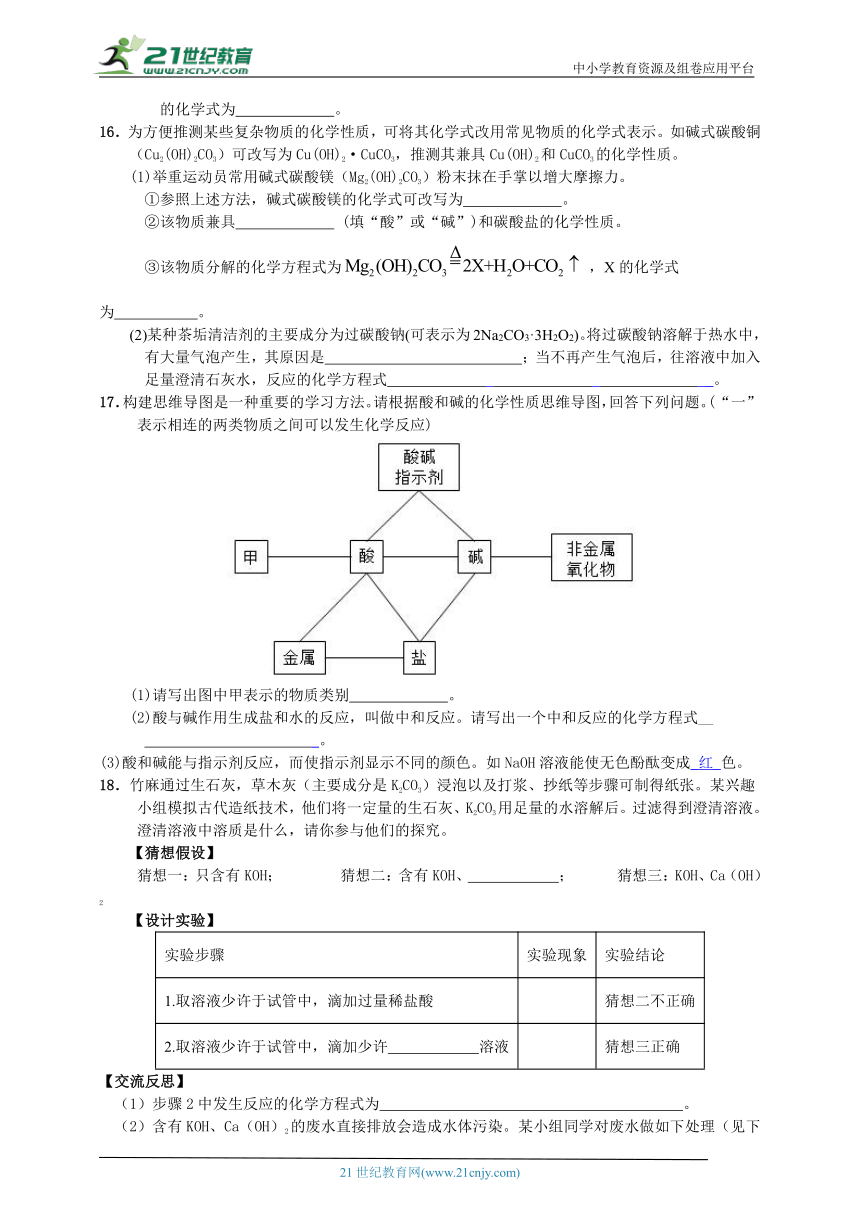
13.向 100g 硫酸铜和盐酸混合液中逐滴加入10%的氢氧化钠溶液,产生沉淀的质量与滴入氢氧化钠溶液的质量关系如图所示,其中 A 点坐标(40,0),下列说法不正确的是( )
A. OA 段与氢氧化钠反应的是盐酸 B. B 点对应的溶液中溶质是氢氧化铜
C. C 点对应溶液的 pH>7 D. 混合溶液中盐酸的溶质质量分数为 3.65%
14.绘制知识网络是化学学习的一种有效方法,元素单质及其化合物的“价态—类别”二维图就是其中的网络图之一。如图是铁及其化合物的“价态—类别”二维图,下列有关说法或方程式正确的是( )
A.物质A的名称是氧化铁
B.①反应可能是Fe2O3+3Al3AlO+2Fe
C.⑤反应可能是FeCl3+3NaOH═Fe(OH)3↓+3NaCl
D.⑤~⑨全部是复分解反应
15.酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的硝酸钡、碳酸钠、氢氧化钾、稀硫酸、氢氧化钙五瓶无色溶液,现将其任意编号A、B、C、D、E,然后两两混合进行实验,其部分现象如下表(微溶物视为可溶物)。
实验 A+E A+B B+C B+E
现象 产生沉淀 产生沉淀 产生沉淀 产生气体
①碳酸钠俗称纯碱,属于 类(填序号字母)
A 酸 B 碱 C 盐
②写出溶液B中溶质的化学式 。
③写出溶液A与E反应的化学方程式 。
(2)我国制碱工业先驱候德榜发明了“候氏制碱法”,其主要化学原理:;等。则X的化学式为 。
16.为方便推测某些复杂物质的化学性质,可将其化学式改用常见物质的化学式表示。如碱式碳酸铜(Cu2(OH)2CO3)可改写为Cu(OH)2·CuCO3,推测其兼具Cu(OH)2和CuCO3的化学性质。
(1)举重运动员常用碱式碳酸镁(Mg2(OH)2CO3)粉末抹在手掌以增大摩擦力。
①参照上述方法,碱式碳酸镁的化学式可改写为 。
②该物质兼具 (填“酸”或“碱”)和碳酸盐的化学性质。
③该物质分解的化学方程式为 ,X的化学式为 。
(2)某种茶垢清洁剂的主要成分为过碳酸钠(可表示为2Na2CO3·3H2O2)。将过碳酸钠溶解于热水中,有大量气泡产生,其原因是 ;当不再产生气泡后,往溶液中加入足量澄清石灰水,反应的化学方程式 _。
17.构建思维导图是一种重要的学习方法。请根据酸和碱的化学性质思维导图,回答下列问题。(“一”表示相连的两类物质之间可以发生化学反应)
(1)请写出图中甲表示的物质类别 。
(2)酸与碱作用生成盐和水的反应,叫做中和反应。请写出一个中和反应的化学方程式__
_。
(3)酸和碱能与指示剂反应,而使指示剂显示不同的颜色。如NaOH溶液能使无色酚酞变成_红_色。
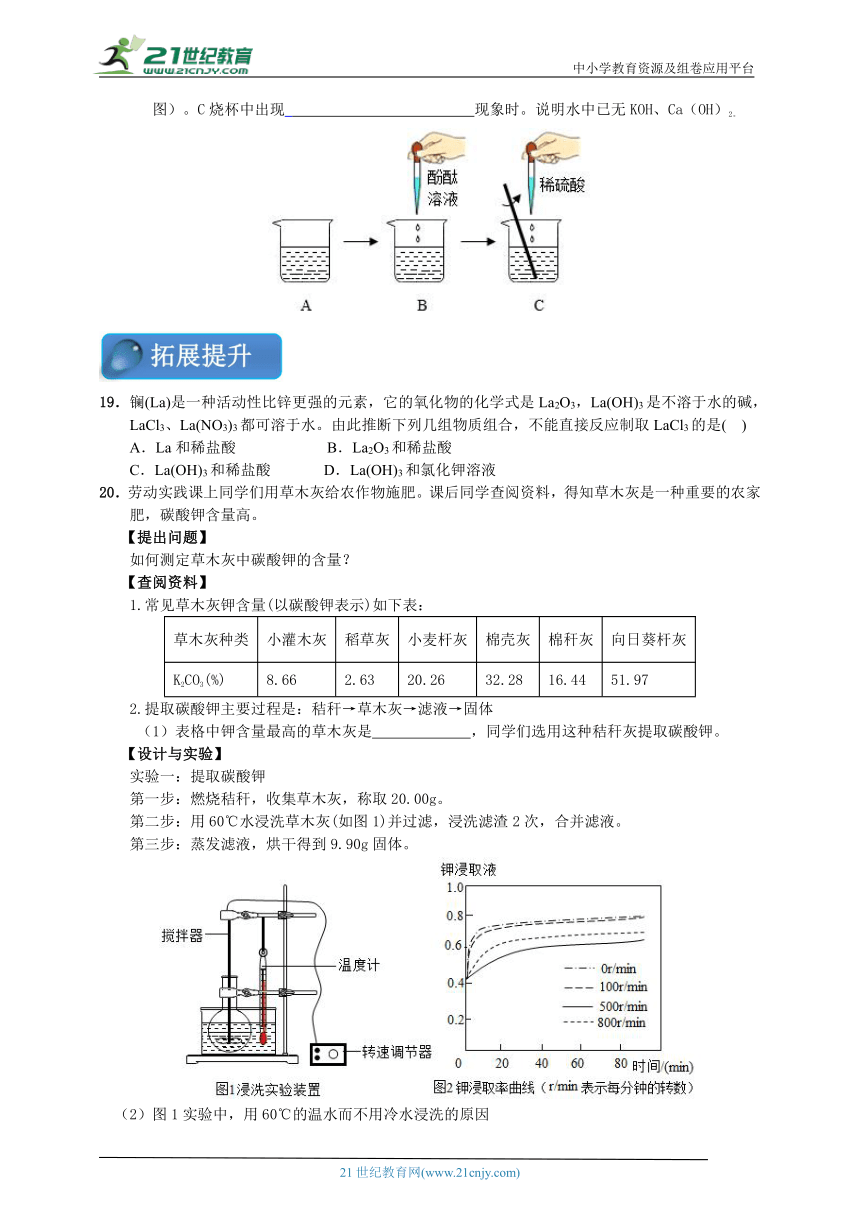
18.竹麻通过生石灰,草木灰(主要成分是K2CO3)浸泡以及打浆、抄纸等步骤可制得纸张。某兴趣小组模拟古代造纸技术,他们将一定量的生石灰、K2CO3用足量的水溶解后。过滤得到澄清溶液。澄清溶液中溶质是什么,请你参与他们的探究。
【猜想假设】
猜想一:只含有KOH; 猜想二:含有KOH、 ; 猜想三:KOH、Ca(OH)2
【设计实验】
实验步骤 实验现象 实验结论
1.取溶液少许于试管中,滴加过量稀盐酸 猜想二不正确
2.取溶液少许于试管中,滴加少许 溶液 猜想三正确
【交流反思】
(1)步骤2中发生反应的化学方程式为 。
(2)含有KOH、Ca(OH)2的废水直接排放会造成水体污染。某小组同学对废水做如下处理(见下图)。C烧杯中出现_ 现象时。说明水中已无KOH、Ca(OH)2。
19.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是( )
A.La和稀盐酸 B.La2O3和稀盐酸
C.La(OH)3和稀盐酸 D.La(OH)3和氯化钾溶液
20.劳动实践课上同学们用草木灰给农作物施肥。课后同学查阅资料,得知草木灰是一种重要的农家肥,碳酸钾含量高。
【提出问题】
如何测定草木灰中碳酸钾的含量?
【查阅资料】
1.常见草木灰钾含量(以碳酸钾表示)如下表:
草木灰种类 小灌木灰 稻草灰 小麦杆灰 棉壳灰 棉秆灰 向日葵杆灰
K2CO3(%) 8.66 2.63 20.26 32.28 16.44 51.97
2.提取碳酸钾主要过程是:秸秆→草木灰→滤液→固体
(1)表格中钾含量最高的草木灰是 ,同学们选用这种秸秆灰提取碳酸钾。
【设计与实验】
实验一:提取碳酸钾
第一步:燃烧秸秆,收集草木灰,称取20.00g。
第二步:用60℃水浸洗草木灰(如图1)并过滤,浸洗滤渣2次,合并滤液。
第三步:蒸发滤液,烘干得到9.90g固体。
(2)图1实验中,用60℃的温水而不用冷水浸洗的原因是 。
(3)根据图2,搅拌器转速控制在每分钟___500 __转,浸取时间为___20___分钟,比较适宜。
实验二:测定碳酸钾含量
取实验一中所得固体3.30g进行图3实验。
(4)实验中需缓慢滴入稀硫酸,原因是 。
(5)装置B的作用是 。
【数据与解释】
(6)称量图3中反应前后烧杯和其中溶液的总质量,增重0.92g。计算草木灰中碳酸钾的质量分数为 %,与表格中数据相比明显偏低,原因可能是 (填序号)。
a.烧杯中溶液与空气接触 b.固体含有其它钾盐 c.固体含有氯化钠
【反思与评价】
(7)我国秸秆产量巨大,可作为生物质发电的原料,还可利用其燃烧发电产生的草木灰提取碳酸钾,其优点有 (写一条)。
2024中化学复习
第7讲 盐 化学肥料 梯级训练 答案版
1.实验室中的药品要求分类存放。某实验室1号柜存放的是单质,2号柜存放的是酸,3号柜存放的是碱,4号柜存放的是盐。纯碱应存放的实验柜是( D )
A.1号柜 B.2号柜 C.3号柜 D.4号柜
2.荔枝生长过程中,需要施肥为果树补充营养。下列属于复合肥的是( A )
A. NH4H2PO4 B. CO(NH2)2 C. NH4NO3 D. KCl
3.工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( A )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
4.下列对物质用途的描述错误的是( C )
A.用生石灰作发热剂 B.干冰用于人工降雨
C.用氢氧化钠治疗胃酸过多 D.碳酸氢钠用于焙制糕点
5.在粗盐初步提纯实验中,下列有关装置和操作正确的是( B )
A. 溶解粗盐 B. 过滤粗盐水
C. 蒸发结晶 D. 趁热取下蒸发皿
6.某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。小洁同学将该融雪剂加水溶解,得到无色溶液,向该溶液中加入K2CO3溶液,有白色沉淀生成。由此可知,该融雪剂的组成可能是( C )
A.CuSO4 NaCl B.Na2CO3 NaCl C.CaCl2 NaCl D.CuSO4 CaCl2
7.物质X和Ba(OH)2在溶液中反应的化学方程式为:,下列说法正确的是( D )
A.X可能为氯化铁 B.X只能为硫酸
C.Y可以为氢氧化铜 D.Y不一定是水
8.下列试剂分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,会出现三种不同现象的是
( A )
A.Na2CO3溶液 B.MgCl2 溶液
C.Ba(OH)2溶液 D .酚酞溶液
9.下列有关鉴别和除杂的方法错误的是( D )
实验目的 实验方法
A 鉴别Na2SO4固体和BaSO4固体 加足量的水观察
B 鉴别木炭粉和二氧化锰粉末 加入过氧化氢溶液,观察现象
C 除去FeSO4溶液中的CuSO4 加入过量铁粉,过滤
D 除去NaCl溶液中的CaCl2 加入过量的Na2CO3溶液,过滤
A.A B.B C.C D.D
10.如图为Fe元素的化合价和物质类别的二维图。下列说法正确的是( B )
A.物质C的化学式为Fe(OH)3 B.物质E的化学式为FeSO4
C.物质A在氧气中燃烧生成物质B D.物质A与稀硫酸反应生成物质D
11.某无色水溶液中可能含有以下离子中的几种:H+、Mg2+、Cu2+、C1-、、,为确定其成分,小芳进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生,过滤;
③取②的部分滤液加入BaC12溶液,有白色沉淀产生。
分析上述实验,下列收对溶液中含有离子的判断正确的是( B )
A. 一定含有H+、Mg2+,可能含有 B. 一定含有H+、Mg2+,,可能含有C1-
C. 一定含有H+、Mg2+,可能含有Cu2+ D. 一定含有H+、Mg2+、、可能含有Cu2+、C1-
12.某无色混合溶液中大量存在四种离子,其个数比为A13+:::M=1:1:3:2,则M为( D )
A. Cu2+ B. Na+ C. C1- D. Mg2+
13.向 100g 硫酸铜和盐酸混合液中逐滴加入10%的氢氧化钠溶液,产生沉淀的质量与滴入氢氧化钠溶液的质量关系如图所示,其中 A 点坐标(40,0),下列说法不正确的是( B )
A. OA 段与氢氧化钠反应的是盐酸 B. B 点对应的溶液中溶质是氢氧化铜
C. C 点对应溶液的 pH>7 D. 混合溶液中盐酸的溶质质量分数为 3.65%
14.绘制知识网络是化学学习的一种有效方法,元素单质及其化合物的“价态—类别”二维图就是其中的网络图之一。如图是铁及其化合物的“价态—类别”二维图,下列有关说法或方程式正确的是( C )
A.物质A的名称是氧化铁
B.①反应可能是Fe2O3+3Al3AlO+2Fe
C.⑤反应可能是FeCl3+3NaOH═Fe(OH)3↓+3NaCl
D.⑤~⑨全部是复分解反应
15.酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的硝酸钡、碳酸钠、氢氧化钾、稀硫酸、氢氧化钙五瓶无色溶液,现将其任意编号A、B、C、D、E,然后两两混合进行实验,其部分现象如下表(微溶物视为可溶物)。
实验 A+E A+B B+C B+E
现象 产生沉淀 产生沉淀 产生沉淀 产生气体
①碳酸钠俗称纯碱,属于____ C ___类(填序号字母)
A 酸 B 碱 C 盐
②写出溶液B中溶质的化学式___ Na2CO3___。
③写出溶液A与E反应的化学方程式_______。
(2)我国制碱工业先驱候德榜发明了“候氏制碱法”,其主要化学原理:;等。则X的化学式为___ NH4C1_。
16.为方便推测某些复杂物质的化学性质,可将其化学式改用常见物质的化学式表示。如碱式碳酸铜(Cu2(OH)2CO3)可改写为Cu(OH)2·CuCO3,推测其兼具Cu(OH)2和CuCO3的化学性质。
(1)举重运动员常用碱式碳酸镁(Mg2(OH)2CO3)粉末抹在手掌以增大摩擦力。
①参照上述方法,碱式碳酸镁的化学式可改写为_____ Mg(OH)2·MgCO3_____。
②该物质兼具______碱____(填“酸”或“碱”)和碳酸盐的化学性质。
③该物质分解的化学方程式为 ,X的化学式为__ MgO ___。
(2)某种茶垢清洁剂的主要成分为过碳酸钠(可表示为2Na2CO3·3H2O2)。将过碳酸钠溶解于热水中,有大量气泡产生,其原因是___过氧化氢受热分解生成水和氧气_____;当不再产生气泡后,往溶液中加入足量澄清石灰水,反应的化学方程式为______。
17.构建思维导图是一种重要的学习方法。请根据酸和碱的化学性质思维导图,回答下列问题。(“一”表示相连的两类物质之间可以发生化学反应)
(1)请写出图中甲表示的物质类别___金属氧化物____。
(2)酸与碱作用生成盐和水的反应,叫做中和反应。请写出一个中和反应的化学方程式____。
(3)酸和碱能与指示剂反应,而使指示剂显示不同的颜色。如NaOH溶液能使无色酚酞变成_红_色。
18.竹麻通过生石灰,草木灰(主要成分是K2CO3)浸泡以及打浆、抄纸等步骤可制得纸张。某兴趣小组模拟古代造纸技术,他们将一定量的生石灰、K2CO3用足量的水溶解后。过滤得到澄清溶液。澄清溶液中溶质是什么,请你参与他们的探究。
【猜想假设】
猜想一:只含有KOH; 猜想二:含有KOH、___ K2CO3___; 猜想三:KOH、Ca(OH)2
【设计实验】
实验步骤 实验现象 实验结论
1.取溶液少许于试管中,滴加过量稀盐酸 ___无明显现象___ 猜想二不正确
2.取溶液少许于试管中,滴加少许_ ____ K2CO3____溶液 __产生白色沉淀____ 猜想三正确
【交流反思】
(1)步骤2中发生反应的化学方程式为______。
(2)含有KOH、Ca(OH)2的废水直接排放会造成水体污染。某小组同学对废水做如下处理(见下图)。C烧杯中出现____溶液由红色变为无色__现象时。说明水中已无KOH、Ca(OH)2。
19.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是(D)
A.La和稀盐酸 B.La2O3和稀盐酸
C.La(OH)3和稀盐酸 D.La(OH)3和氯化钾溶液
20.劳动实践课上同学们用草木灰给农作物施肥。课后同学查阅资料,得知草木灰是一种重要的农家肥,碳酸钾含量高。
【提出问题】
如何测定草木灰中碳酸钾的含量?
【查阅资料】
1.常见草木灰钾含量(以碳酸钾表示)如下表:
草木灰种类 小灌木灰 稻草灰 小麦杆灰 棉壳灰 棉秆灰 向日葵杆灰
K2CO3(%) 8.66 2.63 20.26 32.28 16.44 51.97
2.提取碳酸钾主要过程是:秸秆→草木灰→滤液→固体
(1)表格中钾含量最高的草木灰是___向日葵杆灰___,同学们选用这种秸秆灰提取碳酸钾。
【设计与实验】
实验一:提取碳酸钾
第一步:燃烧秸秆,收集草木灰,称取20.00g。
第二步:用60℃水浸洗草木灰(如图1)并过滤,浸洗滤渣2次,合并滤液。
第三步:蒸发滤液,烘干得到9.90g固体。
(2)图1实验中,用60℃的温水而不用冷水浸洗的原因是__相同时间内,水温高碳酸钾溶解得更快更多,提高溶解效率___。
(3)根据图2,搅拌器转速控制在每分钟___500 __转,浸取时间为___20___分钟,比较适宜。
实验二:测定碳酸钾含量
取实验一中所得固体3.30g进行图3实验。
(4)实验中需缓慢滴入稀硫酸,原因是___有利于二氧化碳被氢氧化钠溶液充分吸收___。
(5)装置B的作用是___吸收气体中的水蒸气 ___。
【数据与解释】
(6)称量图3中反应前后烧杯和其中溶液的总质量,增重0.92g。计算草木灰中碳酸钾的质量分数为___43.28 __%,与表格中数据相比明显偏低,原因可能是__ bc ___(填序号)。
a.烧杯中溶液与空气接触 b.固体含有其它钾盐 c.固体含有氯化钠
【反思与评价】
(7)我国秸秆产量巨大,可作为生物质发电的原料,还可利用其燃烧发电产生的草木灰提取碳酸钾,其优点有_资源综合利用__(写一条)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024中化学复习
第7讲 盐 化学肥料 梯级训练
1.实验室中的药品要求分类存放。某实验室1号柜存放的是单质,2号柜存放的是酸,3号柜存放的是碱,4号柜存放的是盐。纯碱应存放的实验柜是( )
A.1号柜 B.2号柜 C.3号柜 D.4号柜
2.荔枝生长过程中,需要施肥为果树补充营养。下列属于复合肥的是( )
A. NH4H2PO4 B. CO(NH2)2 C. NH4NO3 D. KCl
3.工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
4.下列对物质用途的描述错误的是( )
A.用生石灰作发热剂 B.干冰用于人工降雨
C.用氢氧化钠治疗胃酸过多 D.碳酸氢钠用于焙制糕点
5.在粗盐初步提纯实验中,下列有关装置和操作正确的是( )
A. 溶解粗盐 B. 过滤粗盐水
C. 蒸发结晶 D. 趁热取下蒸发皿
6.某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。小洁同学将该融雪剂加水溶解,得到无色溶液,向该溶液中加入K2CO3溶液,有白色沉淀生成。由此可知,该融雪剂的组成可能是( )
A.CuSO4 NaCl B.Na2CO3 NaCl C.CaCl2 NaCl D.CuSO4 CaCl2
7.物质X和Ba(OH)2在溶液中反应的化学方程式为:,下列说法正确的是( )
A.X可能为氯化铁 B.X只能为硫酸
C.Y可以为氢氧化铜 D.Y不一定是水
8.下列试剂分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,会出现三种不同现象的是
( )
A.Na2CO3溶液 B.MgCl2 溶液
C.Ba(OH)2溶液 D .酚酞溶液
9.下列有关鉴别和除杂的方法错误的是( )
实验目的 实验方法
A 鉴别Na2SO4固体和BaSO4固体 加足量的水观察
B 鉴别木炭粉和二氧化锰粉末 加入过氧化氢溶液,观察现象
C 除去FeSO4溶液中的CuSO4 加入过量铁粉,过滤
D 除去NaCl溶液中的CaCl2 加入过量的Na2CO3溶液,过滤
A.A B.B C.C D.D
10.如图为Fe元素的化合价和物质类别的二维图。下列说法正确的是( )
A.物质C的化学式为Fe(OH)3 B.物质E的化学式为FeSO4
C.物质A在氧气中燃烧生成物质B D.物质A与稀硫酸反应生成物质D
11.某无色水溶液中可能含有以下离子中的几种:H+、Mg2+、Cu2+、C1-、、,为确定其成分,小芳进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生,过滤;
③取②的部分滤液加入BaC12溶液,有白色沉淀产生。
分析上述实验,下列收对溶液中含有离子的判断正确的是( )
A. 一定含有H+、Mg2+,可能含有 B. 一定含有H+、Mg2+,,可能含有C1-
C. 一定含有H+、Mg2+,可能含有Cu2+ D. 一定含有H+、Mg2+、、可能含有Cu2+、C1-
12.某无色混合溶液中大量存在四种离子,其个数比为A13+:::M=1:1:3:2,则M为( )
A. Cu2+ B. Na+ C. C1- D. Mg2+
13.向 100g 硫酸铜和盐酸混合液中逐滴加入10%的氢氧化钠溶液,产生沉淀的质量与滴入氢氧化钠溶液的质量关系如图所示,其中 A 点坐标(40,0),下列说法不正确的是( )
A. OA 段与氢氧化钠反应的是盐酸 B. B 点对应的溶液中溶质是氢氧化铜
C. C 点对应溶液的 pH>7 D. 混合溶液中盐酸的溶质质量分数为 3.65%
14.绘制知识网络是化学学习的一种有效方法,元素单质及其化合物的“价态—类别”二维图就是其中的网络图之一。如图是铁及其化合物的“价态—类别”二维图,下列有关说法或方程式正确的是( )
A.物质A的名称是氧化铁
B.①反应可能是Fe2O3+3Al3AlO+2Fe
C.⑤反应可能是FeCl3+3NaOH═Fe(OH)3↓+3NaCl
D.⑤~⑨全部是复分解反应
15.酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的硝酸钡、碳酸钠、氢氧化钾、稀硫酸、氢氧化钙五瓶无色溶液,现将其任意编号A、B、C、D、E,然后两两混合进行实验,其部分现象如下表(微溶物视为可溶物)。
实验 A+E A+B B+C B+E
现象 产生沉淀 产生沉淀 产生沉淀 产生气体
①碳酸钠俗称纯碱,属于 类(填序号字母)
A 酸 B 碱 C 盐
②写出溶液B中溶质的化学式 。
③写出溶液A与E反应的化学方程式 。
(2)我国制碱工业先驱候德榜发明了“候氏制碱法”,其主要化学原理:;等。则X的化学式为 。
16.为方便推测某些复杂物质的化学性质,可将其化学式改用常见物质的化学式表示。如碱式碳酸铜(Cu2(OH)2CO3)可改写为Cu(OH)2·CuCO3,推测其兼具Cu(OH)2和CuCO3的化学性质。
(1)举重运动员常用碱式碳酸镁(Mg2(OH)2CO3)粉末抹在手掌以增大摩擦力。
①参照上述方法,碱式碳酸镁的化学式可改写为 。
②该物质兼具 (填“酸”或“碱”)和碳酸盐的化学性质。
③该物质分解的化学方程式为 ,X的化学式为 。
(2)某种茶垢清洁剂的主要成分为过碳酸钠(可表示为2Na2CO3·3H2O2)。将过碳酸钠溶解于热水中,有大量气泡产生,其原因是 ;当不再产生气泡后,往溶液中加入足量澄清石灰水,反应的化学方程式 _。
17.构建思维导图是一种重要的学习方法。请根据酸和碱的化学性质思维导图,回答下列问题。(“一”表示相连的两类物质之间可以发生化学反应)
(1)请写出图中甲表示的物质类别 。
(2)酸与碱作用生成盐和水的反应,叫做中和反应。请写出一个中和反应的化学方程式__
_。
(3)酸和碱能与指示剂反应,而使指示剂显示不同的颜色。如NaOH溶液能使无色酚酞变成_红_色。
18.竹麻通过生石灰,草木灰(主要成分是K2CO3)浸泡以及打浆、抄纸等步骤可制得纸张。某兴趣小组模拟古代造纸技术,他们将一定量的生石灰、K2CO3用足量的水溶解后。过滤得到澄清溶液。澄清溶液中溶质是什么,请你参与他们的探究。
【猜想假设】
猜想一:只含有KOH; 猜想二:含有KOH、 ; 猜想三:KOH、Ca(OH)2
【设计实验】
实验步骤 实验现象 实验结论
1.取溶液少许于试管中,滴加过量稀盐酸 猜想二不正确
2.取溶液少许于试管中,滴加少许 溶液 猜想三正确
【交流反思】
(1)步骤2中发生反应的化学方程式为 。
(2)含有KOH、Ca(OH)2的废水直接排放会造成水体污染。某小组同学对废水做如下处理(见下图)。C烧杯中出现_ 现象时。说明水中已无KOH、Ca(OH)2。
19.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是( )
A.La和稀盐酸 B.La2O3和稀盐酸
C.La(OH)3和稀盐酸 D.La(OH)3和氯化钾溶液
20.劳动实践课上同学们用草木灰给农作物施肥。课后同学查阅资料,得知草木灰是一种重要的农家肥,碳酸钾含量高。
【提出问题】
如何测定草木灰中碳酸钾的含量?
【查阅资料】
1.常见草木灰钾含量(以碳酸钾表示)如下表:
草木灰种类 小灌木灰 稻草灰 小麦杆灰 棉壳灰 棉秆灰 向日葵杆灰
K2CO3(%) 8.66 2.63 20.26 32.28 16.44 51.97
2.提取碳酸钾主要过程是:秸秆→草木灰→滤液→固体
(1)表格中钾含量最高的草木灰是 ,同学们选用这种秸秆灰提取碳酸钾。
【设计与实验】
实验一:提取碳酸钾
第一步:燃烧秸秆,收集草木灰,称取20.00g。
第二步:用60℃水浸洗草木灰(如图1)并过滤,浸洗滤渣2次,合并滤液。
第三步:蒸发滤液,烘干得到9.90g固体。
(2)图1实验中,用60℃的温水而不用冷水浸洗的原因是 。
(3)根据图2,搅拌器转速控制在每分钟___500 __转,浸取时间为___20___分钟,比较适宜。
实验二:测定碳酸钾含量
取实验一中所得固体3.30g进行图3实验。
(4)实验中需缓慢滴入稀硫酸,原因是 。
(5)装置B的作用是 。
【数据与解释】
(6)称量图3中反应前后烧杯和其中溶液的总质量,增重0.92g。计算草木灰中碳酸钾的质量分数为 %,与表格中数据相比明显偏低,原因可能是 (填序号)。
a.烧杯中溶液与空气接触 b.固体含有其它钾盐 c.固体含有氯化钠
【反思与评价】
(7)我国秸秆产量巨大,可作为生物质发电的原料,还可利用其燃烧发电产生的草木灰提取碳酸钾,其优点有 (写一条)。
2024中化学复习
第7讲 盐 化学肥料 梯级训练 答案版
1.实验室中的药品要求分类存放。某实验室1号柜存放的是单质,2号柜存放的是酸,3号柜存放的是碱,4号柜存放的是盐。纯碱应存放的实验柜是( D )
A.1号柜 B.2号柜 C.3号柜 D.4号柜
2.荔枝生长过程中,需要施肥为果树补充营养。下列属于复合肥的是( A )
A. NH4H2PO4 B. CO(NH2)2 C. NH4NO3 D. KCl
3.工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( A )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
4.下列对物质用途的描述错误的是( C )
A.用生石灰作发热剂 B.干冰用于人工降雨
C.用氢氧化钠治疗胃酸过多 D.碳酸氢钠用于焙制糕点
5.在粗盐初步提纯实验中,下列有关装置和操作正确的是( B )
A. 溶解粗盐 B. 过滤粗盐水
C. 蒸发结晶 D. 趁热取下蒸发皿
6.某公司生产的融雪剂由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成。小洁同学将该融雪剂加水溶解,得到无色溶液,向该溶液中加入K2CO3溶液,有白色沉淀生成。由此可知,该融雪剂的组成可能是( C )
A.CuSO4 NaCl B.Na2CO3 NaCl C.CaCl2 NaCl D.CuSO4 CaCl2
7.物质X和Ba(OH)2在溶液中反应的化学方程式为:,下列说法正确的是( D )
A.X可能为氯化铁 B.X只能为硫酸
C.Y可以为氢氧化铜 D.Y不一定是水
8.下列试剂分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,会出现三种不同现象的是
( A )
A.Na2CO3溶液 B.MgCl2 溶液
C.Ba(OH)2溶液 D .酚酞溶液
9.下列有关鉴别和除杂的方法错误的是( D )
实验目的 实验方法
A 鉴别Na2SO4固体和BaSO4固体 加足量的水观察
B 鉴别木炭粉和二氧化锰粉末 加入过氧化氢溶液,观察现象
C 除去FeSO4溶液中的CuSO4 加入过量铁粉,过滤
D 除去NaCl溶液中的CaCl2 加入过量的Na2CO3溶液,过滤
A.A B.B C.C D.D
10.如图为Fe元素的化合价和物质类别的二维图。下列说法正确的是( B )
A.物质C的化学式为Fe(OH)3 B.物质E的化学式为FeSO4
C.物质A在氧气中燃烧生成物质B D.物质A与稀硫酸反应生成物质D
11.某无色水溶液中可能含有以下离子中的几种:H+、Mg2+、Cu2+、C1-、、,为确定其成分,小芳进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液加入过量NaOH溶液,有白色沉淀产生,过滤;
③取②的部分滤液加入BaC12溶液,有白色沉淀产生。
分析上述实验,下列收对溶液中含有离子的判断正确的是( B )
A. 一定含有H+、Mg2+,可能含有 B. 一定含有H+、Mg2+,,可能含有C1-
C. 一定含有H+、Mg2+,可能含有Cu2+ D. 一定含有H+、Mg2+、、可能含有Cu2+、C1-
12.某无色混合溶液中大量存在四种离子,其个数比为A13+:::M=1:1:3:2,则M为( D )
A. Cu2+ B. Na+ C. C1- D. Mg2+
13.向 100g 硫酸铜和盐酸混合液中逐滴加入10%的氢氧化钠溶液,产生沉淀的质量与滴入氢氧化钠溶液的质量关系如图所示,其中 A 点坐标(40,0),下列说法不正确的是( B )
A. OA 段与氢氧化钠反应的是盐酸 B. B 点对应的溶液中溶质是氢氧化铜
C. C 点对应溶液的 pH>7 D. 混合溶液中盐酸的溶质质量分数为 3.65%
14.绘制知识网络是化学学习的一种有效方法,元素单质及其化合物的“价态—类别”二维图就是其中的网络图之一。如图是铁及其化合物的“价态—类别”二维图,下列有关说法或方程式正确的是( C )
A.物质A的名称是氧化铁
B.①反应可能是Fe2O3+3Al3AlO+2Fe
C.⑤反应可能是FeCl3+3NaOH═Fe(OH)3↓+3NaCl
D.⑤~⑨全部是复分解反应
15.酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的硝酸钡、碳酸钠、氢氧化钾、稀硫酸、氢氧化钙五瓶无色溶液,现将其任意编号A、B、C、D、E,然后两两混合进行实验,其部分现象如下表(微溶物视为可溶物)。
实验 A+E A+B B+C B+E
现象 产生沉淀 产生沉淀 产生沉淀 产生气体
①碳酸钠俗称纯碱,属于____ C ___类(填序号字母)
A 酸 B 碱 C 盐
②写出溶液B中溶质的化学式___ Na2CO3___。
③写出溶液A与E反应的化学方程式_______。
(2)我国制碱工业先驱候德榜发明了“候氏制碱法”,其主要化学原理:;等。则X的化学式为___ NH4C1_。
16.为方便推测某些复杂物质的化学性质,可将其化学式改用常见物质的化学式表示。如碱式碳酸铜(Cu2(OH)2CO3)可改写为Cu(OH)2·CuCO3,推测其兼具Cu(OH)2和CuCO3的化学性质。
(1)举重运动员常用碱式碳酸镁(Mg2(OH)2CO3)粉末抹在手掌以增大摩擦力。
①参照上述方法,碱式碳酸镁的化学式可改写为_____ Mg(OH)2·MgCO3_____。
②该物质兼具______碱____(填“酸”或“碱”)和碳酸盐的化学性质。
③该物质分解的化学方程式为 ,X的化学式为__ MgO ___。
(2)某种茶垢清洁剂的主要成分为过碳酸钠(可表示为2Na2CO3·3H2O2)。将过碳酸钠溶解于热水中,有大量气泡产生,其原因是___过氧化氢受热分解生成水和氧气_____;当不再产生气泡后,往溶液中加入足量澄清石灰水,反应的化学方程式为______。
17.构建思维导图是一种重要的学习方法。请根据酸和碱的化学性质思维导图,回答下列问题。(“一”表示相连的两类物质之间可以发生化学反应)
(1)请写出图中甲表示的物质类别___金属氧化物____。
(2)酸与碱作用生成盐和水的反应,叫做中和反应。请写出一个中和反应的化学方程式____。
(3)酸和碱能与指示剂反应,而使指示剂显示不同的颜色。如NaOH溶液能使无色酚酞变成_红_色。
18.竹麻通过生石灰,草木灰(主要成分是K2CO3)浸泡以及打浆、抄纸等步骤可制得纸张。某兴趣小组模拟古代造纸技术,他们将一定量的生石灰、K2CO3用足量的水溶解后。过滤得到澄清溶液。澄清溶液中溶质是什么,请你参与他们的探究。
【猜想假设】
猜想一:只含有KOH; 猜想二:含有KOH、___ K2CO3___; 猜想三:KOH、Ca(OH)2
【设计实验】
实验步骤 实验现象 实验结论
1.取溶液少许于试管中,滴加过量稀盐酸 ___无明显现象___ 猜想二不正确
2.取溶液少许于试管中,滴加少许_ ____ K2CO3____溶液 __产生白色沉淀____ 猜想三正确
【交流反思】
(1)步骤2中发生反应的化学方程式为______。
(2)含有KOH、Ca(OH)2的废水直接排放会造成水体污染。某小组同学对废水做如下处理(见下图)。C烧杯中出现____溶液由红色变为无色__现象时。说明水中已无KOH、Ca(OH)2。
19.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是(D)
A.La和稀盐酸 B.La2O3和稀盐酸
C.La(OH)3和稀盐酸 D.La(OH)3和氯化钾溶液
20.劳动实践课上同学们用草木灰给农作物施肥。课后同学查阅资料,得知草木灰是一种重要的农家肥,碳酸钾含量高。
【提出问题】
如何测定草木灰中碳酸钾的含量?
【查阅资料】
1.常见草木灰钾含量(以碳酸钾表示)如下表:
草木灰种类 小灌木灰 稻草灰 小麦杆灰 棉壳灰 棉秆灰 向日葵杆灰
K2CO3(%) 8.66 2.63 20.26 32.28 16.44 51.97
2.提取碳酸钾主要过程是:秸秆→草木灰→滤液→固体
(1)表格中钾含量最高的草木灰是___向日葵杆灰___,同学们选用这种秸秆灰提取碳酸钾。
【设计与实验】
实验一:提取碳酸钾
第一步:燃烧秸秆,收集草木灰,称取20.00g。
第二步:用60℃水浸洗草木灰(如图1)并过滤,浸洗滤渣2次,合并滤液。
第三步:蒸发滤液,烘干得到9.90g固体。
(2)图1实验中,用60℃的温水而不用冷水浸洗的原因是__相同时间内,水温高碳酸钾溶解得更快更多,提高溶解效率___。
(3)根据图2,搅拌器转速控制在每分钟___500 __转,浸取时间为___20___分钟,比较适宜。
实验二:测定碳酸钾含量
取实验一中所得固体3.30g进行图3实验。
(4)实验中需缓慢滴入稀硫酸,原因是___有利于二氧化碳被氢氧化钠溶液充分吸收___。
(5)装置B的作用是___吸收气体中的水蒸气 ___。
【数据与解释】
(6)称量图3中反应前后烧杯和其中溶液的总质量,增重0.92g。计算草木灰中碳酸钾的质量分数为___43.28 __%,与表格中数据相比明显偏低,原因可能是__ bc ___(填序号)。
a.烧杯中溶液与空气接触 b.固体含有其它钾盐 c.固体含有氯化钠
【反思与评价】
(7)我国秸秆产量巨大,可作为生物质发电的原料,还可利用其燃烧发电产生的草木灰提取碳酸钾,其优点有_资源综合利用__(写一条)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
