【中考满分练】2024中考化学二轮复习 第12讲 质量守恒定律及化学方程式 梯级训练(含答案)
文档属性
| 名称 | 【中考满分练】2024中考化学二轮复习 第12讲 质量守恒定律及化学方程式 梯级训练(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 635.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-18 23:15:49 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024中考化学复习
第12讲 质量守恒定律及化学方程式 梯级训练
1.下列化学方程式正确的是( )
A.
B.
C.
D.
2.硝酸在光照时会发生反应:,该反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3. (易错题)现有化学化学反应A+B=C,若将agA和bgB在适当条件下充分反应,分析得知剩余为
一混合物,则生成物质量( )
A.等于(a+b)g B.大于(a+b)g C.小于(a+b)g D.小于或等于(a+b)g
4.氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成
是( )
A. H2 B. Cl2
C. NaOH D. NaNO3
5.(易错题)下列实验能够直接用于验证质量守恒定律的是( )
6.北京冬奥会火种灯使用化合物X作燃料,其燃烧反应方程式为 。推断X的化学式是( )
A.C3H8 B.C3H6 C.C2H6O2 D.C3H8O3
7.过氧化钠(Na2O2)可做呼吸面具中氧气的来源,它与二氧化碳反应后的生成物为( )
A.Na2CO3和H2 B.Na2O和O2 C.NaOH和O2 D.Na2CO3和O2
8.在2A+3B===C+2D反应中,36 g A与56 g B恰好完全反应生成28 g C和一定量的
D。若C的相对分子质量为14,则C和D的相对分子质量之比为( )
A.7∶1 B.7∶8
C.7∶16 D.7∶32
9.(2019·天津)在化学反应A+2B===C+2D中,已知16 g A与64 g B恰好完全反应,生成C和D的质量比为11∶9,又知B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12
C.18 D.36
10.手机使用的锂(Li)电池是新型的高能电池,以质量轻、电容量大而受到重视。某种锂电池的总反应可表示为,下列说法正确的是( )
A.该反应属于化合反应
B.反应前后锂元素的化合价不变
C.MnO2中含有氧分子
D.LiMnO2属于氧化物
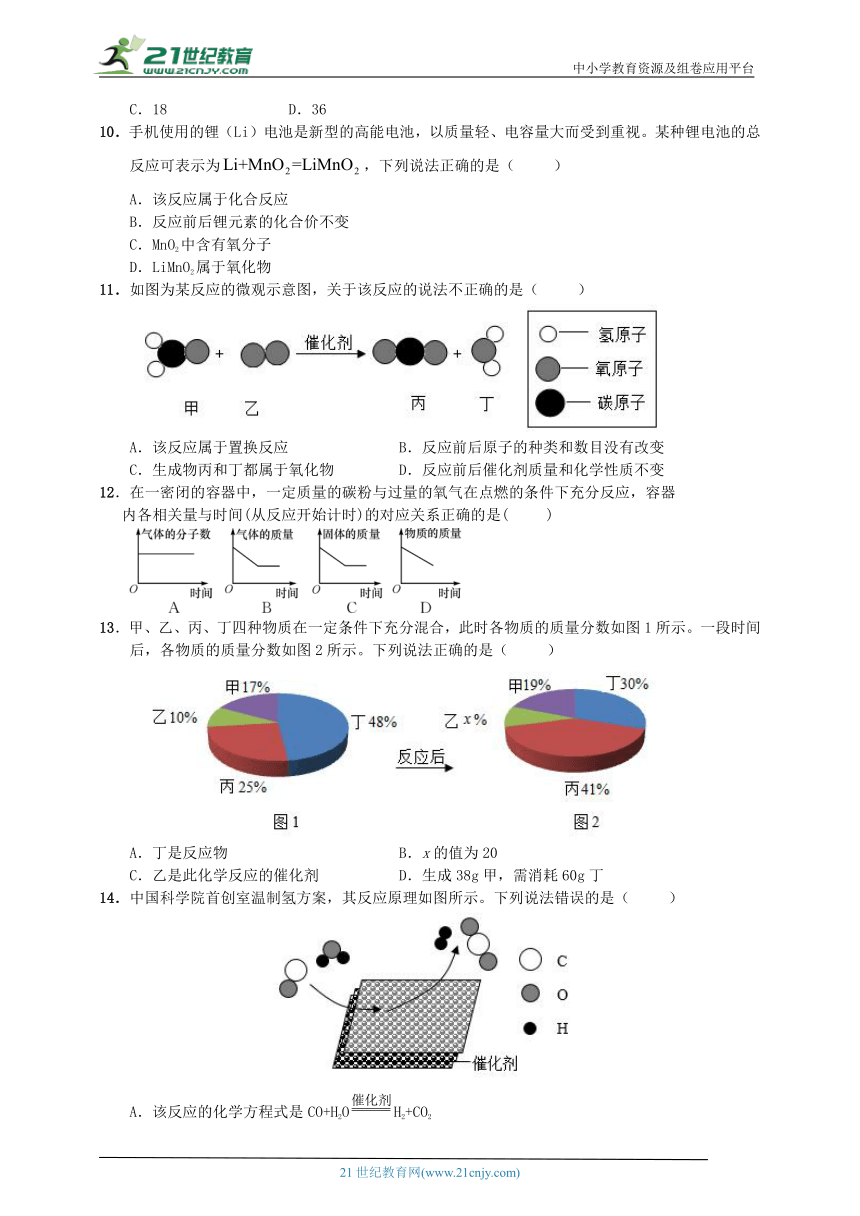
11.如图为某反应的微观示意图,关于该反应的说法不正确的是( )
A.该反应属于置换反应 B.反应前后原子的种类和数目没有改变
C.生成物丙和丁都属于氧化物 D.反应前后催化剂质量和化学性质不变
12.在一密闭的容器中,一定质量的碳粉与过量的氧气在点燃的条件下充分反应,容器
内各相关量与时间(从反应开始计时)的对应关系正确的是( )
13.甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是( )
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
14.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是( )
A.该反应的化学方程式是CO+H2OH2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
15.我国科学家成功合成新型催化剂,能将二氧化碳高效转化为甲醇,其反应的
微观过程如图所示。
(1)该反应的化学方程式是_____ ___。
(2)甲、乙、丙、丁四种物质中属于单质的是_____ ___(填化学式)。
(3)该研究成果不仅可以缓解碳排放引起的_____ ___,还将成为理想的能源补充形式。
16. 2022年4月16日,航天员翟志刚、王亚平、叶光富结束为期6个月的太空之旅,安全返回地球。空间站内利用物质的转化使O2和CO2的含量保持相对稳定。
(1)航天员呼吸所需的O2来自水的电解,其反应的化学方程式是_____ ________ ___。
(2)航天员呼吸产生的CO2进行转化时,其反应的微观示意图如下:
该反应不是置换反应的原因是_____ ________ ________ ___。
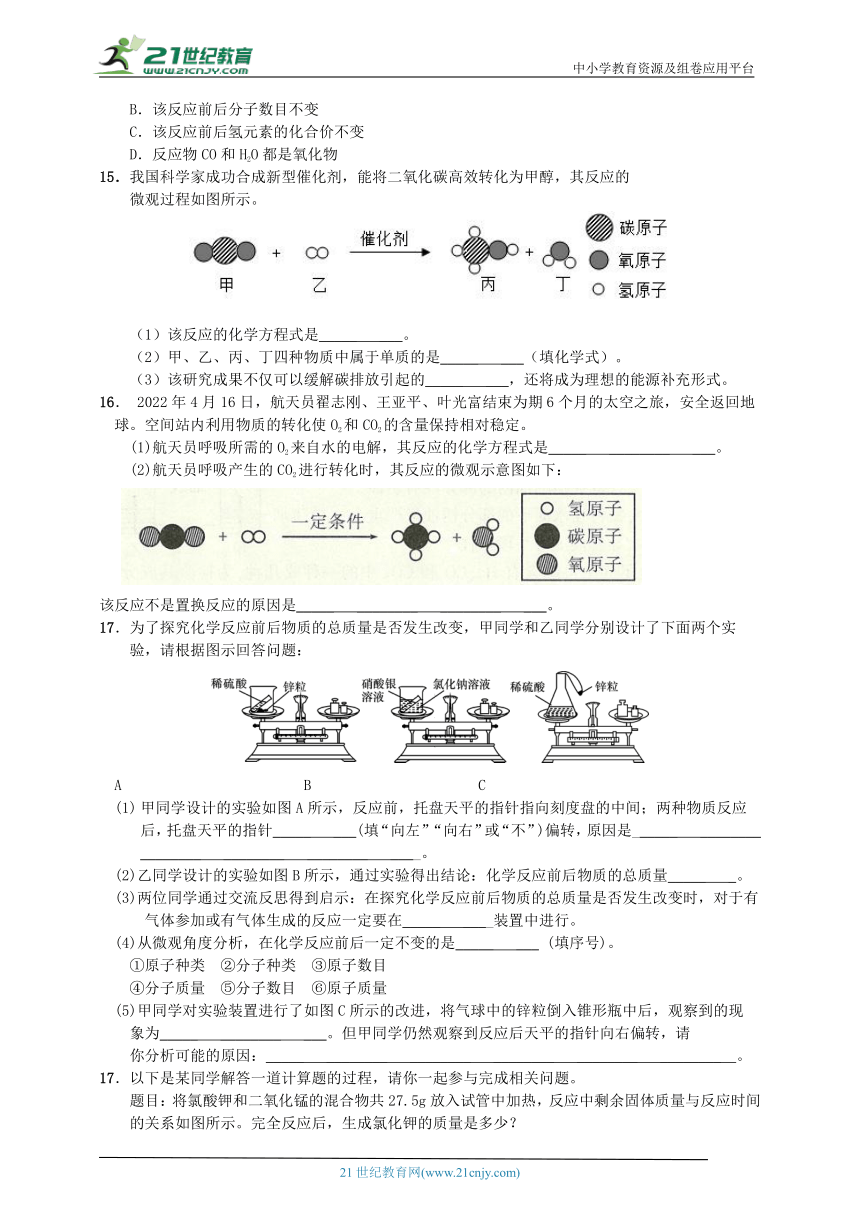
17.为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实
验,请根据图示回答问题:
A B C
甲同学设计的实验如图A所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应
后,托盘天平的指针_____ ___(填“向左”“向右”或“不”)偏转,原因是______ ________ ________ ________ ________ ____。
(2)乙同学设计的实验如图B所示,通过实验得出结论:化学反应前后物质的总质量_____ _。
(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在_____ ____装置中进行。
(4)从微观角度分析,在化学反应前后一定不变的是_____ ___ (填序号)。
①原子种类 ②分子种类 ③原子数目
④分子质量 ⑤分子数目 ⑥原子质量
(5)甲同学对实验装置进行了如图C所示的改进,将气球中的锌粒倒入锥形瓶中后,观察到的现
象为_____ ________ ___。但甲同学仍然观察到反应后天平的指针向右偏转,请
你分析可能的原因:_____ ________ ________ ________ ________ ________ 。
17.以下是某同学解答一道计算题的过程,请你一起参与完成相关问题。
题目:将氯酸钾和二氧化锰的混合物共27.5g放入试管中加热,反应中剩余固体质量与反应时间的关系如图所示。完全反应后,生成氯化钾的质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成KCl的质量为x
x=16.7g
答:生成KC1的质量为16.7g。
请回答下列问题:
(1)从图中可知完全反应后生成的O2质量是_____ ___g。
(2)上述计算过程是否正确?_____ ___ (填“正确”或“错误”)。如果错误,请你重新利用化学方程式计算生成KC1的质量_____ ____。
19.实验室有一瓶含杂质的氯酸钾。某兴趣小组利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如下:
请回答下列问题:
(1)a=_____ ___。
(2)计算受热分解的氯酸钾的质量(精确到0.1 g)。
20.一定质量的某有机化合物完全燃烧,生成2.2 g CO2和1.8 g H2O,另取3.2 g该有机化合物在O2中完全燃烧,消耗4.8 g O2,该有机化合物的化学式可能是( )
A.C2H4 B.CH4O C.CH4 D.C2H4O
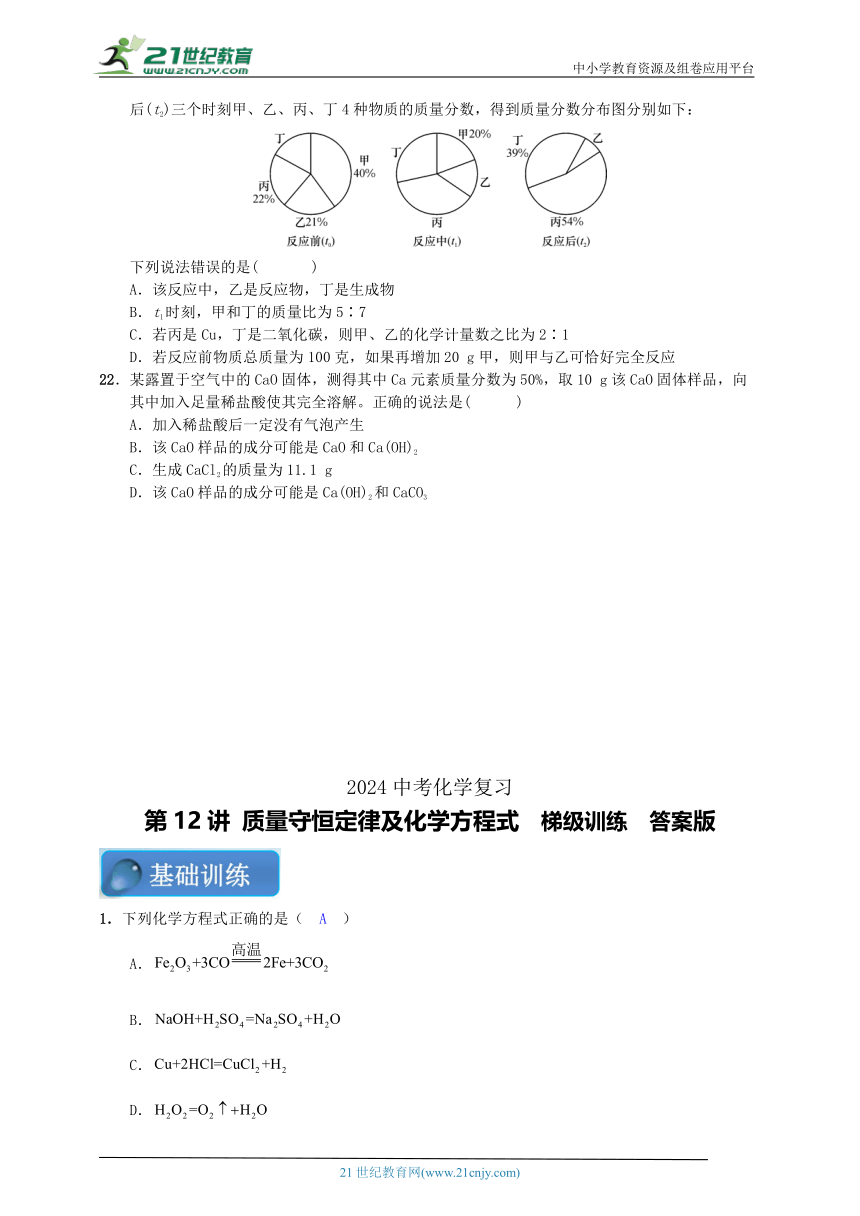
21.(2019·攀枝花)在密闭容器内进行某化学反应,测量反应前(t0)、反应中(t1)、反应后(t2)三个时刻甲、乙、丙、丁4种物质的质量分数,得到质量分数分布图分别如下:
下列说法错误的是( )
A.该反应中,乙是反应物,丁是生成物
B.t1时刻,甲和丁的质量比为5∶7
C.若丙是Cu,丁是二氧化碳,则甲、乙的化学计量数之比为2∶1
D.若反应前物质总质量为100克,如果再增加20 g甲,则甲与乙可恰好完全反应
22.某露置于空气中的CaO固体,测得其中Ca元素质量分数为50%,取10 g该CaO固体样品,向
其中加入足量稀盐酸使其完全溶解。正确的说法是( )
A.加入稀盐酸后一定没有气泡产生
B.该CaO样品的成分可能是CaO和Ca(OH)2
C.生成CaCl2的质量为11.1 g
D.该CaO样品的成分可能是Ca(OH)2和CaCO3
2024中考化学复习
第12讲 质量守恒定律及化学方程式 梯级训练 答案版
1.下列化学方程式正确的是( A )
A.
B.
C.
D.
2.硝酸在光照时会发生反应:,该反应属于( B )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3. (易错题)现有化学化学反应A+B=C,若将agA和bgB在适当条件下充分反应,分析得知剩余为
一混合物,则生成物质量( C )
A.等于(a+b)g B.大于(a+b)g C.小于(a+b)g D.小于或等于(a+b)g
4.氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成
是( D )
A. H2 B. Cl2
C. NaOH D. NaNO3
5.(易错题)下列实验能够直接用于验证质量守恒定律的是( C )
6.北京冬奥会火种灯使用化合物X作燃料,其燃烧反应方程式为 。推断X的化学式是( A )
A.C3H8 B.C3H6 C.C2H6O2 D.C3H8O3
7.过氧化钠(Na2O2)可做呼吸面具中氧气的来源,它与二氧化碳反应后的生成物为( D )
A.Na2CO3和H2 B.Na2O和O2 C.NaOH和O2 D.Na2CO3和O2
8.在2A+3B===C+2D反应中,36 g A与56 g B恰好完全反应生成28 g C和一定量的
D。若C的相对分子质量为14,则C和D的相对分子质量之比为( B )
A.7∶1 B.7∶8
C.7∶16 D.7∶32
9.在化学反应A+2B===C+2D中,已知16 g A与64 g B恰好完全反应,生成C和D的质量比为11∶9,又知B的相对分子质量为32,则D的相对分子质量为( C )
A.9 B.12
C.18 D.36
10.手机使用的锂(Li)电池是新型的高能电池,以质量轻、电容量大而受到重视。某种锂电池的总反应可表示为,下列说法正确的是( A )
A.该反应属于化合反应
B.反应前后锂元素的化合价不变
C.MnO2中含有氧分子
D.LiMnO2属于氧化物
11.如图为某反应的微观示意图,关于该反应的说法不正确的是( A )
A.该反应属于置换反应 B.反应前后原子的种类和数目没有改变
C.生成物丙和丁都属于氧化物 D.反应前后催化剂质量和化学性质不变
12.在一密闭的容器中,一定质量的碳粉与过量的氧气在点燃的条件下充分反应,容器
内各相关量与时间(从反应开始计时)的对应关系正确的是( A )
13.甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是( A )
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
14.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是( C )
A.该反应的化学方程式是CO+H2OH2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
15.我国科学家成功合成新型催化剂,能将二氧化碳高效转化为甲醇,其反应的
微观过程如图所示。
(1)该反应的化学方程式是________。
(2)甲、乙、丙、丁四种物质中属于单质的是___ H2___(填化学式)。
(3)该研究成果不仅可以缓解碳排放引起的__温室效应__,还将成为理想的能源补充形式。
16. 2022年4月16日,航天员翟志刚、王亚平、叶光富结束为期6个月的太空之旅,安全返回地球。空间站内利用物质的转化使O2和CO2的含量保持相对稳定。
(1)航天员呼吸所需的O2来自水的电解,其反应的化学方程式是___。
(2)航天员呼吸产生的CO2进行转化时,其反应的微观示意图如下:
该反应不是置换反应的原因是___生成物中没有单质或生成物均为化合物____。
17.为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实
验,请根据图示回答问题:
A B C
甲同学设计的实验如图A所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应
后,托盘天平的指针__向右__(填“向左”“向右”或“不”)偏转,原因是__锌与硫酸反应生成氢气逸散到空气中,烧杯内质量减少__。
(2)乙同学设计的实验如图B所示,通过实验得出结论:化学反应前后物质的总质量__相等__。
(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在__密闭__装置中进行。
(4)从微观角度分析,在化学反应前后一定不变的是__①③⑥__(填序号)。
①原子种类 ②分子种类 ③原子数目
④分子质量 ⑤分子数目 ⑥原子质量
(5)甲同学对实验装置进行了如图C所示的改进,将气球中的锌粒倒入锥形瓶中后,观察到的现
象为__锥瓶中有气泡冒出,气球变大__。但甲同学仍然观察到反应后天平的指针向右偏转,请
你分析可能的原因:反应生成的氢气使气球胀大,所受空气浮力增大,所以天平指针向右偏
转。
17.以下是某同学解答一道计算题的过程,请你一起参与完成相关问题。
题目:将氯酸钾和二氧化锰的混合物共27.5g放入试管中加热,反应中剩余固体质量与反应时间的关系如图所示。完全反应后,生成氯化钾的质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成KCl的质量为x
x=16.7g
答:生成KC1的质量为16.7g。
请回答下列问题:
(1)从图中可知完全反应后生成的O2质量是___9.6____g。
(2)上述计算过程是否正确?__错误__(填“正确”或“错误”)。如果错误,请你重新利用化学方程式计算生成KC1的质量__14.9g ___。
19.实验室有一瓶含杂质的氯酸钾。某兴趣小组利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如下:
请回答下列问题:
(1)a=__4.5__。
(2)计算受热分解的氯酸钾的质量(精确到0.1 g)。
解:设受热分解的氯酸钾的质量为x。
2KClO32KCl+3O2↑
245 96
x 4.8 g
= x=12.3 g
答:受热分解的氯酸钾的质量为12.3 g。
20.一定质量的某有机化合物完全燃烧,生成2.2 g CO2和1.8 g H2O,另取3.2 g该有机化合物在O2中完全燃烧,消耗4.8 g O2,该有机化合物的化学式可能是( B )
A.C2H4 B.CH4O C.CH4 D.C2H4O
21.(2019·攀枝花)在密闭容器内进行某化学反应,测量反应前(t0)、反应中(t1)、反应后(t2)三个时刻甲、乙、丙、丁4种物质的质量分数,得到质量分数分布图分别如下:
下列说法错误的是( C )
A.该反应中,乙是反应物,丁是生成物
B.t1时刻,甲和丁的质量比为5∶7
C.若丙是Cu,丁是二氧化碳,则甲、乙的化学计量数之比为2∶1
D.若反应前物质总质量为100克,如果再增加20 g甲,则甲与乙可恰好完全反应
22.某露置于空气中的CaO固体,测得其中Ca元素质量分数为50%,取10 g该CaO固体样品,向
其中加入足量稀盐酸使其完全溶解。正确的说法是( D )
A.加入稀盐酸后一定没有气泡产生
B.该CaO样品的成分可能是CaO和Ca(OH)2
C.生成CaCl2的质量为11.1 g
D.该CaO样品的成分可能是Ca(OH)2和CaCO3
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024中考化学复习
第12讲 质量守恒定律及化学方程式 梯级训练
1.下列化学方程式正确的是( )
A.
B.
C.
D.
2.硝酸在光照时会发生反应:,该反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3. (易错题)现有化学化学反应A+B=C,若将agA和bgB在适当条件下充分反应,分析得知剩余为
一混合物,则生成物质量( )
A.等于(a+b)g B.大于(a+b)g C.小于(a+b)g D.小于或等于(a+b)g
4.氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成
是( )
A. H2 B. Cl2
C. NaOH D. NaNO3
5.(易错题)下列实验能够直接用于验证质量守恒定律的是( )
6.北京冬奥会火种灯使用化合物X作燃料,其燃烧反应方程式为 。推断X的化学式是( )
A.C3H8 B.C3H6 C.C2H6O2 D.C3H8O3
7.过氧化钠(Na2O2)可做呼吸面具中氧气的来源,它与二氧化碳反应后的生成物为( )
A.Na2CO3和H2 B.Na2O和O2 C.NaOH和O2 D.Na2CO3和O2
8.在2A+3B===C+2D反应中,36 g A与56 g B恰好完全反应生成28 g C和一定量的
D。若C的相对分子质量为14,则C和D的相对分子质量之比为( )
A.7∶1 B.7∶8
C.7∶16 D.7∶32
9.(2019·天津)在化学反应A+2B===C+2D中,已知16 g A与64 g B恰好完全反应,生成C和D的质量比为11∶9,又知B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12
C.18 D.36
10.手机使用的锂(Li)电池是新型的高能电池,以质量轻、电容量大而受到重视。某种锂电池的总反应可表示为,下列说法正确的是( )
A.该反应属于化合反应
B.反应前后锂元素的化合价不变
C.MnO2中含有氧分子
D.LiMnO2属于氧化物
11.如图为某反应的微观示意图,关于该反应的说法不正确的是( )
A.该反应属于置换反应 B.反应前后原子的种类和数目没有改变
C.生成物丙和丁都属于氧化物 D.反应前后催化剂质量和化学性质不变
12.在一密闭的容器中,一定质量的碳粉与过量的氧气在点燃的条件下充分反应,容器
内各相关量与时间(从反应开始计时)的对应关系正确的是( )
13.甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是( )
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
14.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是( )
A.该反应的化学方程式是CO+H2OH2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
15.我国科学家成功合成新型催化剂,能将二氧化碳高效转化为甲醇,其反应的
微观过程如图所示。
(1)该反应的化学方程式是_____ ___。
(2)甲、乙、丙、丁四种物质中属于单质的是_____ ___(填化学式)。
(3)该研究成果不仅可以缓解碳排放引起的_____ ___,还将成为理想的能源补充形式。
16. 2022年4月16日,航天员翟志刚、王亚平、叶光富结束为期6个月的太空之旅,安全返回地球。空间站内利用物质的转化使O2和CO2的含量保持相对稳定。
(1)航天员呼吸所需的O2来自水的电解,其反应的化学方程式是_____ ________ ___。
(2)航天员呼吸产生的CO2进行转化时,其反应的微观示意图如下:
该反应不是置换反应的原因是_____ ________ ________ ___。
17.为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实
验,请根据图示回答问题:
A B C
甲同学设计的实验如图A所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应
后,托盘天平的指针_____ ___(填“向左”“向右”或“不”)偏转,原因是______ ________ ________ ________ ________ ____。
(2)乙同学设计的实验如图B所示,通过实验得出结论:化学反应前后物质的总质量_____ _。
(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在_____ ____装置中进行。
(4)从微观角度分析,在化学反应前后一定不变的是_____ ___ (填序号)。
①原子种类 ②分子种类 ③原子数目
④分子质量 ⑤分子数目 ⑥原子质量
(5)甲同学对实验装置进行了如图C所示的改进,将气球中的锌粒倒入锥形瓶中后,观察到的现
象为_____ ________ ___。但甲同学仍然观察到反应后天平的指针向右偏转,请
你分析可能的原因:_____ ________ ________ ________ ________ ________ 。
17.以下是某同学解答一道计算题的过程,请你一起参与完成相关问题。
题目:将氯酸钾和二氧化锰的混合物共27.5g放入试管中加热,反应中剩余固体质量与反应时间的关系如图所示。完全反应后,生成氯化钾的质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成KCl的质量为x
x=16.7g
答:生成KC1的质量为16.7g。
请回答下列问题:
(1)从图中可知完全反应后生成的O2质量是_____ ___g。
(2)上述计算过程是否正确?_____ ___ (填“正确”或“错误”)。如果错误,请你重新利用化学方程式计算生成KC1的质量_____ ____。
19.实验室有一瓶含杂质的氯酸钾。某兴趣小组利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如下:
请回答下列问题:
(1)a=_____ ___。
(2)计算受热分解的氯酸钾的质量(精确到0.1 g)。
20.一定质量的某有机化合物完全燃烧,生成2.2 g CO2和1.8 g H2O,另取3.2 g该有机化合物在O2中完全燃烧,消耗4.8 g O2,该有机化合物的化学式可能是( )
A.C2H4 B.CH4O C.CH4 D.C2H4O
21.(2019·攀枝花)在密闭容器内进行某化学反应,测量反应前(t0)、反应中(t1)、反应后(t2)三个时刻甲、乙、丙、丁4种物质的质量分数,得到质量分数分布图分别如下:
下列说法错误的是( )
A.该反应中,乙是反应物,丁是生成物
B.t1时刻,甲和丁的质量比为5∶7
C.若丙是Cu,丁是二氧化碳,则甲、乙的化学计量数之比为2∶1
D.若反应前物质总质量为100克,如果再增加20 g甲,则甲与乙可恰好完全反应
22.某露置于空气中的CaO固体,测得其中Ca元素质量分数为50%,取10 g该CaO固体样品,向
其中加入足量稀盐酸使其完全溶解。正确的说法是( )
A.加入稀盐酸后一定没有气泡产生
B.该CaO样品的成分可能是CaO和Ca(OH)2
C.生成CaCl2的质量为11.1 g
D.该CaO样品的成分可能是Ca(OH)2和CaCO3
2024中考化学复习
第12讲 质量守恒定律及化学方程式 梯级训练 答案版
1.下列化学方程式正确的是( A )
A.
B.
C.
D.
2.硝酸在光照时会发生反应:,该反应属于( B )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3. (易错题)现有化学化学反应A+B=C,若将agA和bgB在适当条件下充分反应,分析得知剩余为
一混合物,则生成物质量( C )
A.等于(a+b)g B.大于(a+b)g C.小于(a+b)g D.小于或等于(a+b)g
4.氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成
是( D )
A. H2 B. Cl2
C. NaOH D. NaNO3
5.(易错题)下列实验能够直接用于验证质量守恒定律的是( C )
6.北京冬奥会火种灯使用化合物X作燃料,其燃烧反应方程式为 。推断X的化学式是( A )
A.C3H8 B.C3H6 C.C2H6O2 D.C3H8O3
7.过氧化钠(Na2O2)可做呼吸面具中氧气的来源,它与二氧化碳反应后的生成物为( D )
A.Na2CO3和H2 B.Na2O和O2 C.NaOH和O2 D.Na2CO3和O2
8.在2A+3B===C+2D反应中,36 g A与56 g B恰好完全反应生成28 g C和一定量的
D。若C的相对分子质量为14,则C和D的相对分子质量之比为( B )
A.7∶1 B.7∶8
C.7∶16 D.7∶32
9.在化学反应A+2B===C+2D中,已知16 g A与64 g B恰好完全反应,生成C和D的质量比为11∶9,又知B的相对分子质量为32,则D的相对分子质量为( C )
A.9 B.12
C.18 D.36
10.手机使用的锂(Li)电池是新型的高能电池,以质量轻、电容量大而受到重视。某种锂电池的总反应可表示为,下列说法正确的是( A )
A.该反应属于化合反应
B.反应前后锂元素的化合价不变
C.MnO2中含有氧分子
D.LiMnO2属于氧化物
11.如图为某反应的微观示意图,关于该反应的说法不正确的是( A )
A.该反应属于置换反应 B.反应前后原子的种类和数目没有改变
C.生成物丙和丁都属于氧化物 D.反应前后催化剂质量和化学性质不变
12.在一密闭的容器中,一定质量的碳粉与过量的氧气在点燃的条件下充分反应,容器
内各相关量与时间(从反应开始计时)的对应关系正确的是( A )
13.甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是( A )
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
14.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是( C )
A.该反应的化学方程式是CO+H2OH2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
15.我国科学家成功合成新型催化剂,能将二氧化碳高效转化为甲醇,其反应的
微观过程如图所示。
(1)该反应的化学方程式是________。
(2)甲、乙、丙、丁四种物质中属于单质的是___ H2___(填化学式)。
(3)该研究成果不仅可以缓解碳排放引起的__温室效应__,还将成为理想的能源补充形式。
16. 2022年4月16日,航天员翟志刚、王亚平、叶光富结束为期6个月的太空之旅,安全返回地球。空间站内利用物质的转化使O2和CO2的含量保持相对稳定。
(1)航天员呼吸所需的O2来自水的电解,其反应的化学方程式是___。
(2)航天员呼吸产生的CO2进行转化时,其反应的微观示意图如下:
该反应不是置换反应的原因是___生成物中没有单质或生成物均为化合物____。
17.为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实
验,请根据图示回答问题:
A B C
甲同学设计的实验如图A所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应
后,托盘天平的指针__向右__(填“向左”“向右”或“不”)偏转,原因是__锌与硫酸反应生成氢气逸散到空气中,烧杯内质量减少__。
(2)乙同学设计的实验如图B所示,通过实验得出结论:化学反应前后物质的总质量__相等__。
(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在__密闭__装置中进行。
(4)从微观角度分析,在化学反应前后一定不变的是__①③⑥__(填序号)。
①原子种类 ②分子种类 ③原子数目
④分子质量 ⑤分子数目 ⑥原子质量
(5)甲同学对实验装置进行了如图C所示的改进,将气球中的锌粒倒入锥形瓶中后,观察到的现
象为__锥瓶中有气泡冒出,气球变大__。但甲同学仍然观察到反应后天平的指针向右偏转,请
你分析可能的原因:反应生成的氢气使气球胀大,所受空气浮力增大,所以天平指针向右偏
转。
17.以下是某同学解答一道计算题的过程,请你一起参与完成相关问题。
题目:将氯酸钾和二氧化锰的混合物共27.5g放入试管中加热,反应中剩余固体质量与反应时间的关系如图所示。完全反应后,生成氯化钾的质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成KCl的质量为x
x=16.7g
答:生成KC1的质量为16.7g。
请回答下列问题:
(1)从图中可知完全反应后生成的O2质量是___9.6____g。
(2)上述计算过程是否正确?__错误__(填“正确”或“错误”)。如果错误,请你重新利用化学方程式计算生成KC1的质量__14.9g ___。
19.实验室有一瓶含杂质的氯酸钾。某兴趣小组利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如下:
请回答下列问题:
(1)a=__4.5__。
(2)计算受热分解的氯酸钾的质量(精确到0.1 g)。
解:设受热分解的氯酸钾的质量为x。
2KClO32KCl+3O2↑
245 96
x 4.8 g
= x=12.3 g
答:受热分解的氯酸钾的质量为12.3 g。
20.一定质量的某有机化合物完全燃烧,生成2.2 g CO2和1.8 g H2O,另取3.2 g该有机化合物在O2中完全燃烧,消耗4.8 g O2,该有机化合物的化学式可能是( B )
A.C2H4 B.CH4O C.CH4 D.C2H4O
21.(2019·攀枝花)在密闭容器内进行某化学反应,测量反应前(t0)、反应中(t1)、反应后(t2)三个时刻甲、乙、丙、丁4种物质的质量分数,得到质量分数分布图分别如下:
下列说法错误的是( C )
A.该反应中,乙是反应物,丁是生成物
B.t1时刻,甲和丁的质量比为5∶7
C.若丙是Cu,丁是二氧化碳,则甲、乙的化学计量数之比为2∶1
D.若反应前物质总质量为100克,如果再增加20 g甲,则甲与乙可恰好完全反应
22.某露置于空气中的CaO固体,测得其中Ca元素质量分数为50%,取10 g该CaO固体样品,向
其中加入足量稀盐酸使其完全溶解。正确的说法是( D )
A.加入稀盐酸后一定没有气泡产生
B.该CaO样品的成分可能是CaO和Ca(OH)2
C.生成CaCl2的质量为11.1 g
D.该CaO样品的成分可能是Ca(OH)2和CaCO3
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
