山东省青岛第五十八中学2023-2024学年高一下学期4月阶段性检测化学试卷(含答案)
文档属性
| 名称 | 山东省青岛第五十八中学2023-2024学年高一下学期4月阶段性检测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 08:11:15 | ||
图片预览

文档简介
青岛第五十八中学2023-2024学年高一下学期4月阶段性检测
化学试卷
2024.4
注意事项:
1.本试卷分第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷为选择题,共40分;第Ⅱ卷为非选择题,共60分,满分100分,考试时间为90分钟。
2.第Ⅰ卷共3页,请将选出的答案标号(A、B、C、D)涂在答题卡上。第Ⅱ卷共2页,将答案用黑色签字笔(0.5mm)写在答题纸上。
3.试卷卷面分5分,如不规范,分等级(5、3、1分)扣除。
可能用到的相对原子质量:H1 B11 C12 O16 Na23 Mg24 Al27
S32 Cl35.5 Cu64 I127 Ba137 Bi209
第Ⅰ卷
一、单项选择题(共10小题,每题2分,共20分。每小题只有一个正确答案。)
1.下列说法中正确的有( )
①“天目一号”气象星座卫星的光伏发电系统工作时可将光能转化为电能
②有化学键断裂并且有能量的吸收或放出的一定是化学变化
③富勒烯、碳纳米管、石墨烯等碳纳米材料都属于胶体
④肼()可作为燃料电池的燃料,其电子式可表示为
⑤、、包含原子最外层电子都满足8电子稳定结构
⑥神舟十七号飞船舱体外壳氮化镓涂层,属于新型金属材料
A.1项 B.2项 C.3项 D.4项
2.下列物质存储或使用方法正确的是( )
A.新制氯水保存于带玻璃塞的棕色广口瓶中
B.铁与氯气能反应,所以液氯不可用钢瓶储存
C.金属钠着火用二氧化碳灭火器扑灭
D.铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物
3.W、X、Y、Z为原子序数依次增大的短周期主族元素,W和Y同族,X和Z同族,X的简单离子和Y的简单离子具有相同的电子层结构,W和X、Z均能形成共价化合物,W和X、Y分别形成的化合物溶于水均呈碱性。下列说法错误的是( )
A.4种元素中Y的金属性最强
B.最高价氧化物对应的水化物的酸性:Z>X
C.简单阳离子氧化性:W>Y
D.W和Y形成的化合物与水反应能生成一种还原性气体
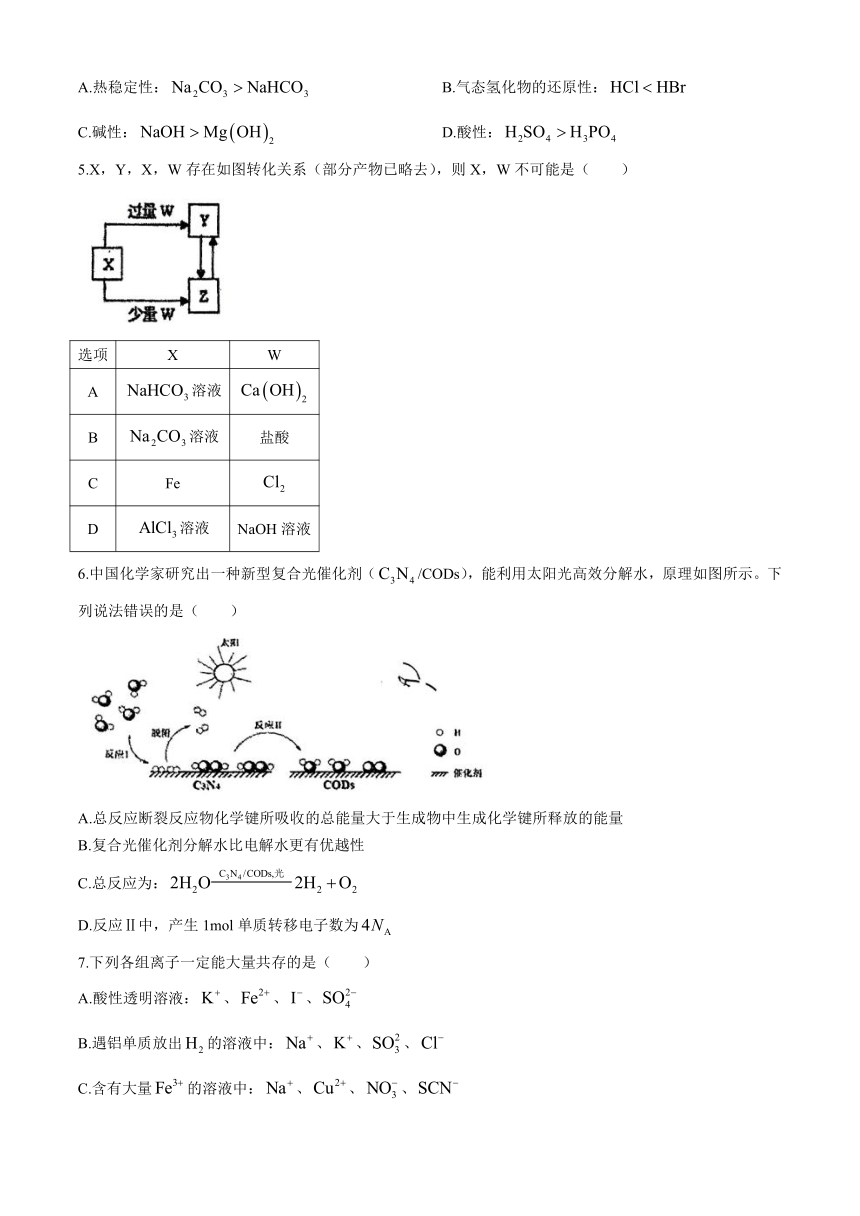
4.下列有关性质的比较,不能用元素周期律解释的是( )
A.热稳定性: B.气态氢化物的还原性:
C.碱性: D.酸性:
5.X,Y,X,W存在如图转化关系(部分产物已略去),则X,W不可能是( )
选项 X W
A 溶液
B 溶液 盐酸
C Fe
D 溶液 NaOH溶液
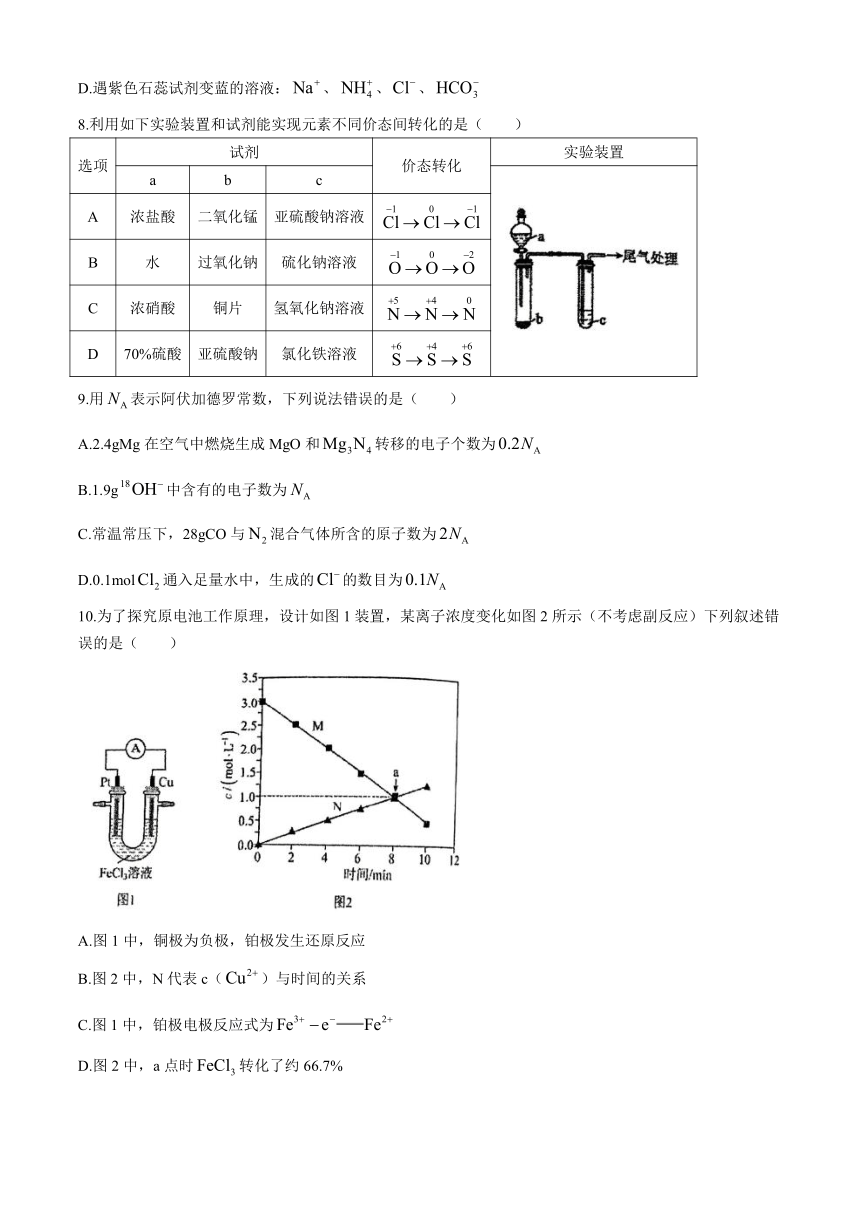
6.中国化学家研究出一种新型复合光催化剂(/CODs),能利用太阳光高效分解水,原理如图所示。下列说法错误的是( )
A.总反应断裂反应物化学键所吸收的总能量大于生成物中生成化学键所释放的能量
B.复合光催化剂分解水比电解水更有优越性
C.总反应为:
D.反应Ⅱ中,产生1mol单质转移电子数为
7.下列各组离子一定能大量共存的是( )
A.酸性透明溶液:、、、
B.遇铝单质放出的溶液中:、、、
C.含有大量的溶液中:、、、
D.遇紫色石蕊试剂变蓝的溶液:、、、
8.利用如下实验装置和试剂能实现元素不同价态间转化的是( )
选项 试剂 价态转化 实验装置
a b c
A 浓盐酸 二氧化锰 亚硫酸钠溶液
B 水 过氧化钠 硫化钠溶液
C 浓硝酸 铜片 氢氧化钠溶液
D 70%硫酸 亚硫酸钠 氯化铁溶液
9.用表示阿伏加德罗常数,下列说法错误的是( )
A.2.4gMg在空气中燃烧生成MgO和转移的电子个数为
B.1.9g中含有的电子数为
C.常温常压下,28gCO与混合气体所含的原子数为
D.0.1mol通入足量水中,生成的的数目为
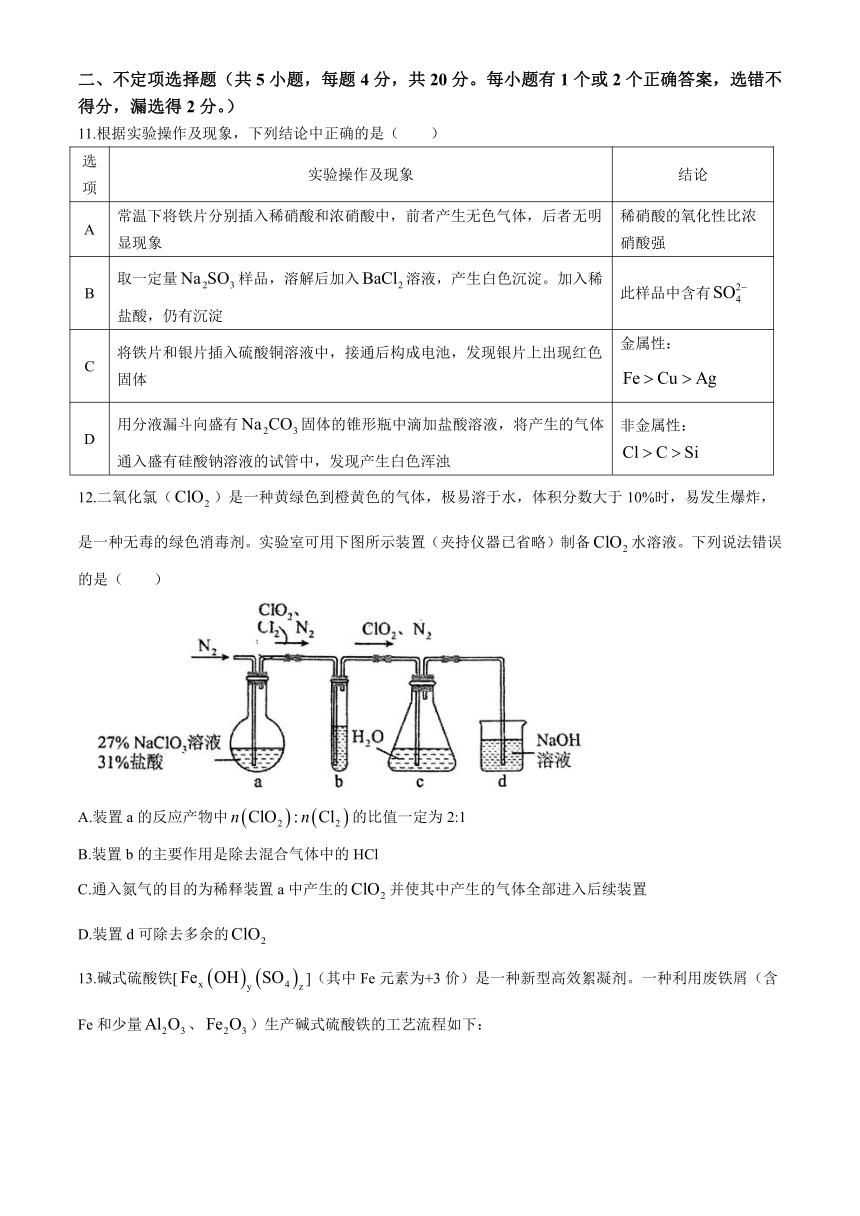
10.为了探究原电池工作原理,设计如图1装置,某离子浓度变化如图2所示(不考虑副反应)下列叙述错误的是( )
A.图1中,铜极为负极,铂极发生还原反应
B.图2中,N代表c()与时间的关系
C.图1中,铂极电极反应式为
D.图2中,a点时转化了约66.7%
二、不定项选择题(共5小题,每题4分,共20分。每小题有1个或2个正确答案,选错不得分,漏选得2分。)
11.根据实验操作及现象,下列结论中正确的是( )
选项 实验操作及现象 结论
A 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
B 取一定量样品,溶解后加入溶液,产生白色沉淀。加入稀盐酸,仍有沉淀 此样品中含有
C 将铁片和银片插入硫酸铜溶液中,接通后构成电池,发现银片上出现红色固体 金属性:
D 用分液漏斗向盛有固体的锥形瓶中滴加盐酸溶液,将产生的气体通入盛有硅酸钠溶液的试管中,发现产生白色浑浊 非金属性:
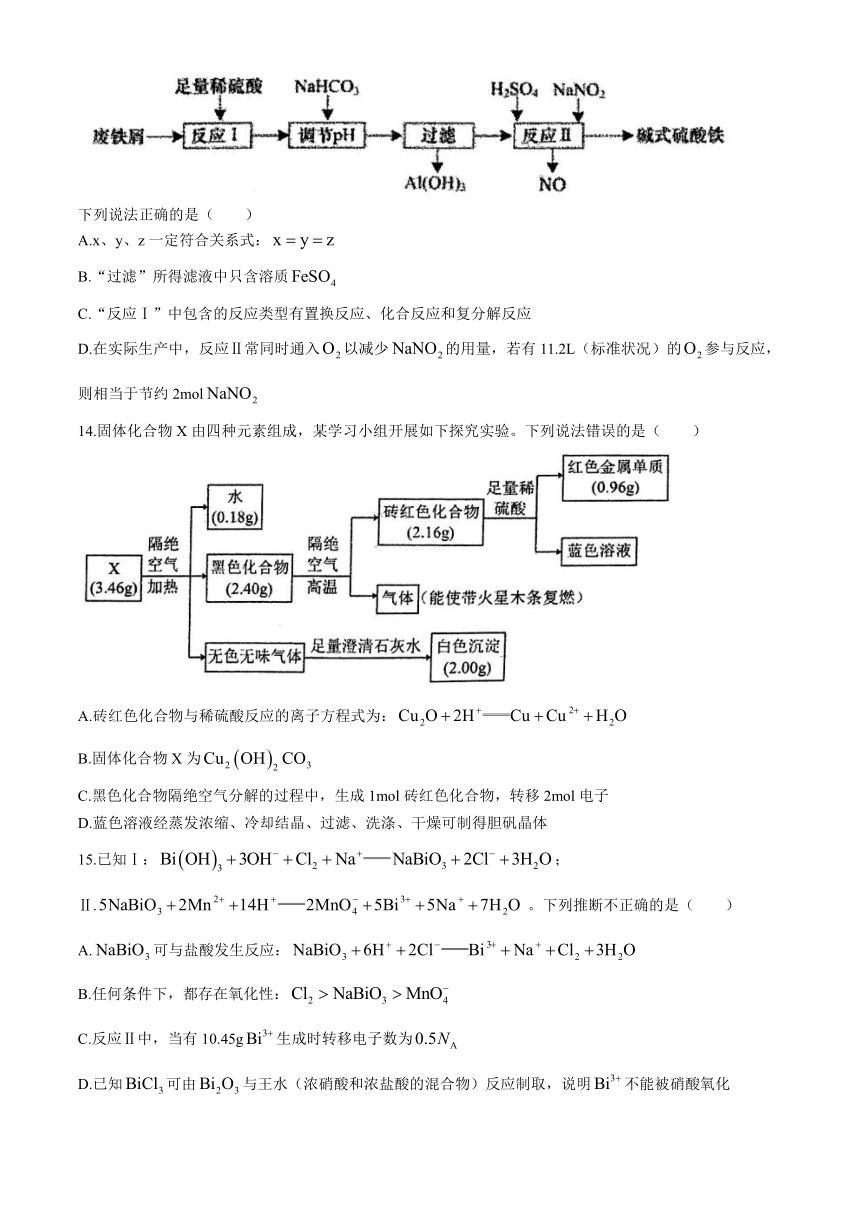
12.二氧化氯()是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备水溶液。下列说法错误的是( )
A.装置a的反应产物中的比值一定为2:1
B.装置b的主要作用是除去混合气体中的HCl
C.通入氮气的目的为稀释装置a中产生的并使其中产生的气体全部进入后续装置
D.装置d可除去多余的
13.碱式硫酸铁[](其中Fe元素为+3价)是一种新型高效絮凝剂。一种利用废铁屑(含Fe和少量、)生产碱式硫酸铁的工艺流程如下:
下列说法正确的是( )
A.x、y、z一定符合关系式:
B.“过滤”所得滤液中只含溶质
C.“反应Ⅰ”中包含的反应类型有置换反应、化合反应和复分解反应
D.在实际生产中,反应Ⅱ常同时通入以减少的用量,若有11.2L(标准状况)的参与反应,则相当于节约2mol
14.固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是( )
A.砖红色化合物与稀硫酸反应的离子方程式为:
B.固体化合物X为
C.黑色化合物隔绝空气分解的过程中,生成1mol砖红色化合物,转移2mol电子
D.蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可制得胆矾晶体
15.已知Ⅰ:;
Ⅱ.。下列推断不正确的是( )
A.可与盐酸发生反应:
B.任何条件下,都存在氧化性:
C.反应Ⅱ中,当有10.45g生成时转移电子数为
D.已知可由与王水(浓硝酸和浓盐酸的混合物)反应制取,说明不能被硝酸氧化
第Ⅱ卷
三、填空题(本题共5题,共60分。)
16.(12分)有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应水化物溶液(浓度均为)的pH与原子序数的关系如图2所示。
根据上述信息进行判断,并回答下列问题:
(1)元素i位于第五周期且与元素z同族,该元素原子序数为___________,该元素单质及其化合物一个重要的应用是____________________。
(2)比较d、f、g常见离子的半径大小____________(由大到小用离子符号表示)。
(3)由元素x、y、z、d四种元素组成的常见的阴阳离子个数比1:1的化合物与氢氧化钡溶液反应的离子方程式为__________________________________。
(4)下列可作为比较f和e金属性强弱的依据是__________。
a.测两种元素单质的硬度和熔、沸点
b.二者最高价氧化物水化物能相互反应
c.比较单质与同浓度盐酸反应的剧烈程度
d.比较两种元素在化合物中化合价的高低
(5)元素g、h按照原子个数比1:1可组成满足8电子稳定结构的四原子分子,该物质能够遇水剧烈反应,生成沉淀和气体。写出相应的化学方程式_____________________。
(6)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄漏时,消防人员通常采用喷洒溶液的方式处理,以较少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为_________________________。已知eyz含有分子中类似的化学键,写出化合物eyz的电子式_________________________。
17.(12分)白硼钙石的主要成分是(含有少量、FeO、和等杂质),利用白硼钙石制取强还原剂的工艺流程如下:
已知微溶于水,易溶于乙醇;偏硼酸钠()易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
(1)中H的化合价为_________,该物质所含的化学键类型有_________________。
(2)写出“酸浸过滤”中发生的主要化学反应方程式______________________________。
(3)“气体”的主要成分为________________。“滤渣1”的主要成分是___________________。
(4)“操作X”为____________________________。
(5)写出“反应Y”的化学方程式________________________________________。
(6)“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克的还原能力)可用衡量含氢还原剂的还原能力,则的有效氢含量为__________(保留2位有效数字)。
18.(12分)碘元素是人体必需的微量元素之一。某小组设计以下实验从海带中提取碘并测定食盐中碘元素的含量。
Ⅰ.海带提碘
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入__________(填仪器名称)中灼烧至海带完全成灰烬,然后继续进行下列流程。
(2)取海带灰浸取液1~2mL,加入0.5mL稀硫酸、0.5mL5%的溶液,然后再加入0.5mL,振荡后静置,若观察到_________(填实验现象),则证明海带中含有碘元素,上述过程中涉及的离子反应方程式为___________________________。
(3)萃取实验中,若要使碘尽可能地完全转移到中,可采取的操作是______________。
Ⅱ.人体碘的重要来源之一是食用加碘食盐(含)。为测定加碘食盐中的碘含量,学习小组设计如下实验:
①配制1L硫代硫酸钠()标准溶液;
②用天平准确称取wg食盐样品,加适量蒸馏水使其完全溶解;
③用稀硫酸酸化所得溶液,加入足量KI溶液,使与KI反应完全生成;
④向②中混合液逐滴加入浓度为的溶液,恰好反应完全时,消耗溶液6.00mL。(已知:)
已知:易溶于水,具有强还原性。
(4)配制硫代硫酸钠溶液时用分析天平准确称量固体的质量为______g。(保留小数点后2位)
(5)配制前蒸馏水需先煮沸再冷却,其目的是____________________。
(6)下列情况中,导致所配溶液的物质的量浓度偏低的是________.(填标号)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.转移溶液至容量瓶过程中,有少量溶液溅出
C.定容时俯视刻度线读数
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(7)上述实验样品中碘元素的含量为__________mg/kg(用含w的代数式表示)。
19.(10分)三氯化硼()用于制备光导纤维和有机硼化物等,制备原理:。某小组据此设计实验制备并测定其纯度,装置如下图所示。
已知:①的熔点为-107.3℃,沸点为12.5℃,极易水解。
②可用于处理尾气CO。
实验(一):制备。
(1)写出制备氯气的离子方程式________________________
(2)装置A中玻璃管a的作用是________________________。E装置的作用是____________________。
(3)写出发生水解的化学方程式__________________________________。
实验(二):纯度的测定。
(4)准确称取wg产品,置于蒸馏水中,完全水解。用硝酸银进行含量测定,发现消耗mg质量分数为b%硝酸银溶液,则产品的纯度为____________。(用含字母w、b、m的式子表示)
20.(12分)某化学兴趣小组在习题解析中看到:“通入溶液出现白色沉淀,是因为在酸性环境中,将氧化成而产生沉淀”。有同学对这个解析提出了质疑,“因没有隔绝空气,也许只是氧化了,与无关”。于是做了“通入溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。
(1)实验小组发现装置C存在不足,不足之处是_______________________。
(2)为探究硫酸钡产生的原因,分别在装置C中进行以下探究实验。则③④号实验,应该选用的试剂为____________。
编号 ① ② ③ ④
试剂 煮沸过的0.1mol/L溶液50mL,再加入食用油25mL 未煮沸过的0.1mol/L溶液50mL 煮沸过的________溶液50mL,再加入食用油25mL 未煮沸过的__________溶液50mL
(3)进行①③号实验前通入氮气的目的是________________________。
(4)实验现象:①号依然澄清,②③④号均出现浑浊。据此请补充②号实验中装置C中反应生成沉淀的化学方程式__________________________________。
(5)图1~4分别为①②③④号实验所测pH随时间变化曲线。
根据以上数据,可得到的结论是_______________________。
(6)计算实验②500s时产生硫酸钡的质量为__________mg。(可忽略溶于水产生的)
青岛第五十八中学2023-2024学年高一下学期4月阶段性检测
化学答案
一、单选
1.B 2.D 3.B 4.A 5.C 6.D 7.A 8.B 9.D 10.C
二、不定项选择
11.C 12.B 13.C 14.B 15.BC
三、填空题
16.(1)51 半导体
(2)
(3)
(4)BC
(5)
(6)
17.(1) 离子键、共价键
(2)
(3)、
(4)冷却结晶
(5)
(6)0.21
18.(1)坩埚
(2)下层呈紫色
(3)多次萃取
(4)0.32
(5)防止与反应
(6)BD (7)
19.(1)
(2)平衡气压使液体顺利流下,防止F中的水进入D
(3)
(4)
20.(1)没有进行封闭,而直接与大气相通
(2)
(3)防止氧化
(4)
(5)与均可以氧化,但与可一起使氧化更快
(6)1165
化学试卷
2024.4
注意事项:
1.本试卷分第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷为选择题,共40分;第Ⅱ卷为非选择题,共60分,满分100分,考试时间为90分钟。
2.第Ⅰ卷共3页,请将选出的答案标号(A、B、C、D)涂在答题卡上。第Ⅱ卷共2页,将答案用黑色签字笔(0.5mm)写在答题纸上。
3.试卷卷面分5分,如不规范,分等级(5、3、1分)扣除。
可能用到的相对原子质量:H1 B11 C12 O16 Na23 Mg24 Al27
S32 Cl35.5 Cu64 I127 Ba137 Bi209
第Ⅰ卷
一、单项选择题(共10小题,每题2分,共20分。每小题只有一个正确答案。)
1.下列说法中正确的有( )
①“天目一号”气象星座卫星的光伏发电系统工作时可将光能转化为电能
②有化学键断裂并且有能量的吸收或放出的一定是化学变化
③富勒烯、碳纳米管、石墨烯等碳纳米材料都属于胶体
④肼()可作为燃料电池的燃料,其电子式可表示为
⑤、、包含原子最外层电子都满足8电子稳定结构
⑥神舟十七号飞船舱体外壳氮化镓涂层,属于新型金属材料
A.1项 B.2项 C.3项 D.4项
2.下列物质存储或使用方法正确的是( )
A.新制氯水保存于带玻璃塞的棕色广口瓶中
B.铁与氯气能反应,所以液氯不可用钢瓶储存
C.金属钠着火用二氧化碳灭火器扑灭
D.铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物
3.W、X、Y、Z为原子序数依次增大的短周期主族元素,W和Y同族,X和Z同族,X的简单离子和Y的简单离子具有相同的电子层结构,W和X、Z均能形成共价化合物,W和X、Y分别形成的化合物溶于水均呈碱性。下列说法错误的是( )
A.4种元素中Y的金属性最强
B.最高价氧化物对应的水化物的酸性:Z>X
C.简单阳离子氧化性:W>Y
D.W和Y形成的化合物与水反应能生成一种还原性气体
4.下列有关性质的比较,不能用元素周期律解释的是( )
A.热稳定性: B.气态氢化物的还原性:
C.碱性: D.酸性:
5.X,Y,X,W存在如图转化关系(部分产物已略去),则X,W不可能是( )
选项 X W
A 溶液
B 溶液 盐酸
C Fe
D 溶液 NaOH溶液
6.中国化学家研究出一种新型复合光催化剂(/CODs),能利用太阳光高效分解水,原理如图所示。下列说法错误的是( )
A.总反应断裂反应物化学键所吸收的总能量大于生成物中生成化学键所释放的能量
B.复合光催化剂分解水比电解水更有优越性
C.总反应为:
D.反应Ⅱ中,产生1mol单质转移电子数为
7.下列各组离子一定能大量共存的是( )
A.酸性透明溶液:、、、
B.遇铝单质放出的溶液中:、、、
C.含有大量的溶液中:、、、
D.遇紫色石蕊试剂变蓝的溶液:、、、
8.利用如下实验装置和试剂能实现元素不同价态间转化的是( )
选项 试剂 价态转化 实验装置
a b c
A 浓盐酸 二氧化锰 亚硫酸钠溶液
B 水 过氧化钠 硫化钠溶液
C 浓硝酸 铜片 氢氧化钠溶液
D 70%硫酸 亚硫酸钠 氯化铁溶液
9.用表示阿伏加德罗常数,下列说法错误的是( )
A.2.4gMg在空气中燃烧生成MgO和转移的电子个数为
B.1.9g中含有的电子数为
C.常温常压下,28gCO与混合气体所含的原子数为
D.0.1mol通入足量水中,生成的的数目为
10.为了探究原电池工作原理,设计如图1装置,某离子浓度变化如图2所示(不考虑副反应)下列叙述错误的是( )
A.图1中,铜极为负极,铂极发生还原反应
B.图2中,N代表c()与时间的关系
C.图1中,铂极电极反应式为
D.图2中,a点时转化了约66.7%
二、不定项选择题(共5小题,每题4分,共20分。每小题有1个或2个正确答案,选错不得分,漏选得2分。)
11.根据实验操作及现象,下列结论中正确的是( )
选项 实验操作及现象 结论
A 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
B 取一定量样品,溶解后加入溶液,产生白色沉淀。加入稀盐酸,仍有沉淀 此样品中含有
C 将铁片和银片插入硫酸铜溶液中,接通后构成电池,发现银片上出现红色固体 金属性:
D 用分液漏斗向盛有固体的锥形瓶中滴加盐酸溶液,将产生的气体通入盛有硅酸钠溶液的试管中,发现产生白色浑浊 非金属性:
12.二氧化氯()是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备水溶液。下列说法错误的是( )
A.装置a的反应产物中的比值一定为2:1
B.装置b的主要作用是除去混合气体中的HCl
C.通入氮气的目的为稀释装置a中产生的并使其中产生的气体全部进入后续装置
D.装置d可除去多余的
13.碱式硫酸铁[](其中Fe元素为+3价)是一种新型高效絮凝剂。一种利用废铁屑(含Fe和少量、)生产碱式硫酸铁的工艺流程如下:
下列说法正确的是( )
A.x、y、z一定符合关系式:
B.“过滤”所得滤液中只含溶质
C.“反应Ⅰ”中包含的反应类型有置换反应、化合反应和复分解反应
D.在实际生产中,反应Ⅱ常同时通入以减少的用量,若有11.2L(标准状况)的参与反应,则相当于节约2mol
14.固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是( )
A.砖红色化合物与稀硫酸反应的离子方程式为:
B.固体化合物X为
C.黑色化合物隔绝空气分解的过程中,生成1mol砖红色化合物,转移2mol电子
D.蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可制得胆矾晶体
15.已知Ⅰ:;
Ⅱ.。下列推断不正确的是( )
A.可与盐酸发生反应:
B.任何条件下,都存在氧化性:
C.反应Ⅱ中,当有10.45g生成时转移电子数为
D.已知可由与王水(浓硝酸和浓盐酸的混合物)反应制取,说明不能被硝酸氧化
第Ⅱ卷
三、填空题(本题共5题,共60分。)
16.(12分)有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应水化物溶液(浓度均为)的pH与原子序数的关系如图2所示。
根据上述信息进行判断,并回答下列问题:
(1)元素i位于第五周期且与元素z同族,该元素原子序数为___________,该元素单质及其化合物一个重要的应用是____________________。
(2)比较d、f、g常见离子的半径大小____________(由大到小用离子符号表示)。
(3)由元素x、y、z、d四种元素组成的常见的阴阳离子个数比1:1的化合物与氢氧化钡溶液反应的离子方程式为__________________________________。
(4)下列可作为比较f和e金属性强弱的依据是__________。
a.测两种元素单质的硬度和熔、沸点
b.二者最高价氧化物水化物能相互反应
c.比较单质与同浓度盐酸反应的剧烈程度
d.比较两种元素在化合物中化合价的高低
(5)元素g、h按照原子个数比1:1可组成满足8电子稳定结构的四原子分子,该物质能够遇水剧烈反应,生成沉淀和气体。写出相应的化学方程式_____________________。
(6)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄漏时,消防人员通常采用喷洒溶液的方式处理,以较少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为_________________________。已知eyz含有分子中类似的化学键,写出化合物eyz的电子式_________________________。
17.(12分)白硼钙石的主要成分是(含有少量、FeO、和等杂质),利用白硼钙石制取强还原剂的工艺流程如下:
已知微溶于水,易溶于乙醇;偏硼酸钠()易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
(1)中H的化合价为_________,该物质所含的化学键类型有_________________。
(2)写出“酸浸过滤”中发生的主要化学反应方程式______________________________。
(3)“气体”的主要成分为________________。“滤渣1”的主要成分是___________________。
(4)“操作X”为____________________________。
(5)写出“反应Y”的化学方程式________________________________________。
(6)“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克的还原能力)可用衡量含氢还原剂的还原能力,则的有效氢含量为__________(保留2位有效数字)。
18.(12分)碘元素是人体必需的微量元素之一。某小组设计以下实验从海带中提取碘并测定食盐中碘元素的含量。
Ⅰ.海带提碘
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入__________(填仪器名称)中灼烧至海带完全成灰烬,然后继续进行下列流程。
(2)取海带灰浸取液1~2mL,加入0.5mL稀硫酸、0.5mL5%的溶液,然后再加入0.5mL,振荡后静置,若观察到_________(填实验现象),则证明海带中含有碘元素,上述过程中涉及的离子反应方程式为___________________________。
(3)萃取实验中,若要使碘尽可能地完全转移到中,可采取的操作是______________。
Ⅱ.人体碘的重要来源之一是食用加碘食盐(含)。为测定加碘食盐中的碘含量,学习小组设计如下实验:
①配制1L硫代硫酸钠()标准溶液;
②用天平准确称取wg食盐样品,加适量蒸馏水使其完全溶解;
③用稀硫酸酸化所得溶液,加入足量KI溶液,使与KI反应完全生成;
④向②中混合液逐滴加入浓度为的溶液,恰好反应完全时,消耗溶液6.00mL。(已知:)
已知:易溶于水,具有强还原性。
(4)配制硫代硫酸钠溶液时用分析天平准确称量固体的质量为______g。(保留小数点后2位)
(5)配制前蒸馏水需先煮沸再冷却,其目的是____________________。
(6)下列情况中,导致所配溶液的物质的量浓度偏低的是________.(填标号)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.转移溶液至容量瓶过程中,有少量溶液溅出
C.定容时俯视刻度线读数
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(7)上述实验样品中碘元素的含量为__________mg/kg(用含w的代数式表示)。
19.(10分)三氯化硼()用于制备光导纤维和有机硼化物等,制备原理:。某小组据此设计实验制备并测定其纯度,装置如下图所示。
已知:①的熔点为-107.3℃,沸点为12.5℃,极易水解。
②可用于处理尾气CO。
实验(一):制备。
(1)写出制备氯气的离子方程式________________________
(2)装置A中玻璃管a的作用是________________________。E装置的作用是____________________。
(3)写出发生水解的化学方程式__________________________________。
实验(二):纯度的测定。
(4)准确称取wg产品,置于蒸馏水中,完全水解。用硝酸银进行含量测定,发现消耗mg质量分数为b%硝酸银溶液,则产品的纯度为____________。(用含字母w、b、m的式子表示)
20.(12分)某化学兴趣小组在习题解析中看到:“通入溶液出现白色沉淀,是因为在酸性环境中,将氧化成而产生沉淀”。有同学对这个解析提出了质疑,“因没有隔绝空气,也许只是氧化了,与无关”。于是做了“通入溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。
(1)实验小组发现装置C存在不足,不足之处是_______________________。
(2)为探究硫酸钡产生的原因,分别在装置C中进行以下探究实验。则③④号实验,应该选用的试剂为____________。
编号 ① ② ③ ④
试剂 煮沸过的0.1mol/L溶液50mL,再加入食用油25mL 未煮沸过的0.1mol/L溶液50mL 煮沸过的________溶液50mL,再加入食用油25mL 未煮沸过的__________溶液50mL
(3)进行①③号实验前通入氮气的目的是________________________。
(4)实验现象:①号依然澄清,②③④号均出现浑浊。据此请补充②号实验中装置C中反应生成沉淀的化学方程式__________________________________。
(5)图1~4分别为①②③④号实验所测pH随时间变化曲线。
根据以上数据,可得到的结论是_______________________。
(6)计算实验②500s时产生硫酸钡的质量为__________mg。(可忽略溶于水产生的)
青岛第五十八中学2023-2024学年高一下学期4月阶段性检测
化学答案
一、单选
1.B 2.D 3.B 4.A 5.C 6.D 7.A 8.B 9.D 10.C
二、不定项选择
11.C 12.B 13.C 14.B 15.BC
三、填空题
16.(1)51 半导体
(2)
(3)
(4)BC
(5)
(6)
17.(1) 离子键、共价键
(2)
(3)、
(4)冷却结晶
(5)
(6)0.21
18.(1)坩埚
(2)下层呈紫色
(3)多次萃取
(4)0.32
(5)防止与反应
(6)BD (7)
19.(1)
(2)平衡气压使液体顺利流下,防止F中的水进入D
(3)
(4)
20.(1)没有进行封闭,而直接与大气相通
(2)
(3)防止氧化
(4)
(5)与均可以氧化,但与可一起使氧化更快
(6)1165
同课章节目录
