2024年中考化学复习专题--流程题(含解析)
文档属性
| 名称 | 2024年中考化学复习专题--流程题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 599.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 15:17:15 | ||
图片预览


文档简介
2024年中考化学复习专题--流程题
1.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
回答问题:
(1)反应③的化学方程式为 。该反应的基本类型属于 反应。
(2)反应②的化学方程式为 。
(3)整个生产过程中可循环利用的物质是 (填化学式)。
2.高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿(主要成份MnO2)制备高锰酸钾的流程图。
(1)MnO2、KOH在高温熔融的条件下中通入空气时生成锰酸钾和水,该反应的化学方程式为 。
(2)I、Ⅱ、Ⅲ均为同一操作,其名称是 。
(3)物质A为 ,反应③的基本反应类型是 。
(4)物质B的用途是 (写一种)。
(5)上述流程中可以循环使用的物质有 。
a. MnO2
b. K2CO3
c.CO2
d. K2MnO4
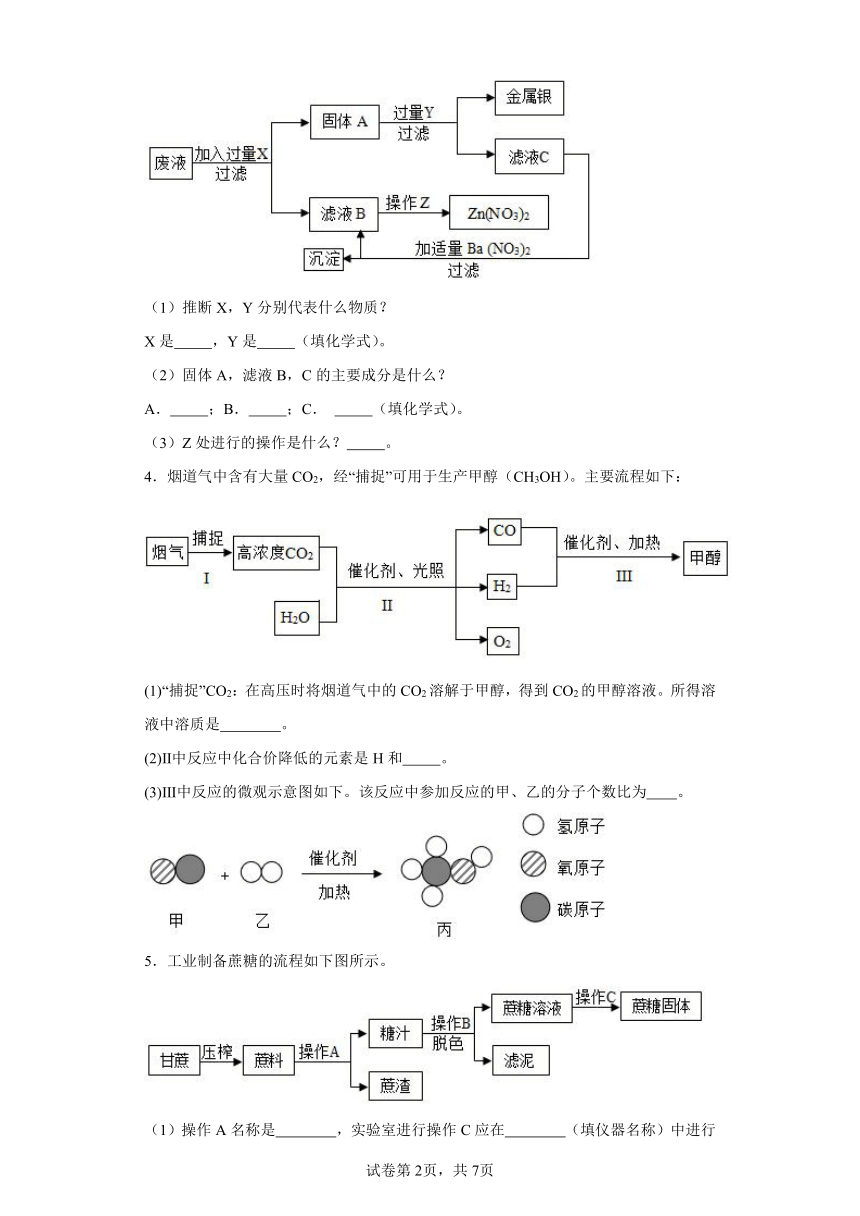
3.某工厂排出的污水主要含Zn(NO3)2和AgNO3,为了从中回收金属Ag和Zn(NO3)2,某中学化学课外活动组设计了以下的实验步骤:
(1)推断X,Y分别代表什么物质?
X是 ,Y是 (填化学式)。
(2)固体A,滤液B,C的主要成分是什么?
A. ;B. ;C. (填化学式)。
(3)Z处进行的操作是什么? 。
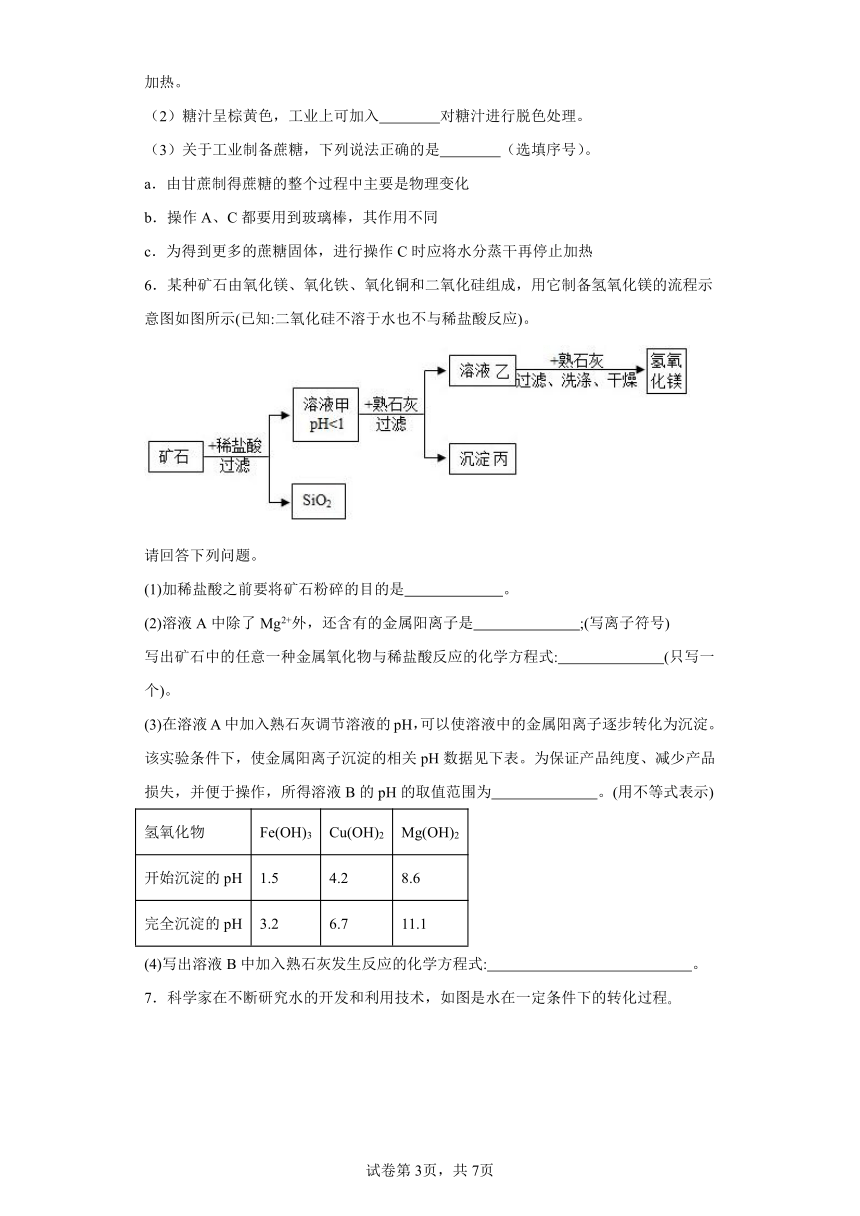
4.烟道气中含有大量CO2,经“捕捉”可用于生产甲醇(CH3OH)。主要流程如下:
(1)“捕捉”CO2:在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液。所得溶液中溶质是 。
(2)Ⅱ中反应中化合价降低的元素是H和 。
(3)Ⅲ中反应的微观示意图如下。该反应中参加反应的甲、乙的分子个数比为 。
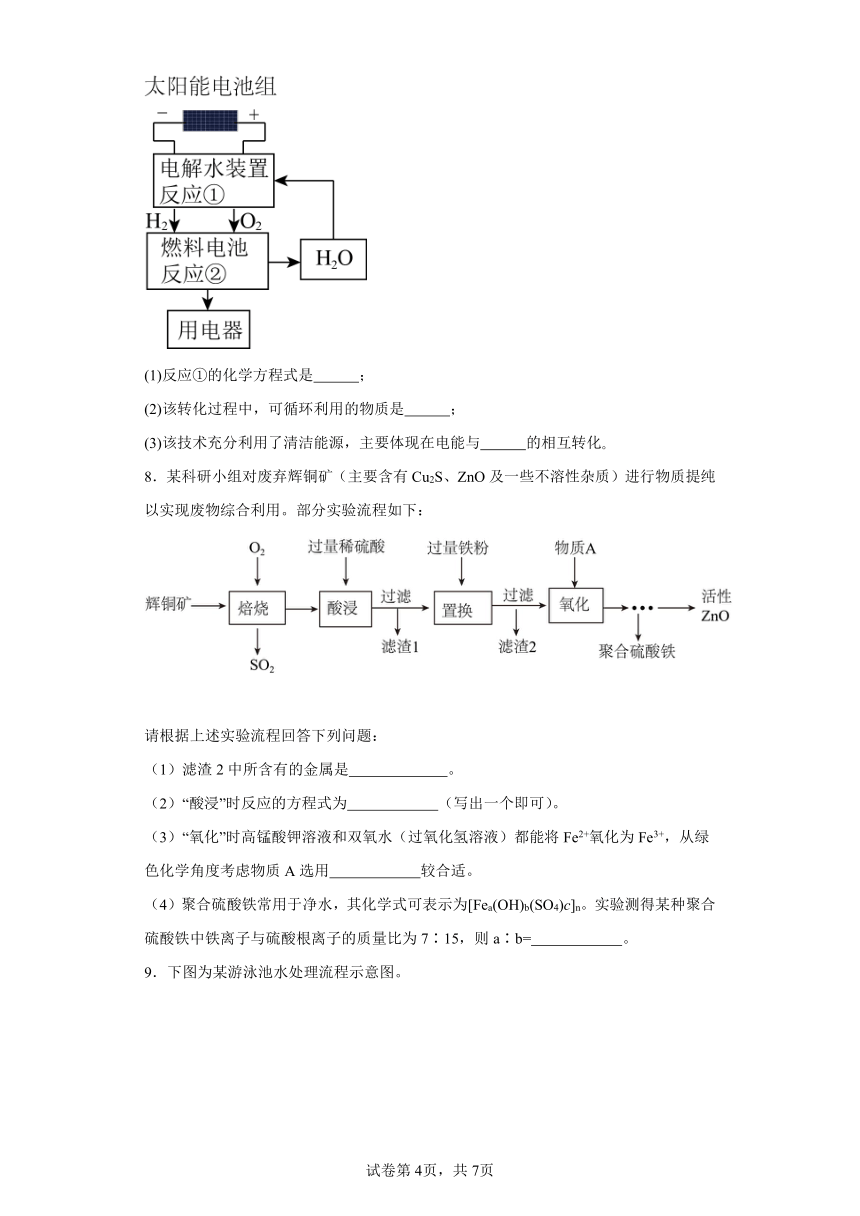
5.工业制备蔗糖的流程如下图所示。
(1)操作A名称是 ,实验室进行操作C应在 (填仪器名称)中进行加热。
(2)糖汁呈棕黄色,工业上可加入 对糖汁进行脱色处理。
(3)关于工业制备蔗糖,下列说法正确的是 (选填序号)。
a.由甘蔗制得蔗糖的整个过程中主要是物理变化
b.操作A、C都要用到玻璃棒,其作用不同
c.为得到更多的蔗糖固体,进行操作C时应将水分蒸干再停止加热
6.某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
请回答下列问题。
(1)加稀盐酸之前要将矿石粉碎的目的是 。
(2)溶液A中除了Mg2+外,还含有的金属阳离子是 ;(写离子符号)
写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式: (只写一个)。
(3)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为 。(用不等式表示)
氢氧化物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀的pH 1.5 4.2 8.6
完全沉淀的pH 3.2 6.7 11.1
(4)写出溶液B中加入熟石灰发生反应的化学方程式: 。
7.科学家在不断研究水的开发和利用技术,如图是水在一定条件下的转化过程
(1)反应①的化学方程式是 ;
(2)该转化过程中,可循环利用的物质是 ;
(3)该技术充分利用了清洁能源,主要体现在电能与 的相互转化
8.某科研小组对废弃辉铜矿(主要含有Cu2S、ZnO及一些不溶性杂质)进行物质提纯以实现废物综合利用。部分实验流程如下:
请根据上述实验流程回答下列问题:
(1)滤渣2中所含有的金属是 。
(2)“酸浸”时反应的方程式为 (写出一个即可)。
(3)“氧化”时高锰酸钾溶液和双氧水(过氧化氢溶液)都能将Fe2+氧化为Fe3+,从绿色化学角度考虑物质A选用 较合适。
(4)聚合硫酸铁常用于净水,其化学式可表示为[Fea(OH)b(SO4)c]n。实验测得某种聚合硫酸铁中铁离子与硫酸根离子的质量比为7∶15,则a∶b= 。
9.下图为某游泳池水处理流程示意图。
(1)添加絮凝剂的作用是 。
(2)砂缸可除去不溶于水的杂质,其原理类似于实验室中的 操作。
(3)消毒剂投放器通臭氧杀菌消毒,这是利用臭氧的 (选填“物理”或“化学”)性质。
(4)取给水口的水样,滴加适量肥皂水,振荡,观察到泡沫多、浮渣少、说明水样属于 (选填“硬水”或“软水”)。
(5)依据以上流程示意图,写出游泳池节约用水的一条措施: 。
10.自来水厂净水过程的主要操作流程如图:
回答下列问题:
(1)试剂A是 填名称;该过程属于 变化(填“物理”或“化学”)。
(2)明矾作絮凝剂是因为溶于水产生胶状物氢氧化铝,氢氧化铝的化学式为 ;最终输送到用户家中的自来水 (填“一定”或“不一定”)是软水。
(3)氯气(Cl2)是水的净化中常用的一种消毒剂,它溶于水时跟水反应生成盐酸(HCl)和次氯酸(HClO),(HClO)氯元素的化合价为
11.“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如下:
(1)膜反应器中发生的是分解反应,X的化学式是 。
(2)流程中可循环利用的物质是 ,主产品除X外,还有 。
(3)反应器中发生反应的化学方程式为 。
12.水是生命之源,万物之本。“生命吸管”将湖水转变为饮用水的过程示意图如图:
注:超滤膜除去细菌和部分病毒
(1)生命吸管中过滤棉的作用是 。
(2)使用活性炭层是利用其 作用,除去水中的一些异味和色素。
(3)“离子交换树脂”发生的反应之一是: NaR+CaCl2→CaR2+NaCl,生成的 CaR2 会附着在生命吸管内,据此分析离子交换树脂的作用是 ;若要检验处理后的水是硬水还是软水,可用 检验。
(4)电解水实验中(如图),常用 检验玻璃管 a 中的气体,电解水反应的符号表达式为: 。
13.高纯碳酸钙广泛应用于精密电子陶瓷、医药等的生产,某兴趣小组按图所示实验步骤,模拟工业流程制备高纯碳酸钙,请回答下列问题。
(1)“酸溶”过程中,将一定浓度的盐酸缓慢加入粉碎后的优质石灰石中,同时搅拌。搅拌的目的是 。
(2)在“酸溶”过程中发生的反应的化学方程式为 。
(3)“操作1”的名称 ,需要用到的玻璃仪器有烧杯、玻璃棒和 。
(4)“操作2”得到的NH4Cl是一种氮肥,计算NH4Cl中的含肥量 (只要求代入数字过程,不必算出答案)。
14.海水中含有丰富的资源,下图是从海水中提取镁的简单流程。
(1)操作①的名称为 。
(2)沉淀B与试剂C发生中和反应,该反应的化学方程式为 。
(3)由无水MgCl2电解制取Mg的化学反应方程式为 。其基本反应类型 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. 分解 NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓ CO2、NH3
【详解】(1)反应③碳酸氢钠受热分解生成了碳酸钠、二氧化碳和水,反应的方程式是:;该反应由一种物质生成了三种物质,属于分解反应;
(2)反应②是饱和食盐水中的氯化钠、水与氨气、二氧化碳反应生成碳酸氢钠沉淀和氯化铵,反应的方程式是:NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓;
(3)通过分析反应原理可知,氨气、二氧化碳既是反应物,也是生成物,所以整个流程中可以循环利用的物质是NH3、CO2。
2. 2MnO2+4KOH+O22K2MnO4+2H2O 过滤 氯化钙 复分解反应 干燥剂 AC
【详解】(1)MnO2、KOH在高温熔融的条件下中通入空气时生成锰酸钾和水,该反应的化学方程式为:2MnO2+4KOH+O22K2MnO4+2H2O;
(2)Ⅰ、Ⅱ、Ⅲ均为同一操作,其名称是过滤,通过过滤把液体和固体分离;
(3)物质A为氯化钙,过程中氯化钙和碳酸钾反应生成碳酸钙沉淀和氯化钾,反应③的基本反应类型是复分解反应;
(4)物质B是氧化钙,氧化钙可以用作干燥剂;
(5)既是反应物又是生成物的物质可以循环利用,上述流程中可以循环使用的物质有二氧化锰和二氧化碳。
3. Zn H2SO4 Ag,Zn Zn(NO3)2 ZnSO4、H2SO4 蒸发结晶
【分析】本题采用逆推法,滤液B变成Zn(NO3)2固体即少了水,可见滤液B为Zn(NO3)2溶液,操作Z是蒸发。又知沉淀,该沉淀中含,沉淀为BaSO4,则C为ZnSO4和过量的稀硫酸。那么固体A内含Zn,Y为H2SO4,且A内还含Ag,废液中AgNO3+X(过量)=A(Ag,Zn)+Zn(NO3)2,则X为Zn。
【详解】(1)X是Zn,Y是H2SO4;
(2)A是Ag,Zn;B是Zn(NO3)2;C是ZnSO4、H2SO4;
(3)Z处进行的操作是蒸发结晶。
4.(1)CO2
(2)C
(3)1:2
【详解】(1)气体溶于液体中,液体是溶剂,气体是溶质。CO2的甲醇溶液中溶质是CO2;
(2)由流程图可知,高浓度CO2和H2O在催化剂和光照的条件下,生成CO、H2和O2,反应前C显+4价,H显+1价,O显-2价;反应后C显+2价,H显0价,O显0价,故Ⅱ中反应中化合价降低的元素是H和C;
(3)由流程图可知,CO和H2在催化剂和加热的条件下生成CH3OH,根据质量守恒定律和反应的微观示意图可推出反应的方程式为,Ⅲ中反应中参加反应的甲、乙的分子个数比为1:2 。
5. 过滤 蒸发皿 活性炭 ab
【详解】(1)经过操作A得到糖汁(液体)和蔗渣(固体),过滤能将液体与固体分离,所以操作A名称是过滤,操作C是蒸发,实验室进行操作C应在蒸发皿中进行加热;
(2)活性炭具有吸附性,能吸附色素和异味,糖汁呈棕黄色,工业上可加入活性炭对糖汁进行脱色处理;
(3)a、根据流程图可知,由甘蔗制得蔗糖的整个过程中没有新物质生成,主要是物理变化,故a正确;b、操作A过滤,要用玻璃棒引流,操作蒸发要用玻璃棒搅拌,使液体均匀受热,所以操作A、C都要用到玻璃棒,其作用不同,故b正确;c、蒸发时出现多量固体应停止加热,利用蒸发皿的余热,使水分全部蒸发,故c错误,故选ab。
6. 增大接触面积,使反应更充分 Fe3+、Cu2+、H+ MgO+2HCl═MgCl2+H2O(或Fe2O3+6HCl═2FeCl3+3H2O或CuO+2HCl═CuCl2+H2O ) 6.7 8.6 MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
【详解】(1)加稀盐酸之前要将矿石粉碎的目的是增大接触面积,使反应跟充分;
(2)溶液A中含有镁离子、铁离子、铜离子和氢离子等4种阳离子,除了Mg2+外,还含有的金属阳离子是Fe3+、Cu2+、H+;稀盐酸和氧化镁反应生成氯化镁和水,和氧化铁反应生成氯化铁和水,和氧化铜反应生成氯化铜和水,反应的化学方程式为:MgO+2HCl═MgCl2+H2O,Fe2O3+6HCl═2FeCl3+3H2O,CuO+2HCl═CuCl2+H2O;
(3)由表中数据可知,溶液pH在6.7时,铁离子和铜离子完全形成沉淀,而镁离子在pH=8.6时开始产生沉淀,因此溶液B的pH可允许的范围为是6.7 8.6;
(4)溶液B中加入熟石灰时,氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,发生的化学反应方程式为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2。
7.(1)
(2)水
(3)化学能
【详解】(1)反应①,即水电解生成氢气和氧气,反应的化学方程式为:;
(2)由流程可知,反应过程中使用了水,最后又生成了水,所以可循环利用的物质是水;
(3)该技术中水电解属于化学变化,主要体现了电能与化学能的相互转化。
8. 铜和铁(或Cu和Fe) 双氧水(或过氧化氢溶液) 2 :1(或2)
【分析】辉铜矿焙烧生成氧化铜和二氧化硫,酸浸稀硫酸和氧化铜生成硫酸铜和水,氧化锌和稀硫酸生成硫酸锌和水,加入过量铁粉,铁和硫酸铜反应生成硫酸亚铁和铜。
【详解】(1)加入过量铁粉,铁和硫酸铜反应生成硫酸亚铁和铜,故滤渣2中所含有的金属是铜和铁(或Cu和Fe)。
(2)“酸浸”时反应是氧化铜和稀硫酸生成硫酸铜和水,故反应的化学方程式为。
(3)“氧化”时高锰酸钾溶液和双氧水(过氧化氢溶液)都能将Fe2+氧化为Fe3+,高锰酸钾被还原生成锰酸钾和二氧化锰,过氧化氢被还原生成水,无污染,故从绿色化学角度考虑物质A选用双氧水(或过氧化氢溶液)较合适。
(4)聚合硫酸铁常用于净水,其化学式可表示为[Fea(OH)b(SO4)c]n。实验测得某种聚合硫酸铁中铁离子与硫酸根离子的质量比为7∶15,则,,化合物中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,,,故a∶b=2 :1(或2)。
9.(1)吸附水中的悬浮杂质,加速其沉降
(2)过滤
(3)化学
(4)软水
(5)溢流出的水处理后循环使用
【详解】(1)净水过程中加入的絮凝剂是明矾,明矾在水中易水解生成氢氧化铝胶体,其可以吸附水中的细小颗粒,使之沉降,达到絮凝的目的。
(2)砂缸可除去不溶于水的杂质,其可以分离液体和固体,其原理类似于实验室中的过滤操作。
(3)通臭氧杀菌消毒,过程中发生了化学变化,这是利用臭氧的化学性质。
(4)向水样中加入适量的肥皂水,振荡,泡沫多无浮渣或浮渣少的是软水,泡沫少浮渣多的是硬水。
(5)从示意图中看到,有溢流口,故可以将溢流出的水处理后循环使用以节约水资源。
10.(1) 活性炭 物理
(2) Al(OH)3 不一定
(3)+1价/正一价
【详解】(1)活性炭具有吸附性,以及过滤可以将不溶性固体从溶液中分离出来,所以试剂A是活性炭,该过程中没有新物质生成,属于物理变化;
(2)氢氧化铝中,铝元素显+3价,氢氧根显-1价,所以氢氧化铝的化学式为Al(OH)3;最终输送到用户家中的自来水中含有矿物质等,不一定是软水;
(3)次氯酸(HClO)中,氧元素显-2价,氢元素显+1价,根据在化合物中正负化合价代数和为零,可得氯元素的化合价为+1价。
11.(1)H2
(2) 碘/I2 硫酸
(3)SO2+2H2O+I2H2SO4+2HI
【详解】(1)膜反应器中发生的是分解反应,即一定条件下碘化氢分解生成碘和氢气,X的化学式是H2;
(2)据图分析可知:流程中可循环利用的物质是碘;主产品是氢气和硫酸;
(3)反应器中二氧化硫、水、碘反应生成硫酸和碘化氢,发生反应的化学方程式为:SO2+2H2O+I2H2SO4+2HI。
12.(1)除去水中的难溶性固体杂质
(2)吸附
(3) 降低水的硬度或软化硬水或除去水中的钙镁离子等 肥皂水
(4) 带火星的木条
【详解】(1)生命吸管中过滤棉的作用是除去水中的难溶性固体杂质;
(2)活性炭具有吸附性,使用活性炭层是利用其吸附作用,除去水中的一些异味和色素;
(3)生成的CaR2会附着在生命吸管内,据此分析离子交换树脂的作用是降低水的硬度或软化硬水或除去水中的钙镁离子等;若要检验处理后的水是硬水还是软水,可用肥皂水检验。,产生较多泡沫的是软水,产生较少泡沫的是硬水;
(4)水通电时,负极产生氢气,正极产生氧气,体积比为2:1,电解水实验中(如图),a管产生的气体较少,为氧气,氧气具有助燃性,常用带火星的木条检验玻璃管a中的气体,水通电分解生成氢气和氧气,该反应的符号表达式为:。
13. 增大反应物之间的接触面积,使反应更充分 过滤 漏斗
【详解】(1)“酸溶”过程中,将一定浓度的盐酸缓慢加入粉碎后的优质石灰石中,同时搅拌。搅拌的目的是增大反应物之间的接触面积,使反应更充分。
(2)在“酸溶”过程中发生的反应为碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳气体,。
(3)“操作1”是分离固液的操作,名称为过滤;需要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(4)NH4Cl是一种氮肥, NH4Cl中的含肥量。
14. 过滤 Mg(OH)2+2HCl=MgCl2+2H2O MgCl2Mg +Cl2↑ 分解反应
【详解】(1)操作①后得到固体和液体,故(1)操作①的名称为过滤;
(2)沉淀B是氢氧化镁,试剂C是稀盐酸,故该反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O
(3)由无水MgCl2电解制取Mg的化学反应方程式为MgCl2Mg +Cl2↑;该反应符合“一变多”的特征,属于分解反应。
答案第1页,共2页
答案第1页,共2页
1.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
回答问题:
(1)反应③的化学方程式为 。该反应的基本类型属于 反应。
(2)反应②的化学方程式为 。
(3)整个生产过程中可循环利用的物质是 (填化学式)。
2.高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿(主要成份MnO2)制备高锰酸钾的流程图。
(1)MnO2、KOH在高温熔融的条件下中通入空气时生成锰酸钾和水,该反应的化学方程式为 。
(2)I、Ⅱ、Ⅲ均为同一操作,其名称是 。
(3)物质A为 ,反应③的基本反应类型是 。
(4)物质B的用途是 (写一种)。
(5)上述流程中可以循环使用的物质有 。
a. MnO2
b. K2CO3
c.CO2
d. K2MnO4
3.某工厂排出的污水主要含Zn(NO3)2和AgNO3,为了从中回收金属Ag和Zn(NO3)2,某中学化学课外活动组设计了以下的实验步骤:
(1)推断X,Y分别代表什么物质?
X是 ,Y是 (填化学式)。
(2)固体A,滤液B,C的主要成分是什么?
A. ;B. ;C. (填化学式)。
(3)Z处进行的操作是什么? 。
4.烟道气中含有大量CO2,经“捕捉”可用于生产甲醇(CH3OH)。主要流程如下:
(1)“捕捉”CO2:在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液。所得溶液中溶质是 。
(2)Ⅱ中反应中化合价降低的元素是H和 。
(3)Ⅲ中反应的微观示意图如下。该反应中参加反应的甲、乙的分子个数比为 。
5.工业制备蔗糖的流程如下图所示。
(1)操作A名称是 ,实验室进行操作C应在 (填仪器名称)中进行加热。
(2)糖汁呈棕黄色,工业上可加入 对糖汁进行脱色处理。
(3)关于工业制备蔗糖,下列说法正确的是 (选填序号)。
a.由甘蔗制得蔗糖的整个过程中主要是物理变化
b.操作A、C都要用到玻璃棒,其作用不同
c.为得到更多的蔗糖固体,进行操作C时应将水分蒸干再停止加热
6.某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
请回答下列问题。
(1)加稀盐酸之前要将矿石粉碎的目的是 。
(2)溶液A中除了Mg2+外,还含有的金属阳离子是 ;(写离子符号)
写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式: (只写一个)。
(3)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为 。(用不等式表示)
氢氧化物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀的pH 1.5 4.2 8.6
完全沉淀的pH 3.2 6.7 11.1
(4)写出溶液B中加入熟石灰发生反应的化学方程式: 。
7.科学家在不断研究水的开发和利用技术,如图是水在一定条件下的转化过程
(1)反应①的化学方程式是 ;
(2)该转化过程中,可循环利用的物质是 ;
(3)该技术充分利用了清洁能源,主要体现在电能与 的相互转化
8.某科研小组对废弃辉铜矿(主要含有Cu2S、ZnO及一些不溶性杂质)进行物质提纯以实现废物综合利用。部分实验流程如下:
请根据上述实验流程回答下列问题:
(1)滤渣2中所含有的金属是 。
(2)“酸浸”时反应的方程式为 (写出一个即可)。
(3)“氧化”时高锰酸钾溶液和双氧水(过氧化氢溶液)都能将Fe2+氧化为Fe3+,从绿色化学角度考虑物质A选用 较合适。
(4)聚合硫酸铁常用于净水,其化学式可表示为[Fea(OH)b(SO4)c]n。实验测得某种聚合硫酸铁中铁离子与硫酸根离子的质量比为7∶15,则a∶b= 。
9.下图为某游泳池水处理流程示意图。
(1)添加絮凝剂的作用是 。
(2)砂缸可除去不溶于水的杂质,其原理类似于实验室中的 操作。
(3)消毒剂投放器通臭氧杀菌消毒,这是利用臭氧的 (选填“物理”或“化学”)性质。
(4)取给水口的水样,滴加适量肥皂水,振荡,观察到泡沫多、浮渣少、说明水样属于 (选填“硬水”或“软水”)。
(5)依据以上流程示意图,写出游泳池节约用水的一条措施: 。
10.自来水厂净水过程的主要操作流程如图:
回答下列问题:
(1)试剂A是 填名称;该过程属于 变化(填“物理”或“化学”)。
(2)明矾作絮凝剂是因为溶于水产生胶状物氢氧化铝,氢氧化铝的化学式为 ;最终输送到用户家中的自来水 (填“一定”或“不一定”)是软水。
(3)氯气(Cl2)是水的净化中常用的一种消毒剂,它溶于水时跟水反应生成盐酸(HCl)和次氯酸(HClO),(HClO)氯元素的化合价为
11.“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如下:
(1)膜反应器中发生的是分解反应,X的化学式是 。
(2)流程中可循环利用的物质是 ,主产品除X外,还有 。
(3)反应器中发生反应的化学方程式为 。
12.水是生命之源,万物之本。“生命吸管”将湖水转变为饮用水的过程示意图如图:
注:超滤膜除去细菌和部分病毒
(1)生命吸管中过滤棉的作用是 。
(2)使用活性炭层是利用其 作用,除去水中的一些异味和色素。
(3)“离子交换树脂”发生的反应之一是: NaR+CaCl2→CaR2+NaCl,生成的 CaR2 会附着在生命吸管内,据此分析离子交换树脂的作用是 ;若要检验处理后的水是硬水还是软水,可用 检验。
(4)电解水实验中(如图),常用 检验玻璃管 a 中的气体,电解水反应的符号表达式为: 。
13.高纯碳酸钙广泛应用于精密电子陶瓷、医药等的生产,某兴趣小组按图所示实验步骤,模拟工业流程制备高纯碳酸钙,请回答下列问题。
(1)“酸溶”过程中,将一定浓度的盐酸缓慢加入粉碎后的优质石灰石中,同时搅拌。搅拌的目的是 。
(2)在“酸溶”过程中发生的反应的化学方程式为 。
(3)“操作1”的名称 ,需要用到的玻璃仪器有烧杯、玻璃棒和 。
(4)“操作2”得到的NH4Cl是一种氮肥,计算NH4Cl中的含肥量 (只要求代入数字过程,不必算出答案)。
14.海水中含有丰富的资源,下图是从海水中提取镁的简单流程。
(1)操作①的名称为 。
(2)沉淀B与试剂C发生中和反应,该反应的化学方程式为 。
(3)由无水MgCl2电解制取Mg的化学反应方程式为 。其基本反应类型 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. 分解 NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓ CO2、NH3
【详解】(1)反应③碳酸氢钠受热分解生成了碳酸钠、二氧化碳和水,反应的方程式是:;该反应由一种物质生成了三种物质,属于分解反应;
(2)反应②是饱和食盐水中的氯化钠、水与氨气、二氧化碳反应生成碳酸氢钠沉淀和氯化铵,反应的方程式是:NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓;
(3)通过分析反应原理可知,氨气、二氧化碳既是反应物,也是生成物,所以整个流程中可以循环利用的物质是NH3、CO2。
2. 2MnO2+4KOH+O22K2MnO4+2H2O 过滤 氯化钙 复分解反应 干燥剂 AC
【详解】(1)MnO2、KOH在高温熔融的条件下中通入空气时生成锰酸钾和水,该反应的化学方程式为:2MnO2+4KOH+O22K2MnO4+2H2O;
(2)Ⅰ、Ⅱ、Ⅲ均为同一操作,其名称是过滤,通过过滤把液体和固体分离;
(3)物质A为氯化钙,过程中氯化钙和碳酸钾反应生成碳酸钙沉淀和氯化钾,反应③的基本反应类型是复分解反应;
(4)物质B是氧化钙,氧化钙可以用作干燥剂;
(5)既是反应物又是生成物的物质可以循环利用,上述流程中可以循环使用的物质有二氧化锰和二氧化碳。
3. Zn H2SO4 Ag,Zn Zn(NO3)2 ZnSO4、H2SO4 蒸发结晶
【分析】本题采用逆推法,滤液B变成Zn(NO3)2固体即少了水,可见滤液B为Zn(NO3)2溶液,操作Z是蒸发。又知沉淀,该沉淀中含,沉淀为BaSO4,则C为ZnSO4和过量的稀硫酸。那么固体A内含Zn,Y为H2SO4,且A内还含Ag,废液中AgNO3+X(过量)=A(Ag,Zn)+Zn(NO3)2,则X为Zn。
【详解】(1)X是Zn,Y是H2SO4;
(2)A是Ag,Zn;B是Zn(NO3)2;C是ZnSO4、H2SO4;
(3)Z处进行的操作是蒸发结晶。
4.(1)CO2
(2)C
(3)1:2
【详解】(1)气体溶于液体中,液体是溶剂,气体是溶质。CO2的甲醇溶液中溶质是CO2;
(2)由流程图可知,高浓度CO2和H2O在催化剂和光照的条件下,生成CO、H2和O2,反应前C显+4价,H显+1价,O显-2价;反应后C显+2价,H显0价,O显0价,故Ⅱ中反应中化合价降低的元素是H和C;
(3)由流程图可知,CO和H2在催化剂和加热的条件下生成CH3OH,根据质量守恒定律和反应的微观示意图可推出反应的方程式为,Ⅲ中反应中参加反应的甲、乙的分子个数比为1:2 。
5. 过滤 蒸发皿 活性炭 ab
【详解】(1)经过操作A得到糖汁(液体)和蔗渣(固体),过滤能将液体与固体分离,所以操作A名称是过滤,操作C是蒸发,实验室进行操作C应在蒸发皿中进行加热;
(2)活性炭具有吸附性,能吸附色素和异味,糖汁呈棕黄色,工业上可加入活性炭对糖汁进行脱色处理;
(3)a、根据流程图可知,由甘蔗制得蔗糖的整个过程中没有新物质生成,主要是物理变化,故a正确;b、操作A过滤,要用玻璃棒引流,操作蒸发要用玻璃棒搅拌,使液体均匀受热,所以操作A、C都要用到玻璃棒,其作用不同,故b正确;c、蒸发时出现多量固体应停止加热,利用蒸发皿的余热,使水分全部蒸发,故c错误,故选ab。
6. 增大接触面积,使反应更充分 Fe3+、Cu2+、H+ MgO+2HCl═MgCl2+H2O(或Fe2O3+6HCl═2FeCl3+3H2O或CuO+2HCl═CuCl2+H2O ) 6.7 8.6 MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
【详解】(1)加稀盐酸之前要将矿石粉碎的目的是增大接触面积,使反应跟充分;
(2)溶液A中含有镁离子、铁离子、铜离子和氢离子等4种阳离子,除了Mg2+外,还含有的金属阳离子是Fe3+、Cu2+、H+;稀盐酸和氧化镁反应生成氯化镁和水,和氧化铁反应生成氯化铁和水,和氧化铜反应生成氯化铜和水,反应的化学方程式为:MgO+2HCl═MgCl2+H2O,Fe2O3+6HCl═2FeCl3+3H2O,CuO+2HCl═CuCl2+H2O;
(3)由表中数据可知,溶液pH在6.7时,铁离子和铜离子完全形成沉淀,而镁离子在pH=8.6时开始产生沉淀,因此溶液B的pH可允许的范围为是6.7 8.6;
(4)溶液B中加入熟石灰时,氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,发生的化学反应方程式为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2。
7.(1)
(2)水
(3)化学能
【详解】(1)反应①,即水电解生成氢气和氧气,反应的化学方程式为:;
(2)由流程可知,反应过程中使用了水,最后又生成了水,所以可循环利用的物质是水;
(3)该技术中水电解属于化学变化,主要体现了电能与化学能的相互转化。
8. 铜和铁(或Cu和Fe) 双氧水(或过氧化氢溶液) 2 :1(或2)
【分析】辉铜矿焙烧生成氧化铜和二氧化硫,酸浸稀硫酸和氧化铜生成硫酸铜和水,氧化锌和稀硫酸生成硫酸锌和水,加入过量铁粉,铁和硫酸铜反应生成硫酸亚铁和铜。
【详解】(1)加入过量铁粉,铁和硫酸铜反应生成硫酸亚铁和铜,故滤渣2中所含有的金属是铜和铁(或Cu和Fe)。
(2)“酸浸”时反应是氧化铜和稀硫酸生成硫酸铜和水,故反应的化学方程式为。
(3)“氧化”时高锰酸钾溶液和双氧水(过氧化氢溶液)都能将Fe2+氧化为Fe3+,高锰酸钾被还原生成锰酸钾和二氧化锰,过氧化氢被还原生成水,无污染,故从绿色化学角度考虑物质A选用双氧水(或过氧化氢溶液)较合适。
(4)聚合硫酸铁常用于净水,其化学式可表示为[Fea(OH)b(SO4)c]n。实验测得某种聚合硫酸铁中铁离子与硫酸根离子的质量比为7∶15,则,,化合物中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,,,故a∶b=2 :1(或2)。
9.(1)吸附水中的悬浮杂质,加速其沉降
(2)过滤
(3)化学
(4)软水
(5)溢流出的水处理后循环使用
【详解】(1)净水过程中加入的絮凝剂是明矾,明矾在水中易水解生成氢氧化铝胶体,其可以吸附水中的细小颗粒,使之沉降,达到絮凝的目的。
(2)砂缸可除去不溶于水的杂质,其可以分离液体和固体,其原理类似于实验室中的过滤操作。
(3)通臭氧杀菌消毒,过程中发生了化学变化,这是利用臭氧的化学性质。
(4)向水样中加入适量的肥皂水,振荡,泡沫多无浮渣或浮渣少的是软水,泡沫少浮渣多的是硬水。
(5)从示意图中看到,有溢流口,故可以将溢流出的水处理后循环使用以节约水资源。
10.(1) 活性炭 物理
(2) Al(OH)3 不一定
(3)+1价/正一价
【详解】(1)活性炭具有吸附性,以及过滤可以将不溶性固体从溶液中分离出来,所以试剂A是活性炭,该过程中没有新物质生成,属于物理变化;
(2)氢氧化铝中,铝元素显+3价,氢氧根显-1价,所以氢氧化铝的化学式为Al(OH)3;最终输送到用户家中的自来水中含有矿物质等,不一定是软水;
(3)次氯酸(HClO)中,氧元素显-2价,氢元素显+1价,根据在化合物中正负化合价代数和为零,可得氯元素的化合价为+1价。
11.(1)H2
(2) 碘/I2 硫酸
(3)SO2+2H2O+I2H2SO4+2HI
【详解】(1)膜反应器中发生的是分解反应,即一定条件下碘化氢分解生成碘和氢气,X的化学式是H2;
(2)据图分析可知:流程中可循环利用的物质是碘;主产品是氢气和硫酸;
(3)反应器中二氧化硫、水、碘反应生成硫酸和碘化氢,发生反应的化学方程式为:SO2+2H2O+I2H2SO4+2HI。
12.(1)除去水中的难溶性固体杂质
(2)吸附
(3) 降低水的硬度或软化硬水或除去水中的钙镁离子等 肥皂水
(4) 带火星的木条
【详解】(1)生命吸管中过滤棉的作用是除去水中的难溶性固体杂质;
(2)活性炭具有吸附性,使用活性炭层是利用其吸附作用,除去水中的一些异味和色素;
(3)生成的CaR2会附着在生命吸管内,据此分析离子交换树脂的作用是降低水的硬度或软化硬水或除去水中的钙镁离子等;若要检验处理后的水是硬水还是软水,可用肥皂水检验。,产生较多泡沫的是软水,产生较少泡沫的是硬水;
(4)水通电时,负极产生氢气,正极产生氧气,体积比为2:1,电解水实验中(如图),a管产生的气体较少,为氧气,氧气具有助燃性,常用带火星的木条检验玻璃管a中的气体,水通电分解生成氢气和氧气,该反应的符号表达式为:。
13. 增大反应物之间的接触面积,使反应更充分 过滤 漏斗
【详解】(1)“酸溶”过程中,将一定浓度的盐酸缓慢加入粉碎后的优质石灰石中,同时搅拌。搅拌的目的是增大反应物之间的接触面积,使反应更充分。
(2)在“酸溶”过程中发生的反应为碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳气体,。
(3)“操作1”是分离固液的操作,名称为过滤;需要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(4)NH4Cl是一种氮肥, NH4Cl中的含肥量。
14. 过滤 Mg(OH)2+2HCl=MgCl2+2H2O MgCl2Mg +Cl2↑ 分解反应
【详解】(1)操作①后得到固体和液体,故(1)操作①的名称为过滤;
(2)沉淀B是氢氧化镁,试剂C是稀盐酸,故该反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O
(3)由无水MgCl2电解制取Mg的化学反应方程式为MgCl2Mg +Cl2↑;该反应符合“一变多”的特征,属于分解反应。
答案第1页,共2页
答案第1页,共2页
同课章节目录
