8.1自然资源的开发利用 课件(24张PPT)高中化学人教版(2019)必修 第二册
文档属性
| 名称 | 8.1自然资源的开发利用 课件(24张PPT)高中化学人教版(2019)必修 第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 18:42:10 | ||
图片预览






文档简介
(共24张PPT)
自然资源是人类社会发展不可或缺的自然物质基础,包括土地与土壤资源、矿产资源、生物资源、水资源、能源资源、环境资源等,根据其能否再生可以分为可再生资源和不可再生资源。
化学是人类利用自然资源和应对环境问题的重要科学依据,本节我们将以金属矿物、海水资源和化石燃料的综合利用为例,认识化学的应用价值,了解与此有关的环境与发展问题。
自然资源的开发利用
铂矿
蓝铜矿
赤铁矿
赤铜矿
铅锌矿
钨矿
铝矿
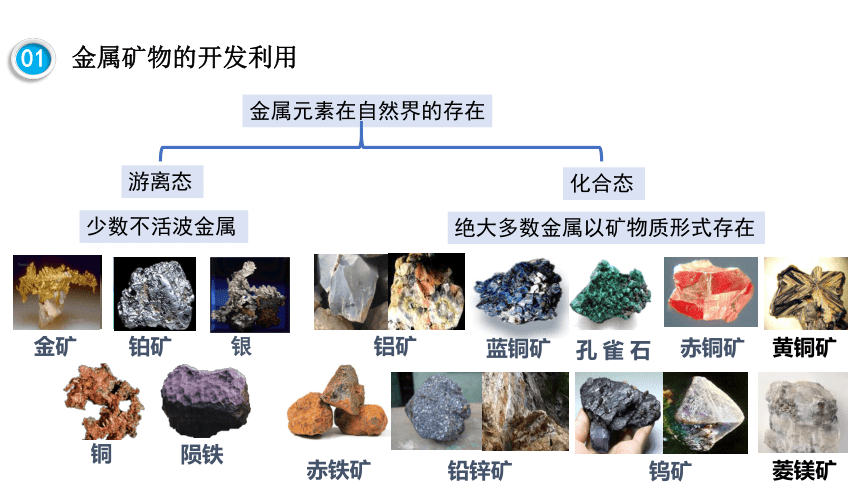
金属元素在自然界的存在
游离态
化合态
少数不活波金属
铜
银
陨铁
金矿
绝大多数金属以矿物质形式存在
孔雀石
铅锌矿
菱镁矿
黄铜矿
01
金属矿物的开发利用
春秋、战国的青铜剑
古代使用的金属有哪些?为什么?
和冶炼金属相关
高压钠灯
铁锅
不锈钢锅
钛合金羽毛球拍
镍合金门锁
除金、铂等极少数金属,绝大多数金属元素以化合态的形式存在于自然界。
【思考】地壳中含量最高和次高的金属元素是什么?
含量最高的是铝,其次是铁。
黄铜矿
金矿
赤铁矿
(CuFeS2)
石器时代先进入青铜器时代,继而进入铁器时代,而铝的利用要比铜和铁晚得多,仅仅是100多年前的事情.所以利用的先后顺序为铜、铁、铝
【回忆】人类使用铝铁铜三种金属的顺序是什么?
【思考】地壳中铝的含量比铁和铜高,但是铝使用的时间却远远晚于铜和铁,这是为什么呢?不同活动性顺序的金属,提取的方法一样吗?
青铜器时代
铁器时代
开发使用铝
(距今100多年前)
(公元前2500年)
(公元前4000年)
Au、Ag、Cu、
Fe、
古代
现代
Al、
Ti
金属越活泼,越难冶炼。
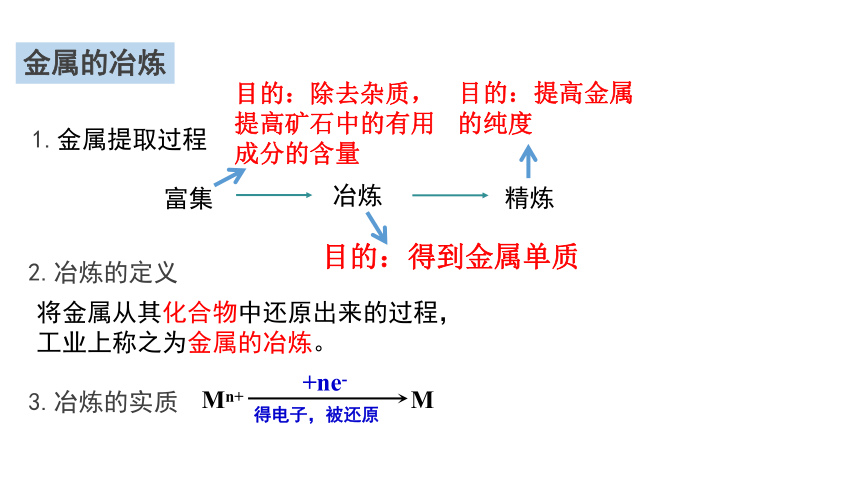
金属的冶炼
将金属从其化合物中还原出来的过程,
工业上称之为金属的冶炼。
2.冶炼的定义
3.冶炼的实质
1.金属提取过程
富集
冶炼
精炼
目的:除去杂质,提高矿石中的有用成分的含量
目的:得到金属单质
目的:提高金属的纯度
Mn+ M
+ne-
得电子,被还原
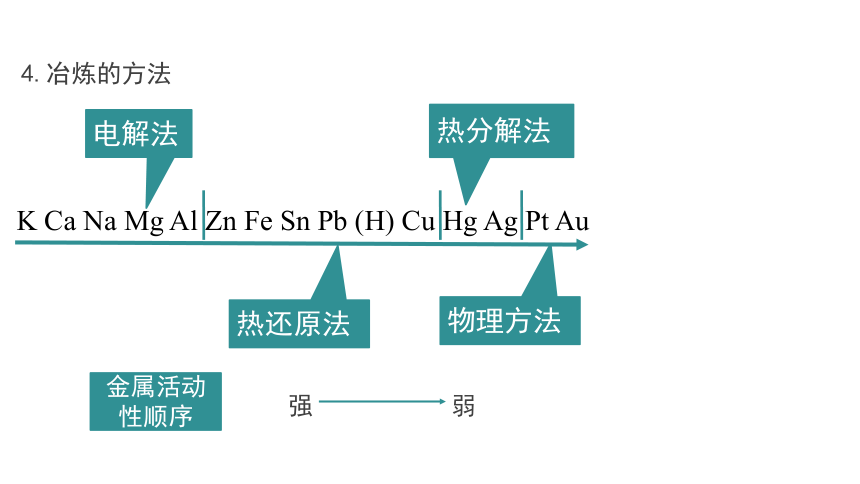
4.冶炼的方法
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
热分解法
物理方法
金属活动性顺序
强 弱
①.物理方法
适用于极不活泼的金属,如Pt、Au
如“沙土淘金”就是利用水冲洗沙子,将沙土冲走,剩下密度很大的金砂,再进一步分离便可得到金属纯金。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
②.热分解法
对一些不活泼金属,可以直接用加热分解的方法将它们从其化合物中还原出来。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
如古代炼丹术士葛洪的《抱朴子》中“丹砂烧之成水银”
HgS ===2Hg + S
2HgO === 2Hg + O2 ↑
2Ag2O === 4Ag + O2 ↑
常见的还有:
③.电解法
适用于一些非常活泼的金属,采用一般的还原剂很难将它们从其化合物中还原出来,工业上常用电解法冶炼。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
MgCl2 (熔融) Mg + Cl2 ↑
电解
2NaCl (熔融) 2Na+Cl2 ↑
电解
2Al2O3 (熔融) 4Al + 3O2 ↑
电解
冰晶石
冰晶石的作用是降低Al2O3的熔化温度
1827年,德国化学家维勒用金属钾制得了铝
1854 年,法国的德维尔用金属钠制得铝
铝的发现史
拿破仑大帝喜欢炫耀自己。每次宴会,餐桌上的用具几乎全是用银制成的,唯有他自己用的那一个碗却是铝制品。为什么贵为法国皇帝用色泽要暗得多的铝碗呢?
电解法
电解法——适用于很活泼的金属(K Ca Na Mg Al )
【思考】已知有关物质的熔沸点数据如下表:
物质 MgO Al2O3 MgCl2 AlCl3
熔点/℃ 2852 2054 714 190(以分子形式存在)
沸点/℃ 3600 2980 1412 180
参考上述数据回答问题:
(1)工业上为什么常用电解熔融MgCl2的方法生产金属镁,而不用电解MgO的方法生产镁?
(2)工业上为什么常用电解Al2O3冰晶石熔融混合物的方法生产金属铝,而不用电解AlCl3的方法生产铝?
因为MgO的熔点远高于MgCl2,所以电解熔融
的MgO需要更多的能量,更高的温度,成本更高 。
从表中可以发现,AlCl3的熔点很低,且沸点比熔点低,易升华; 熔融时不存在离子,不能导电,故不能被电解。
④.热还原法
大部分金属的冶炼都是通过在高温下发生的氧化还原反应完成的。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
常见的还原剂:CO、H2、C(焦炭)、活泼金属(如铝热反应)
Fe2O3+3CO === 2Fe + 3CO2
高温
CuO+H2 === Cu + H2O
高温
Fe2O3+3CO === 2Fe + 3CO2
高温
CuO+H2 === Cu + H2O
高温
热还原法:常用的还原剂有:CO、H2、C(焦炭)、活泼金属
热还原法
热还原法
Fe2O3+2Al 2Fe + Al2O3
高温
铝热法:用金属铝做还原剂冶炼活泼性不如铝且“高熔点”的金属(Fe、V、Cr、Mn等)
应用:①冶炼熔点较高的金属,如铬、锰、钨、钒等
②金属焊接,如焊接钢轨。
铝热反应
现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中
Fe2O3+2Al 2Fe + Al2O3
高温
【思考】
1、铝热反应需要高温条件,是否还需要持续加热?
2、实验中,镁条、氯酸钾的作用是什么
3、蒸发皿中铺少量细沙的作用是什么?
铝热剂
02
海水资源的开发利用
海洋约占地球表面积的71%。海洋中水的储量约为1.3×1018吨,约占地球上总水量的97%。
从太空观察地球,会看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中。
由于与岩石、大气和生物的相互作用,海水中溶解
和悬浮着大量的无机物和有机物。海水中主要含有H、O
元素,还含有丰富的Cl、Na、Mg、S、Ca、K、Br、C、Sr、
B、F等多种元素。
海水资源
化学资源
水资源
新型能源
思路二
分离出盐分
1. 海水资源的特点
广阔性
多样性
分散性
电渗析法
离子交换法
反渗析法
2. 利用途径及海水淡化方法
海水淡化
思路一
提取出淡水
海水循环冷却
海水水资源的利用
蒸馏法
历史最久
电渗析法
离子交换法
蒸馏法
海水
晒盐
粗盐
提纯
精盐
海水制盐
1. 海水制盐 “煮海为盐”
(1)氯碱工业:
(2)制钠和氯气:
(3)制盐酸:
(4)制漂白剂(84消毒液):
(5)制纯碱:
2NaCl(熔融)=== 2Na + Cl2↑
电解
2NaCl+ 2H2O === H2↑+ Cl2 ↑ +2NaOH
电解
H2+ Cl2 === 2HCl
点燃
2NaOH+Cl2===NaClO+NaCl+H2O
2NaHCO3 ===Na2CO3+CO2↑+H2O
△
(饱和食盐水)
2. 海水提溴
(1) 海水提溴的方法(吹出法)
根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出氧化和吸收环节主要反应的离子方程式。
②2Br- + Cl2═ Br2+ 2Cl-
④2H2O+SO2+Br2═H2SO4+2HBr
⑤2Br-+Cl2═ Br2+2Cl-
3、海水资源的其他利用
(1)从海水中提取铀和重水,用于核能开发。
(2)开发潮汐能、波浪能等新型能源。
自然资源是人类社会发展不可或缺的自然物质基础,包括土地与土壤资源、矿产资源、生物资源、水资源、能源资源、环境资源等,根据其能否再生可以分为可再生资源和不可再生资源。
化学是人类利用自然资源和应对环境问题的重要科学依据,本节我们将以金属矿物、海水资源和化石燃料的综合利用为例,认识化学的应用价值,了解与此有关的环境与发展问题。
自然资源的开发利用
铂矿
蓝铜矿
赤铁矿
赤铜矿
铅锌矿
钨矿
铝矿
金属元素在自然界的存在
游离态
化合态
少数不活波金属
铜
银
陨铁
金矿
绝大多数金属以矿物质形式存在
孔雀石
铅锌矿
菱镁矿
黄铜矿
01
金属矿物的开发利用
春秋、战国的青铜剑
古代使用的金属有哪些?为什么?
和冶炼金属相关
高压钠灯
铁锅
不锈钢锅
钛合金羽毛球拍
镍合金门锁
除金、铂等极少数金属,绝大多数金属元素以化合态的形式存在于自然界。
【思考】地壳中含量最高和次高的金属元素是什么?
含量最高的是铝,其次是铁。
黄铜矿
金矿
赤铁矿
(CuFeS2)
石器时代先进入青铜器时代,继而进入铁器时代,而铝的利用要比铜和铁晚得多,仅仅是100多年前的事情.所以利用的先后顺序为铜、铁、铝
【回忆】人类使用铝铁铜三种金属的顺序是什么?
【思考】地壳中铝的含量比铁和铜高,但是铝使用的时间却远远晚于铜和铁,这是为什么呢?不同活动性顺序的金属,提取的方法一样吗?
青铜器时代
铁器时代
开发使用铝
(距今100多年前)
(公元前2500年)
(公元前4000年)
Au、Ag、Cu、
Fe、
古代
现代
Al、
Ti
金属越活泼,越难冶炼。
金属的冶炼
将金属从其化合物中还原出来的过程,
工业上称之为金属的冶炼。
2.冶炼的定义
3.冶炼的实质
1.金属提取过程
富集
冶炼
精炼
目的:除去杂质,提高矿石中的有用成分的含量
目的:得到金属单质
目的:提高金属的纯度
Mn+ M
+ne-
得电子,被还原
4.冶炼的方法
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
热分解法
物理方法
金属活动性顺序
强 弱
①.物理方法
适用于极不活泼的金属,如Pt、Au
如“沙土淘金”就是利用水冲洗沙子,将沙土冲走,剩下密度很大的金砂,再进一步分离便可得到金属纯金。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
②.热分解法
对一些不活泼金属,可以直接用加热分解的方法将它们从其化合物中还原出来。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
如古代炼丹术士葛洪的《抱朴子》中“丹砂烧之成水银”
HgS ===2Hg + S
2HgO === 2Hg + O2 ↑
2Ag2O === 4Ag + O2 ↑
常见的还有:
③.电解法
适用于一些非常活泼的金属,采用一般的还原剂很难将它们从其化合物中还原出来,工业上常用电解法冶炼。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
MgCl2 (熔融) Mg + Cl2 ↑
电解
2NaCl (熔融) 2Na+Cl2 ↑
电解
2Al2O3 (熔融) 4Al + 3O2 ↑
电解
冰晶石
冰晶石的作用是降低Al2O3的熔化温度
1827年,德国化学家维勒用金属钾制得了铝
1854 年,法国的德维尔用金属钠制得铝
铝的发现史
拿破仑大帝喜欢炫耀自己。每次宴会,餐桌上的用具几乎全是用银制成的,唯有他自己用的那一个碗却是铝制品。为什么贵为法国皇帝用色泽要暗得多的铝碗呢?
电解法
电解法——适用于很活泼的金属(K Ca Na Mg Al )
【思考】已知有关物质的熔沸点数据如下表:
物质 MgO Al2O3 MgCl2 AlCl3
熔点/℃ 2852 2054 714 190(以分子形式存在)
沸点/℃ 3600 2980 1412 180
参考上述数据回答问题:
(1)工业上为什么常用电解熔融MgCl2的方法生产金属镁,而不用电解MgO的方法生产镁?
(2)工业上为什么常用电解Al2O3冰晶石熔融混合物的方法生产金属铝,而不用电解AlCl3的方法生产铝?
因为MgO的熔点远高于MgCl2,所以电解熔融
的MgO需要更多的能量,更高的温度,成本更高 。
从表中可以发现,AlCl3的熔点很低,且沸点比熔点低,易升华; 熔融时不存在离子,不能导电,故不能被电解。
④.热还原法
大部分金属的冶炼都是通过在高温下发生的氧化还原反应完成的。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
常见的还原剂:CO、H2、C(焦炭)、活泼金属(如铝热反应)
Fe2O3+3CO === 2Fe + 3CO2
高温
CuO+H2 === Cu + H2O
高温
Fe2O3+3CO === 2Fe + 3CO2
高温
CuO+H2 === Cu + H2O
高温
热还原法:常用的还原剂有:CO、H2、C(焦炭)、活泼金属
热还原法
热还原法
Fe2O3+2Al 2Fe + Al2O3
高温
铝热法:用金属铝做还原剂冶炼活泼性不如铝且“高熔点”的金属(Fe、V、Cr、Mn等)
应用:①冶炼熔点较高的金属,如铬、锰、钨、钒等
②金属焊接,如焊接钢轨。
铝热反应
现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中
Fe2O3+2Al 2Fe + Al2O3
高温
【思考】
1、铝热反应需要高温条件,是否还需要持续加热?
2、实验中,镁条、氯酸钾的作用是什么
3、蒸发皿中铺少量细沙的作用是什么?
铝热剂
02
海水资源的开发利用
海洋约占地球表面积的71%。海洋中水的储量约为1.3×1018吨,约占地球上总水量的97%。
从太空观察地球,会看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中。
由于与岩石、大气和生物的相互作用,海水中溶解
和悬浮着大量的无机物和有机物。海水中主要含有H、O
元素,还含有丰富的Cl、Na、Mg、S、Ca、K、Br、C、Sr、
B、F等多种元素。
海水资源
化学资源
水资源
新型能源
思路二
分离出盐分
1. 海水资源的特点
广阔性
多样性
分散性
电渗析法
离子交换法
反渗析法
2. 利用途径及海水淡化方法
海水淡化
思路一
提取出淡水
海水循环冷却
海水水资源的利用
蒸馏法
历史最久
电渗析法
离子交换法
蒸馏法
海水
晒盐
粗盐
提纯
精盐
海水制盐
1. 海水制盐 “煮海为盐”
(1)氯碱工业:
(2)制钠和氯气:
(3)制盐酸:
(4)制漂白剂(84消毒液):
(5)制纯碱:
2NaCl(熔融)=== 2Na + Cl2↑
电解
2NaCl+ 2H2O === H2↑+ Cl2 ↑ +2NaOH
电解
H2+ Cl2 === 2HCl
点燃
2NaOH+Cl2===NaClO+NaCl+H2O
2NaHCO3 ===Na2CO3+CO2↑+H2O
△
(饱和食盐水)
2. 海水提溴
(1) 海水提溴的方法(吹出法)
根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出氧化和吸收环节主要反应的离子方程式。
②2Br- + Cl2═ Br2+ 2Cl-
④2H2O+SO2+Br2═H2SO4+2HBr
⑤2Br-+Cl2═ Br2+2Cl-
3、海水资源的其他利用
(1)从海水中提取铀和重水,用于核能开发。
(2)开发潮汐能、波浪能等新型能源。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
