第二节 研究有机化合物的一般方法 课件(15张PPT)
文档属性
| 名称 | 第二节 研究有机化合物的一般方法 课件(15张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 966.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 18:47:25 | ||
图片预览





文档简介
(共15张PPT)
确定有机物分子的实验式
思考与交流:
得到纯净的有机物后,如何确定它的分子式?
一般先要进行定性分析与定量分析。
任务一:元素的定性分析与定量分析
1.元素定性分析——确定有机物的元素组成
2.元素定量分析——确定有机物的实验式
通过无机物的质量推算出该有机物所含各元素的质量分数,然后计算出该有机物分子内各元素原子的 ,确定其____________ (也称 )。
最简整数比
实验式
最简式
一般是将一定量的有机物燃烧,转化为简单的无机物。
任务二:李比希和他的元素分析仪
有机化合物的元素定量分析最早由德国化学家
李比希提出。李比希他创立了有机化学,因此被称为“有机化学之父”。他创建了元素分析仪,用CuO作氧化剂,将仅含C、H、0元素的有机化合物氧化,对有机化合物元素进行定量分析。
(J·von Liebig,1803—1873)
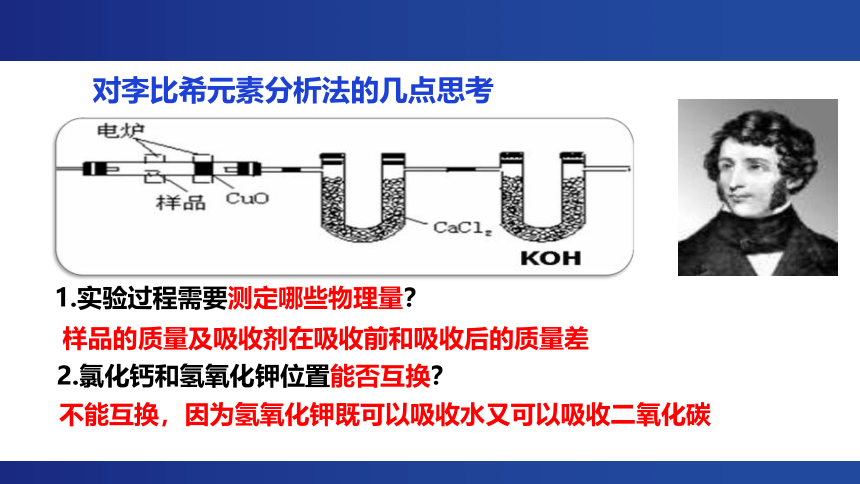
对李比希元素分析法的几点思考
1.实验过程需要测定哪些物理量?
样品的质量及吸收剂在吸收前和吸收后的质量差
2.氯化钙和氢氧化钾位置能否互换?
不能互换,因为氢氧化钾既可以吸收水又可以吸收二氧化碳
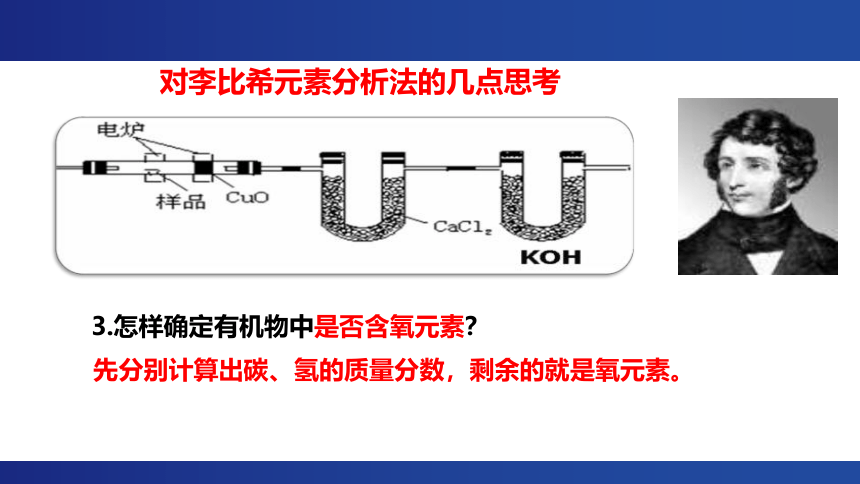
对李比希元素分析法的几点思考
3.怎样确定有机物中是否含氧元素?
先分别计算出碳、氢的质量分数,剩余的就是氧元素。
4.你觉得该装置有需要改进的地方吗?
对李比希元素分析法的几点思考
a.在吸收剂之间加一个检验水是否吸收完全的装置
b.在最后再加一个装有碱石灰的干燥管防止空气中的二氧化碳
和水进入。
c.……
李比希不仅建立了可以定量测定碳、氢 、氧元素的分析方法,还建立了有机化合物中含氮、硫、卤素等元素的定量分析方法,为现代元素定量分析奠定了基础。
任务二:李比希和他的元素分析仪
图1-13 现代元素分析仪
取一定量仅含C、H、O的有机物
加CuO
O2或
CO2
H2O
测得前后的质量差
用无水CaCl2
吸收
用KOH浓溶液或碱石灰吸收
计算C、H原子质量分数
剩余的为O原子的质量分数
测得前后的质量差
任务二:李比希和他的元素分析仪
计算可得出有机物的实验式
任务三:典型例题确定有机物的实验式
【例题1】含C、H、O三元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.2%,氢的质量分数为13.1%。试求该未知物A的实验式。
(2)计算该有机化合物分子内各元素原子的个数比:
(1)计算该有机化合物中氧元素的质量分数:
ω(O)=100%-52.2%-13.1%=34.7%
N(C):N(H):N(O)=
52.2%
12.01
13.1%
1.008
34.7%
16.00
:
:
=2:6:1
该未知物A的实验式为C2H6O。
=4.35:13.1:2.17
【例题2】 某有机化合物的分子中含碳71.58%,氢6.67%,氮4.91%,其余
为氧元素,试求该有机化合物的实验式。
有机化合物中的氧元素的质量分数
ω(O)=100%-71.58%-6.67%-4.91%=16.84%,
=17:19:1:3
该有机化合物的分子式为C17H19NO3。
=5.97:6.67:0.35:1.05
任务三:典型例题确定有机物的实验式
任务四:迁移应用
【例题3】某有机化合物是汽车防冻液的成分之一,经燃烧法元素分析测定,该有机化合物中各元素的质量分数是:碳38.7%,氢9.7%,氧51.6%。求该有机化合物的实验式。
该有机物的实验式为CH3O。
N(C):N(H):N(O)=
38.7%
12
9.7%
1
51.6%
16
:
:
=1:3:1
任务四:迁移应用
【例题4】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。将此9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g,求有机物A的实验式。
该有机物A的实验式为CH2O。
N(C):N(H):N(O)=0.3:0.6:0.3=1:2:1
n(CO2)=
13.2g
44g/mol
=0.3mol
n(H2O)=
5.4g
18g/mol
=0.3mol
n(C)=0.3mol
n(H)=0.6mol
n(O)=(9.0-0.3×12-0.6×1)÷16=0.3mol
确定有机物分子实验式的方法模型
有机化合物
燃烧
简单的无机物
定量测定
计算推算
各元素的质量分数
计算
实验式(最简式)
同学们,再见
确定有机物分子的实验式
思考与交流:
得到纯净的有机物后,如何确定它的分子式?
一般先要进行定性分析与定量分析。
任务一:元素的定性分析与定量分析
1.元素定性分析——确定有机物的元素组成
2.元素定量分析——确定有机物的实验式
通过无机物的质量推算出该有机物所含各元素的质量分数,然后计算出该有机物分子内各元素原子的 ,确定其____________ (也称 )。
最简整数比
实验式
最简式
一般是将一定量的有机物燃烧,转化为简单的无机物。
任务二:李比希和他的元素分析仪
有机化合物的元素定量分析最早由德国化学家
李比希提出。李比希他创立了有机化学,因此被称为“有机化学之父”。他创建了元素分析仪,用CuO作氧化剂,将仅含C、H、0元素的有机化合物氧化,对有机化合物元素进行定量分析。
(J·von Liebig,1803—1873)
对李比希元素分析法的几点思考
1.实验过程需要测定哪些物理量?
样品的质量及吸收剂在吸收前和吸收后的质量差
2.氯化钙和氢氧化钾位置能否互换?
不能互换,因为氢氧化钾既可以吸收水又可以吸收二氧化碳
对李比希元素分析法的几点思考
3.怎样确定有机物中是否含氧元素?
先分别计算出碳、氢的质量分数,剩余的就是氧元素。
4.你觉得该装置有需要改进的地方吗?
对李比希元素分析法的几点思考
a.在吸收剂之间加一个检验水是否吸收完全的装置
b.在最后再加一个装有碱石灰的干燥管防止空气中的二氧化碳
和水进入。
c.……
李比希不仅建立了可以定量测定碳、氢 、氧元素的分析方法,还建立了有机化合物中含氮、硫、卤素等元素的定量分析方法,为现代元素定量分析奠定了基础。
任务二:李比希和他的元素分析仪
图1-13 现代元素分析仪
取一定量仅含C、H、O的有机物
加CuO
O2或
CO2
H2O
测得前后的质量差
用无水CaCl2
吸收
用KOH浓溶液或碱石灰吸收
计算C、H原子质量分数
剩余的为O原子的质量分数
测得前后的质量差
任务二:李比希和他的元素分析仪
计算可得出有机物的实验式
任务三:典型例题确定有机物的实验式
【例题1】含C、H、O三元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.2%,氢的质量分数为13.1%。试求该未知物A的实验式。
(2)计算该有机化合物分子内各元素原子的个数比:
(1)计算该有机化合物中氧元素的质量分数:
ω(O)=100%-52.2%-13.1%=34.7%
N(C):N(H):N(O)=
52.2%
12.01
13.1%
1.008
34.7%
16.00
:
:
=2:6:1
该未知物A的实验式为C2H6O。
=4.35:13.1:2.17
【例题2】 某有机化合物的分子中含碳71.58%,氢6.67%,氮4.91%,其余
为氧元素,试求该有机化合物的实验式。
有机化合物中的氧元素的质量分数
ω(O)=100%-71.58%-6.67%-4.91%=16.84%,
=17:19:1:3
该有机化合物的分子式为C17H19NO3。
=5.97:6.67:0.35:1.05
任务三:典型例题确定有机物的实验式
任务四:迁移应用
【例题3】某有机化合物是汽车防冻液的成分之一,经燃烧法元素分析测定,该有机化合物中各元素的质量分数是:碳38.7%,氢9.7%,氧51.6%。求该有机化合物的实验式。
该有机物的实验式为CH3O。
N(C):N(H):N(O)=
38.7%
12
9.7%
1
51.6%
16
:
:
=1:3:1
任务四:迁移应用
【例题4】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。将此9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g,求有机物A的实验式。
该有机物A的实验式为CH2O。
N(C):N(H):N(O)=0.3:0.6:0.3=1:2:1
n(CO2)=
13.2g
44g/mol
=0.3mol
n(H2O)=
5.4g
18g/mol
=0.3mol
n(C)=0.3mol
n(H)=0.6mol
n(O)=(9.0-0.3×12-0.6×1)÷16=0.3mol
确定有机物分子实验式的方法模型
有机化合物
燃烧
简单的无机物
定量测定
计算推算
各元素的质量分数
计算
实验式(最简式)
同学们,再见
