第四节 羧酸 羧酸衍生物 课件(19张PPT)高中化学人教版(2019)选择性必修3
文档属性
| 名称 | 第四节 羧酸 羧酸衍生物 课件(19张PPT)高中化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 927.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 18:48:57 | ||
图片预览




文档简介
(共19张PPT)
羧酸 羧酸衍生物
【学习任务一】认识羧酸的组成
1、概念:羧酸是由烃基(或氢原子)与羧基相连构成的有机化合物。
2、分类
(阅读教材P71)
烃基不同
CH3COOH
CH2=CHCOOH
C17H35COOH 硬脂酸
C17H33COOH 油酸
C15H31COOH软脂酸
脂肪酸
芳香酸
C6H5COOH
烃基为链状
含苯环
羧基数目
一元羧酸
二元羧酸
多元羧酸
CH3CH2COOH
HOOC-COOH
【学习任务一】认识羧酸的组成
结构特点:既有羧基又有醛基
(蚁酸)
HCOOH
甲酸是最简单的羧酸,是一种无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶。
(1)甲酸
3、几种常见的羧酸
O
H—C—O—H
羧基
醛基
具有醛和羧酸的性质
【学习任务一】认识羧酸的组成
3、几种常见的羧酸
(2)苯甲酸——俗称安息香酸
苯甲酸是一种无色晶体,易升华,微溶于水,易溶于乙醇。苯甲酸可以用于合成香料、药物等,它的钠盐是常用的食品防腐剂。
COOH
【学习任务一】认识羧酸的组成
3、几种常见的羧酸
乙二酸是最简单的二元羧酸,无色晶体,可溶于水和乙醇。通常含有两分子结晶水,是化学分析中常用的还原剂,也是重要的化工原料。例如:乙二酸能够使酸性高猛酸钾褪色。
(3)乙二酸——俗称草酸
请阅读P72资料卡片
【学习任务二】了解羧酸的物理性质
名称 结构简式 熔点/℃ 沸点/℃
甲酸 HCOOH 8 101
乙酸 CH3COOH 17 118
丙酸 CH3CH2COOH -21 141
正丁酸 CH3CH2CH2COOH -5 166
十八酸(硬脂酸) CH3(CH2)16COOH 70 383
苯甲酸 —COOH 122 249
阅读P72第一段及表3-4,总结羧酸的物理性质及其递变规律。
【学习任务二】了解羧酸的物理性质
相对分子质量相当的不同有机物的沸点数据
名称 甲酸 乙醛 乙醇 乙酸 丙醛 正丙醇 丙酸 丁醛 正丁醇
结构简式 HCOOH CH3CHO CH3CH2OH CH3COOH CH3CH2CHO CH3CH2CH2OH CH3CH2COOH CH3(CH2)2CHO CH3(CH2)2CH2OH
相对分子质量 46 44 46 60 58 60 74 72 74
沸点/℃ 101 21 78.4 118 49 97.2 141 76 117.8
结论:羧酸与相对分子质量相近的其他有机物的沸点相比,沸点较高。
思考:为什么与相对分子质量相近的其他有机物的沸点相比:羧酸的沸点较高
R
H
O
C
O
这与分子间可以形成氢键有关。
R
H
O
C
O
…
氢键
R
H
O
C
O
R
H
O
C
O
…
氢键
原因:由于羧酸分子形成氢键的机会比相对分子质量相近的醇的多,
羧酸的沸点比相应的醇的高。
小结: 羧酸的物理性质
随着分子中碳原子数的增加,熔沸点逐渐升高。
羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
水溶性:
甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。
随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。
高级脂肪酸是不溶于水的蜡状固体。
熔沸点:
分析结构,了解断键方式
官能团:羧基
由于受氧原子电负性较大等因素的影响,当羧酸发生化学反应时,羧基结构中的两个部位容易断裂。
①电离出H+,表现酸性
②羟基被取代,生成酯、酰胺等
问题:乙酸中的羧基也含有碳氧双键,能否和氢气发生加成反应?
受羟基的影响:使羰基较难发生加成反应
③难加成
【学习任务三】学习羧酸的化学性质
1、羧酸的酸性
E 、与某些盐反应
A、使紫色石蕊试液变色
B、与活泼金属反应
D、与碱反应
C、与碱性氧化物反应
A、使紫色石蕊试液变色
B、与活泼金属反应
D、与碱反应
C、与碱性氧化物反应
具有酸的通性
【学习任务三】学习羧酸的化学性质
探究 羧酸的酸性
[问题]羧酸的化学性质与乙酸的相似,如何通过实验证明其他羧酸也具有酸性?如何通过比较乙酸、碳酸和苯酚的酸性强弱?
[设计与实验]
(1)设计实验证明羧酸具有酸性(提供的羧酸有甲酸、苯甲酸和乙二酸)。
实验内容 实验现象 结论
分别取少量甲酸、苯甲酸、乙二酸于试管中,加水溶解,再分别滴入几滴石蕊溶液
溶液变红色
甲酸、苯甲酸、乙二酸显酸性
(2)利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,
比较乙酸、碳酸和苯酚的酸性强弱
接口的顺序:
A→D→E→B→C→F→G→H→I→J
酸性:乙酸 > 碳酸 > 苯酚
【讨论】
经过实验测定,向苯酚钠溶液中通入少量二氧化碳,最终溶液中产生了碳酸氢钠,而没有碳酸钠的产生。根据上述提示,请写出各装置中发生反应的化学方程式。
相关的反应:
NaHCO3+CH3COOH=CH3COONa+CO2↑+H2O
Na2CO3+2CH3COOH→2CH3COONa+CO2↑+H2O
ONa
OH
+ CO2 + H2O
+NaHCO3
酸性:乙酸>碳酸>苯酚> HCO3-
结论:
2.酯化反应
CH3COOH+C2H5 OH CH3COOC2H5 +H2O
浓硫酸
△
碎瓷片(防止暴沸), 乙醇3mL,浓硫酸2mL ,乙酸2mL,饱和的Na2CO3溶液
⑴反应后右侧的试管有什么现象
饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。
实验试剂:
问题思考:
催化剂,吸水剂
(2)浓硫酸的作用是什么?
不纯净;乙酸、乙醇
(3)得到的反应产物是否纯净?主要杂质有哪些?
问题思考:
① 中和乙酸
② 溶解乙醇
③ 降低酯在水中的溶解度,便于分层
防止发生倒吸
(4)饱和Na2CO3溶液有什么作用?
(5)为什么导管不插入饱和Na2CO3溶液中?
2.酯化反应
CH3COOH+C2H5 OH CH3COOC2H5 +H2O
浓硫酸
△
碎瓷片(防止暴沸), 乙醇3mL,浓硫酸2mL ,乙酸2mL,饱和的Na2CO3溶液
实验试剂:
同位素示踪法:
18
18
18
18
乙醇中的氧用18O进行标记,通过探测仪器追踪18O在何种产物中(位置、数量)。
酯化反应断键实质:酸脱羟基醇脱氢
P74
P74【思考与讨论】在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?请结合化学反应原理的有关知识进行说明。
CH3COOH+C2H5 OH CH3COOC2H5 +H2O
浓硫酸
△
研究对象:
采取措施:
①加热,蒸出乙酸乙酯,平衡正向移动,提高产率。
②利用浓硫酸吸收生成的水,平衡正向移动,提高产率。
③适当增大乙醇的用量(乙醇沸点比乙酸低,更易挥发),
平衡正向移动,可以提高乙酸的转化率,从而提高产率。
减小生成物浓度
增大反应物浓度:
“醇、醛、酸、酯”的相互转化模型
R—O—H
醇
O
—C—H
=
醛
氧化(O2)
还原(H2)
O
—C—O—H
=
羧酸
(O2、酸性KMnO4溶液、溴水、
新制Cu(OH)2、Ag(NH3)2OH )
氧化
O
—C—O-
=
酸性
酯化反应
O
—C—O—R
=
酯
小结:
羧酸 羧酸衍生物
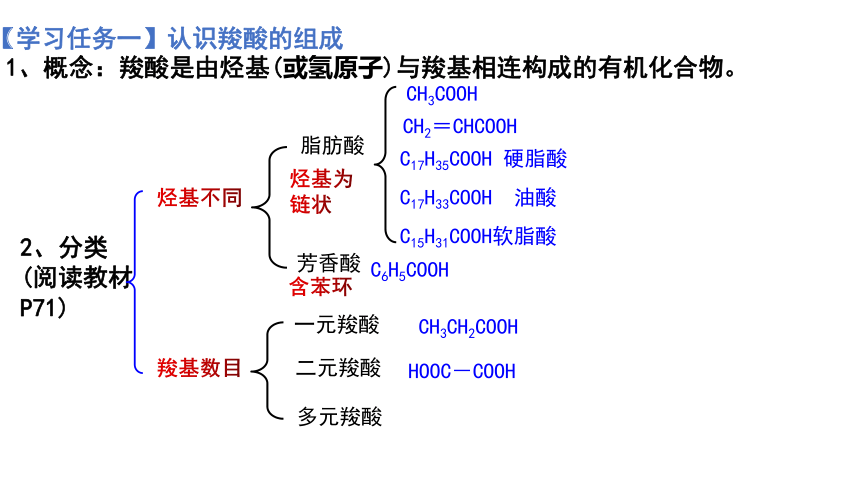
【学习任务一】认识羧酸的组成
1、概念:羧酸是由烃基(或氢原子)与羧基相连构成的有机化合物。
2、分类
(阅读教材P71)
烃基不同
CH3COOH
CH2=CHCOOH
C17H35COOH 硬脂酸
C17H33COOH 油酸
C15H31COOH软脂酸
脂肪酸
芳香酸
C6H5COOH
烃基为链状
含苯环
羧基数目
一元羧酸
二元羧酸
多元羧酸
CH3CH2COOH
HOOC-COOH
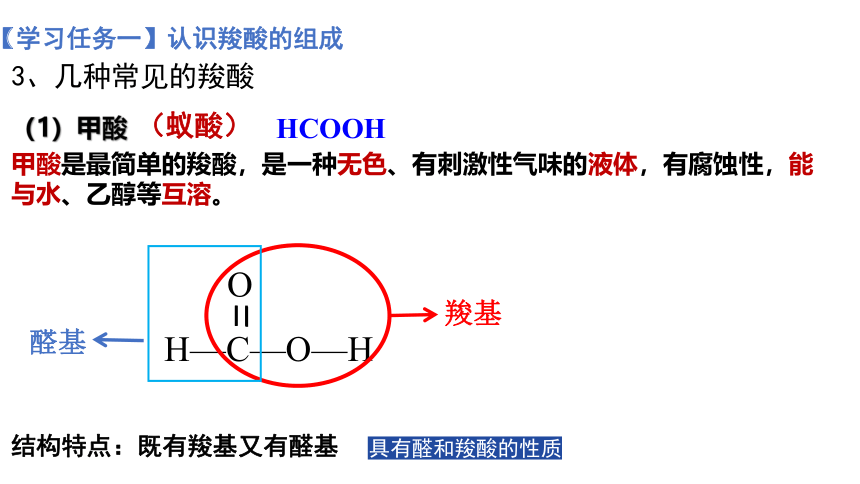
【学习任务一】认识羧酸的组成
结构特点:既有羧基又有醛基
(蚁酸)
HCOOH
甲酸是最简单的羧酸,是一种无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶。
(1)甲酸
3、几种常见的羧酸
O
H—C—O—H
羧基
醛基
具有醛和羧酸的性质
【学习任务一】认识羧酸的组成
3、几种常见的羧酸
(2)苯甲酸——俗称安息香酸
苯甲酸是一种无色晶体,易升华,微溶于水,易溶于乙醇。苯甲酸可以用于合成香料、药物等,它的钠盐是常用的食品防腐剂。
COOH
【学习任务一】认识羧酸的组成
3、几种常见的羧酸
乙二酸是最简单的二元羧酸,无色晶体,可溶于水和乙醇。通常含有两分子结晶水,是化学分析中常用的还原剂,也是重要的化工原料。例如:乙二酸能够使酸性高猛酸钾褪色。
(3)乙二酸——俗称草酸
请阅读P72资料卡片
【学习任务二】了解羧酸的物理性质
名称 结构简式 熔点/℃ 沸点/℃
甲酸 HCOOH 8 101
乙酸 CH3COOH 17 118
丙酸 CH3CH2COOH -21 141
正丁酸 CH3CH2CH2COOH -5 166
十八酸(硬脂酸) CH3(CH2)16COOH 70 383
苯甲酸 —COOH 122 249
阅读P72第一段及表3-4,总结羧酸的物理性质及其递变规律。
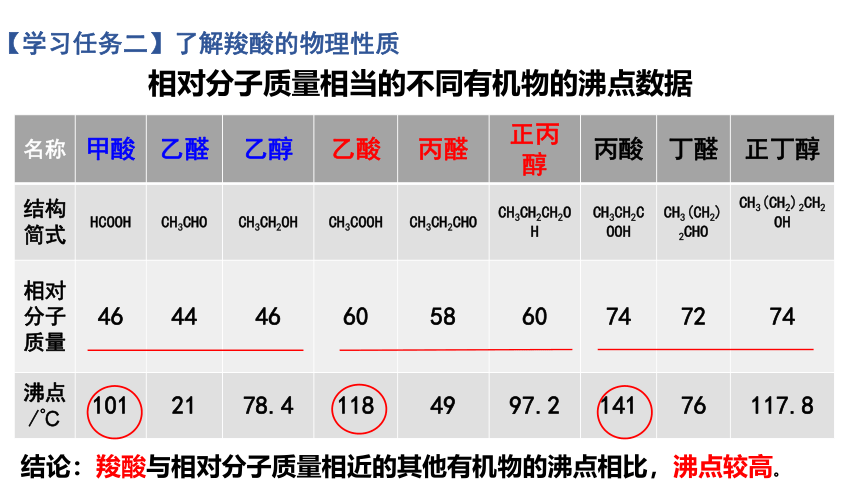
【学习任务二】了解羧酸的物理性质
相对分子质量相当的不同有机物的沸点数据
名称 甲酸 乙醛 乙醇 乙酸 丙醛 正丙醇 丙酸 丁醛 正丁醇
结构简式 HCOOH CH3CHO CH3CH2OH CH3COOH CH3CH2CHO CH3CH2CH2OH CH3CH2COOH CH3(CH2)2CHO CH3(CH2)2CH2OH
相对分子质量 46 44 46 60 58 60 74 72 74
沸点/℃ 101 21 78.4 118 49 97.2 141 76 117.8
结论:羧酸与相对分子质量相近的其他有机物的沸点相比,沸点较高。
思考:为什么与相对分子质量相近的其他有机物的沸点相比:羧酸的沸点较高
R
H
O
C
O
这与分子间可以形成氢键有关。
R
H
O
C
O
…
氢键
R
H
O
C
O
R
H
O
C
O
…
氢键
原因:由于羧酸分子形成氢键的机会比相对分子质量相近的醇的多,
羧酸的沸点比相应的醇的高。
小结: 羧酸的物理性质
随着分子中碳原子数的增加,熔沸点逐渐升高。
羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
水溶性:
甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。
随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。
高级脂肪酸是不溶于水的蜡状固体。
熔沸点:
分析结构,了解断键方式
官能团:羧基
由于受氧原子电负性较大等因素的影响,当羧酸发生化学反应时,羧基结构中的两个部位容易断裂。
①电离出H+,表现酸性
②羟基被取代,生成酯、酰胺等
问题:乙酸中的羧基也含有碳氧双键,能否和氢气发生加成反应?
受羟基的影响:使羰基较难发生加成反应
③难加成
【学习任务三】学习羧酸的化学性质
1、羧酸的酸性
E 、与某些盐反应
A、使紫色石蕊试液变色
B、与活泼金属反应
D、与碱反应
C、与碱性氧化物反应
A、使紫色石蕊试液变色
B、与活泼金属反应
D、与碱反应
C、与碱性氧化物反应
具有酸的通性
【学习任务三】学习羧酸的化学性质
探究 羧酸的酸性
[问题]羧酸的化学性质与乙酸的相似,如何通过实验证明其他羧酸也具有酸性?如何通过比较乙酸、碳酸和苯酚的酸性强弱?
[设计与实验]
(1)设计实验证明羧酸具有酸性(提供的羧酸有甲酸、苯甲酸和乙二酸)。
实验内容 实验现象 结论
分别取少量甲酸、苯甲酸、乙二酸于试管中,加水溶解,再分别滴入几滴石蕊溶液
溶液变红色
甲酸、苯甲酸、乙二酸显酸性
(2)利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,
比较乙酸、碳酸和苯酚的酸性强弱
接口的顺序:
A→D→E→B→C→F→G→H→I→J
酸性:乙酸 > 碳酸 > 苯酚
【讨论】
经过实验测定,向苯酚钠溶液中通入少量二氧化碳,最终溶液中产生了碳酸氢钠,而没有碳酸钠的产生。根据上述提示,请写出各装置中发生反应的化学方程式。
相关的反应:
NaHCO3+CH3COOH=CH3COONa+CO2↑+H2O
Na2CO3+2CH3COOH→2CH3COONa+CO2↑+H2O
ONa
OH
+ CO2 + H2O
+NaHCO3
酸性:乙酸>碳酸>苯酚> HCO3-
结论:
2.酯化反应
CH3COOH+C2H5 OH CH3COOC2H5 +H2O
浓硫酸
△
碎瓷片(防止暴沸), 乙醇3mL,浓硫酸2mL ,乙酸2mL,饱和的Na2CO3溶液
⑴反应后右侧的试管有什么现象
饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。
实验试剂:
问题思考:
催化剂,吸水剂
(2)浓硫酸的作用是什么?
不纯净;乙酸、乙醇
(3)得到的反应产物是否纯净?主要杂质有哪些?
问题思考:
① 中和乙酸
② 溶解乙醇
③ 降低酯在水中的溶解度,便于分层
防止发生倒吸
(4)饱和Na2CO3溶液有什么作用?
(5)为什么导管不插入饱和Na2CO3溶液中?
2.酯化反应
CH3COOH+C2H5 OH CH3COOC2H5 +H2O
浓硫酸
△
碎瓷片(防止暴沸), 乙醇3mL,浓硫酸2mL ,乙酸2mL,饱和的Na2CO3溶液
实验试剂:
同位素示踪法:
18
18
18
18
乙醇中的氧用18O进行标记,通过探测仪器追踪18O在何种产物中(位置、数量)。
酯化反应断键实质:酸脱羟基醇脱氢
P74
P74【思考与讨论】在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?请结合化学反应原理的有关知识进行说明。
CH3COOH+C2H5 OH CH3COOC2H5 +H2O
浓硫酸
△
研究对象:
采取措施:
①加热,蒸出乙酸乙酯,平衡正向移动,提高产率。
②利用浓硫酸吸收生成的水,平衡正向移动,提高产率。
③适当增大乙醇的用量(乙醇沸点比乙酸低,更易挥发),
平衡正向移动,可以提高乙酸的转化率,从而提高产率。
减小生成物浓度
增大反应物浓度:
“醇、醛、酸、酯”的相互转化模型
R—O—H
醇
O
—C—H
=
醛
氧化(O2)
还原(H2)
O
—C—O—H
=
羧酸
(O2、酸性KMnO4溶液、溴水、
新制Cu(OH)2、Ag(NH3)2OH )
氧化
O
—C—O-
=
酸性
酯化反应
O
—C—O—R
=
酯
小结:
