九下化学人教新课标课题1 常见的酸和碱教与学导学案(共4课时)
文档属性
| 名称 | 九下化学人教新课标课题1 常见的酸和碱教与学导学案(共4课时) |

|
|
| 格式 | zip | ||
| 文件大小 | 100.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-10-26 00:00:00 | ||
图片预览




文档简介
九下化学人教新课标10.1《常见的酸和碱》教与学导学案(共4课时)
第十单元 酸和碱
课题1 常见的酸和碱
【学习目标】
1、知识与技能:认识几种常见的酸和碱,知 ( http: / / www.21cnjy.com )道酸和碱各自都具有相似的化学性质;知道酸和碱的腐蚀性,能熟练取用酸和碱及其溶液;会用酸碱指示剂检验溶液的酸碱性。
2、过程与方法:通过浓硫酸、氢氧化钠强腐蚀 ( http: / / www.21cnjy.com )性和浓硫酸稀释实验,学会浓硫酸的稀释方法,强化实验及生活中安全意识;通过同学间的合作进行活动探究—寻找指示剂,学会如何利用和开发身边的物质进行科学探究;通过几种常见的酸和碱化学性质探究比较,能简单的归纳出几种酸和碱各自相似的化学性质;通过酸和碱溶液导电性实验的探究,知道溶液导电的原因。
3、情感、态度与价值观:树立科学的物质观, ( http: / / www.21cnjy.com )学会用辩证的观点看待事物,能透过表面现象挖掘事物具有共性的本质原因;知道化学作为自然科学的一部分,它本身就起源于人类生产活动,树立学好化学,更要用好化学的意识。
【重点难点】酸和碱的化学性质以及寻找指示剂的探究;认识身边的物质,开发和利用身边的物质
【学法指导】实验观察法 探究法、讨论归纳法
第一课时
导 学 过 程 方法导引
【知识回顾】1、二氧化碳通入紫色石蕊溶液中有什么现象?写出化学方程式。2、在前面学习的内容中,你知道了哪些是酸? 哪些是碱吗?2、我的疑惑: 自主学习小组合作完成
【合作探究,释疑解惑】一、酸碱指示剂1、阅读课本P50,你知道了哪些是酸?哪些是碱?2、实验探究P50实验10-1。教师演示,学生观察,记录实验现象。 填写在课本P51的表格上。 板书酸碱指示剂(完成教辅P62知识要点一。1、2。)二、常见的酸(一)几种常见的酸 1.盐酸、浓硫酸的物理性质。(1)实验探究:课本P52实验10-2,(教师展示浓盐酸、浓硫酸)(2)学生观察并记录实验现象,完成教辅P62知识点二、1、2.2.盐酸、浓硫酸的用途 阅读课本P52表格(盐酸、硫酸的用途)(1)人体胃液中有 ,可以帮助消化;(2)用于金属除锈的是 。(3)浓硫酸具有 性,可以作干燥剂,可以干燥的气体有: 。3.浓硫酸和特性:演示课本实验10-3,10-4观察记录实验现象、归纳出浓硫酸的性质。板书:(知识升华) 抽查学生阅读情况。学生归纳总结学生记录归纳总结盐酸、浓硫酸物理性质
【检测反馈,学以致用】1、下列物质都是日常生活中 ( http: / / www.21cnjy.com )遇到的物质,其中能使紫色石蕊溶液变红的是( ) A.食盐水 B.柠檬水 C.肥皂水 D.石灰水2、某化学兴趣小组探究采用下列花朵制作指示剂,实验记录如下:自制指示剂在不同溶液中的颜色变化盐酸酒精溶液氢氧化钠溶液石灰水红玫瑰粉红色粉红色绿色绿色万寿菊黄色黄色黄色黄色月季花浅红色红色黄色黄色根据上表信息回答: (1)不能做酸碱指示剂的是 。 (2)小明用此月季花花汁检验附近纸厂排放的废液的酸碱性,溶液显黄色,则此废液显 。 (3)由上述信息你有什么感想? 。( )3.下列物质敞口放置在空气中,质量增加的是 A.浓硫酸 B.食盐水 C.浓盐酸 D.酒精( ) 4、将氢气、一氧化碳 ( http: / / www.21cnjy.com )、二氧化碳、氮气依次通过加热的氧化铜、澄清石灰水、浓硫酸,最后得到的气体(每步都完全反应)是
A.二氧化碳 B.水蒸气和氮气 C.氮气 D.氢气和氮气( ) 5、若将浓盐酸、浓硫酸敞口放置在空气中,一段时间后,可以肯定的是
A.溶质质量都减小 B.溶剂质量都增大 C.溶液质量都增大 D.溶质质量分数都减小( ) 6、下列气体不能用浓硫酸干燥的是 A 氧气 B 二氧化碳 C 氨气(NH3) D 氯化氢气体( )7、 如图所示,向小试管中分别加入下列一定量的浓硫酸,则右侧U型管中的液面 发生的变化是 A.仍然持平 B.左高右低 C.左低右高 D.两边都升高 学生完成指名汇报
【总结提炼,知识升华】板书设计课题1 常见的酸和碱酸碱指示剂 1、什么叫酸碱指示剂 。 2、常见的指示剂: 、 。 3、指示剂与酸碱作用:指示剂在水溶液或中性溶液中(溶液本身颜色)酸碱石蕊酚酞4、溶液酸碱性怎样检验? 。二、常见的酸(一)几种常见的酸 1、浓盐酸、浓硫酸的物理性质浓 盐 酸浓 硫 酸颜色、 状态气味打开瓶盖现象性质敞口放置现象性质2.盐酸、浓硫酸的用途【课后训练,巩固拓展】
课后作业以现用《新课程实践与探究丛书》教辅为准。简称为《教辅》
第十单元 酸和碱
课题1 常见的酸和碱
第二课时
导 学 过 程 方法导引
【知识回顾】1.在酸溶液中加入石蕊显 色,加酚酞会显 色。在碱溶液中加入石蕊显 色,加酚酞会显 色。2.在某溶液中加入石蕊显红色,该溶液可能是( ) A.水 B.酒精溶液 C.石灰水 D.稀盐酸3.在某溶液中先加石蕊显蓝色,如果向溶液中加入酚酞,则应显( )A.红色 B.无色 C.紫色 D.蓝色 2、我的疑惑: 独立完成,展示完成情况
【合作探究,释疑解惑】(三)酸的化学性质1、回顾并演示P54实验得出:酸与指示剂反应。 得出酸的性质1:酸+石蕊→石蕊变红 酸+酚酞→酚酞不变色2、回顾第八单元金属的化学性质,教师再次演示下列实验,观察现象并完成化学方程式:铁、锌、铝分别与盐酸、硫酸反应 注意:(1)金属与酸反应有什么条件?(2)铁与酸反应生成物中的铁显什么价?(3)酸与金属反应的条件是什么?酸的性质2:酸+金属→盐+H2↑3、演示实验:P54探究(3)完成在课本上P54探究实验现 象化 学 方 程 式铁锈+盐酸铁锈+硫酸氧化铜+硫酸酸的性质3:酸+金属氧化物→盐+H2O 4、回顾实验室制二氧化碳的化学反应化学方程式: 说明了酸还具有与CaCO3类物质反应。即酸的性质4:酸+盐反应→新盐+新酸 小组讨论,回顾指示剂、金属与酸反应知识。学生观察记录实验现象归纳小结酸的化学性质3、4
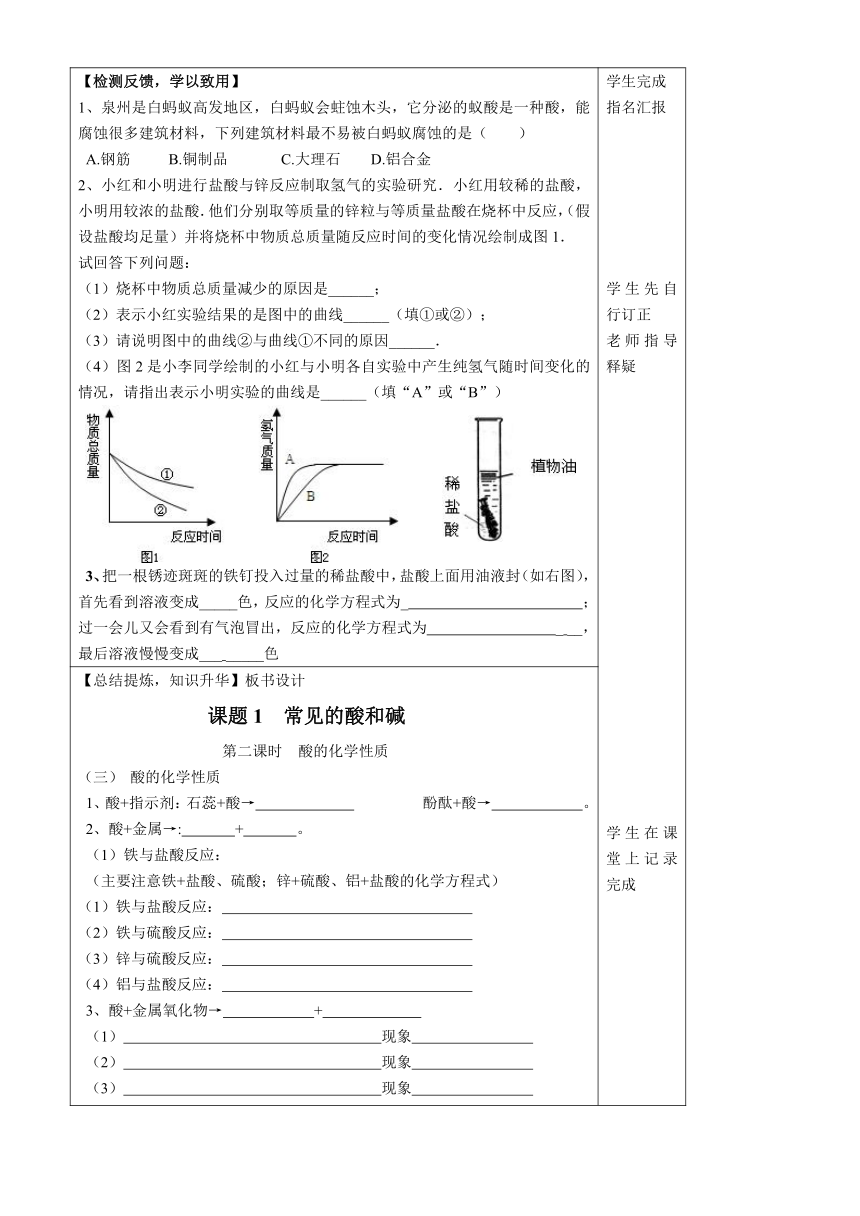
【检测反馈,学以致用】1、泉州是白蚂蚁高发 ( http: / / www.21cnjy.com )地区,白蚂蚁会蛀蚀木头,它分泌的蚁酸是一种酸,能腐蚀很多建筑材料,下列建筑材料最不易被白蚂蚁腐蚀的是( ) A.钢筋 B.铜制品 C.大理石 D.铝合金2、小红和小明进行盐酸与锌反应制取 ( http: / / www.21cnjy.com )氢气的实验研究.小红用较稀的盐酸,小明用较浓的盐酸.他们分别取等质量的锌粒与等质量盐酸在烧杯中反应,(假设盐酸均足量)并将烧杯中物质总质量随反应时间的变化情况绘制成图1.试回答下列问题:(1)烧杯中物质总质量减少的原因是______;(2)表示小红实验结果的是图中的曲线______(填①或②);(3)请说明图中的曲线②与曲线①不同的原因______.(4)图2是小李同学绘制的小红与小明各自实验中产生纯氢气随时间变化的情况,请指出表示小明实验的曲线是______(填“A”或“B”) ( http: / / www.21cnjy.com )3、把一根锈迹斑斑的铁钉投入过量的稀盐酸中,盐酸上面用油液封(如右图),首先看到溶液变成_____色,反应的化学方程式为_ ;过一会儿又会看到有气泡冒出,反应的化学方程式为 _ __,最后溶液慢慢变成___ _____色 学生完成指名汇报学生先自行订正老师指导释疑学生在课堂上记录完成学生课后练习老师抽查
【总结提炼,知识升华】板书设计课题1 常见的酸和碱第二课时 酸的化学性质酸的化学性质 1、酸+指示剂:石蕊+酸→ 酚酞+酸→ 。 2、酸+金属→: + 。 (1)铁与盐酸反应:(主要注意铁+盐酸、硫酸;锌+硫酸、铝+盐酸的化学方程式)(1)铁与盐酸反应: (2)铁与硫酸反应: (3)锌与硫酸反应: (4)铝与盐酸反应: 3、酸+金属氧化物→ + (1) 现象 (2) 现象 (3) 现象 4、酸+盐→ + 【课后训练,巩固拓展】( )1、稀盐酸、稀硫酸可以给金属表面除锈。现将一根生锈的铁钉放入盛有稀盐酸的试管中,可能观察到的现象是 ①铁钉表面上的铁锈消失 ②铁钉上有气泡 ③溶液显棕黄色 A.只有①② B.只有①③ C.只有③ D.①②③ ( )2、铜片在酒精灯火焰上加热后表面会变黑,有的同学认为 A.只有①② B.只有①③ C.只有③ D.①②③ 3、写出下列化学方程式(1)铁与稀硫酸反应 (2)铝与稀盐酸反应 (3)铁锈与稀盐酸反应 (4)氧化铜与硫酸反应 4、衣服上不小心沾上了铁锈 ( http: / / www.21cnjy.com )(Fe2O3),可将铁锈浸泡在草酸溶液中除去,草酸(H2C2O4)是一种酸,具有酸相似的化学性质,写出有关化学方程式。 。课后作业:《教辅》P67-69.
课后作业以现用《新课程实践与探究丛书》教辅为准。简称为《教辅》
第十单元 酸和碱
课题1 常见的酸和碱
第三课时 常见的碱
导 学 过 程 方法导引
【知识回顾】1、石蕊+酸→ 色 酚酞+酸→ 色。2.写出下列化学方程式: 铁与硫酸反应:铁与盐酸反应:生锈铁钉加入到盐酸中:氧化铜粉末加入到硫酸中稍微加热。 3、我的疑惑: 自主学习小组合作完成
【合作探究,释疑解惑】三、常见的碱(一)常见的碱1.氢氧化钠和氢氧化钙的物理性质氢氧化钠和氢氧化钙是两种常见的碱。演示实验P55实验10-5.填写课本P55表格。阅读课本内容,完成板书内容。再演示实验10-6 阅读课本内容。板书:(见板书设计)(二)碱的化学性质1.回顾:石蕊、酚酞加入氢氧化钠、氢氧化钙溶液显什么色?板书12.回顾:石灰水中通入二氧化碳(实验室检验二氧化碳)的方法。 按下图进行实验:看到的现象是: ,取下橡皮塞,将锥形瓶的液体倒入试管中,然后向试管中滴加稀盐酸,观察到的现象是 说明CO2与氢氧化钠反应有 生成。(板书性质2) 阅读课本完成在后面板书设计内容上观察记录现象归纳小结得出碱的性质2
【检测反馈,学以致用】1、氢氧化钠是一种重要的化工原料,俗称 ( http: / / www.21cnjy.com ) 。氢氧化钠极易吸收水分,可用作某些气体的 剂,它的水溶液倒入充满CO2的矿泉水瓶中,密闭、振荡,可以看到 ,发生反应的化学方程式为,因此,氢氧化钠应密封保存。( )2.下列各组物质均可用固体氢氧化钠干燥的是 A.H2、O2、CO B. H2、O2、CO2 C. H2、SO2、CO2 D.CO、O2、CO2 ( )3.除去N2中混有的少量水 ( http: / / www.21cnjy.com )蒸气、H2、CO2,实验操作有:①通入少量浓硫酸;②通入灼热的CuO;③通过NaOH溶液。正确的顺序是 A.③②① B. ①②③ C. ①③② D.②①③ 4、用一种试剂或方法除去下列物质中的杂质(括号内为杂质),用化学方程式表示。(1)CaO(CaCO3) ;(2)Ca(OH)2 (CaO) ;(3)CO2(CO) ;(4)CO(CO2) . 学生完成指名汇报教师释疑辅导完成
【总结提炼,知识升华】板书设计课题1 常见的酸和碱(三)常见的碱 (一)常见的碱1、氢氧化钠和氢氧化钙的物理性质氢氧化钠 氢氧化钙 俗名色、态溶解性腐蚀性吸水性用 途氢氧化钠不能干燥的气体有: 。Ca(OH)2的产生: 。(二)碱的化学性质1.碱+石蕊→ 色,碱+酚酞→ 色。2.碱+非金属氧化物→盐+水 、 。【课后训练,巩固拓展】课后作业:课本习题:P591-5题
课后作业以现用《新课程实践与探究丛书》教辅为准。简称为《教辅》
第十单元 酸和碱
课题1 常见的酸和碱
第四课时 酸碱构成
导 学 过 程 方法导引
【知识回顾】1、酸+石蕊→ 色 酸+酚酞→ 色, 碱+石蕊→ 色 碱+酚酞→ 色,2.写出下列化学方程式 实验室检验二氧化碳 :用NaOH溶液除去工厂废气中含有的二氧化硫 :三氧化硫与氢氧化钠溶液反应 : 3、我的疑惑: 自主学习小组合作完成
【合作探究,释疑解惑】四、酸、碱的构成1.回顾:酸、碱有哪些相似的化学性质?完成相应的化学方程式。问:酸碱为什么有这些相似的化学性质?演示实验P57实验10-7盐酸硫酸NaOH溶液KOH溶液水酒精灯泡溶液导电性阅读课本P57相关内容:溶液导电原因是什么? 硫酸、盐酸、NaOH、KOH溶液中有哪些离子? 、 、 。得出酸、碱的构成(板书)(见板书设计) 学生复习完成化学方程式学生记录灯泡亮度情况说明溶液导电原因归纳总结出酸碱的构成
【检测反馈,学以致用】( )1、下列几组物质按酸、碱、盐顺序排列的是A.KNO3、KOH、HCl B. Ca(OH)2、HCl、NaCl C. H2SO4、Na2CO3 、Ba(OH)2 D.HNO3、NaOH、CuSO4( )2.酸溶液具有相似的化学性质是由于酸溶液中存在A.酸分子 B. 水分子 C. 酸根离子 D.氢离子( )3.某些物质的水溶液能够导电的原因是由于存在自由移动的 A.电子 B. 分子 C. 原子 D.离子4.含有少量杂质的盐酸样品,经分析 ( http: / / www.21cnjy.com )含有H+、Cl-和SO42-,则杂质的化学式为 ,若测得溶液中的Cl-和SO42-个数之比为20:1,则H+、Cl-的个数之比是 。 学生完成指名汇报学生自主完成教师指导、释疑
【总结提炼,知识升华】板书设计课题1 常见的酸和碱(四)酸、碱溶液的构成 1 酸→ + 酸具有相似化学性质的原因: 。 2. 碱→ + 碱具有相似化学性质的原因: 。酸:氢前酸根尾;碱:金前OH后。【课后训练,巩固拓展】盐酸溶液中含有H2O分子、H+和Cl-离子,要探究是哪一种粒子能使紫色石蕊溶液变成红色,请观察在白色点滴板上进行的下列实验,将实验现象和结论填入下表。滴加紫色石蕊溶液后的现象结论第1孔孔中溶液仍为紫色水分子 第2孔 第3孔、第4孔 课后作业:《教辅》P72达标训练
课后作业以现用《新课程实践与探究丛书》教辅为准。简称为《教辅》
第十单元 酸和碱
课题1 常见的酸和碱
【学习目标】
1、知识与技能:认识几种常见的酸和碱,知 ( http: / / www.21cnjy.com )道酸和碱各自都具有相似的化学性质;知道酸和碱的腐蚀性,能熟练取用酸和碱及其溶液;会用酸碱指示剂检验溶液的酸碱性。
2、过程与方法:通过浓硫酸、氢氧化钠强腐蚀 ( http: / / www.21cnjy.com )性和浓硫酸稀释实验,学会浓硫酸的稀释方法,强化实验及生活中安全意识;通过同学间的合作进行活动探究—寻找指示剂,学会如何利用和开发身边的物质进行科学探究;通过几种常见的酸和碱化学性质探究比较,能简单的归纳出几种酸和碱各自相似的化学性质;通过酸和碱溶液导电性实验的探究,知道溶液导电的原因。
3、情感、态度与价值观:树立科学的物质观, ( http: / / www.21cnjy.com )学会用辩证的观点看待事物,能透过表面现象挖掘事物具有共性的本质原因;知道化学作为自然科学的一部分,它本身就起源于人类生产活动,树立学好化学,更要用好化学的意识。
【重点难点】酸和碱的化学性质以及寻找指示剂的探究;认识身边的物质,开发和利用身边的物质
【学法指导】实验观察法 探究法、讨论归纳法
第一课时
导 学 过 程 方法导引
【知识回顾】1、二氧化碳通入紫色石蕊溶液中有什么现象?写出化学方程式。2、在前面学习的内容中,你知道了哪些是酸? 哪些是碱吗?2、我的疑惑: 自主学习小组合作完成
【合作探究,释疑解惑】一、酸碱指示剂1、阅读课本P50,你知道了哪些是酸?哪些是碱?2、实验探究P50实验10-1。教师演示,学生观察,记录实验现象。 填写在课本P51的表格上。 板书酸碱指示剂(完成教辅P62知识要点一。1、2。)二、常见的酸(一)几种常见的酸 1.盐酸、浓硫酸的物理性质。(1)实验探究:课本P52实验10-2,(教师展示浓盐酸、浓硫酸)(2)学生观察并记录实验现象,完成教辅P62知识点二、1、2.2.盐酸、浓硫酸的用途 阅读课本P52表格(盐酸、硫酸的用途)(1)人体胃液中有 ,可以帮助消化;(2)用于金属除锈的是 。(3)浓硫酸具有 性,可以作干燥剂,可以干燥的气体有: 。3.浓硫酸和特性:演示课本实验10-3,10-4观察记录实验现象、归纳出浓硫酸的性质。板书:(知识升华) 抽查学生阅读情况。学生归纳总结学生记录归纳总结盐酸、浓硫酸物理性质
【检测反馈,学以致用】1、下列物质都是日常生活中 ( http: / / www.21cnjy.com )遇到的物质,其中能使紫色石蕊溶液变红的是( ) A.食盐水 B.柠檬水 C.肥皂水 D.石灰水2、某化学兴趣小组探究采用下列花朵制作指示剂,实验记录如下:自制指示剂在不同溶液中的颜色变化盐酸酒精溶液氢氧化钠溶液石灰水红玫瑰粉红色粉红色绿色绿色万寿菊黄色黄色黄色黄色月季花浅红色红色黄色黄色根据上表信息回答: (1)不能做酸碱指示剂的是 。 (2)小明用此月季花花汁检验附近纸厂排放的废液的酸碱性,溶液显黄色,则此废液显 。 (3)由上述信息你有什么感想? 。( )3.下列物质敞口放置在空气中,质量增加的是 A.浓硫酸 B.食盐水 C.浓盐酸 D.酒精( ) 4、将氢气、一氧化碳 ( http: / / www.21cnjy.com )、二氧化碳、氮气依次通过加热的氧化铜、澄清石灰水、浓硫酸,最后得到的气体(每步都完全反应)是
A.二氧化碳 B.水蒸气和氮气 C.氮气 D.氢气和氮气( ) 5、若将浓盐酸、浓硫酸敞口放置在空气中,一段时间后,可以肯定的是
A.溶质质量都减小 B.溶剂质量都增大 C.溶液质量都增大 D.溶质质量分数都减小( ) 6、下列气体不能用浓硫酸干燥的是 A 氧气 B 二氧化碳 C 氨气(NH3) D 氯化氢气体( )7、 如图所示,向小试管中分别加入下列一定量的浓硫酸,则右侧U型管中的液面 发生的变化是 A.仍然持平 B.左高右低 C.左低右高 D.两边都升高 学生完成指名汇报
【总结提炼,知识升华】板书设计课题1 常见的酸和碱酸碱指示剂 1、什么叫酸碱指示剂 。 2、常见的指示剂: 、 。 3、指示剂与酸碱作用:指示剂在水溶液或中性溶液中(溶液本身颜色)酸碱石蕊酚酞4、溶液酸碱性怎样检验? 。二、常见的酸(一)几种常见的酸 1、浓盐酸、浓硫酸的物理性质浓 盐 酸浓 硫 酸颜色、 状态气味打开瓶盖现象性质敞口放置现象性质2.盐酸、浓硫酸的用途【课后训练,巩固拓展】
课后作业以现用《新课程实践与探究丛书》教辅为准。简称为《教辅》
第十单元 酸和碱
课题1 常见的酸和碱
第二课时
导 学 过 程 方法导引
【知识回顾】1.在酸溶液中加入石蕊显 色,加酚酞会显 色。在碱溶液中加入石蕊显 色,加酚酞会显 色。2.在某溶液中加入石蕊显红色,该溶液可能是( ) A.水 B.酒精溶液 C.石灰水 D.稀盐酸3.在某溶液中先加石蕊显蓝色,如果向溶液中加入酚酞,则应显( )A.红色 B.无色 C.紫色 D.蓝色 2、我的疑惑: 独立完成,展示完成情况
【合作探究,释疑解惑】(三)酸的化学性质1、回顾并演示P54实验得出:酸与指示剂反应。 得出酸的性质1:酸+石蕊→石蕊变红 酸+酚酞→酚酞不变色2、回顾第八单元金属的化学性质,教师再次演示下列实验,观察现象并完成化学方程式:铁、锌、铝分别与盐酸、硫酸反应 注意:(1)金属与酸反应有什么条件?(2)铁与酸反应生成物中的铁显什么价?(3)酸与金属反应的条件是什么?酸的性质2:酸+金属→盐+H2↑3、演示实验:P54探究(3)完成在课本上P54探究实验现 象化 学 方 程 式铁锈+盐酸铁锈+硫酸氧化铜+硫酸酸的性质3:酸+金属氧化物→盐+H2O 4、回顾实验室制二氧化碳的化学反应化学方程式: 说明了酸还具有与CaCO3类物质反应。即酸的性质4:酸+盐反应→新盐+新酸 小组讨论,回顾指示剂、金属与酸反应知识。学生观察记录实验现象归纳小结酸的化学性质3、4
【检测反馈,学以致用】1、泉州是白蚂蚁高发 ( http: / / www.21cnjy.com )地区,白蚂蚁会蛀蚀木头,它分泌的蚁酸是一种酸,能腐蚀很多建筑材料,下列建筑材料最不易被白蚂蚁腐蚀的是( ) A.钢筋 B.铜制品 C.大理石 D.铝合金2、小红和小明进行盐酸与锌反应制取 ( http: / / www.21cnjy.com )氢气的实验研究.小红用较稀的盐酸,小明用较浓的盐酸.他们分别取等质量的锌粒与等质量盐酸在烧杯中反应,(假设盐酸均足量)并将烧杯中物质总质量随反应时间的变化情况绘制成图1.试回答下列问题:(1)烧杯中物质总质量减少的原因是______;(2)表示小红实验结果的是图中的曲线______(填①或②);(3)请说明图中的曲线②与曲线①不同的原因______.(4)图2是小李同学绘制的小红与小明各自实验中产生纯氢气随时间变化的情况,请指出表示小明实验的曲线是______(填“A”或“B”) ( http: / / www.21cnjy.com )3、把一根锈迹斑斑的铁钉投入过量的稀盐酸中,盐酸上面用油液封(如右图),首先看到溶液变成_____色,反应的化学方程式为_ ;过一会儿又会看到有气泡冒出,反应的化学方程式为 _ __,最后溶液慢慢变成___ _____色 学生完成指名汇报学生先自行订正老师指导释疑学生在课堂上记录完成学生课后练习老师抽查
【总结提炼,知识升华】板书设计课题1 常见的酸和碱第二课时 酸的化学性质酸的化学性质 1、酸+指示剂:石蕊+酸→ 酚酞+酸→ 。 2、酸+金属→: + 。 (1)铁与盐酸反应:(主要注意铁+盐酸、硫酸;锌+硫酸、铝+盐酸的化学方程式)(1)铁与盐酸反应: (2)铁与硫酸反应: (3)锌与硫酸反应: (4)铝与盐酸反应: 3、酸+金属氧化物→ + (1) 现象 (2) 现象 (3) 现象 4、酸+盐→ + 【课后训练,巩固拓展】( )1、稀盐酸、稀硫酸可以给金属表面除锈。现将一根生锈的铁钉放入盛有稀盐酸的试管中,可能观察到的现象是 ①铁钉表面上的铁锈消失 ②铁钉上有气泡 ③溶液显棕黄色 A.只有①② B.只有①③ C.只有③ D.①②③ ( )2、铜片在酒精灯火焰上加热后表面会变黑,有的同学认为 A.只有①② B.只有①③ C.只有③ D.①②③ 3、写出下列化学方程式(1)铁与稀硫酸反应 (2)铝与稀盐酸反应 (3)铁锈与稀盐酸反应 (4)氧化铜与硫酸反应 4、衣服上不小心沾上了铁锈 ( http: / / www.21cnjy.com )(Fe2O3),可将铁锈浸泡在草酸溶液中除去,草酸(H2C2O4)是一种酸,具有酸相似的化学性质,写出有关化学方程式。 。课后作业:《教辅》P67-69.
课后作业以现用《新课程实践与探究丛书》教辅为准。简称为《教辅》
第十单元 酸和碱
课题1 常见的酸和碱
第三课时 常见的碱
导 学 过 程 方法导引
【知识回顾】1、石蕊+酸→ 色 酚酞+酸→ 色。2.写出下列化学方程式: 铁与硫酸反应:铁与盐酸反应:生锈铁钉加入到盐酸中:氧化铜粉末加入到硫酸中稍微加热。 3、我的疑惑: 自主学习小组合作完成
【合作探究,释疑解惑】三、常见的碱(一)常见的碱1.氢氧化钠和氢氧化钙的物理性质氢氧化钠和氢氧化钙是两种常见的碱。演示实验P55实验10-5.填写课本P55表格。阅读课本内容,完成板书内容。再演示实验10-6 阅读课本内容。板书:(见板书设计)(二)碱的化学性质1.回顾:石蕊、酚酞加入氢氧化钠、氢氧化钙溶液显什么色?板书12.回顾:石灰水中通入二氧化碳(实验室检验二氧化碳)的方法。 按下图进行实验:看到的现象是: ,取下橡皮塞,将锥形瓶的液体倒入试管中,然后向试管中滴加稀盐酸,观察到的现象是 说明CO2与氢氧化钠反应有 生成。(板书性质2) 阅读课本完成在后面板书设计内容上观察记录现象归纳小结得出碱的性质2
【检测反馈,学以致用】1、氢氧化钠是一种重要的化工原料,俗称 ( http: / / www.21cnjy.com ) 。氢氧化钠极易吸收水分,可用作某些气体的 剂,它的水溶液倒入充满CO2的矿泉水瓶中,密闭、振荡,可以看到 ,发生反应的化学方程式为,因此,氢氧化钠应密封保存。( )2.下列各组物质均可用固体氢氧化钠干燥的是 A.H2、O2、CO B. H2、O2、CO2 C. H2、SO2、CO2 D.CO、O2、CO2 ( )3.除去N2中混有的少量水 ( http: / / www.21cnjy.com )蒸气、H2、CO2,实验操作有:①通入少量浓硫酸;②通入灼热的CuO;③通过NaOH溶液。正确的顺序是 A.③②① B. ①②③ C. ①③② D.②①③ 4、用一种试剂或方法除去下列物质中的杂质(括号内为杂质),用化学方程式表示。(1)CaO(CaCO3) ;(2)Ca(OH)2 (CaO) ;(3)CO2(CO) ;(4)CO(CO2) . 学生完成指名汇报教师释疑辅导完成
【总结提炼,知识升华】板书设计课题1 常见的酸和碱(三)常见的碱 (一)常见的碱1、氢氧化钠和氢氧化钙的物理性质氢氧化钠 氢氧化钙 俗名色、态溶解性腐蚀性吸水性用 途氢氧化钠不能干燥的气体有: 。Ca(OH)2的产生: 。(二)碱的化学性质1.碱+石蕊→ 色,碱+酚酞→ 色。2.碱+非金属氧化物→盐+水 、 。【课后训练,巩固拓展】课后作业:课本习题:P591-5题
课后作业以现用《新课程实践与探究丛书》教辅为准。简称为《教辅》
第十单元 酸和碱
课题1 常见的酸和碱
第四课时 酸碱构成
导 学 过 程 方法导引
【知识回顾】1、酸+石蕊→ 色 酸+酚酞→ 色, 碱+石蕊→ 色 碱+酚酞→ 色,2.写出下列化学方程式 实验室检验二氧化碳 :用NaOH溶液除去工厂废气中含有的二氧化硫 :三氧化硫与氢氧化钠溶液反应 : 3、我的疑惑: 自主学习小组合作完成
【合作探究,释疑解惑】四、酸、碱的构成1.回顾:酸、碱有哪些相似的化学性质?完成相应的化学方程式。问:酸碱为什么有这些相似的化学性质?演示实验P57实验10-7盐酸硫酸NaOH溶液KOH溶液水酒精灯泡溶液导电性阅读课本P57相关内容:溶液导电原因是什么? 硫酸、盐酸、NaOH、KOH溶液中有哪些离子? 、 、 。得出酸、碱的构成(板书)(见板书设计) 学生复习完成化学方程式学生记录灯泡亮度情况说明溶液导电原因归纳总结出酸碱的构成
【检测反馈,学以致用】( )1、下列几组物质按酸、碱、盐顺序排列的是A.KNO3、KOH、HCl B. Ca(OH)2、HCl、NaCl C. H2SO4、Na2CO3 、Ba(OH)2 D.HNO3、NaOH、CuSO4( )2.酸溶液具有相似的化学性质是由于酸溶液中存在A.酸分子 B. 水分子 C. 酸根离子 D.氢离子( )3.某些物质的水溶液能够导电的原因是由于存在自由移动的 A.电子 B. 分子 C. 原子 D.离子4.含有少量杂质的盐酸样品,经分析 ( http: / / www.21cnjy.com )含有H+、Cl-和SO42-,则杂质的化学式为 ,若测得溶液中的Cl-和SO42-个数之比为20:1,则H+、Cl-的个数之比是 。 学生完成指名汇报学生自主完成教师指导、释疑
【总结提炼,知识升华】板书设计课题1 常见的酸和碱(四)酸、碱溶液的构成 1 酸→ + 酸具有相似化学性质的原因: 。 2. 碱→ + 碱具有相似化学性质的原因: 。酸:氢前酸根尾;碱:金前OH后。【课后训练,巩固拓展】盐酸溶液中含有H2O分子、H+和Cl-离子,要探究是哪一种粒子能使紫色石蕊溶液变成红色,请观察在白色点滴板上进行的下列实验,将实验现象和结论填入下表。滴加紫色石蕊溶液后的现象结论第1孔孔中溶液仍为紫色水分子 第2孔 第3孔、第4孔 课后作业:《教辅》P72达标训练
课后作业以现用《新课程实践与探究丛书》教辅为准。简称为《教辅》
同课章节目录
