非选择题专练5 专项练增分提能(含解析)2024年高考化学二轮复习
文档属性
| 名称 | 非选择题专练5 专项练增分提能(含解析)2024年高考化学二轮复习 |  | |
| 格式 | DOCX | ||
| 文件大小 | 466.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-18 22:06:15 | ||
图片预览




文档简介
非选择题专练5
非选择题:本题共4小题。
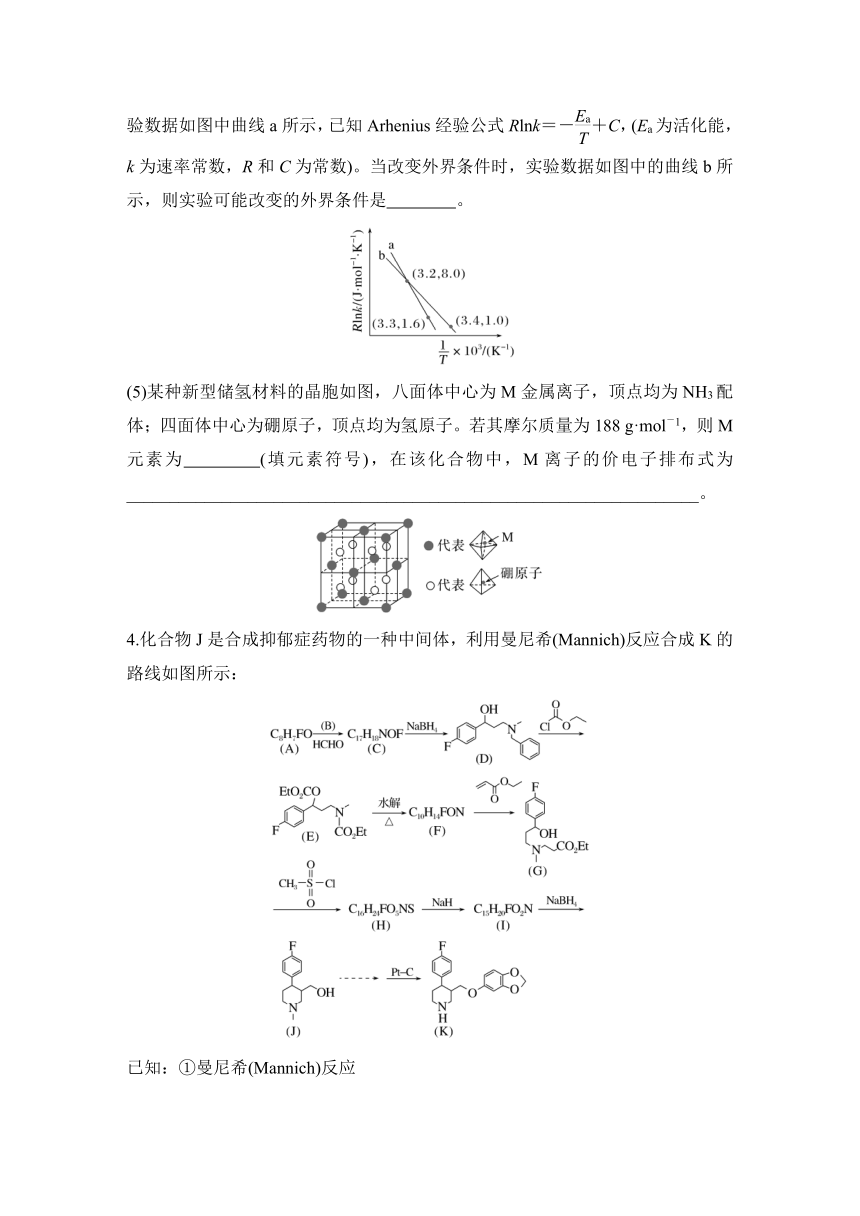
1.铁是人体必需的微量元素之一,菠菜、黑木耳等食品中富含铁元素,其中菠菜中的铁元素主要以草酸亚铁(FeC2O4)的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。
(1)隔绝空气的条件下草酸亚铁受热分解的化学方程式是___________________________________________________________________
__________________________________________________________________。
(2)菠菜的预处理
上述预处理流程中需要用到的仪器有烧杯、玻璃棒、酒精灯、 (从下图中选择,写出名称)。
(3)检验待测液中是否含有Fe2+、Fe3+
检验试剂 现象 结论
① 溶液变为红色 待测液中含有Fe3+
② ③ 待测液中含有Fe2+
(4)利用KMnO4标准溶液测定菠菜中铁元素的含量
步骤Ⅰ:取10.00 mL待测液于锥形瓶中,滴加KMnO4溶液至溶液显紫色。
步骤Ⅱ:向步骤Ⅰ得到的混合液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤Ⅲ:向步骤Ⅱ所得待测液中加入适量稀H2SO4,用c mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液V mL。
①步骤Ⅰ滴加KMnO4溶液的目的是_________________________________
_______________________________________________________________。
②步骤Ⅲ滴加KMnO4溶液时发生反应的离子方程式为___________________________________________________________________
________________________________________________________________。
③菠菜中铁的含量为 mg/100 g(即每100 g菠菜中铁元素的质量)。
2.锂离子电池通常含有多种金属元素,废弃锂离子电池的回收处理对资源利用和环境保护有重要意义。某实验小组从某废旧锂电池正极活性材料[主要成分可表示为LiNixCo(1-x)O2]中分别回收处理金属元素,工艺流程如图:
已知:①“酸浸”后滤液中主要金属阳离子为Li+、Ni2+、Co2+。
②沉镍反应为
回答下列问题:
(1)基态氧原子的核外电子空间运动状态有 种。丁二酮肟分子中sp3杂化的原子个数为 ,二丁二酮肟镍中存在的化学键有 (填序号)。
A.π键 B.氢键 C.金属键 D.配位键
(2)锂电池负极材料为Li2C6,废旧锂电池加NaCl溶液浸泡,既可将废电池充分放电,保证拆解安全,还可以达到 的目的。
(3)“酸浸”过程的主要反应离子方程式为_______________________________
__________________________________________________________________。
(4)“萃取”钴离子的原理可表示为2HA+Co2+CoA2+2H+,pH太小萃取率偏低的原因为_________________________________________________________
___________________________________________________________________。
(5)CoC2O4和Li2CO3在空气氛围中焙烧可得到LiCoO2,该反应化学方程式为___________________________________________________________________
___________________________________________________________________。
(6)将草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中固体残留率(固体残留率=×100%)变化如图,则C点固体物质化学式为 。
3.我国提出2060年前实现碳中和,为有效降低大气中CO2的含量,以CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
Ⅰ.主反应:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1=-156.9 kJ·mol-1
Ⅱ.副反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.1 kJ·mol-l
(1)已知:Ⅲ.2H2(g)+O2(g)===2H2O(g) ΔH3=-395.6 kJ·mol-1
Ⅳ.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH4= 。
(2)CO2加氢合成甲烷时,通常控制温度为500 ℃左右,其可能的原因为 。
A.反应速率快 B.平衡转化率高
C.催化剂活性高 D.主反应催化剂选择性好
(3)500 ℃时,向1 L恒容密闭容器中充入4 mol CO2和12 mol H2,初始压强为p,20 min时主、副反应都达到平衡状态,测得c(H2O)=5 mol·L-1,体系压强为3/4p,则0~20 min内v(CH4)= mol·L-1·min-1,平衡时CH4选择性= (CH4选择性=×100%,计算保留三位有效数字)。
(4)以CO2催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为3CH3OH(g)C3H6(g)+3H2O(g)。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式Rlnk=-+C,(Ea为活化能,k为速率常数,R和C为常数)。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是 。
(5)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为NH3配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为188 g·mol-1,则M元素为 (填元素符号),在该化合物中,M离子的价电子排布式为__________________________________________________________________。
4.化合物J是合成抑郁症药物的一种中间体,利用曼尼希(Mannich)反应合成K的路线如图所示:
已知:①曼尼希(Mannich)反应
(R=烃基,H);
②R1COR2R1CH(OH)R2或R1COOR2R1CH2OH(R=烃基);
③Et代表乙基,属于芳香族化合物。
回答下列问题:
(1) 化学名称是 ,F中所含官能团的名称是亚氨基、 。
(2)B的结构简式为 ,B只有一个侧链且是六元芳香化合物的同分异构体数目有 种。
(3)D→E需要在足量K2CO3条件下进行,该化学方程式为___________________________________,I→J的反应类型是 。
(4)综合上述信息,写出由和制备的合成路线(其它试剂任选)。
非选择题专练5
1.答案 (1)FeC2O4FeO+CO↑+CO2↑
(2)坩埚、漏斗、100 mL容量瓶 (3)①KSCN溶液
②K3[Fe(CN)6]溶液 ③产生特征蓝色沉淀 (4)①将待测液中的H2C2O4等还原性杂质氧化除去;将Fe2+氧化为Fe3+ ②5Fe2++MnO+8H+===5Fe3++Mn2++4H2O ③2 800cV
解析 (1)由草酸亚铁中各元素化合价知,隔绝空气的条件下其受热分解生成FeO、CO、CO2。(2)灼烧需要坩埚,过滤需要漏斗,配制100 mL溶液需要100 mL容量瓶。(3)①由检验三价铁离子的现象为“溶液变为红色”可知,加入的试剂为KSCN溶液。②检验二价铁离子可用K3[Fe(CN)6]溶液。③二价铁离子与K3[Fe(CN)6]反应产生特征蓝色沉淀。(4)①由上述分析知,待测液中含有Fe2+,且待测液中还可能含有H2C2O4等还原性杂质,故步骤Ⅰ滴加KMnO4溶液的目的是将待测液中的H2C2O4等还原性杂质氧化除去,同时将Fe2+氧化为Fe3+。②Fe2+与MnO在酸性条件下发生氧化还原反应,产生Fe3+、Mn2+、H2O,根据得失电子守恒、电荷守恒、原子守恒,可配平离子方程式。③由关系式5Fe2+~MnO,可得n(Fe2+)=5n(KMnO4)=5cV×10-3 mol,则100 mL待测液中铁元素的质量为×5cV×10-3 mol×56 g·mol-1=2 800×10-3cV g=2 800cV mg,故100 g菠菜中铁的含量为2 800cV mg。
2.答案 (1)5 4 AD
(2)将负极锂元素转移到正极材料中,提高锂的回收率
(3)2LiNixCo(1-x)O2+6H++H2O2===2Li++2xNi2++2(1-x)Co2++4H2O+O2↑
(4)pH越小,H+浓度越大,平衡逆向移动,降低了萃取率
(5)4CoC2O4+2LiCO3+3O24LiCoO2+10CO2
(6)Co2O3
解析 (1)基态氧原子的核外电子排布式为1s22s22p4,轨道数为5,核外电子空间运动状态有5种,丁二酮肟分子中sp3杂化的原子是两个甲基中的碳原子,两个羟基中的氧原子,个数为4,二丁二酮肟镍中存在的化学键有σ键、π键、配位键,氢键不属于化学键,金属键存在于金属或合金中,故答案选AD。
(2)锂电池负极材料为Li2C6,废旧锂电池加NaCl溶液浸泡,可将废电池充分放电,保证拆解安全,还可以达到将负极锂元素转移到正极材料中,提高锂的回收率的目的。
(3)从题干可知,酸浸后的滤液中主要金属阳离子为Li+、Ni2+和Co2+,同时有氧气生成,酸浸过程中的主要反应离子方程式为2LiNixCo(1-x)O2+6H++H2O2===2Li++2xNi2++2(1-x)Co2++4H2O+O2↑。
(4)萃取钴离子的原理可表示为2HA+Co2+CoA2+2H+,pH越小,氢离子浓度越大,该反应化学平衡逆向移动,降低了萃取率。
(5)CoC2O4与Li2CO3在空气中焙烧可得到LiCoO2,Co失电子化合价从+2价升高为+3价,则反应物中O2得电子生成CO2,根据得失电子守恒和原子守恒,反应的化学方程式为4CoC2O4+2Li2CO3+3O24LiCoO2+10CO2。
(6)CoC2O4·2H2O(M=183 g/mol),取1 mol的CoC2O4·2H2O,则Co元素的质量为59 g,C点固体物质中O元素约为183 g×45.36%-59 g=24 g,Co原子和O原子物质的量之比为1∶1.5,化学式为Co2O3。
3.答案 (1)-634.3 kJ·mol-1
(2)ACD
(3)0.1 mol·L-1·min-1 66.7%
(4)使用更高效的催化剂或增大催化剂的比表面积
(5)Fe 3d6
解析 (1)根据盖斯定律反应Ⅲ×2-反应Ⅰ=Ⅳ,则ΔH4=2×ΔH3-ΔH1=(-395.6×2+156.9) kJ/mol=-634.3 kJ/mol;
(2)CO2加氢合成甲烷时,也有副产物发生,主反应是放热反应,副反应是吸热反应,通常控制温度为500 ℃左右,此时催化剂的活性高,反应速率快,由于有副反应发生,因此应是主反应催化剂选择性好,而温度高,副反应平衡正向移动,主反应平衡逆向移动;
(3)500 ℃时,向1 L恒容密闭容器中充入4 mol CO2和12 mol H2,初始压强为p,20 min时主、副反应都达到平衡状态,测得c(H2O)=5 mol·L-1,体系压强为p,建立三段式:
2x+y=5,根据物质的量之比等于压强之比得到=,解得x=2,y=1,则0~20 min内v(CH4)===0.1 mol/(L·min),平衡时CH4选择性×100%≈66.7%;
(4)当改变外界条件时,实验数据如图中的曲线b所示,斜率降低,说明活化能降低,则实验可能改变的外界条件是使用更高效的催化剂或增大催化剂的比表面积;
(5)由图可知,黑球代表M(NH3)6,位于顶点和面心,个数为8×+6×=4,白球代表BH4,位于体内,个数为8,则黑球∶白球=4∶8=1∶2,则化学式为M(NH3)6(BH4)2,摩尔质量为188 g·mol-1,则M的摩尔质量为(188-17×6-15×2) g·mol-1=56 g·mol-1,则M元素为Fe;M(NH3)6(BH4)2中,NH3为分子,不带电荷,BH带1个单位负电荷,则Fe为+2价,其价电子排布式为3d6。
4.答案 (1) 丙烯酸乙酯或2-丙烯酸乙酯 碳氟键(或氟原子或碳卤键)、羟基
(2) 10
(3)+2+K2CO3―→++KHCO3+KCl 还原反应
(4)
解析 根据已知②、D的结构简式,推知C为,由已知①中曼尼希反应,A为与HCHO、B反应生成C,故B的结构简式为,D与发生取代反应生成E,对比F、G的结构简式可知,E发生水解反应生成F,F与发生加成反应生成G,推知F为,G与发生取代反应生成H,H在NaH条件下发生取代反应成环生成I,I发生还原反应生成J,J系列转化生成K。(1) 化学名称是丙烯酸乙酯或2-丙烯酸乙酯,F中所含官能团的名称是亚氨基、碳氟键(或氟原子或碳卤键)、羟基;(2)B的结构简式为,B的芳香族同分异构体含有苯环()或吡啶环(),B的同分异构体只有一个侧链,若为苯环,侧链为CH3CH2NH2、CH3NHCH3失去1个氢原子形成的基团,依次有3种、2种,去掉B本身,该情况有4种;若为吡啶环,侧链只能为—CH2CH2CH3或—CH(CH3)2,与N原子分别有邻、间、对3种位置关系,符合条件的同分异构体共有4+3×2=10种;(3)D→E需要在足量K2CO3条件下进行,该化学方程式为+2+K2CO3―→++KHCO3+KCl;I~J的反应类型为还原反应;(4)根据信息②,还原生成,结合F→G→H→I的转化可知,与反应生成,然后与反应生成,最后在NaH条件下反应生成。
非选择题:本题共4小题。
1.铁是人体必需的微量元素之一,菠菜、黑木耳等食品中富含铁元素,其中菠菜中的铁元素主要以草酸亚铁(FeC2O4)的形式存在,草酸亚铁粉末难溶于水。某小组设计实验检验和测定菠菜中的铁元素。
(1)隔绝空气的条件下草酸亚铁受热分解的化学方程式是___________________________________________________________________
__________________________________________________________________。
(2)菠菜的预处理
上述预处理流程中需要用到的仪器有烧杯、玻璃棒、酒精灯、 (从下图中选择,写出名称)。
(3)检验待测液中是否含有Fe2+、Fe3+
检验试剂 现象 结论
① 溶液变为红色 待测液中含有Fe3+
② ③ 待测液中含有Fe2+
(4)利用KMnO4标准溶液测定菠菜中铁元素的含量
步骤Ⅰ:取10.00 mL待测液于锥形瓶中,滴加KMnO4溶液至溶液显紫色。
步骤Ⅱ:向步骤Ⅰ得到的混合液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤Ⅲ:向步骤Ⅱ所得待测液中加入适量稀H2SO4,用c mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液V mL。
①步骤Ⅰ滴加KMnO4溶液的目的是_________________________________
_______________________________________________________________。
②步骤Ⅲ滴加KMnO4溶液时发生反应的离子方程式为___________________________________________________________________
________________________________________________________________。
③菠菜中铁的含量为 mg/100 g(即每100 g菠菜中铁元素的质量)。
2.锂离子电池通常含有多种金属元素,废弃锂离子电池的回收处理对资源利用和环境保护有重要意义。某实验小组从某废旧锂电池正极活性材料[主要成分可表示为LiNixCo(1-x)O2]中分别回收处理金属元素,工艺流程如图:
已知:①“酸浸”后滤液中主要金属阳离子为Li+、Ni2+、Co2+。
②沉镍反应为
回答下列问题:
(1)基态氧原子的核外电子空间运动状态有 种。丁二酮肟分子中sp3杂化的原子个数为 ,二丁二酮肟镍中存在的化学键有 (填序号)。
A.π键 B.氢键 C.金属键 D.配位键
(2)锂电池负极材料为Li2C6,废旧锂电池加NaCl溶液浸泡,既可将废电池充分放电,保证拆解安全,还可以达到 的目的。
(3)“酸浸”过程的主要反应离子方程式为_______________________________
__________________________________________________________________。
(4)“萃取”钴离子的原理可表示为2HA+Co2+CoA2+2H+,pH太小萃取率偏低的原因为_________________________________________________________
___________________________________________________________________。
(5)CoC2O4和Li2CO3在空气氛围中焙烧可得到LiCoO2,该反应化学方程式为___________________________________________________________________
___________________________________________________________________。
(6)将草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中固体残留率(固体残留率=×100%)变化如图,则C点固体物质化学式为 。
3.我国提出2060年前实现碳中和,为有效降低大气中CO2的含量,以CO2为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。CO2在固体催化剂表面加氢合成甲烷过程中发生如下反应:
Ⅰ.主反应:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1=-156.9 kJ·mol-1
Ⅱ.副反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.1 kJ·mol-l
(1)已知:Ⅲ.2H2(g)+O2(g)===2H2O(g) ΔH3=-395.6 kJ·mol-1
Ⅳ.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH4= 。
(2)CO2加氢合成甲烷时,通常控制温度为500 ℃左右,其可能的原因为 。
A.反应速率快 B.平衡转化率高
C.催化剂活性高 D.主反应催化剂选择性好
(3)500 ℃时,向1 L恒容密闭容器中充入4 mol CO2和12 mol H2,初始压强为p,20 min时主、副反应都达到平衡状态,测得c(H2O)=5 mol·L-1,体系压强为3/4p,则0~20 min内v(CH4)= mol·L-1·min-1,平衡时CH4选择性= (CH4选择性=×100%,计算保留三位有效数字)。
(4)以CO2催化加氢合成的甲醇为原料,在催化剂作用下可以制取丙烯,反应的化学方程式为3CH3OH(g)C3H6(g)+3H2O(g)。该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arhenius经验公式Rlnk=-+C,(Ea为活化能,k为速率常数,R和C为常数)。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是 。
(5)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为NH3配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为188 g·mol-1,则M元素为 (填元素符号),在该化合物中,M离子的价电子排布式为__________________________________________________________________。
4.化合物J是合成抑郁症药物的一种中间体,利用曼尼希(Mannich)反应合成K的路线如图所示:
已知:①曼尼希(Mannich)反应
(R=烃基,H);
②R1COR2R1CH(OH)R2或R1COOR2R1CH2OH(R=烃基);
③Et代表乙基,属于芳香族化合物。
回答下列问题:
(1) 化学名称是 ,F中所含官能团的名称是亚氨基、 。
(2)B的结构简式为 ,B只有一个侧链且是六元芳香化合物的同分异构体数目有 种。
(3)D→E需要在足量K2CO3条件下进行,该化学方程式为___________________________________,I→J的反应类型是 。
(4)综合上述信息,写出由和制备的合成路线(其它试剂任选)。
非选择题专练5
1.答案 (1)FeC2O4FeO+CO↑+CO2↑
(2)坩埚、漏斗、100 mL容量瓶 (3)①KSCN溶液
②K3[Fe(CN)6]溶液 ③产生特征蓝色沉淀 (4)①将待测液中的H2C2O4等还原性杂质氧化除去;将Fe2+氧化为Fe3+ ②5Fe2++MnO+8H+===5Fe3++Mn2++4H2O ③2 800cV
解析 (1)由草酸亚铁中各元素化合价知,隔绝空气的条件下其受热分解生成FeO、CO、CO2。(2)灼烧需要坩埚,过滤需要漏斗,配制100 mL溶液需要100 mL容量瓶。(3)①由检验三价铁离子的现象为“溶液变为红色”可知,加入的试剂为KSCN溶液。②检验二价铁离子可用K3[Fe(CN)6]溶液。③二价铁离子与K3[Fe(CN)6]反应产生特征蓝色沉淀。(4)①由上述分析知,待测液中含有Fe2+,且待测液中还可能含有H2C2O4等还原性杂质,故步骤Ⅰ滴加KMnO4溶液的目的是将待测液中的H2C2O4等还原性杂质氧化除去,同时将Fe2+氧化为Fe3+。②Fe2+与MnO在酸性条件下发生氧化还原反应,产生Fe3+、Mn2+、H2O,根据得失电子守恒、电荷守恒、原子守恒,可配平离子方程式。③由关系式5Fe2+~MnO,可得n(Fe2+)=5n(KMnO4)=5cV×10-3 mol,则100 mL待测液中铁元素的质量为×5cV×10-3 mol×56 g·mol-1=2 800×10-3cV g=2 800cV mg,故100 g菠菜中铁的含量为2 800cV mg。
2.答案 (1)5 4 AD
(2)将负极锂元素转移到正极材料中,提高锂的回收率
(3)2LiNixCo(1-x)O2+6H++H2O2===2Li++2xNi2++2(1-x)Co2++4H2O+O2↑
(4)pH越小,H+浓度越大,平衡逆向移动,降低了萃取率
(5)4CoC2O4+2LiCO3+3O24LiCoO2+10CO2
(6)Co2O3
解析 (1)基态氧原子的核外电子排布式为1s22s22p4,轨道数为5,核外电子空间运动状态有5种,丁二酮肟分子中sp3杂化的原子是两个甲基中的碳原子,两个羟基中的氧原子,个数为4,二丁二酮肟镍中存在的化学键有σ键、π键、配位键,氢键不属于化学键,金属键存在于金属或合金中,故答案选AD。
(2)锂电池负极材料为Li2C6,废旧锂电池加NaCl溶液浸泡,可将废电池充分放电,保证拆解安全,还可以达到将负极锂元素转移到正极材料中,提高锂的回收率的目的。
(3)从题干可知,酸浸后的滤液中主要金属阳离子为Li+、Ni2+和Co2+,同时有氧气生成,酸浸过程中的主要反应离子方程式为2LiNixCo(1-x)O2+6H++H2O2===2Li++2xNi2++2(1-x)Co2++4H2O+O2↑。
(4)萃取钴离子的原理可表示为2HA+Co2+CoA2+2H+,pH越小,氢离子浓度越大,该反应化学平衡逆向移动,降低了萃取率。
(5)CoC2O4与Li2CO3在空气中焙烧可得到LiCoO2,Co失电子化合价从+2价升高为+3价,则反应物中O2得电子生成CO2,根据得失电子守恒和原子守恒,反应的化学方程式为4CoC2O4+2Li2CO3+3O24LiCoO2+10CO2。
(6)CoC2O4·2H2O(M=183 g/mol),取1 mol的CoC2O4·2H2O,则Co元素的质量为59 g,C点固体物质中O元素约为183 g×45.36%-59 g=24 g,Co原子和O原子物质的量之比为1∶1.5,化学式为Co2O3。
3.答案 (1)-634.3 kJ·mol-1
(2)ACD
(3)0.1 mol·L-1·min-1 66.7%
(4)使用更高效的催化剂或增大催化剂的比表面积
(5)Fe 3d6
解析 (1)根据盖斯定律反应Ⅲ×2-反应Ⅰ=Ⅳ,则ΔH4=2×ΔH3-ΔH1=(-395.6×2+156.9) kJ/mol=-634.3 kJ/mol;
(2)CO2加氢合成甲烷时,也有副产物发生,主反应是放热反应,副反应是吸热反应,通常控制温度为500 ℃左右,此时催化剂的活性高,反应速率快,由于有副反应发生,因此应是主反应催化剂选择性好,而温度高,副反应平衡正向移动,主反应平衡逆向移动;
(3)500 ℃时,向1 L恒容密闭容器中充入4 mol CO2和12 mol H2,初始压强为p,20 min时主、副反应都达到平衡状态,测得c(H2O)=5 mol·L-1,体系压强为p,建立三段式:
2x+y=5,根据物质的量之比等于压强之比得到=,解得x=2,y=1,则0~20 min内v(CH4)===0.1 mol/(L·min),平衡时CH4选择性×100%≈66.7%;
(4)当改变外界条件时,实验数据如图中的曲线b所示,斜率降低,说明活化能降低,则实验可能改变的外界条件是使用更高效的催化剂或增大催化剂的比表面积;
(5)由图可知,黑球代表M(NH3)6,位于顶点和面心,个数为8×+6×=4,白球代表BH4,位于体内,个数为8,则黑球∶白球=4∶8=1∶2,则化学式为M(NH3)6(BH4)2,摩尔质量为188 g·mol-1,则M的摩尔质量为(188-17×6-15×2) g·mol-1=56 g·mol-1,则M元素为Fe;M(NH3)6(BH4)2中,NH3为分子,不带电荷,BH带1个单位负电荷,则Fe为+2价,其价电子排布式为3d6。
4.答案 (1) 丙烯酸乙酯或2-丙烯酸乙酯 碳氟键(或氟原子或碳卤键)、羟基
(2) 10
(3)+2+K2CO3―→++KHCO3+KCl 还原反应
(4)
解析 根据已知②、D的结构简式,推知C为,由已知①中曼尼希反应,A为与HCHO、B反应生成C,故B的结构简式为,D与发生取代反应生成E,对比F、G的结构简式可知,E发生水解反应生成F,F与发生加成反应生成G,推知F为,G与发生取代反应生成H,H在NaH条件下发生取代反应成环生成I,I发生还原反应生成J,J系列转化生成K。(1) 化学名称是丙烯酸乙酯或2-丙烯酸乙酯,F中所含官能团的名称是亚氨基、碳氟键(或氟原子或碳卤键)、羟基;(2)B的结构简式为,B的芳香族同分异构体含有苯环()或吡啶环(),B的同分异构体只有一个侧链,若为苯环,侧链为CH3CH2NH2、CH3NHCH3失去1个氢原子形成的基团,依次有3种、2种,去掉B本身,该情况有4种;若为吡啶环,侧链只能为—CH2CH2CH3或—CH(CH3)2,与N原子分别有邻、间、对3种位置关系,符合条件的同分异构体共有4+3×2=10种;(3)D→E需要在足量K2CO3条件下进行,该化学方程式为+2+K2CO3―→++KHCO3+KCl;I~J的反应类型为还原反应;(4)根据信息②,还原生成,结合F→G→H→I的转化可知,与反应生成,然后与反应生成,最后在NaH条件下反应生成。
同课章节目录
