2 2.1共价键(共18张ppt)化学人教版(2019)选择性必修
文档属性
| 名称 | 2 2.1共价键(共18张ppt)化学人教版(2019)选择性必修 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-18 22:20:27 | ||
图片预览




文档简介
(共18张PPT)
第二章 分子结构与性质
第一节 共价键
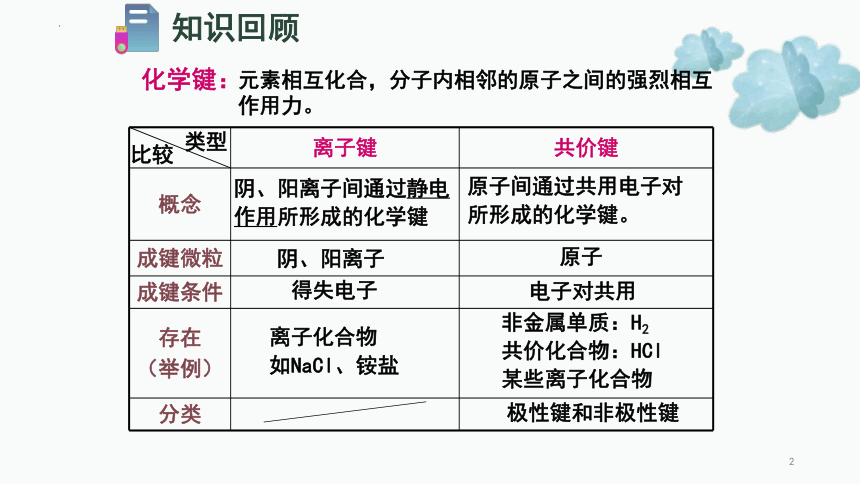
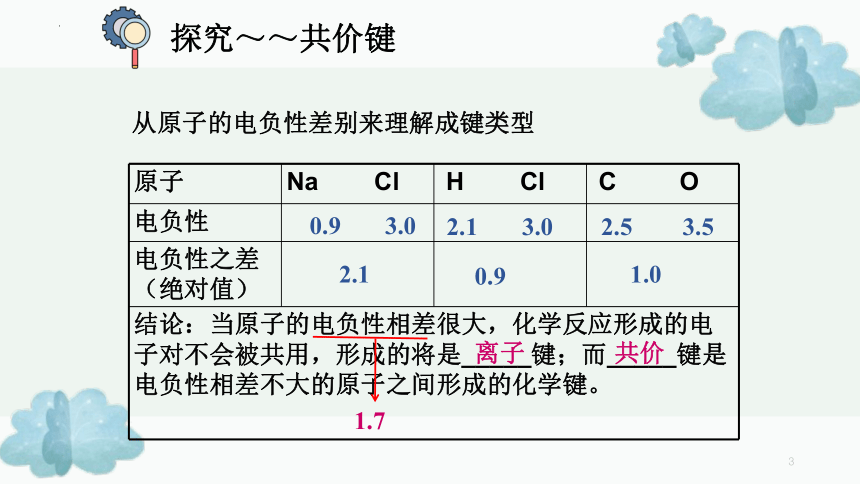
知识回顾元素相互化合,分子内相邻的原子之间的强烈相互作用力。化学键:离子键共价键概念成键微粒成键条件存在(举例)分类类型比较阴、阳离子间通过静电作用所形成的化学键阴、阳离子得失电子离子化合物如NaCl、铵盐原子间通过共用电子对所形成的化学键。原子电子对共用非金属单质:H2共价化合物:HCl某些离子化合物极性键和非极性键探究~~共价键从原子的电负性差别来理解成键类型原子Na ClH ClC O电负性电负性之差(绝对值)结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是电负性相差不大的原子之间形成的化学键。2.5 3.52.10.91.0离子共价1.70.9 3.02.1 3.0原子间通过共用电子对产生的强烈作用2.共价键的本质一、共价键H↑1sH↓1s(即原子轨道重叠)3.共价键的特征(1)饱和性按照共价键的共用电子对理论,一个原子有几个,便可和几个电子配对成键,这就是共价键的饱和性未成对电子自旋状态相反的例如只能有H2、HCl、Cl2等,不可能H3、H2Cl和Cl3等共价键的饱和性决定了共价化合物的分子组成。一、共价键
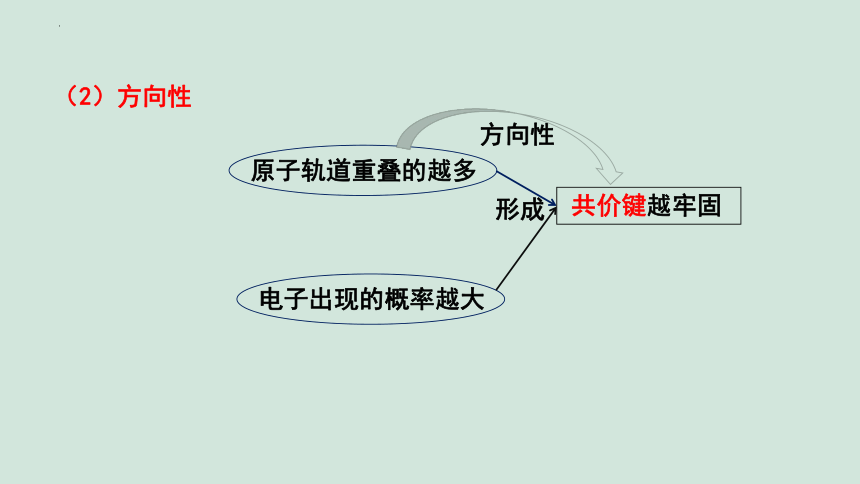
原子轨道重叠的越多
电子出现的概率越大
共价键越牢固
形成
方向性
(2)方向性
思考交流
除了s轨道和s轨道重叠形成共价键外,还能找到其他轨道重叠形成共价键的例子吗?以H、Cl为例。
H-Cl
H-H
Cl-Cl
请归纳H-H、H-Cl和Cl-Cl的特点。
(1)σ键
s s σ键,如:H-H
-
s p σ键,如:H-Cl
-
p p σ键,如:Cl-Cl
-
“头碰头”
原子轨道的重叠方式:
种类
轴对称
电子云的对称方式:
4.共价键的分类
形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
一、共价键(2)π键4.共价键的分类σ键是有两个原子的p轨道“头碰头”π键是有两个原子的p轨道“肩并肩”每个π键的电子云有两块组成,它们互为镜像,这种特征称为镜面对称特征形成π键的原子轨道重叠程度较小,故π键不如σ键牢固。已知氮分子的共价键是三键,你能通过原子轨道重叠来解释其共价键的形成过程吗?通过氮气中氮氮三键形成过程的分析,如何判断共价键是σ键或是π键?
【思考交流】
单键 双键 三键
σ键
1个σ键、1个π键
1个σ键、2个π键
观察乙烷、乙烯的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
C-Cσ键
C-Hσ键
二、键参数1.键能键能指气态分子中1mol化学键解离成气态原子所吸收的能量2.键长键长是构成化学键的两个原子的核间距3.键角在多原子分子中,两个相邻共价键之间的夹角为键角键能越大,能量越低,物质越稳定。△H=反应物键能之和-生成物键能之和从以下数据中可以得到什么结论:③相同的成键原子:单键键长>双键键长>叁键键长①通常,键长越短,键能越大,共价键越稳定。探究H-FH-ClH-BrH-I键长(pm)92128141161键能(kJ/mol)567431366298C-CC=CC C键长(pm)154134120键能(kJ/mol)347598820②同种类型的共价键,成键原子的原子半径越大,键长越长。正四面体109°28′107°18′多原子分子的键角一定,表明共价键具有方向性键长和键角的数值可通过晶体的X射线衍射实验获得NH3H2OCO2常见分子的空间结构与键角三角锥形V形(角形)104°45′直线形180°CH4一、共价键键参数对分子性质的影响1.有关CH2=CH—C≡N分子中所含化学键数目
的说法正确的是( )
A.6个σ键,3个π键 B.4个σ键,3个π键
C.6个σ键,2个π键 D.3个σ键,3个π键
【课堂练习】
2.下列说法正确的是( )A.键能越大,表示该分子越容易受热分解 B.共价键都具有方向性
C.H﹣Cl的键能为431.8kJ mol﹣1,H﹣Br的键能为
366kJ mol﹣1,说明HCl比HBr分子稳定
D.在分子中,两个成键的原子间的距离叫键长
第二章 分子结构与性质
第一节 共价键
知识回顾元素相互化合,分子内相邻的原子之间的强烈相互作用力。化学键:离子键共价键概念成键微粒成键条件存在(举例)分类类型比较阴、阳离子间通过静电作用所形成的化学键阴、阳离子得失电子离子化合物如NaCl、铵盐原子间通过共用电子对所形成的化学键。原子电子对共用非金属单质:H2共价化合物:HCl某些离子化合物极性键和非极性键探究~~共价键从原子的电负性差别来理解成键类型原子Na ClH ClC O电负性电负性之差(绝对值)结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是电负性相差不大的原子之间形成的化学键。2.5 3.52.10.91.0离子共价1.70.9 3.02.1 3.0原子间通过共用电子对产生的强烈作用2.共价键的本质一、共价键H↑1sH↓1s(即原子轨道重叠)3.共价键的特征(1)饱和性按照共价键的共用电子对理论,一个原子有几个,便可和几个电子配对成键,这就是共价键的饱和性未成对电子自旋状态相反的例如只能有H2、HCl、Cl2等,不可能H3、H2Cl和Cl3等共价键的饱和性决定了共价化合物的分子组成。一、共价键
原子轨道重叠的越多
电子出现的概率越大
共价键越牢固
形成
方向性
(2)方向性
思考交流
除了s轨道和s轨道重叠形成共价键外,还能找到其他轨道重叠形成共价键的例子吗?以H、Cl为例。
H-Cl
H-H
Cl-Cl
请归纳H-H、H-Cl和Cl-Cl的特点。
(1)σ键
s s σ键,如:H-H
-
s p σ键,如:H-Cl
-
p p σ键,如:Cl-Cl
-
“头碰头”
原子轨道的重叠方式:
种类
轴对称
电子云的对称方式:
4.共价键的分类
形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
一、共价键(2)π键4.共价键的分类σ键是有两个原子的p轨道“头碰头”π键是有两个原子的p轨道“肩并肩”每个π键的电子云有两块组成,它们互为镜像,这种特征称为镜面对称特征形成π键的原子轨道重叠程度较小,故π键不如σ键牢固。已知氮分子的共价键是三键,你能通过原子轨道重叠来解释其共价键的形成过程吗?通过氮气中氮氮三键形成过程的分析,如何判断共价键是σ键或是π键?
【思考交流】
单键 双键 三键
σ键
1个σ键、1个π键
1个σ键、2个π键
观察乙烷、乙烯的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
C-Cσ键
C-Hσ键
二、键参数1.键能键能指气态分子中1mol化学键解离成气态原子所吸收的能量2.键长键长是构成化学键的两个原子的核间距3.键角在多原子分子中,两个相邻共价键之间的夹角为键角键能越大,能量越低,物质越稳定。△H=反应物键能之和-生成物键能之和从以下数据中可以得到什么结论:③相同的成键原子:单键键长>双键键长>叁键键长①通常,键长越短,键能越大,共价键越稳定。探究H-FH-ClH-BrH-I键长(pm)92128141161键能(kJ/mol)567431366298C-CC=CC C键长(pm)154134120键能(kJ/mol)347598820②同种类型的共价键,成键原子的原子半径越大,键长越长。正四面体109°28′107°18′多原子分子的键角一定,表明共价键具有方向性键长和键角的数值可通过晶体的X射线衍射实验获得NH3H2OCO2常见分子的空间结构与键角三角锥形V形(角形)104°45′直线形180°CH4一、共价键键参数对分子性质的影响1.有关CH2=CH—C≡N分子中所含化学键数目
的说法正确的是( )
A.6个σ键,3个π键 B.4个σ键,3个π键
C.6个σ键,2个π键 D.3个σ键,3个π键
【课堂练习】
2.下列说法正确的是( )A.键能越大,表示该分子越容易受热分解 B.共价键都具有方向性
C.H﹣Cl的键能为431.8kJ mol﹣1,H﹣Br的键能为
366kJ mol﹣1,说明HCl比HBr分子稳定
D.在分子中,两个成键的原子间的距离叫键长
