第二节 氯及其化合物 第2课时 教案 化学人教版高中必修第一册
文档属性
| 名称 | 第二节 氯及其化合物 第2课时 教案 化学人教版高中必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 571.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-18 00:00:00 | ||
图片预览


文档简介
氯及其化合物 (第2课时)
大单元-高中化学必修1第二章第二单元
1.了解实验室和工业上生产氯气的原理;
2.掌握实验室制备氯气的发生装置、收集装置、尾气处理装置等;
3.学会实验室制取氯气装置的设计及实验时的注意事项。
猜谜语:
黄绿有毒密度大,性质活泼显氧化,
变价金属显高价,杀菌漂白常用它。
------------打一化学物质(氯气)
通过学习氯气我们已基本了解了氯气的化学性质,那么氯气是怎么制取的呢?
【任务四】氯气的制备
【任务四】氯气的制备
1.分析产生氯气的反应
【活动设计】
研究发现,舍勒发现制备氯气的反应中MnO2被还原后得到Mn2+。 根据强氧化剂制弱氧化剂的规律,除了MnO2之外,下列哪些物质可用于实验室制取氯气? 已知氧化性强弱顺序: PbO2>KMnO4>MnO2>Cl2>Br2>Fe2O3 除了可以将Cl-氧化制取Cl2,是否能用合适的还原剂将 KClO3还原来制取Cl2? 写出制备氯气的化学方程式: 。 可用的氧化剂还有: 。 你认为可用哪种还原剂? 。
【设计意图】
应用氧化还原反应的知识对制取氯气的反应加以分析,多角度地分析化学反应,运用化学反应原理解决实际问题。
2.实验室制取氯气的装置设计
【活动设计】
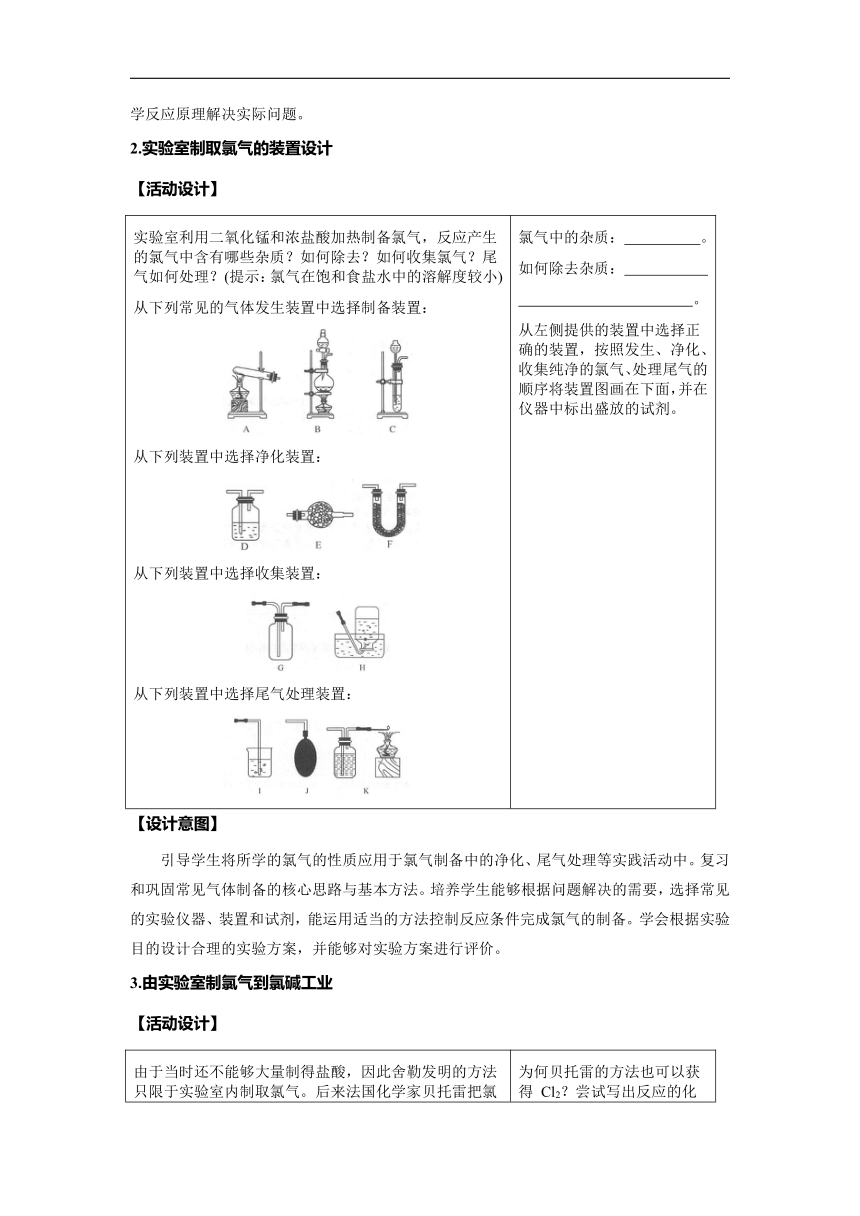
实验室利用二氧化锰和浓盐酸加热制备氯气,反应产生的氯气中含有哪些杂质?如何除去?如何收集氯气?尾气如何处理?(提示:氯气在饱和食盐水中的溶解度较小) 从下列常见的气体发生装置中选择制备装置: 从下列装置中选择净化装置: 从下列装置中选择收集装置: 从下列装置中选择尾气处理装置: 氯气中的杂质: 。 如何除去杂质: 。 从左侧提供的装置中选择正确的装置,按照发生、净化、收集纯净的氯气、处理尾气的顺序将装置图画在下面,并在仪器中标出盛放的试剂。
【设计意图】
引导学生将所学的氯气的性质应用于氯气制备中的净化、尾气处理等实践活动中。复习和巩固常见气体制备的核心思路与基本方法。培养学生能够根据问题解决的需要,选择常见的实验仪器、装置和试剂,能运用适当的方法控制反应条件完成氯气的制备。学会根据实验目的设计合理的实验方案,并能够对实验方案进行评价。
3.由实验室制氯气到氯碱工业
【活动设计】
由于当时还不能够大量制得盐酸,因此舍勒发明的方法只限于实验室内制取氯气。后来法国化学家贝托雷把氯化钠、软锰矿和浓硫酸的混合物装入铅蒸馏器中,经过加热制得了氯气,因为此法原料易得,所以自1774年舍勒制得氯气到1836年止,人们一直沿用贝托雷发明的方法来生产氯气。 1836年古萨格发明了一种焦化塔,用来吸收路布兰法生产纯碱(Na2CO3)的过程中排出的氯化氢气体得到盐酸,从此盐酸才成为一种比较便宜的酸,被广为利用。至此,舍勒发明的生产氯气的方法,经过改进,成为大规模生产氯气的方法。 上述制氯气的方法虽然在历史上都起过一定的作用,但是它们与电解法生产氯气相比,无论从经济效益还是从 生产规模上,都大为逊色。当电解法在生产上付诸实践时,上述生产氯气的方法就逐渐被淘汰了。电解法的诞生要追溯到1833年,法拉第经过一系列的实验,发现当把电流作用在氯化钠的水溶液时,能够获得氯气,同时得到氢气和烧碱。到19世纪70至80年代,出现了比较好的直流发电机,电解法才得到广泛的应用。从此,氯气的工业生产跨入了一个新纪元。 为何贝托雷的方法也可以获得 Cl2?尝试写出反应的化学方程式: 。 写出电解法制备氯气的化学方程式: 。 分析电解法为何最终能成为工业生产氯气的主流方法。 。
【设计意图】
充分利用化学史进行教学,体会化学的不断发展。启发学生从多个角度辨析工业生产和实验室制备物质的区别,同时树立可持续发展和绿色化学的意识。
4.模拟电解实验,分析反应
【活动设计】
按下列装置模拟工业电解法制备氯气:
深度思考:电解的工作原理。 查阅资料,并思考假如电解氯化镁溶液将得到什么产物。
【设计意图】
从宏观上认识化学反应,并且利用所学知识加以分析,最终转化为化学语言。
5.氯气制备的明天
【活动设计】
研究发现,将工业制备的副产品氯化氢通过催化氧化法直接转化为氯气。实现氯元素的闭路循环和反应过程的零排放,既能解决氯化氢大量过剩和氯气生产的高耗电问题,又能改善氯碱平衡,使氯碱工业优化升级,其工艺流程如下图所示。 根据所给材料写出催化氧化法制氯气的化学方程式: 。 评价左图中装置7和装置8的功能: 。
【设计意图】
以催化氧化法制氯气为素材,介绍当今多元化制备氯气的方法,培养学生快速获取信息的能力并构建价值观。同时,让学生书写陌生情境下的化学方程式和评价化工流程图中装置的功能,培养学生的科学态度与社会责任感。
1.下列关于实验室用MnO2制取Cl2的叙述中错误的是( )
A.该反应是一个氧化还原反应,其中MnO2是氧化剂
B.可以用排饱和食盐水法收集氯气
C.该反应需要加热
D.用NaOH溶液除去Cl2中混有的HCl
2.氯碱工业是化学工业的重要支柱,它的产品有( )
A.氯气 B.氯气和氢气 C.氯气和烧碱 D.氯气、氢气和烧碱
3.实验室用二氧化锰和浓盐酸来制取氯气,操作步骤正确的是( )
①将烧瓶固定在铁架台上 ②把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定铁圈放好石棉网 ③用药匙向烧瓶中加入MnO2,再向分液漏斗中加浓盐酸,并将导管放入集气瓶中 ④检查装置的气密性 ⑤在圆底烧瓶上装好分液漏斗,连接好导气管
A.②③④①⑤ B.②①③⑤④
C.②①⑤④③ D.②①③④⑤
4.下图中能验证氯化钠溶液(含酚酞)电解产物的装置是( )
5.(多选)氯化溴(BrCl)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物与非金属反应生成相应的卤化物,与水反应的化学方程式为BrCl+H2O = HCl+HBrO。下列关于BrCl的叙述错误的是( )
A.氯化溴是单质
B.和NaOH溶液反应生成NaCl和NaBrO
C.能使滴有KSCN的FeCl2溶液变成红色
D.与水反应时BrCl既是氧化剂又是还原剂
6.实验室用图1装置制备氯气。
(1)写出装置A中反应的化学方程式: 。
(2)装置B的作用是 ,装置C的作用是 ,装置E的
作用是 。
(3)本实验要求使用浓盐酸制取,这引起同学们极大的兴趣:
浓盐酸与二氧化锰反应的临界浓度(指浓盐酸与二氧化锰由反应
到不反应时浓盐酸的浓度)究竟要达到多少呢?为此同学们查阅
资料后,设计如下实验方案。
浓盐酸与二氧化锰反应过程中,浓度不断降低,当盐酸浓度降至
临界浓度时,反应停止。根据反应生成氯气的体积,可求出参加
反应的HCl的质量。用反应前HCl的总质量减去参加反应的HCl
的质量,算出剩余HCl的质量,再求出反应后剩余盐酸的质量(不含MnCl2),就可以求出临界浓度。
①本实验使用图2装置进行测定,装置中采用水浴加热的好处是
。
②通过实验测定如下数据。
已知浓盐酸浓度为36%,密度为118g·mL-1。计算上述表格中盐酸的临界浓度。
(4)通过查阅资料可知,二氧化锰与浓盐酸的反应分下列四步进行。
第一步:MnO2+2H2O = Mn(OH)4(快反应)
第二步:Mn(OH)4+4HCl = MnCl4+4H2O(快反应)
第三步:MnCl4MnCl2+2C1·(慢反应)
第四步:C1·+Cl·= C12↑(快反应)
已知水溶液中MnCl4为绿色,MnCl2为浅粉色。请设计实验证明二氧化锰与浓盐酸的反应过程中经历了第三步反应: 。
练习与测评参考答案
【评价】
题号 核心素养 水平 解答与说明
1 宏观辨识与微观探析 水平1 D
2 宏观辨识与微观探析 水平1 D
3 宏观辨识与微观探析 水平2 C
4 宏观辨识与微观探析 水平2 D
5 宏观辨识与微观探析 科学探究与创新意识 水平3 AD
6 科学探究与创新意识 科学精神与社会责任 水平3 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)除去氯气中的氯化氢气体; 除去氯气中的水蒸气;安全瓶 (3)①受热均匀、可以控制温度、减少盐酸的挥发; ②22.12%;21.91%;21.52%;21.85% (4)先用MnO2和冷浓盐酸反应,一会儿再加热,如果加热前观察到溶液变绿色且无气体生成,加热后溶液的绿色消失并产生黄绿色气体,则说明反应经历了第三步过程
大单元-高中化学必修1第二章第二单元
1.了解实验室和工业上生产氯气的原理;
2.掌握实验室制备氯气的发生装置、收集装置、尾气处理装置等;
3.学会实验室制取氯气装置的设计及实验时的注意事项。
猜谜语:
黄绿有毒密度大,性质活泼显氧化,
变价金属显高价,杀菌漂白常用它。
------------打一化学物质(氯气)
通过学习氯气我们已基本了解了氯气的化学性质,那么氯气是怎么制取的呢?
【任务四】氯气的制备
【任务四】氯气的制备
1.分析产生氯气的反应
【活动设计】
研究发现,舍勒发现制备氯气的反应中MnO2被还原后得到Mn2+。 根据强氧化剂制弱氧化剂的规律,除了MnO2之外,下列哪些物质可用于实验室制取氯气? 已知氧化性强弱顺序: PbO2>KMnO4>MnO2>Cl2>Br2>Fe2O3 除了可以将Cl-氧化制取Cl2,是否能用合适的还原剂将 KClO3还原来制取Cl2? 写出制备氯气的化学方程式: 。 可用的氧化剂还有: 。 你认为可用哪种还原剂? 。
【设计意图】
应用氧化还原反应的知识对制取氯气的反应加以分析,多角度地分析化学反应,运用化学反应原理解决实际问题。
2.实验室制取氯气的装置设计
【活动设计】
实验室利用二氧化锰和浓盐酸加热制备氯气,反应产生的氯气中含有哪些杂质?如何除去?如何收集氯气?尾气如何处理?(提示:氯气在饱和食盐水中的溶解度较小) 从下列常见的气体发生装置中选择制备装置: 从下列装置中选择净化装置: 从下列装置中选择收集装置: 从下列装置中选择尾气处理装置: 氯气中的杂质: 。 如何除去杂质: 。 从左侧提供的装置中选择正确的装置,按照发生、净化、收集纯净的氯气、处理尾气的顺序将装置图画在下面,并在仪器中标出盛放的试剂。
【设计意图】
引导学生将所学的氯气的性质应用于氯气制备中的净化、尾气处理等实践活动中。复习和巩固常见气体制备的核心思路与基本方法。培养学生能够根据问题解决的需要,选择常见的实验仪器、装置和试剂,能运用适当的方法控制反应条件完成氯气的制备。学会根据实验目的设计合理的实验方案,并能够对实验方案进行评价。
3.由实验室制氯气到氯碱工业
【活动设计】
由于当时还不能够大量制得盐酸,因此舍勒发明的方法只限于实验室内制取氯气。后来法国化学家贝托雷把氯化钠、软锰矿和浓硫酸的混合物装入铅蒸馏器中,经过加热制得了氯气,因为此法原料易得,所以自1774年舍勒制得氯气到1836年止,人们一直沿用贝托雷发明的方法来生产氯气。 1836年古萨格发明了一种焦化塔,用来吸收路布兰法生产纯碱(Na2CO3)的过程中排出的氯化氢气体得到盐酸,从此盐酸才成为一种比较便宜的酸,被广为利用。至此,舍勒发明的生产氯气的方法,经过改进,成为大规模生产氯气的方法。 上述制氯气的方法虽然在历史上都起过一定的作用,但是它们与电解法生产氯气相比,无论从经济效益还是从 生产规模上,都大为逊色。当电解法在生产上付诸实践时,上述生产氯气的方法就逐渐被淘汰了。电解法的诞生要追溯到1833年,法拉第经过一系列的实验,发现当把电流作用在氯化钠的水溶液时,能够获得氯气,同时得到氢气和烧碱。到19世纪70至80年代,出现了比较好的直流发电机,电解法才得到广泛的应用。从此,氯气的工业生产跨入了一个新纪元。 为何贝托雷的方法也可以获得 Cl2?尝试写出反应的化学方程式: 。 写出电解法制备氯气的化学方程式: 。 分析电解法为何最终能成为工业生产氯气的主流方法。 。
【设计意图】
充分利用化学史进行教学,体会化学的不断发展。启发学生从多个角度辨析工业生产和实验室制备物质的区别,同时树立可持续发展和绿色化学的意识。
4.模拟电解实验,分析反应
【活动设计】
按下列装置模拟工业电解法制备氯气:
深度思考:电解的工作原理。 查阅资料,并思考假如电解氯化镁溶液将得到什么产物。
【设计意图】
从宏观上认识化学反应,并且利用所学知识加以分析,最终转化为化学语言。
5.氯气制备的明天
【活动设计】
研究发现,将工业制备的副产品氯化氢通过催化氧化法直接转化为氯气。实现氯元素的闭路循环和反应过程的零排放,既能解决氯化氢大量过剩和氯气生产的高耗电问题,又能改善氯碱平衡,使氯碱工业优化升级,其工艺流程如下图所示。 根据所给材料写出催化氧化法制氯气的化学方程式: 。 评价左图中装置7和装置8的功能: 。
【设计意图】
以催化氧化法制氯气为素材,介绍当今多元化制备氯气的方法,培养学生快速获取信息的能力并构建价值观。同时,让学生书写陌生情境下的化学方程式和评价化工流程图中装置的功能,培养学生的科学态度与社会责任感。
1.下列关于实验室用MnO2制取Cl2的叙述中错误的是( )
A.该反应是一个氧化还原反应,其中MnO2是氧化剂
B.可以用排饱和食盐水法收集氯气
C.该反应需要加热
D.用NaOH溶液除去Cl2中混有的HCl
2.氯碱工业是化学工业的重要支柱,它的产品有( )
A.氯气 B.氯气和氢气 C.氯气和烧碱 D.氯气、氢气和烧碱
3.实验室用二氧化锰和浓盐酸来制取氯气,操作步骤正确的是( )
①将烧瓶固定在铁架台上 ②把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定铁圈放好石棉网 ③用药匙向烧瓶中加入MnO2,再向分液漏斗中加浓盐酸,并将导管放入集气瓶中 ④检查装置的气密性 ⑤在圆底烧瓶上装好分液漏斗,连接好导气管
A.②③④①⑤ B.②①③⑤④
C.②①⑤④③ D.②①③④⑤
4.下图中能验证氯化钠溶液(含酚酞)电解产物的装置是( )
5.(多选)氯化溴(BrCl)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物与非金属反应生成相应的卤化物,与水反应的化学方程式为BrCl+H2O = HCl+HBrO。下列关于BrCl的叙述错误的是( )
A.氯化溴是单质
B.和NaOH溶液反应生成NaCl和NaBrO
C.能使滴有KSCN的FeCl2溶液变成红色
D.与水反应时BrCl既是氧化剂又是还原剂
6.实验室用图1装置制备氯气。
(1)写出装置A中反应的化学方程式: 。
(2)装置B的作用是 ,装置C的作用是 ,装置E的
作用是 。
(3)本实验要求使用浓盐酸制取,这引起同学们极大的兴趣:
浓盐酸与二氧化锰反应的临界浓度(指浓盐酸与二氧化锰由反应
到不反应时浓盐酸的浓度)究竟要达到多少呢?为此同学们查阅
资料后,设计如下实验方案。
浓盐酸与二氧化锰反应过程中,浓度不断降低,当盐酸浓度降至
临界浓度时,反应停止。根据反应生成氯气的体积,可求出参加
反应的HCl的质量。用反应前HCl的总质量减去参加反应的HCl
的质量,算出剩余HCl的质量,再求出反应后剩余盐酸的质量(不含MnCl2),就可以求出临界浓度。
①本实验使用图2装置进行测定,装置中采用水浴加热的好处是
。
②通过实验测定如下数据。
已知浓盐酸浓度为36%,密度为118g·mL-1。计算上述表格中盐酸的临界浓度。
(4)通过查阅资料可知,二氧化锰与浓盐酸的反应分下列四步进行。
第一步:MnO2+2H2O = Mn(OH)4(快反应)
第二步:Mn(OH)4+4HCl = MnCl4+4H2O(快反应)
第三步:MnCl4MnCl2+2C1·(慢反应)
第四步:C1·+Cl·= C12↑(快反应)
已知水溶液中MnCl4为绿色,MnCl2为浅粉色。请设计实验证明二氧化锰与浓盐酸的反应过程中经历了第三步反应: 。
练习与测评参考答案
【评价】
题号 核心素养 水平 解答与说明
1 宏观辨识与微观探析 水平1 D
2 宏观辨识与微观探析 水平1 D
3 宏观辨识与微观探析 水平2 C
4 宏观辨识与微观探析 水平2 D
5 宏观辨识与微观探析 科学探究与创新意识 水平3 AD
6 科学探究与创新意识 科学精神与社会责任 水平3 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)除去氯气中的氯化氢气体; 除去氯气中的水蒸气;安全瓶 (3)①受热均匀、可以控制温度、减少盐酸的挥发; ②22.12%;21.91%;21.52%;21.85% (4)先用MnO2和冷浓盐酸反应,一会儿再加热,如果加热前观察到溶液变绿色且无气体生成,加热后溶液的绿色消失并产生黄绿色气体,则说明反应经历了第三步过程
