山东省济阳县第一中学人教版高中化学选修四单元复习测试卷:第2章 化学反应速率和化学平衡
文档属性
| 名称 | 山东省济阳县第一中学人教版高中化学选修四单元复习测试卷:第2章 化学反应速率和化学平衡 |  | |
| 格式 | zip | ||
| 文件大小 | 598.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-10-28 13:13:13 | ||
图片预览




文档简介
人教版高中化学选修四
第二章化学反应速率和化学平衡单元测试
(测试时间:90分钟 满分100分)
选择题(每题只有一个正确选项,每题3分,共51分)
1.改编(化学反应进行的方向)下列说法不正确的是( )
A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B.凡是放热反应都是自发的,因为吸热反应都是非自发的
C.NH4HCO3(s) == NH3( ( http: / / www.21cnjy.com )g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
D.反应2Mg(s)+CO2(g) == C (s)+2MgO(s)能自发进行,则该反应的ΔH<0
答案 B
解析:ΔH<0、ΔS>0,则ΔH-TΔS<0,任何温度下反应都能自发进行,A正确;某些熵增的吸热反
应也能自发进行,B错误; C项,ΔH >0,能自发,说明ΔS >0,正确;D项,反应的ΔS
<0,能自发,说明ΔH<0,正确.
1-1.下列说法正确的是( ).
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
答案 C
解析:反应的自发性是由熵变和焓变共同决定的 ( http: / / www.21cnjy.com ),A、B错误.C项中反应的ΔS>0,若ΔH<0,则一定自发,现常温下不自发,说明ΔH>0,正确.D项中反应的ΔS<0,能自发,说明ΔH<0,错误.
1-2.下列说法正确的是( )
A.一定温度下,反应MgCl2(l) == Mg(l)+Cl2(g)的ΔH>0 ΔS>0
B.凡是放热反应都是自发的,凡是吸热反应都是非自发的
C.常温下,水电解生成氢气和氧气,即常温下水的分解反应是自发反应
D.H2O(g)变成液态水,ΔS>0
答案 A
解析:镁在氯气中的燃烧是放热反应,反之则为 ( http: / / www.21cnjy.com )吸热反应,MgCl2的分解是熵值增大的反应,ΔS>0,A正确;有些吸热反应也可以自发进行,如2N2O5(g) == 4NO2(g)+O2(g) ΔH>0,B错误;水在常温常压下电解才能发生分解,即环境对它做功,才能使它发生反应,所以是非自发反应,C错误;同种物质气态时熵值最大,H2O(g)变成液态水,熵值减小ΔS<0,D错误.
2.原创(化学反应速率)在2 L的密闭容器中,发生以下反应:2A(g)+B(g) xC(g)+D(g).若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,生成C的物质的量为2.4mol,则下列说法不正确的是( )
A.X=2
B.10秒时B的物质的量为2.8 mol
C.前10秒钟D的平均反应速率为0.12 mol·L-1·s-1
D.A的转化率为60%
答案 C
解析: 前10秒钟,C的平 ( http: / / www.21cnjy.com )均反应速率为0.12 mol·L-1·s-1 , 根据速率之比等于系数之比,x=2, 前10秒钟D的平均反应速率为0.06mol·L-1·s-1 ,则A项正确,C项错误,D项 ,前10秒钟,B的平均反应速率为0.06 mol·L-1·s-1,则消耗的B的物质的量为0.06 mol·L-1·s-1×10 s×2 L=1.2 mol,B剩余的物质的量为4 mol-1.2 mol=2.8 mol,B正确,前10秒钟参加反应的A为0.12 mol·L-1·s-1×10 s×2 L=2.4mol,所以A的转化率为60%,D正确.
2-1.N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g)ΔH>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
A.0~20 s内平均反应速率v(N2O5)=0.1 mol·(L·s)-1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
答案 D
解析:0~20 s内,v(N2O5)==0.05 mol·(L·s)-1;10 s时,反应仍在向正反应方向进行,v(正)>v(逆);20 s时,v(正)=v(逆),反应达到平衡状态.
2-2.在恒温、恒容的容器中进行反应:2HIH2+I2 ΔH>0,反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 s B.等于12 s C.大于12 s D.小于12 s
答案 C
解析:随着反应的进行,反应物的浓度逐渐减小,所以后一阶段的平均反应速率小于前一阶段的平均反应速率,即 > ,解得Δt>12 s.
3.原创(影响化学反应速率的因素) 运用外界条件对化学反应速率的影响理论,判断下列叙述正确的是( )
A.钠常温下与氧气反应生成Na2O,升高温度生成 Na2O的速率加快
B.常温下,铜与稀硝酸反应生成NO,增大硝酸的浓度,生成NO的速率加快
C.锌与稀硫酸制备氢气,加入少量的硫酸铜溶液,生成H2的速率加快
D.对密闭容器中发生的反应2NO22NO+O2 缩小体积,增大压强,V(正)减小,V(逆)增大
答案 C
解析:升高温度钠与氧气生成过氧化钠,铜与浓硝酸反应生成二氧化氮,对2NO2 == 2NO
+O2 缩小体积,增大压强V(正)V(逆)都增大,A、B、D错误,锌与稀硫酸制备氢气,
加入少量的硫酸铜溶液,锌与置换出的铜形成无数微小的原电池,加快了反应速率,C正确.
3-1.在密闭容器中发生如下反应:2X(g)+Y(g) Z(g) ΔH<0.如图是表示该反应的速率
(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则
下列说法中不正确的是( )
( http: / / www.21cnjy.com )
A.t3时减小了压强 B.t1-t6时间段 t6时X的转化率最高
C.t5时升高了温度 D.t2时使用了催化剂
答案 B
解析:t1时反应达到平衡,t2时正逆反应速率同等倍数的增大,应该是使用了催化剂;t3时
正逆反应速率都减小,但V(逆)>V(正),应该是缩小体积减小压强;t5时正逆反应速率
都增大,但V(逆)>V(正),向逆反应方向(吸热方向)移动,应该是升温;t1-t6时间段 两
次平衡移动都是向逆反应方向移动,所以 t6时X的转化率最低.
3-2.用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体.下列措施对改变反应的速率几乎没
有影响的是( )
A.用相同浓度但温度较高的盐酸代替常温下的盐酸
B.增大反应体系的压强或减小反应体系的压强
C.改用相同质量但为粉末状态的碳酸钙代替块状碳酸钙
D.改用与原盐酸含有相同H+浓度的稀硫酸
答案 B
解析 由于CaCO3和稀盐酸是固体和液 ( http: / / www.21cnjy.com )体之间的反应,所以改变压强对反应速率几乎没有影响.改用与原盐酸含有相同H+浓度的稀硫酸,由于硫酸钙微溶,包在碳酸钙周围,阻碍反应的发生,速率减小.
4.原创(可逆反应及其特点)在体积 ( http: / / www.21cnjy.com )为2L的密闭容器中通入0.4molSO2和0.2molO2发生反应2SO2+O2 2SO3,下列叙述正确的是( )
A.若反应中加入的是18O2,达到平衡后SO2中不可能含有18O
B.平衡时,SO3的浓度可能为0.2 mol/L
C.当不再生成SO3时反应达到平衡
D.温度不变,改变SO2和O2的加入量,达到平衡时C2(SO3)/C2(SO2)·C(O2)不变
答案 D
解析:18O2中的18O通过化合反 ( http: / / www.21cnjy.com )应存在于SO3中,SO3 中的18O通过分解反应会存在于SO2中,最终SO3、SO2、O2中都含有18O,A项错误;可逆反应不可能进行到底,B项错误;可逆反应的化学平衡为动态平衡,平衡时生成三氧化硫的反应并没有停止,C项错误;C2(SO3)/C2(SO2)·C(O2)为该反应的平衡常数,温度不变平衡常数不变,D项正确.
4-1.在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L.当反应达到平衡时可能存在的数据是( )
A.SO2为0.4 mol/L,O2为0.2 mol/L
B.SO3为0.25 mol/L
C.SO2、SO3均为0.15 mol/L
D.SO3为0.4 mol/L
答案 B
解析: A项数据表明,题中0.2 mol/L ( http: / / www.21cnjy.com )的SO3完全转化成了SO2和O2,即平衡时,c(SO3)=0,这是不可能的;B项说明在题给浓度的基础上又有0.05 mol/L SO2和0.025 mol/L O2化合生成0.05 mol/L SO3,这是可能的;C项数据表明SO2、SO3的浓度都在原浓度基础上减少了0.05 mol/L,这也是不可能的;D项数据说明SO2完全转化成了SO3,即平衡时c(SO2)=0,c(O2)=0,这也是不可能的.
4-2.对于某一可逆反应,在不同条件下的平衡状态中,正、逆反应速率的关系是( )
答案 A
解析:四个选项中,只有选项A在任意时刻都会v(正)=v(逆),即反应处于平衡状态.
5.改编(化学平衡状态的判定)一定条件下,在固定容积密闭容器中发生可逆反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列对反应是否达到平衡的推断正确的是( )
A.达到化学平衡时,化学反应速率的关系是3v正(NH3)=2v逆 (H2O)
B.达到化学平衡时,NH3、O2、NO、H2O物质的量之比为4∶5∶4∶6
C.混合气体的密度一定时,该化学反应达到化学平衡
D.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
答案 A
解析:A项,3v正 (NH ( http: / / www.21cnjy.com )3)=2v逆(H2O),设v正(NH3)=3则 v逆(H2O)=2那么v逆(NH3)=3,反应处于平衡状态,故A正确;B项,到达平衡时,反应混合物的物质的量关系与起始投入量及转化率有关,达到化学平衡时,NH3、O2、NO、H2O物质的量之比可能为4:5:4:6,也可能不是,故B错误;C、混合气的密度等于混合气的总质量与容器容积的比值,混合气体的总质量不变,容器的容积不变,该体系密度始终不变,不能说明到达平衡,故C错误;D项单位时间内生成x mol NO的同时消耗x mol NH3,反应进程中始终按照这样进行,故D错误.
5-1.在一定温度下的体积不变的密闭容器中,当下列哪些量不再发生变化时,表明下述反
应: A(s)+2B(g)C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量
A.②③⑤⑥⑦ B.①②③⑥⑦
C.②③④⑤⑥ D.①③④⑤⑦
答案 A
解析:A(s)+2B(s)C(g)+D(g)是反应前后气体体积相等的反应,不管是否平衡,混合气体的压强始终不变,气体的总物质的量也不变,故①④不是判断是否达到平衡的标志.
5-2.某温度下,体积一定的密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s) ΔH>0,下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体密度不变时,反应达到平衡
C.当容器中气体密度不变时,反应达到平衡
D.平衡后加入X,上述反应的ΔH增大
答案 B
解析:W为固体,故加入少 ( http: / / www.21cnjy.com )量W,反应速率不变,A错;因为W为固体,故当容器中气体密度不变时,反应达到平衡,B正确;该反应气体的物质的量不变,压强始终不变,C错误;反应的ΔH为一定值,平衡后加入X,ΔH不变,D错.
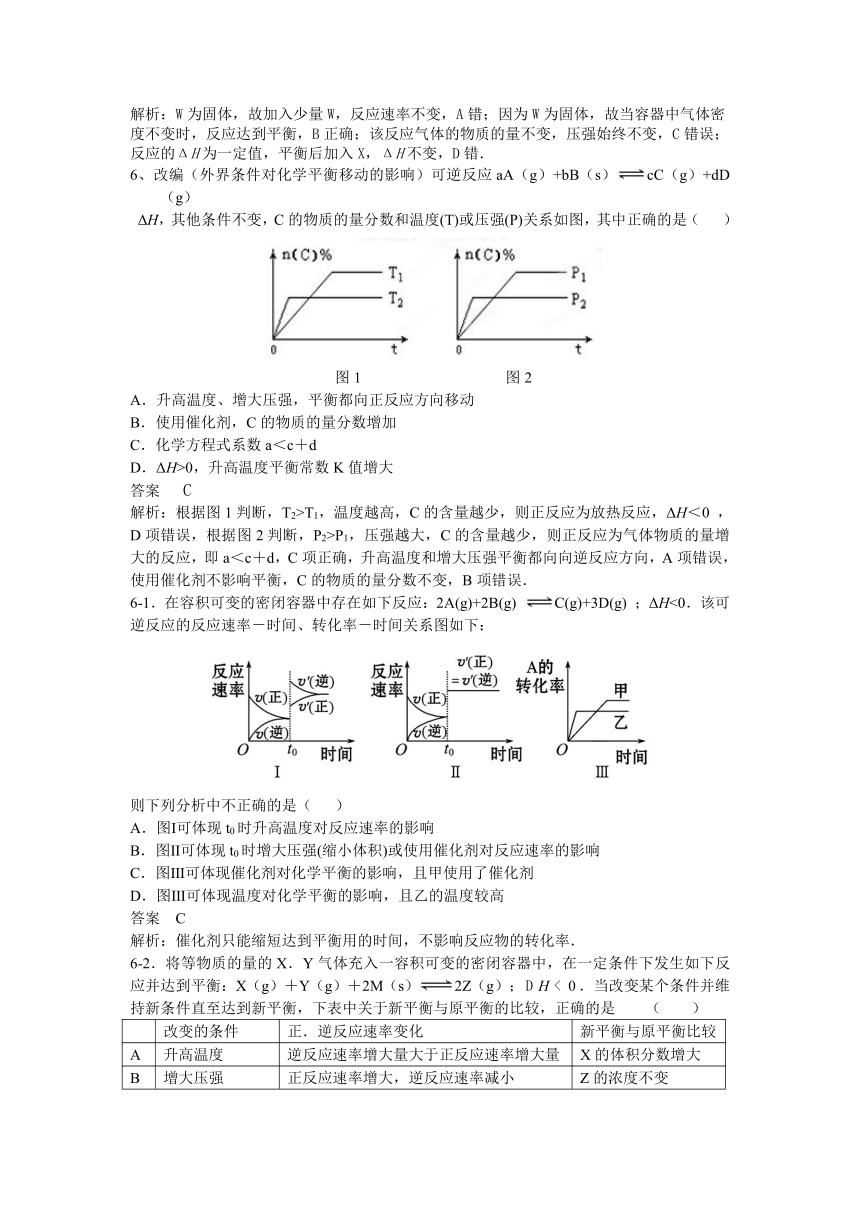
6、改编(外界条件对化学平衡移动的影响)可逆反应aA(g)+bB(s)cC(g)+dD(g)
ΔH,其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
( http: / / www.21cnjy.com )
图1 图2
A.升高温度、增大压强,平衡都向正反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.ΔH>0,升高温度平衡常数K值增大
答案 C
解析:根据图1判断,T2>T1,温度越 ( http: / / www.21cnjy.com )高,C的含量越少,则正反应为放热反应,ΔH<0 ,D项错误,根据图2判断,P2>P1,压强越大,C的含量越少,则正反应为气体物质的量增大的反应,即a<c+d,C项正确,升高温度和增大压强平衡都向向逆反应方向,A项错误,使用催化剂不影响平衡,C的物质的量分数不变,B项错误.
6-1.在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g)+3D(g) ;ΔH<0.该可逆反应的反应速率-时间、转化率-时间关系图如下:
( http: / / www.21cnjy.com )
则下列分析中不正确的是( )
A.图Ⅰ可体现t0时升高温度对反应速率的影响
B.图Ⅱ可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ可体现催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ可体现温度对化学平衡的影响,且乙的温度较高
答案 C
解析:催化剂只能缩短达到平衡用的时间,不影响反应物的转化率.
6-2.将等物质的量的X.Y气体充入一容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)+2M(s)2Z(g);.当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是 ( )
改变的条件 正.逆反应速率变化 新平衡与原平衡比较
A 升高温度 逆反应速率增大量大于正反应速率增大量 X的体积分数增大
B 增大压强 正反应速率增大,逆反应速率减小 Z的浓度不变
C 减小压强 正.逆反应速率都减小 Y的体积分数变大
D 充入一定量的Z 逆反应速率增大 X的体积分数变大
答案 A
解析:该反应是气体物质的量不变的放热反 ( http: / / www.21cnjy.com )应,升高温度,逆反应速率增大量大于正反应速率增大量,平衡逆向移动,X的体积分数增大,A项正确;增大压强,正反应速率增大倍数相同,平衡不移动,但由于体积缩小,Z的浓度增大,B项错误;减小压强,平衡不移动,Y的体积分数不变,C项错误;充入一定量的Z,由于容积可变,建立等效平衡,X的体积分数不变,D项错误.
7.(催化剂对反应速率和平衡的影响)在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示.
下列叙述正确的是( )
A.该反应的热化学方程式:N2+3H22NH3 ΔH=-92 kJ/mol
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放出的热量增多
D.加入催化剂可增大正反应速率,降低逆反应速率
答案 B
解析:A项没有标物质的状态;C项加催化剂不影响反应热;D项催化剂可增大正反应速率,也可增大逆反应速率.
7-1.根据反应Br+H2HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是( )
( http: / / www.21cnjy.com )
A.正反应吸热
B.加入催化剂,该化学反应的反应热不变
C.加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示
D.加入催化剂可增大正反应速率,降低逆反应速率
答案 D
解析:加入催化剂能同等程度地加快正、逆反应速率.
7-2.对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是( )
A.①压强对反应的影响(p2>p1)
B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响
D.④催化剂对反应的影响
答案 C
解析:①中由于p1条件下反应先达平衡状态,即p1>p2,A错误;升高温度,N2(g)+3H2(g) 2NH3(g)ΔH<0的平衡逆向移动,N2的转化率降低,图像②错误;催化剂能加快化学反应速率,缩短达到平衡的时间,故有催化剂时先达平衡,④错误;向平衡体系中加入N2瞬间,v正增大,v逆不变,v正>v逆,平衡正向移动,C正确.
8.改编(勒夏特列原理及其应用)下列实验事实不能用平衡移动原理解释的是( )
A. ( http: / / www.21cnjy.com )将NO2球浸泡在冷水和热水中,热水中的球泡颜色加
B.氯水中有下列平衡Cl2+H2OHCl+HClO,当加入碳酸钙后,HClO的浓度增大漂白性增强
C.H2O2中加入二氧化锰,生成氧气的速率加快
D.反应CO(g)+NO2(g)CO2(g)+NO(g),达平衡后,升高温度体系颜色变深
答案 C
解析:勒夏特列原理即化学平衡移动原理,必须是化学平衡移动问题,才能用该原理解释,催化剂不影响平衡,故选C .
8-1.下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B.合成氨工业中使用铁触媒做催化剂
C.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
D.对2HI(g)H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
答案:B
解析:勒夏特列原理即化学平衡移动原理,必须是化学平衡移动问题,才能用该原理解释,催化剂不影响平衡,故选B.
8-2.下列能用勒夏特列原理解释的是( )
A.高温及加入催化剂都能使合成氨的反应速率加快
B.红棕色的NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
答案 B
解析:勒夏特列原理即化学平衡移动原 ( http: / / www.21cnjy.com )理.凡是外界因素对化学平衡的影响都可用勒夏特列原理来解释.催化剂不能引起化学平衡移动,不能用原理解释.D项加压平衡不移动,颜色加深,因为体积缩小.
9、改编(化学平衡常数)在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应体
系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图
二.
( http: / / www.21cnjy.com )
下列分析不正确的是( )
A. 该反应的平衡常数表达式为:K=
B.0~4 min时,A的平均反应速率为0.01 mol/(L·min)
C.由T1向T2变化时,v正>v逆
D.平衡后升高温度,K值增大
答案 D
解析:根据图一所示A、B、C物质的量的变化,可知该可逆反应为:2A(g)+B(g) C(g),由此可知B正确; 由图一知在4 min时A消耗0.4 mol,故0~4 min时,A的平均反应速率为:0.4 mol/(10 L×4 min)=0.01 mol/(L·min);由图二知在T3时反应达到平衡,故在T3前,反应一直正向进行,v正>v逆;由T3升温到T4时,C%减小,说明平衡逆向进行,故可判知正反应为放热反应,升高温度,平衡逆向移动,K值减小
9-1.关于化学平衡常数,下列说法不正确的是( )
A.化学平衡常数不随反应物或生成物的浓度的改变而改变
B.化学平衡常数随温度的改变而改变
C.对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1
D.温度越高,K值越大
答案 D
解析:化学平衡常数K=生成物浓度幂的积/ ( http: / / www.21cnjy.com )反应物浓度幂的积, 化学平衡常数只与温度有关,与物质的浓度无关.故A、B正确,根据化学平衡常数的计算式可以知道对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1,故C正确.对放热反应,温度越高,K值越小,D项错误.
9-2、一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)
MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横
坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )
选项 x y
A 温度 容器内混合气体的密度
B CO的物质的量 CO2与CO的物质的量之比
C SO2的浓度 平衡常数K
D MgSO4的质量(忽略体积) CO的转化率
答案 A
解析:由于此反应为吸热反应,升高温度 ( http: / / www.21cnjy.com ),平衡正向移动,混合气体质量增加,密度增大,A正确;当增加CO的物质的量时,相当于增大体系的压强,平衡逆向移动,CO的转化率减小,CO2与CO的物质的量之比减小,B错误;平衡常数只与温度有关,与SO2的浓度无关,C错误;MgSO4为固体,增加其质量对平衡无影响,所以CO的转化率不变,D错误.
10.原创(化学平衡常数的应用)设反应 ( http: / / www.21cnjy.com )①Fe(s)+CO2(g)FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2.在不同温度下,K1、K2的值如下:
T/K K1 K2
973 1.47 2.38
1 173 2.15 1.67
下列有关叙述正确的是( )
A.b>0
B.在973 K下增大压强,K2增大
C.a>b
D.在1173K下反应①平衡后再充入CO2平衡正向移动,K1增大
答案 C
解析:由题意知温度升高K1增大 ( http: / / www.21cnjy.com ),K2减小,说明升温,反应①的平衡向右移动,反应②的平衡向左移动,所以①中正反应是吸热反应,a>0,②中正反应是放热反应,b<0,A错,C对;增大压强,两平衡均不移动,K2不变,B错;在1173K下反应①平衡后再充入CO2平衡正向移动,但温度不变平衡常数不变,D错误.
10-1.高温下,某反应达到平衡,平衡常数K=.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
答案 A
解析:由平衡常数K=,温度升高时H2 ( http: / / www.21cnjy.com )浓度减小,说明在恒容时平衡正向移动,ΔH>0,A正确;该反应的化学方程式CO2(g)+H2(g)CO(g)+H2O(g),在增大压强时H2的浓度不变,升高温度,v正和v逆都增大.
10-2.在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如下表:
实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
n(X) n(Y) n(M)
① 700 0.40 0.10 0.090
② 800 0.10 0.40 0.080
③ 800 0.20 0.30 a
④ 900 0.10 0.15 b
下列说法正确的是( )
A.实验①中,若5 min时测得n(M)= ( http: / / www.21cnjy.com )0.050 mol,则0至5 min 时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
答案 C
解析:A项,根据方程式可知在 ( http: / / www.21cnjy.com )5 min内反应生成的n(N)等于生成的n(M),则v(N)==1×10-3 mol·L-1·min-1,该项错误;B项,根据表格中数据可知平衡时c(X)=0.002 mol·L-1、c(Y)=0.032 mol·L-1、c(N)=c(M)=0.008 mol·L-1,则平衡常数K===1.0,该项错误;C项,因该反应在800 ℃时平衡常数为1.0,设反应中转化的X的物质的量为x,则有(0.20-x)×(0.30-x)=x·x,故x=0.12 mol,X的转化率为×100%=60%,该项正确;假设在900 ℃时,该反应的平衡常数也为1.0,根据实验④中的数据可知b=0.060,由①中数据可知在700 ℃时平衡常数约为2.6,结合800 ℃时平衡常数为1.0可知,温度越高,该平衡常数越小,平衡逆向移动,故b<0.060,该项错误.
11.改编(速率图像)如图是可逆反应A+2B2C+3D ΔH,化学反应速率与化学平衡
随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
A.ΔH<0
B.D可能是气体
C.升高温度,平衡常数K增大
D.A、B、C、D均为气体
答案 A
解析:根据图示降温平衡正向移动,说明正 ( http: / / www.21cnjy.com )反应为放热反应,ΔH<0 ,A项正确,逆反应吸热,升高温度,逆向移动,K值减小,增大压强,平衡正向移动,则正反应方向为气体物质的量减小的反应,D不可能为气体,A、B、C、D均为气体更不可能,B、D项错误.
11-1.对于可逆反应A(g)+2B(g)??2C(g)(正反应吸热),下列图象正确的是( )
( http: / / www.21cnjy.com )
答案 D
解析:加压平衡向正反应方向移动,V(正 ( http: / / www.21cnjy.com ))>V(逆),可见A、B错;升高温度,平衡向正反应方向移动,A的转化率增大,此时A的百分含量变小;同时反应速率加快,应该先达到平衡,故C错、D对;答案为D.
11-2、在密闭容器中进行反应:2SO2 ( http: / / www.21cnjy.com )(g)+O2(g)??2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )
A.催化剂失效 B.减小生成物的浓度
C.降低体系温度 D.增大容器的体积
答案:C
解析:从图像可以看出:改变条件后,反应速率与 ( http: / / www.21cnjy.com )原平衡速率出现断层且低于原平衡反应速率,说明改变的条件可能是降低温度或减压,从改变条件后的v′(正)与v′(逆)的大小关系,可得出化学平衡应向正向移动.现分析,降低温度,该平衡向正向移动,必有v′(正)>v′(逆),故选C.
12、(化学平衡像分析-“先拐先平” ( http: / / www.21cnjy.com )、“定一议二”)对于可逆反应:2A(g)+B(g)??2C(g) ΔH<0,下列各图正确的是 ( )
答案 A
解析 A项,升温,先达到平衡且平衡左移 ( http: / / www.21cnjy.com ),C的百分含量减小,正确.B项,加压,v(正)、v(逆)均增大,错误.C项,催化剂只能加快反应速率,不会改变平衡组分的百分含量,错误.D项,加压平衡右移,A的转化率增大,同一压强下,升温平衡左移,A的转化率应减小,错误.
12-1.根据下列有关图象,说法正确的是( )
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B.由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C.由图Ⅱ知,t3时采取增大反应体系压强的措施
D.若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
答案 D
解析:A项,T1、T3处未达到平衡,T2 ( http: / / www.21cnjy.com )处于平衡状态;由图Ⅱ得:t1~t2应该是NH3的质量分数最大的时候,因t3、t5时刻平衡都向逆反应方向移动,NH3的体积分数减小;t3时v逆、v正都减小,且v逆>v正,则采取的措施是减小压强;由图Ⅲ可知:反应1 mol CO放热43 kJ,容积为10 L,平衡时消耗n(CO)=n(H2O)=1.2 mol 放热为51.6 kJ.
12-2.可逆反应aA(g)+bB(g) cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是( )
A.a+b>c+d, T1>T2 , ΔH>0
B.a+b>c+d, T1C.a+bT2 , ΔH>0
D.a+b答案 B
解析:根据图2,增大压强,正反应速 ( http: / / www.21cnjy.com )率大于逆反应速率,平衡正向移动,说明a+b>c+d,根据图1.T113.(转化率)某温度下,在一个2 L的密闭容器中加入2 mol A和1 mol B进行如下反应:
3A(g)+2B(g)4C(s)+D(g),反应2 min后达到平衡,测得生成0.8 mol C,下列说法正
确的是 ( ).
A.前2 min,D的平均反应速率为0.1 mol·L-1·min-1
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动,化学平衡常数不变
D.增加B,平衡向右移动,B的平衡转化率增大
答案 B
解析:生成0.8mol C的同时消耗 ( http: / / www.21cnjy.com )0.4 mol B,生成0.2 mol D,则前2 min,v(D)=0.05 mol·L-1·min-1,B的平衡转化率为0.4mol/1mol×100%=40%,A错,B对;增大该体系的压强,平衡向正反应方向移动,但平衡常数不变,C错;增加B,平衡向右移动,A的平衡转化率增大但B的平衡转化率减小,D错.
13-1.H2和CO2在高温催化剂条件下发生反应:CO2(g)+H2(g)CO(g)+H2O(g).
下表是986 ℃时,在容积不变的密闭容器中进行反应的四组数据:
编号 起始浓度/(mol·L-1) 平衡浓度/(mol·L-1)
c0(H2) c0(CO2) c0(H2O) c0(CO) c(H2) c(CO2) c(H2O) c(CO)
1 1.0 1.0 0 0 0.44 0.44 0.56 0.56
2 1.0 2.0 0 0 0.27 1.27 0.73 0.73
3 0 0 2.0 2.0 0.88 0.88 1.12 1.12
4 0.2 0.4 0.6 0.8 0.344 0.544 0.456 0.656
下列叙述中正确的是 ( ).
①该温度下反应的平衡常数约为1.62 ( http: / / www.21cnjy.com )②该反应的平衡常数与反应的起始浓度无关 ③增大CO2的起始浓度,可使CO2的转化率增大 ④从反应开始至达到平衡状态,混合气体的密度没有发生改变
A.②③ B.①②③ C.①②④ D.①③
答案 C
解析:此温度下K===1.62,平衡常数K只是温度的函数,与起始浓度无关,故①②正确;增大CO2起始浓度,CO2转化率降低,③错误;反应体系中各物质均为气体,且容积不变,故从始至终密度不变,④正确.
13-2.等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s),该反应的ΔH<0,下列叙述正确的是( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率v正(X)=2v逆(Z)
C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
答案 A
解析:该反应是正反应放热,气体物质的量不变的反应,平衡常数K值越大,正向进行程度越大,X的转化率越大,A项正确;达到平衡时,反应速率应为2v正(X)=v逆(Z),B项错误;反应放热,达到平衡后,降低温度,平衡正向移动,应为正向反应速率减小的倍数小于逆向反应速率减小的倍数,C项错误;增大压强平衡不移动,D项错误.
14.(等效平衡)某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变.下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
答案 D
解析:A项,根据题意,在此 ( http: / / www.21cnjy.com )平衡系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变,反应又是在恒温恒容条件下进行的,说明此平衡为等效平衡,根据恒温恒容条件下等效平衡的原理,反应前后气体的系数应相等,因此m=2,选项正确; B项,平衡常数的变化只与温度的变化有关,此反应是在恒温条件下进行,故两次平衡的平衡常数相同,选项正确;C项,平衡转化率等于变化量跟起始量之比,根据三段式原理,X与Y的变化量是1:2关系,而题目中给定的X与Y起始量也是1:2关系,因此X与Y的平衡转化率之比为1:1选项正确,; D项,根据三段式,结合第一次平衡时Z的体积分数为10%,可以计算出c(Z)=0.15 mol·L-1,两次平衡为等效平衡,因此第二次平衡时,Z的浓度也为0.15 mol·L-1 ,选项错误.
14-1.已知2SO2(g)+O2(g)??2SO3(g) ΔH<0,向同温、同体积的三个真空密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和 0.5 mol O2;(丙)2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
答案 B
解析 甲、丙属于等效平衡,乙相当于把甲的体 ( http: / / www.21cnjy.com )积扩大1倍,平衡逆向移动.A项,压强p:p甲=p丙<2p乙;C项,k甲=k丙=k乙;D项,Q甲+Q丙=Q,Q甲>2Q乙.
14-2、在容积为2 L的3个密闭容器中发生反应3A(g)+B(g)xC(g),按不同方式投入反
应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 甲 乙 丙
反应物投入量 3 mol A、2 mol B 6 mol A、4 mol B 2 mol C
到达平衡的时间/min 5 8
A的浓度/(mol·L-1) c1 c2
C的体积分数 w1 w3
混合气体密度/(g·L-1) ρ1 ρ2
下列说法正确的是( ).
A.若x<4,则2c1<c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
答案 C
解析:A项,若甲、乙建立等效平衡,则2c1= ( http: / / www.21cnjy.com )c2,但乙对于甲而言,相当于体积减小压强增大,由于x<4,则平衡正向移动,所以2c1>c2;B项,起始甲中投入量与化学方程式化学计量数比不等,故w3不可能等于w1,x的值也不能确定,错;C项,起始乙投入的量是甲的2倍,根据质量守恒定律知,反应前后总质量不变,而容积体积又相等,故有2ρ1=ρ2,正确;D项,v(A)=,错误.
15.原创(“三段式”在平衡计算中的应用)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25,若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t ℃时反应达到平衡.此时FeO(s)转化率为50%,则x值( )
A.0.05 B.0.03 C.0.06 D.0.02
答案 A
解析:根据反应: FeO(s)+CO(g)Fe(s)+CO2(g)
初始物质的量/mol 0.02 x 0 0
变化物质的量/mol 0.01 0.01 0.01 0.01
平衡物质的量/mol 0.01 x-0.01 0.01 0.01
根据化学平衡常数可知:K=0.01/(x-0.01)=0.25,解得x=0.05.
15-1.PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)??PCl5(g),并于10 min时达到平衡.有关数据如下:
PCl3(g) Cl2(g) PCl5(g)
初始浓度(mol·L-1) 2.0 1.0 0
平衡浓度(mol·L-1) c1 c2 0.4
下列判断不正确的是 ( ).
A.10 min内,v(Cl2)=0.04 mol·L-1·min-1
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的<1
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件再达平衡时,c(PCl5)<0.2 mol·L-1
答案 C
解析: PCl3(g)+Cl2(g)??PCl5(g)
c(起始)/mol·L-1 2.0 1.0 0
c(转化)/mol·L-1 0.4 0.4 0.4
c(平衡)/mol·L-1 1.6 0.6 0.4
10 min内,v(Cl2)=0.04 mo ( http: / / www.21cnjy.com )l·L-1·min-1,A正确;平衡时,n(Cl2)=1.2 mol,B正确;平衡常数减小,说明平衡逆向移动,则PCl3的>1,C错误;D项中当c(PCl5)=0.2 mol·L-1时浓度商为Qc==,而此温度下的平衡常数K==由K<Qc可得当c(PCl5)=0.2 mol·L-1时反应未达到平衡状态,平衡向逆反应进行,故达到平衡时,c(PCl5)<0.2 mol·L-1.
15-2.密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)??H2(g)+CO2(g).在500 ℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A.25% B.50% C.75% D.80%
答案 C
解析:利用平衡常数K,然后根据”三段式“进行计算.
16.原创(化学平衡原理的工业应用)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
①、增加压强 ②、降低温 ( http: / / www.21cnjy.com )度 ③、增大CO的浓度 ④、更换催化剂 ⑤、增大水蒸气的浓度 ⑥、升高温度 ⑦、定时移走二氧化碳 ⑧、减小压强
A.①③④ B.②⑤⑦ C.①⑤⑦ D.⑤⑦⑧
答案 B
解析:该反应为气体物质的量不变的 ( http: / / www.21cnjy.com )放热反应,压强改变对平衡无影响,①⑥错误;催化剂不影响平衡,④错误,增大CO的浓度,CO的转化率减小,增大水蒸气的浓度,平衡右移,CO的转化率增大,③错误⑤正确,,移走二氧化碳有利于平衡正向移动,⑦正确,故选B.
16-1.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
答案 D
解析:反应中S为液体(l)两侧气体反应前后不一致,故随着反应的进行压强变化,A项错;平衡时,分离出硫,其他条件不变,正反应速率不变,B项错;平衡时,其他条件不变,升高温度,平衡向逆反应方向移动,SO2的转化率减小,C项错;平衡常数仅与温度有关,故其他条件不变时,使用不同的催化剂,该反应的平衡常数不变,D项对.
16-2.臭氧是理想的烟气脱硝试剂,其脱硝 ( http: / / www.21cnjy.com )反应为:2NO2(g)+O3(g)??N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A B C D
升高温度,平衡常数减小 0~3 s内,反应速率为:v(NO2)=0.2 mol·L-1 t1时仅加入催化剂,平衡正向移动 达平衡时,仅改变x,则x为c(O2)
答案 A
解析:A项正确,由图像,反应物的总能量 ( http: / / www.21cnjy.com )高于生成物的总能量,说明此反应是放热反应,所以升高温度,平衡将逆向移动,平衡常数减小;B项错误;v(NO2)应等于0.2 mol·L-1·s-1;C项错误,加入催化剂,平衡不发生移动;D项错误,达平衡时,增大c(O2),平衡逆向移动,NO2的转化率会减小.
17.改编(“虚拟过程或假设法”解化学平衡移动问题)在两个恒容容器中有平衡体系:A(g) 2B(g)和2C(g) D(g),X1和X2分别是A和C的转化率.在温度不变情况下,均增加相同的A和C的物质的量,下列判断正确的是( )
A.X1降低,X2增大 B.X1、X2均降低
C.X1增大,X2降低 D.X1、X2均增大
答案 A
解析:假设开始加入1molA,在体积为V的容器中反应,达到平衡,转化率为X1,平衡后,
再加入1molA于另一个相同的容器中,建立的平衡一样A的转化率也是X1,但实际上A加
入原容器,相当于将两个容器各压缩一半,压缩平衡逆向移动,X1的转化率降低.第二个
反应,正反应方向物质的量减小,同样分析,转化率X增大.
17-1.在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)zC(g)+
mD(s).平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,
再达平衡时,测得A的浓度为0.3mol/L.则下列有关判断正确的是( )
A.x+y>z+m B.B的转化率一定减小
C.平衡向正反应方向移动 D.重新建立平衡K值减小
答案 B
解析:将容器的容积扩大到原来的两倍 ( http: / / www.21cnjy.com ),假设平衡不移动,A的浓度为0.25mol/L,现在A的浓度为0.3mol/L大于0.25mol/L,说明扩大体积,减小压强,平衡向逆反应方向移动,B的转化率一定减小,且x+y>z,因为温度不变,所以K值不变.
17-2.恒温条件下,反应N2(g)+3H2(g)??2NH3(g)在密闭容器中达到平衡状态,混合气体的平均摩尔质量为,N2与NH3的浓度均为c mol/L.若将容器的容积压缩为原来的,当达到新平衡时,下列说法中正确的是( )
A.新的平衡体系中,N2的浓度小于2c mol/L大于c mol/L
B.新的平衡体系中,NH3的浓度小于2c mol/L大于c mol/L
C.新的平衡体系中,混合气体的平均摩尔质量小于
D.新的平衡体系中,气体的密度是原平衡体系的1倍
答案 A
解析:将容器的容积压缩为原来的,平衡向正反应方向移动,N2的浓度小于2c mol/L,又根据勒夏特列原理,新的平衡体系中,N2的浓度应大于c mol/L,A项正确;平衡向正反应方向移动必定使NH3的浓度大于2c mol/L,B项错误;平均摩尔质量=,平衡向正反应方向移动,n(总)减小,增大,C项不正确;由于混合气体的总质量不变,而容器的容积为原来的,故气体的密度为原来的2倍,D项不正确.
填空题(共49分,其中18题10分,19题11分,20题14分,21题14分)
18.改编(化学反应速率及影响因素)Ⅰ、某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
( http: / / www.21cnjy.com )
(1)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为
v(X)= ,
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)达到平衡时Y的转化率是 ,增大压强,X的转化率 (填“增大””减小”或”不变”)
Ⅱ、把除去氧化膜的铝片投入到盛有少量稀盐酸的试管中,发现氢气发
生的速率变化情况如图所示.其中t1~t2速率变化的主要原因是 ;
t2~t3速率变化的主要原因是____________________________________.
答案 Ⅰ、(1)0.075mol/(l.min)(2)3X+Y2Z (3)10% 增大
Ⅱ、反应是放热反应,使温度升高,所以反应速率加快 随着反应的进行,H+浓度减小,反应速率逐渐减慢.
解析:Ⅱ、铝与HCl溶液的反应是放热反 ( http: / / www.21cnjy.com )应,反应过程中,反应物的浓度不断减小,因此,该反应中并存两个影响化学反应速率的外因:一是反应放出的热能使反应体系温度升高,化学反应速率加快;二是反应使HCl物质的量浓度减小,化学反应速率减慢.由图像可知,在t1~t2的时间内温度变化是影响化学反应速率的主要外因,在t2~t3的时间内,HCl物质的量浓度的变化是影响化学反应速率的主要外因.
18-1.Ⅰ、一密闭容器中发生下列反应:N2(g)+3H2(g)2NH3(g);△H<0下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1 t3 t4 .
(2)下列时间段中,氨的百分含量最高的是 .
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)温度不变,若在t6时刻向反应体系中充入氮气,t7时刻建立新的平衡,
①请在原图中画出速率变化曲线
②新的平衡状态时,平衡常数K (填“增大””减小”或”不变”)
Ⅱ、在25 ℃时,向100 mL含HCl 14.6 g的盐酸溶液里放入5.6 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)H2,又经过4 min,铁粉完全溶解.则:
(1)在前2 min内,用FeCl2表示的平均反应速率是_______________________.
(2)在后4 min内,用HCl表示的平均反应速率是__________________________.
(3)前2 min与后4 min相 ( http: / / www.21cnjy.com )比,反应速率________(填“前者”或“后者”)较快,其原因是____________________ ____ ____________________________________________.
答案:Ⅰ、(1)升高温度 使用催化剂 减小压强 (2)A (3)①略 ②不变
Ⅱ、(1)0.25 mol·L-1·min-1 (2)0.25 mol·L-1·min-1 (3)前者 前2 min时HCl的浓度较大
解析:Ⅱ、n(HCl)==0.4 mol,c(HCl)==4.0 mol·L-1,n(Fe)=0.1 mol.
Fe + 2HCl == FeCl2 + H2↑
初态/mol: 0.1 0.4 0 0
2 min末/mol:0.05 0.4-0.1 0.05 0.05
6 min末/mol: 0 0.2 0.1 0.1
故前2 min内,v(FeCl2)==0.25 mol·L-1·min-1;
后4 min内,v(HCl)==0.25 mol·L-1·min-1.
19.原创(化学平衡及影响因素)
(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0
① 达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号).
a.升高温度 b.加 ( http: / / www.21cnjy.com )入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚 f.增加H2的浓度
②改变条件,平衡向正反应方向移动,反应物的转化率 (填”一定”或“不一定”)增大.
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 CH3OH CH3OCH3 H2O
浓度/(mol·L-1) 0.44 0.6 0.6
①比较此时正、逆反应速率的大小:v(正)________v(逆)(填“>”“<”或“=”).
②若加入CH3OH后,经10 min反 ( http: / / www.21cnjy.com )应达到平衡,此时c(CH3OH)=________; 该时间内反应速率v(CH3OH)=________.
③一定温度下,能判断上述反应达化学平衡状态的依据是
a.容器内压强一定 b.容器内气体的密度一定
c.不再生成 CH3OCH3 d.CH3OH和CH3OCH3的生成速率之比为2:1
答案 (1) ① c、e、f ②不一定
(2)①> ②0.04 mol·L-1 0.16 mol·L-1·min-1 ③ d
解析:(1)①正反应是放 ( http: / / www.21cnjy.com )热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大H2浓度,平衡右移,但CO转化率增大,故选c、e、f.
(2)此时的浓度熵Qc==1.86<400,反应未达到平衡状态,向正反应方向移动,故v(正)>v(逆);设平衡时生成物的浓度为(0.6 mol·L-1+x),则甲醇的浓度为(0.44 mol·L-1-2x),根据平衡常数表达式400=,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1.由表可知,甲醇的起始浓度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,10 min变化的浓度为1.6 mol·L-1,故v(CH3OH)=0.16 mol·(L·min)-1.
19-1.氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
(1)当反应达到平衡时,N2和H2 ( http: / / www.21cnjy.com )的浓度比是 ;N2和H2的转化率比是 .反应放出的热量 (填“大于”“小于”或“等于”)184.8 kJ
(2)降低平衡体系的温度 ( http: / / www.21cnjy.com )(保持体积不变),混合气体的平均相对分子质量 ,密度 .平衡常数K (填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器 ( http: / / www.21cnjy.com )内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍.
答案 (1)1∶3 1∶1 小于 (2)增大 不变 增大 (3)逆向 (4)向左移动 小于
解析:(3)达平衡后,保持压强不变,充入氩气,使体系体积增大,浓度减小,相当于减小反应物压强,使平衡逆向移动.
(4)恒容时升高温度至原来的2倍 ( http: / / www.21cnjy.com ),平衡向吸热反应的方向移动,即向左移动,根据勒夏特列原理,达新平衡后,容器内温度大于原来的温度,小于原来温度的2倍.
20.改编(化学平衡移动原理、化学平衡常数)高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g) Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如右表所示:
温度/℃ 1 000 1 150 1 300
平衡常数 4.0 3.7 3.5
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH (填“>”“<”或“=”)0.
(2)在一个容积为10 L的密闭容 ( http: / / www.21cnjy.com )器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= 、CO的平衡转化率= .
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时,某时刻 ( http: / / www.21cnjy.com )CO2和CO的物质的量浓度分别为0.2mol·L-1和0.1mol·L-1,则此时反应是否达到平衡 (填“是”或“否”),V(正) V(逆)(填“>”“<”或“=”)
答案 (1)c(CO2)/c(CO) < (2)0.006 mol·L-1·min-1 60% (3)C (4)否 >
解析:(4)c(CO2)/c( ( http: / / www.21cnjy.com )CO)=0.2mol·L-1/0.1mol·L-1=2<4,反应未达到平衡,应向正反应方向移动,V(正)>V(逆)
20-1.在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的平均相对分子质量减小.回答下列问题:
(1)反应的ΔH________0(填“大于 ( http: / / www.21cnjy.com )”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示.在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________.
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率
降低,经10 s又达到平衡.
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________ .
②列式计算温度T时反应的平衡常数K2:_______________________________ .
(3)温度T时反应达平衡后,将反应容 ( http: / / www.21cnjy.com )器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________________________________.
答案 (1)大于 0. ( http: / / www.21cnjy.com )001 0 0.36 mol·L-1 (2)①大于 反应正方向吸热,反应向吸热方向进行,故温度升高 ②平衡时,c(NO2)=0.120 mol·L-1+0.002 0 mol·L-1·s-1×10 s×2=0.16 mol·L-1
c(N2O4)=0.040 mol·L-1-0.002 0 mol·L-1·s-1×10 s=0.020 mol·L-1
K2==1.3 mol·L-1
(3)逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
解析:首先根据,温度升高 ( http: / / www.21cnjy.com ),混合气体的平均相对分子质量减小,说明平衡向生成NO2的正反应方向移动,即正反应是吸热气体物质的量增大的反应.然后根据平衡移动原理进行判断.
21.(知识综合、等效平衡、虚拟过程)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) N2O4(g) ΔH<0)
(1)一段时间后,反应达到平衡,此 ( http: / / www.21cnjy.com )时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入 ( http: / / www.21cnjy.com )与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通人等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______.
答案 (1)< 变小 (2)增大 不变 变小 (3)A (4)0.02mol
解析:反应本身是体积缩小的放热反应.
(1)由于A为恒容体系,B为恒压体系,在平衡时pA<pB,故v(A)<v(B),若打开K2,A、B形成一个新的恒压体系,气体体积将变小.
(2)若再通入NO2,对于A相当于加压, ( http: / / www.21cnjy.com )原平衡向正反应方向移动,NO2的转化率增大.若再通入Ne,对于A,末改变体系中各物质的浓度,平衡不移动,转化率不变;对于B,其体积增大,相当于减小压强,平衡向逆反应方向移动,NO2的转化率减小.
(3)此时A为绝热体系,随反应的进行,体系温度升高,即TA>TB,A相对于B是升高温度,平衡向逆反应方向移动,A中颜色加深.
(4)=即n总==0.08 mo ( http: / / www.21cnjy.com )l,投入NO2的物质的量为=0.1 mol,根据”三段式“计算,平衡时N2O4的物质的量为0.02mol.
21-1.工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).
(1)在—定温度和压强下,CO(g)+2H2(g)CH3OH(g) ΔH=-128.8 kJ/mol.若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示).若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”).
(2)判断该反应达到平衡状态的依据是________(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
E.CH3OH、CO、H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 甲 乙 丙
反应物投入量 1 mol CO、2 mol H2 1 mol CH3OH 2 mol CH3OH
平衡时数据 反应能量变化的绝对值(kJ) a b c
反应物转化率 α1 α1 α3
体系压强(Pa) p1 p2 p3
则a+b=________;a1+a3________1(填“<”、“>”或“=”,下同);2p2________p3.
答案:(1) 正向移动 增大 (2)BE (3)128.8 < >
解析:(1) CO(g)+2H2(g)??CH3OH(g)
起始浓度(mol/L) 5a 10a 0
转化浓度(mol/L) 3a 6a 3a
平衡浓度(mol/L) 2a 4a 3a
所以平衡常数K==.若达平衡后再向容器中 ( http: / / www.21cnjy.com )投入10a mol CO、20a mol H2和10a mol CH3OH(g),则此时Qcα3,所以α1+α3<1;比较乙、丙可知,丙中甲醇的物质的量为乙中的2倍,压强增大,对于反应CO(g)+2H2(g)??CH3OH(g),平衡向生成甲醇的方向移动,故2p2>p3..
催化剂
高温
催化剂
高温
催化剂
高温
第二章化学反应速率和化学平衡单元测试
(测试时间:90分钟 满分100分)
选择题(每题只有一个正确选项,每题3分,共51分)
1.改编(化学反应进行的方向)下列说法不正确的是( )
A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B.凡是放热反应都是自发的,因为吸热反应都是非自发的
C.NH4HCO3(s) == NH3( ( http: / / www.21cnjy.com )g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
D.反应2Mg(s)+CO2(g) == C (s)+2MgO(s)能自发进行,则该反应的ΔH<0
答案 B
解析:ΔH<0、ΔS>0,则ΔH-TΔS<0,任何温度下反应都能自发进行,A正确;某些熵增的吸热反
应也能自发进行,B错误; C项,ΔH >0,能自发,说明ΔS >0,正确;D项,反应的ΔS
<0,能自发,说明ΔH<0,正确.
1-1.下列说法正确的是( ).
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
答案 C
解析:反应的自发性是由熵变和焓变共同决定的 ( http: / / www.21cnjy.com ),A、B错误.C项中反应的ΔS>0,若ΔH<0,则一定自发,现常温下不自发,说明ΔH>0,正确.D项中反应的ΔS<0,能自发,说明ΔH<0,错误.
1-2.下列说法正确的是( )
A.一定温度下,反应MgCl2(l) == Mg(l)+Cl2(g)的ΔH>0 ΔS>0
B.凡是放热反应都是自发的,凡是吸热反应都是非自发的
C.常温下,水电解生成氢气和氧气,即常温下水的分解反应是自发反应
D.H2O(g)变成液态水,ΔS>0
答案 A
解析:镁在氯气中的燃烧是放热反应,反之则为 ( http: / / www.21cnjy.com )吸热反应,MgCl2的分解是熵值增大的反应,ΔS>0,A正确;有些吸热反应也可以自发进行,如2N2O5(g) == 4NO2(g)+O2(g) ΔH>0,B错误;水在常温常压下电解才能发生分解,即环境对它做功,才能使它发生反应,所以是非自发反应,C错误;同种物质气态时熵值最大,H2O(g)变成液态水,熵值减小ΔS<0,D错误.
2.原创(化学反应速率)在2 L的密闭容器中,发生以下反应:2A(g)+B(g) xC(g)+D(g).若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,生成C的物质的量为2.4mol,则下列说法不正确的是( )
A.X=2
B.10秒时B的物质的量为2.8 mol
C.前10秒钟D的平均反应速率为0.12 mol·L-1·s-1
D.A的转化率为60%
答案 C
解析: 前10秒钟,C的平 ( http: / / www.21cnjy.com )均反应速率为0.12 mol·L-1·s-1 , 根据速率之比等于系数之比,x=2, 前10秒钟D的平均反应速率为0.06mol·L-1·s-1 ,则A项正确,C项错误,D项 ,前10秒钟,B的平均反应速率为0.06 mol·L-1·s-1,则消耗的B的物质的量为0.06 mol·L-1·s-1×10 s×2 L=1.2 mol,B剩余的物质的量为4 mol-1.2 mol=2.8 mol,B正确,前10秒钟参加反应的A为0.12 mol·L-1·s-1×10 s×2 L=2.4mol,所以A的转化率为60%,D正确.
2-1.N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g)ΔH>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
A.0~20 s内平均反应速率v(N2O5)=0.1 mol·(L·s)-1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
答案 D
解析:0~20 s内,v(N2O5)==0.05 mol·(L·s)-1;10 s时,反应仍在向正反应方向进行,v(正)>v(逆);20 s时,v(正)=v(逆),反应达到平衡状态.
2-2.在恒温、恒容的容器中进行反应:2HIH2+I2 ΔH>0,反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 s B.等于12 s C.大于12 s D.小于12 s
答案 C
解析:随着反应的进行,反应物的浓度逐渐减小,所以后一阶段的平均反应速率小于前一阶段的平均反应速率,即 > ,解得Δt>12 s.
3.原创(影响化学反应速率的因素) 运用外界条件对化学反应速率的影响理论,判断下列叙述正确的是( )
A.钠常温下与氧气反应生成Na2O,升高温度生成 Na2O的速率加快
B.常温下,铜与稀硝酸反应生成NO,增大硝酸的浓度,生成NO的速率加快
C.锌与稀硫酸制备氢气,加入少量的硫酸铜溶液,生成H2的速率加快
D.对密闭容器中发生的反应2NO22NO+O2 缩小体积,增大压强,V(正)减小,V(逆)增大
答案 C
解析:升高温度钠与氧气生成过氧化钠,铜与浓硝酸反应生成二氧化氮,对2NO2 == 2NO
+O2 缩小体积,增大压强V(正)V(逆)都增大,A、B、D错误,锌与稀硫酸制备氢气,
加入少量的硫酸铜溶液,锌与置换出的铜形成无数微小的原电池,加快了反应速率,C正确.
3-1.在密闭容器中发生如下反应:2X(g)+Y(g) Z(g) ΔH<0.如图是表示该反应的速率
(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则
下列说法中不正确的是( )
( http: / / www.21cnjy.com )
A.t3时减小了压强 B.t1-t6时间段 t6时X的转化率最高
C.t5时升高了温度 D.t2时使用了催化剂
答案 B
解析:t1时反应达到平衡,t2时正逆反应速率同等倍数的增大,应该是使用了催化剂;t3时
正逆反应速率都减小,但V(逆)>V(正),应该是缩小体积减小压强;t5时正逆反应速率
都增大,但V(逆)>V(正),向逆反应方向(吸热方向)移动,应该是升温;t1-t6时间段 两
次平衡移动都是向逆反应方向移动,所以 t6时X的转化率最低.
3-2.用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体.下列措施对改变反应的速率几乎没
有影响的是( )
A.用相同浓度但温度较高的盐酸代替常温下的盐酸
B.增大反应体系的压强或减小反应体系的压强
C.改用相同质量但为粉末状态的碳酸钙代替块状碳酸钙
D.改用与原盐酸含有相同H+浓度的稀硫酸
答案 B
解析 由于CaCO3和稀盐酸是固体和液 ( http: / / www.21cnjy.com )体之间的反应,所以改变压强对反应速率几乎没有影响.改用与原盐酸含有相同H+浓度的稀硫酸,由于硫酸钙微溶,包在碳酸钙周围,阻碍反应的发生,速率减小.
4.原创(可逆反应及其特点)在体积 ( http: / / www.21cnjy.com )为2L的密闭容器中通入0.4molSO2和0.2molO2发生反应2SO2+O2 2SO3,下列叙述正确的是( )
A.若反应中加入的是18O2,达到平衡后SO2中不可能含有18O
B.平衡时,SO3的浓度可能为0.2 mol/L
C.当不再生成SO3时反应达到平衡
D.温度不变,改变SO2和O2的加入量,达到平衡时C2(SO3)/C2(SO2)·C(O2)不变
答案 D
解析:18O2中的18O通过化合反 ( http: / / www.21cnjy.com )应存在于SO3中,SO3 中的18O通过分解反应会存在于SO2中,最终SO3、SO2、O2中都含有18O,A项错误;可逆反应不可能进行到底,B项错误;可逆反应的化学平衡为动态平衡,平衡时生成三氧化硫的反应并没有停止,C项错误;C2(SO3)/C2(SO2)·C(O2)为该反应的平衡常数,温度不变平衡常数不变,D项正确.
4-1.在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L.当反应达到平衡时可能存在的数据是( )
A.SO2为0.4 mol/L,O2为0.2 mol/L
B.SO3为0.25 mol/L
C.SO2、SO3均为0.15 mol/L
D.SO3为0.4 mol/L
答案 B
解析: A项数据表明,题中0.2 mol/L ( http: / / www.21cnjy.com )的SO3完全转化成了SO2和O2,即平衡时,c(SO3)=0,这是不可能的;B项说明在题给浓度的基础上又有0.05 mol/L SO2和0.025 mol/L O2化合生成0.05 mol/L SO3,这是可能的;C项数据表明SO2、SO3的浓度都在原浓度基础上减少了0.05 mol/L,这也是不可能的;D项数据说明SO2完全转化成了SO3,即平衡时c(SO2)=0,c(O2)=0,这也是不可能的.
4-2.对于某一可逆反应,在不同条件下的平衡状态中,正、逆反应速率的关系是( )
答案 A
解析:四个选项中,只有选项A在任意时刻都会v(正)=v(逆),即反应处于平衡状态.
5.改编(化学平衡状态的判定)一定条件下,在固定容积密闭容器中发生可逆反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列对反应是否达到平衡的推断正确的是( )
A.达到化学平衡时,化学反应速率的关系是3v正(NH3)=2v逆 (H2O)
B.达到化学平衡时,NH3、O2、NO、H2O物质的量之比为4∶5∶4∶6
C.混合气体的密度一定时,该化学反应达到化学平衡
D.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
答案 A
解析:A项,3v正 (NH ( http: / / www.21cnjy.com )3)=2v逆(H2O),设v正(NH3)=3则 v逆(H2O)=2那么v逆(NH3)=3,反应处于平衡状态,故A正确;B项,到达平衡时,反应混合物的物质的量关系与起始投入量及转化率有关,达到化学平衡时,NH3、O2、NO、H2O物质的量之比可能为4:5:4:6,也可能不是,故B错误;C、混合气的密度等于混合气的总质量与容器容积的比值,混合气体的总质量不变,容器的容积不变,该体系密度始终不变,不能说明到达平衡,故C错误;D项单位时间内生成x mol NO的同时消耗x mol NH3,反应进程中始终按照这样进行,故D错误.
5-1.在一定温度下的体积不变的密闭容器中,当下列哪些量不再发生变化时,表明下述反
应: A(s)+2B(g)C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量
A.②③⑤⑥⑦ B.①②③⑥⑦
C.②③④⑤⑥ D.①③④⑤⑦
答案 A
解析:A(s)+2B(s)C(g)+D(g)是反应前后气体体积相等的反应,不管是否平衡,混合气体的压强始终不变,气体的总物质的量也不变,故①④不是判断是否达到平衡的标志.
5-2.某温度下,体积一定的密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s) ΔH>0,下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体密度不变时,反应达到平衡
C.当容器中气体密度不变时,反应达到平衡
D.平衡后加入X,上述反应的ΔH增大
答案 B
解析:W为固体,故加入少 ( http: / / www.21cnjy.com )量W,反应速率不变,A错;因为W为固体,故当容器中气体密度不变时,反应达到平衡,B正确;该反应气体的物质的量不变,压强始终不变,C错误;反应的ΔH为一定值,平衡后加入X,ΔH不变,D错.
6、改编(外界条件对化学平衡移动的影响)可逆反应aA(g)+bB(s)cC(g)+dD(g)
ΔH,其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
( http: / / www.21cnjy.com )
图1 图2
A.升高温度、增大压强,平衡都向正反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.ΔH>0,升高温度平衡常数K值增大
答案 C
解析:根据图1判断,T2>T1,温度越 ( http: / / www.21cnjy.com )高,C的含量越少,则正反应为放热反应,ΔH<0 ,D项错误,根据图2判断,P2>P1,压强越大,C的含量越少,则正反应为气体物质的量增大的反应,即a<c+d,C项正确,升高温度和增大压强平衡都向向逆反应方向,A项错误,使用催化剂不影响平衡,C的物质的量分数不变,B项错误.
6-1.在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g)+3D(g) ;ΔH<0.该可逆反应的反应速率-时间、转化率-时间关系图如下:
( http: / / www.21cnjy.com )
则下列分析中不正确的是( )
A.图Ⅰ可体现t0时升高温度对反应速率的影响
B.图Ⅱ可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ可体现催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ可体现温度对化学平衡的影响,且乙的温度较高
答案 C
解析:催化剂只能缩短达到平衡用的时间,不影响反应物的转化率.
6-2.将等物质的量的X.Y气体充入一容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)+2M(s)2Z(g);.当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是 ( )
改变的条件 正.逆反应速率变化 新平衡与原平衡比较
A 升高温度 逆反应速率增大量大于正反应速率增大量 X的体积分数增大
B 增大压强 正反应速率增大,逆反应速率减小 Z的浓度不变
C 减小压强 正.逆反应速率都减小 Y的体积分数变大
D 充入一定量的Z 逆反应速率增大 X的体积分数变大
答案 A
解析:该反应是气体物质的量不变的放热反 ( http: / / www.21cnjy.com )应,升高温度,逆反应速率增大量大于正反应速率增大量,平衡逆向移动,X的体积分数增大,A项正确;增大压强,正反应速率增大倍数相同,平衡不移动,但由于体积缩小,Z的浓度增大,B项错误;减小压强,平衡不移动,Y的体积分数不变,C项错误;充入一定量的Z,由于容积可变,建立等效平衡,X的体积分数不变,D项错误.
7.(催化剂对反应速率和平衡的影响)在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示.
下列叙述正确的是( )
A.该反应的热化学方程式:N2+3H22NH3 ΔH=-92 kJ/mol
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放出的热量增多
D.加入催化剂可增大正反应速率,降低逆反应速率
答案 B
解析:A项没有标物质的状态;C项加催化剂不影响反应热;D项催化剂可增大正反应速率,也可增大逆反应速率.
7-1.根据反应Br+H2HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是( )
( http: / / www.21cnjy.com )
A.正反应吸热
B.加入催化剂,该化学反应的反应热不变
C.加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示
D.加入催化剂可增大正反应速率,降低逆反应速率
答案 D
解析:加入催化剂能同等程度地加快正、逆反应速率.
7-2.对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是( )
A.①压强对反应的影响(p2>p1)
B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响
D.④催化剂对反应的影响
答案 C
解析:①中由于p1条件下反应先达平衡状态,即p1>p2,A错误;升高温度,N2(g)+3H2(g) 2NH3(g)ΔH<0的平衡逆向移动,N2的转化率降低,图像②错误;催化剂能加快化学反应速率,缩短达到平衡的时间,故有催化剂时先达平衡,④错误;向平衡体系中加入N2瞬间,v正增大,v逆不变,v正>v逆,平衡正向移动,C正确.
8.改编(勒夏特列原理及其应用)下列实验事实不能用平衡移动原理解释的是( )
A. ( http: / / www.21cnjy.com )将NO2球浸泡在冷水和热水中,热水中的球泡颜色加
B.氯水中有下列平衡Cl2+H2OHCl+HClO,当加入碳酸钙后,HClO的浓度增大漂白性增强
C.H2O2中加入二氧化锰,生成氧气的速率加快
D.反应CO(g)+NO2(g)CO2(g)+NO(g),达平衡后,升高温度体系颜色变深
答案 C
解析:勒夏特列原理即化学平衡移动原理,必须是化学平衡移动问题,才能用该原理解释,催化剂不影响平衡,故选C .
8-1.下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B.合成氨工业中使用铁触媒做催化剂
C.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
D.对2HI(g)H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
答案:B
解析:勒夏特列原理即化学平衡移动原理,必须是化学平衡移动问题,才能用该原理解释,催化剂不影响平衡,故选B.
8-2.下列能用勒夏特列原理解释的是( )
A.高温及加入催化剂都能使合成氨的反应速率加快
B.红棕色的NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
答案 B
解析:勒夏特列原理即化学平衡移动原 ( http: / / www.21cnjy.com )理.凡是外界因素对化学平衡的影响都可用勒夏特列原理来解释.催化剂不能引起化学平衡移动,不能用原理解释.D项加压平衡不移动,颜色加深,因为体积缩小.
9、改编(化学平衡常数)在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应体
系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图
二.
( http: / / www.21cnjy.com )
下列分析不正确的是( )
A. 该反应的平衡常数表达式为:K=
B.0~4 min时,A的平均反应速率为0.01 mol/(L·min)
C.由T1向T2变化时,v正>v逆
D.平衡后升高温度,K值增大
答案 D
解析:根据图一所示A、B、C物质的量的变化,可知该可逆反应为:2A(g)+B(g) C(g),由此可知B正确; 由图一知在4 min时A消耗0.4 mol,故0~4 min时,A的平均反应速率为:0.4 mol/(10 L×4 min)=0.01 mol/(L·min);由图二知在T3时反应达到平衡,故在T3前,反应一直正向进行,v正>v逆;由T3升温到T4时,C%减小,说明平衡逆向进行,故可判知正反应为放热反应,升高温度,平衡逆向移动,K值减小
9-1.关于化学平衡常数,下列说法不正确的是( )
A.化学平衡常数不随反应物或生成物的浓度的改变而改变
B.化学平衡常数随温度的改变而改变
C.对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1
D.温度越高,K值越大
答案 D
解析:化学平衡常数K=生成物浓度幂的积/ ( http: / / www.21cnjy.com )反应物浓度幂的积, 化学平衡常数只与温度有关,与物质的浓度无关.故A、B正确,根据化学平衡常数的计算式可以知道对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1,故C正确.对放热反应,温度越高,K值越小,D项错误.
9-2、一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)
MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横
坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )
选项 x y
A 温度 容器内混合气体的密度
B CO的物质的量 CO2与CO的物质的量之比
C SO2的浓度 平衡常数K
D MgSO4的质量(忽略体积) CO的转化率
答案 A
解析:由于此反应为吸热反应,升高温度 ( http: / / www.21cnjy.com ),平衡正向移动,混合气体质量增加,密度增大,A正确;当增加CO的物质的量时,相当于增大体系的压强,平衡逆向移动,CO的转化率减小,CO2与CO的物质的量之比减小,B错误;平衡常数只与温度有关,与SO2的浓度无关,C错误;MgSO4为固体,增加其质量对平衡无影响,所以CO的转化率不变,D错误.
10.原创(化学平衡常数的应用)设反应 ( http: / / www.21cnjy.com )①Fe(s)+CO2(g)FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2.在不同温度下,K1、K2的值如下:
T/K K1 K2
973 1.47 2.38
1 173 2.15 1.67
下列有关叙述正确的是( )
A.b>0
B.在973 K下增大压强,K2增大
C.a>b
D.在1173K下反应①平衡后再充入CO2平衡正向移动,K1增大
答案 C
解析:由题意知温度升高K1增大 ( http: / / www.21cnjy.com ),K2减小,说明升温,反应①的平衡向右移动,反应②的平衡向左移动,所以①中正反应是吸热反应,a>0,②中正反应是放热反应,b<0,A错,C对;增大压强,两平衡均不移动,K2不变,B错;在1173K下反应①平衡后再充入CO2平衡正向移动,但温度不变平衡常数不变,D错误.
10-1.高温下,某反应达到平衡,平衡常数K=.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
答案 A
解析:由平衡常数K=,温度升高时H2 ( http: / / www.21cnjy.com )浓度减小,说明在恒容时平衡正向移动,ΔH>0,A正确;该反应的化学方程式CO2(g)+H2(g)CO(g)+H2O(g),在增大压强时H2的浓度不变,升高温度,v正和v逆都增大.
10-2.在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如下表:
实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
n(X) n(Y) n(M)
① 700 0.40 0.10 0.090
② 800 0.10 0.40 0.080
③ 800 0.20 0.30 a
④ 900 0.10 0.15 b
下列说法正确的是( )
A.实验①中,若5 min时测得n(M)= ( http: / / www.21cnjy.com )0.050 mol,则0至5 min 时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
答案 C
解析:A项,根据方程式可知在 ( http: / / www.21cnjy.com )5 min内反应生成的n(N)等于生成的n(M),则v(N)==1×10-3 mol·L-1·min-1,该项错误;B项,根据表格中数据可知平衡时c(X)=0.002 mol·L-1、c(Y)=0.032 mol·L-1、c(N)=c(M)=0.008 mol·L-1,则平衡常数K===1.0,该项错误;C项,因该反应在800 ℃时平衡常数为1.0,设反应中转化的X的物质的量为x,则有(0.20-x)×(0.30-x)=x·x,故x=0.12 mol,X的转化率为×100%=60%,该项正确;假设在900 ℃时,该反应的平衡常数也为1.0,根据实验④中的数据可知b=0.060,由①中数据可知在700 ℃时平衡常数约为2.6,结合800 ℃时平衡常数为1.0可知,温度越高,该平衡常数越小,平衡逆向移动,故b<0.060,该项错误.
11.改编(速率图像)如图是可逆反应A+2B2C+3D ΔH,化学反应速率与化学平衡
随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
A.ΔH<0
B.D可能是气体
C.升高温度,平衡常数K增大
D.A、B、C、D均为气体
答案 A
解析:根据图示降温平衡正向移动,说明正 ( http: / / www.21cnjy.com )反应为放热反应,ΔH<0 ,A项正确,逆反应吸热,升高温度,逆向移动,K值减小,增大压强,平衡正向移动,则正反应方向为气体物质的量减小的反应,D不可能为气体,A、B、C、D均为气体更不可能,B、D项错误.
11-1.对于可逆反应A(g)+2B(g)??2C(g)(正反应吸热),下列图象正确的是( )
( http: / / www.21cnjy.com )
答案 D
解析:加压平衡向正反应方向移动,V(正 ( http: / / www.21cnjy.com ))>V(逆),可见A、B错;升高温度,平衡向正反应方向移动,A的转化率增大,此时A的百分含量变小;同时反应速率加快,应该先达到平衡,故C错、D对;答案为D.
11-2、在密闭容器中进行反应:2SO2 ( http: / / www.21cnjy.com )(g)+O2(g)??2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )
A.催化剂失效 B.减小生成物的浓度
C.降低体系温度 D.增大容器的体积
答案:C
解析:从图像可以看出:改变条件后,反应速率与 ( http: / / www.21cnjy.com )原平衡速率出现断层且低于原平衡反应速率,说明改变的条件可能是降低温度或减压,从改变条件后的v′(正)与v′(逆)的大小关系,可得出化学平衡应向正向移动.现分析,降低温度,该平衡向正向移动,必有v′(正)>v′(逆),故选C.
12、(化学平衡像分析-“先拐先平” ( http: / / www.21cnjy.com )、“定一议二”)对于可逆反应:2A(g)+B(g)??2C(g) ΔH<0,下列各图正确的是 ( )
答案 A
解析 A项,升温,先达到平衡且平衡左移 ( http: / / www.21cnjy.com ),C的百分含量减小,正确.B项,加压,v(正)、v(逆)均增大,错误.C项,催化剂只能加快反应速率,不会改变平衡组分的百分含量,错误.D项,加压平衡右移,A的转化率增大,同一压强下,升温平衡左移,A的转化率应减小,错误.
12-1.根据下列有关图象,说法正确的是( )
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B.由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C.由图Ⅱ知,t3时采取增大反应体系压强的措施
D.若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
答案 D
解析:A项,T1、T3处未达到平衡,T2 ( http: / / www.21cnjy.com )处于平衡状态;由图Ⅱ得:t1~t2应该是NH3的质量分数最大的时候,因t3、t5时刻平衡都向逆反应方向移动,NH3的体积分数减小;t3时v逆、v正都减小,且v逆>v正,则采取的措施是减小压强;由图Ⅲ可知:反应1 mol CO放热43 kJ,容积为10 L,平衡时消耗n(CO)=n(H2O)=1.2 mol 放热为51.6 kJ.
12-2.可逆反应aA(g)+bB(g) cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是( )
A.a+b>c+d, T1>T2 , ΔH>0
B.a+b>c+d, T1
D.a+b
解析:根据图2,增大压强,正反应速 ( http: / / www.21cnjy.com )率大于逆反应速率,平衡正向移动,说明a+b>c+d,根据图1.T1
3A(g)+2B(g)4C(s)+D(g),反应2 min后达到平衡,测得生成0.8 mol C,下列说法正
确的是 ( ).
A.前2 min,D的平均反应速率为0.1 mol·L-1·min-1
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动,化学平衡常数不变
D.增加B,平衡向右移动,B的平衡转化率增大
答案 B
解析:生成0.8mol C的同时消耗 ( http: / / www.21cnjy.com )0.4 mol B,生成0.2 mol D,则前2 min,v(D)=0.05 mol·L-1·min-1,B的平衡转化率为0.4mol/1mol×100%=40%,A错,B对;增大该体系的压强,平衡向正反应方向移动,但平衡常数不变,C错;增加B,平衡向右移动,A的平衡转化率增大但B的平衡转化率减小,D错.
13-1.H2和CO2在高温催化剂条件下发生反应:CO2(g)+H2(g)CO(g)+H2O(g).
下表是986 ℃时,在容积不变的密闭容器中进行反应的四组数据:
编号 起始浓度/(mol·L-1) 平衡浓度/(mol·L-1)
c0(H2) c0(CO2) c0(H2O) c0(CO) c(H2) c(CO2) c(H2O) c(CO)
1 1.0 1.0 0 0 0.44 0.44 0.56 0.56
2 1.0 2.0 0 0 0.27 1.27 0.73 0.73
3 0 0 2.0 2.0 0.88 0.88 1.12 1.12
4 0.2 0.4 0.6 0.8 0.344 0.544 0.456 0.656
下列叙述中正确的是 ( ).
①该温度下反应的平衡常数约为1.62 ( http: / / www.21cnjy.com )②该反应的平衡常数与反应的起始浓度无关 ③增大CO2的起始浓度,可使CO2的转化率增大 ④从反应开始至达到平衡状态,混合气体的密度没有发生改变
A.②③ B.①②③ C.①②④ D.①③
答案 C
解析:此温度下K===1.62,平衡常数K只是温度的函数,与起始浓度无关,故①②正确;增大CO2起始浓度,CO2转化率降低,③错误;反应体系中各物质均为气体,且容积不变,故从始至终密度不变,④正确.
13-2.等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s),该反应的ΔH<0,下列叙述正确的是( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率v正(X)=2v逆(Z)
C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
答案 A
解析:该反应是正反应放热,气体物质的量不变的反应,平衡常数K值越大,正向进行程度越大,X的转化率越大,A项正确;达到平衡时,反应速率应为2v正(X)=v逆(Z),B项错误;反应放热,达到平衡后,降低温度,平衡正向移动,应为正向反应速率减小的倍数小于逆向反应速率减小的倍数,C项错误;增大压强平衡不移动,D项错误.
14.(等效平衡)某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变.下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
答案 D
解析:A项,根据题意,在此 ( http: / / www.21cnjy.com )平衡系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变,反应又是在恒温恒容条件下进行的,说明此平衡为等效平衡,根据恒温恒容条件下等效平衡的原理,反应前后气体的系数应相等,因此m=2,选项正确; B项,平衡常数的变化只与温度的变化有关,此反应是在恒温条件下进行,故两次平衡的平衡常数相同,选项正确;C项,平衡转化率等于变化量跟起始量之比,根据三段式原理,X与Y的变化量是1:2关系,而题目中给定的X与Y起始量也是1:2关系,因此X与Y的平衡转化率之比为1:1选项正确,; D项,根据三段式,结合第一次平衡时Z的体积分数为10%,可以计算出c(Z)=0.15 mol·L-1,两次平衡为等效平衡,因此第二次平衡时,Z的浓度也为0.15 mol·L-1 ,选项错误.
14-1.已知2SO2(g)+O2(g)??2SO3(g) ΔH<0,向同温、同体积的三个真空密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和 0.5 mol O2;(丙)2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
答案 B
解析 甲、丙属于等效平衡,乙相当于把甲的体 ( http: / / www.21cnjy.com )积扩大1倍,平衡逆向移动.A项,压强p:p甲=p丙<2p乙;C项,k甲=k丙=k乙;D项,Q甲+Q丙=Q,Q甲>2Q乙.
14-2、在容积为2 L的3个密闭容器中发生反应3A(g)+B(g)xC(g),按不同方式投入反
应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 甲 乙 丙
反应物投入量 3 mol A、2 mol B 6 mol A、4 mol B 2 mol C
到达平衡的时间/min 5 8
A的浓度/(mol·L-1) c1 c2
C的体积分数 w1 w3
混合气体密度/(g·L-1) ρ1 ρ2
下列说法正确的是( ).
A.若x<4,则2c1<c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
答案 C
解析:A项,若甲、乙建立等效平衡,则2c1= ( http: / / www.21cnjy.com )c2,但乙对于甲而言,相当于体积减小压强增大,由于x<4,则平衡正向移动,所以2c1>c2;B项,起始甲中投入量与化学方程式化学计量数比不等,故w3不可能等于w1,x的值也不能确定,错;C项,起始乙投入的量是甲的2倍,根据质量守恒定律知,反应前后总质量不变,而容积体积又相等,故有2ρ1=ρ2,正确;D项,v(A)=,错误.
15.原创(“三段式”在平衡计算中的应用)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25,若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t ℃时反应达到平衡.此时FeO(s)转化率为50%,则x值( )
A.0.05 B.0.03 C.0.06 D.0.02
答案 A
解析:根据反应: FeO(s)+CO(g)Fe(s)+CO2(g)
初始物质的量/mol 0.02 x 0 0
变化物质的量/mol 0.01 0.01 0.01 0.01
平衡物质的量/mol 0.01 x-0.01 0.01 0.01
根据化学平衡常数可知:K=0.01/(x-0.01)=0.25,解得x=0.05.
15-1.PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)??PCl5(g),并于10 min时达到平衡.有关数据如下:
PCl3(g) Cl2(g) PCl5(g)
初始浓度(mol·L-1) 2.0 1.0 0
平衡浓度(mol·L-1) c1 c2 0.4
下列判断不正确的是 ( ).
A.10 min内,v(Cl2)=0.04 mol·L-1·min-1
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的<1
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件再达平衡时,c(PCl5)<0.2 mol·L-1
答案 C
解析: PCl3(g)+Cl2(g)??PCl5(g)
c(起始)/mol·L-1 2.0 1.0 0
c(转化)/mol·L-1 0.4 0.4 0.4
c(平衡)/mol·L-1 1.6 0.6 0.4
10 min内,v(Cl2)=0.04 mo ( http: / / www.21cnjy.com )l·L-1·min-1,A正确;平衡时,n(Cl2)=1.2 mol,B正确;平衡常数减小,说明平衡逆向移动,则PCl3的>1,C错误;D项中当c(PCl5)=0.2 mol·L-1时浓度商为Qc==,而此温度下的平衡常数K==由K<Qc可得当c(PCl5)=0.2 mol·L-1时反应未达到平衡状态,平衡向逆反应进行,故达到平衡时,c(PCl5)<0.2 mol·L-1.
15-2.密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)??H2(g)+CO2(g).在500 ℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A.25% B.50% C.75% D.80%
答案 C
解析:利用平衡常数K,然后根据”三段式“进行计算.
16.原创(化学平衡原理的工业应用)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
①、增加压强 ②、降低温 ( http: / / www.21cnjy.com )度 ③、增大CO的浓度 ④、更换催化剂 ⑤、增大水蒸气的浓度 ⑥、升高温度 ⑦、定时移走二氧化碳 ⑧、减小压强
A.①③④ B.②⑤⑦ C.①⑤⑦ D.⑤⑦⑧
答案 B
解析:该反应为气体物质的量不变的 ( http: / / www.21cnjy.com )放热反应,压强改变对平衡无影响,①⑥错误;催化剂不影响平衡,④错误,增大CO的浓度,CO的转化率减小,增大水蒸气的浓度,平衡右移,CO的转化率增大,③错误⑤正确,,移走二氧化碳有利于平衡正向移动,⑦正确,故选B.
16-1.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
答案 D
解析:反应中S为液体(l)两侧气体反应前后不一致,故随着反应的进行压强变化,A项错;平衡时,分离出硫,其他条件不变,正反应速率不变,B项错;平衡时,其他条件不变,升高温度,平衡向逆反应方向移动,SO2的转化率减小,C项错;平衡常数仅与温度有关,故其他条件不变时,使用不同的催化剂,该反应的平衡常数不变,D项对.
16-2.臭氧是理想的烟气脱硝试剂,其脱硝 ( http: / / www.21cnjy.com )反应为:2NO2(g)+O3(g)??N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A B C D
升高温度,平衡常数减小 0~3 s内,反应速率为:v(NO2)=0.2 mol·L-1 t1时仅加入催化剂,平衡正向移动 达平衡时,仅改变x,则x为c(O2)
答案 A
解析:A项正确,由图像,反应物的总能量 ( http: / / www.21cnjy.com )高于生成物的总能量,说明此反应是放热反应,所以升高温度,平衡将逆向移动,平衡常数减小;B项错误;v(NO2)应等于0.2 mol·L-1·s-1;C项错误,加入催化剂,平衡不发生移动;D项错误,达平衡时,增大c(O2),平衡逆向移动,NO2的转化率会减小.
17.改编(“虚拟过程或假设法”解化学平衡移动问题)在两个恒容容器中有平衡体系:A(g) 2B(g)和2C(g) D(g),X1和X2分别是A和C的转化率.在温度不变情况下,均增加相同的A和C的物质的量,下列判断正确的是( )
A.X1降低,X2增大 B.X1、X2均降低
C.X1增大,X2降低 D.X1、X2均增大
答案 A
解析:假设开始加入1molA,在体积为V的容器中反应,达到平衡,转化率为X1,平衡后,
再加入1molA于另一个相同的容器中,建立的平衡一样A的转化率也是X1,但实际上A加
入原容器,相当于将两个容器各压缩一半,压缩平衡逆向移动,X1的转化率降低.第二个
反应,正反应方向物质的量减小,同样分析,转化率X增大.
17-1.在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)zC(g)+
mD(s).平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,
再达平衡时,测得A的浓度为0.3mol/L.则下列有关判断正确的是( )
A.x+y>z+m B.B的转化率一定减小
C.平衡向正反应方向移动 D.重新建立平衡K值减小
答案 B
解析:将容器的容积扩大到原来的两倍 ( http: / / www.21cnjy.com ),假设平衡不移动,A的浓度为0.25mol/L,现在A的浓度为0.3mol/L大于0.25mol/L,说明扩大体积,减小压强,平衡向逆反应方向移动,B的转化率一定减小,且x+y>z,因为温度不变,所以K值不变.
17-2.恒温条件下,反应N2(g)+3H2(g)??2NH3(g)在密闭容器中达到平衡状态,混合气体的平均摩尔质量为,N2与NH3的浓度均为c mol/L.若将容器的容积压缩为原来的,当达到新平衡时,下列说法中正确的是( )
A.新的平衡体系中,N2的浓度小于2c mol/L大于c mol/L
B.新的平衡体系中,NH3的浓度小于2c mol/L大于c mol/L
C.新的平衡体系中,混合气体的平均摩尔质量小于
D.新的平衡体系中,气体的密度是原平衡体系的1倍
答案 A
解析:将容器的容积压缩为原来的,平衡向正反应方向移动,N2的浓度小于2c mol/L,又根据勒夏特列原理,新的平衡体系中,N2的浓度应大于c mol/L,A项正确;平衡向正反应方向移动必定使NH3的浓度大于2c mol/L,B项错误;平均摩尔质量=,平衡向正反应方向移动,n(总)减小,增大,C项不正确;由于混合气体的总质量不变,而容器的容积为原来的,故气体的密度为原来的2倍,D项不正确.
填空题(共49分,其中18题10分,19题11分,20题14分,21题14分)
18.改编(化学反应速率及影响因素)Ⅰ、某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
( http: / / www.21cnjy.com )
(1)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为
v(X)= ,
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)达到平衡时Y的转化率是 ,增大压强,X的转化率 (填“增大””减小”或”不变”)
Ⅱ、把除去氧化膜的铝片投入到盛有少量稀盐酸的试管中,发现氢气发
生的速率变化情况如图所示.其中t1~t2速率变化的主要原因是 ;
t2~t3速率变化的主要原因是____________________________________.
答案 Ⅰ、(1)0.075mol/(l.min)(2)3X+Y2Z (3)10% 增大
Ⅱ、反应是放热反应,使温度升高,所以反应速率加快 随着反应的进行,H+浓度减小,反应速率逐渐减慢.
解析:Ⅱ、铝与HCl溶液的反应是放热反 ( http: / / www.21cnjy.com )应,反应过程中,反应物的浓度不断减小,因此,该反应中并存两个影响化学反应速率的外因:一是反应放出的热能使反应体系温度升高,化学反应速率加快;二是反应使HCl物质的量浓度减小,化学反应速率减慢.由图像可知,在t1~t2的时间内温度变化是影响化学反应速率的主要外因,在t2~t3的时间内,HCl物质的量浓度的变化是影响化学反应速率的主要外因.
18-1.Ⅰ、一密闭容器中发生下列反应:N2(g)+3H2(g)2NH3(g);△H<0下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1 t3 t4 .
(2)下列时间段中,氨的百分含量最高的是 .
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)温度不变,若在t6时刻向反应体系中充入氮气,t7时刻建立新的平衡,
①请在原图中画出速率变化曲线
②新的平衡状态时,平衡常数K (填“增大””减小”或”不变”)
Ⅱ、在25 ℃时,向100 mL含HCl 14.6 g的盐酸溶液里放入5.6 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)H2,又经过4 min,铁粉完全溶解.则:
(1)在前2 min内,用FeCl2表示的平均反应速率是_______________________.
(2)在后4 min内,用HCl表示的平均反应速率是__________________________.
(3)前2 min与后4 min相 ( http: / / www.21cnjy.com )比,反应速率________(填“前者”或“后者”)较快,其原因是____________________ ____ ____________________________________________.
答案:Ⅰ、(1)升高温度 使用催化剂 减小压强 (2)A (3)①略 ②不变
Ⅱ、(1)0.25 mol·L-1·min-1 (2)0.25 mol·L-1·min-1 (3)前者 前2 min时HCl的浓度较大
解析:Ⅱ、n(HCl)==0.4 mol,c(HCl)==4.0 mol·L-1,n(Fe)=0.1 mol.
Fe + 2HCl == FeCl2 + H2↑
初态/mol: 0.1 0.4 0 0
2 min末/mol:0.05 0.4-0.1 0.05 0.05
6 min末/mol: 0 0.2 0.1 0.1
故前2 min内,v(FeCl2)==0.25 mol·L-1·min-1;
后4 min内,v(HCl)==0.25 mol·L-1·min-1.
19.原创(化学平衡及影响因素)
(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0
① 达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号).
a.升高温度 b.加 ( http: / / www.21cnjy.com )入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚 f.增加H2的浓度
②改变条件,平衡向正反应方向移动,反应物的转化率 (填”一定”或“不一定”)增大.
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 CH3OH CH3OCH3 H2O
浓度/(mol·L-1) 0.44 0.6 0.6
①比较此时正、逆反应速率的大小:v(正)________v(逆)(填“>”“<”或“=”).
②若加入CH3OH后,经10 min反 ( http: / / www.21cnjy.com )应达到平衡,此时c(CH3OH)=________; 该时间内反应速率v(CH3OH)=________.
③一定温度下,能判断上述反应达化学平衡状态的依据是
a.容器内压强一定 b.容器内气体的密度一定
c.不再生成 CH3OCH3 d.CH3OH和CH3OCH3的生成速率之比为2:1
答案 (1) ① c、e、f ②不一定
(2)①> ②0.04 mol·L-1 0.16 mol·L-1·min-1 ③ d
解析:(1)①正反应是放 ( http: / / www.21cnjy.com )热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大H2浓度,平衡右移,但CO转化率增大,故选c、e、f.
(2)此时的浓度熵Qc==1.86<400,反应未达到平衡状态,向正反应方向移动,故v(正)>v(逆);设平衡时生成物的浓度为(0.6 mol·L-1+x),则甲醇的浓度为(0.44 mol·L-1-2x),根据平衡常数表达式400=,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1.由表可知,甲醇的起始浓度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,10 min变化的浓度为1.6 mol·L-1,故v(CH3OH)=0.16 mol·(L·min)-1.
19-1.氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
(1)当反应达到平衡时,N2和H2 ( http: / / www.21cnjy.com )的浓度比是 ;N2和H2的转化率比是 .反应放出的热量 (填“大于”“小于”或“等于”)184.8 kJ
(2)降低平衡体系的温度 ( http: / / www.21cnjy.com )(保持体积不变),混合气体的平均相对分子质量 ,密度 .平衡常数K (填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器 ( http: / / www.21cnjy.com )内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍.
答案 (1)1∶3 1∶1 小于 (2)增大 不变 增大 (3)逆向 (4)向左移动 小于
解析:(3)达平衡后,保持压强不变,充入氩气,使体系体积增大,浓度减小,相当于减小反应物压强,使平衡逆向移动.
(4)恒容时升高温度至原来的2倍 ( http: / / www.21cnjy.com ),平衡向吸热反应的方向移动,即向左移动,根据勒夏特列原理,达新平衡后,容器内温度大于原来的温度,小于原来温度的2倍.
20.改编(化学平衡移动原理、化学平衡常数)高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g) Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如右表所示:
温度/℃ 1 000 1 150 1 300
平衡常数 4.0 3.7 3.5
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH (填“>”“<”或“=”)0.
(2)在一个容积为10 L的密闭容 ( http: / / www.21cnjy.com )器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= 、CO的平衡转化率= .
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000℃时,某时刻 ( http: / / www.21cnjy.com )CO2和CO的物质的量浓度分别为0.2mol·L-1和0.1mol·L-1,则此时反应是否达到平衡 (填“是”或“否”),V(正) V(逆)(填“>”“<”或“=”)
答案 (1)c(CO2)/c(CO) < (2)0.006 mol·L-1·min-1 60% (3)C (4)否 >
解析:(4)c(CO2)/c( ( http: / / www.21cnjy.com )CO)=0.2mol·L-1/0.1mol·L-1=2<4,反应未达到平衡,应向正反应方向移动,V(正)>V(逆)
20-1.在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的平均相对分子质量减小.回答下列问题:
(1)反应的ΔH________0(填“大于 ( http: / / www.21cnjy.com )”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示.在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________.
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率
降低,经10 s又达到平衡.
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________ .
②列式计算温度T时反应的平衡常数K2:_______________________________ .
(3)温度T时反应达平衡后,将反应容 ( http: / / www.21cnjy.com )器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________________________________.
答案 (1)大于 0. ( http: / / www.21cnjy.com )001 0 0.36 mol·L-1 (2)①大于 反应正方向吸热,反应向吸热方向进行,故温度升高 ②平衡时,c(NO2)=0.120 mol·L-1+0.002 0 mol·L-1·s-1×10 s×2=0.16 mol·L-1
c(N2O4)=0.040 mol·L-1-0.002 0 mol·L-1·s-1×10 s=0.020 mol·L-1
K2==1.3 mol·L-1
(3)逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
解析:首先根据,温度升高 ( http: / / www.21cnjy.com ),混合气体的平均相对分子质量减小,说明平衡向生成NO2的正反应方向移动,即正反应是吸热气体物质的量增大的反应.然后根据平衡移动原理进行判断.
21.(知识综合、等效平衡、虚拟过程)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) N2O4(g) ΔH<0)
(1)一段时间后,反应达到平衡,此 ( http: / / www.21cnjy.com )时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入 ( http: / / www.21cnjy.com )与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通人等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______.
答案 (1)< 变小 (2)增大 不变 变小 (3)A (4)0.02mol
解析:反应本身是体积缩小的放热反应.
(1)由于A为恒容体系,B为恒压体系,在平衡时pA<pB,故v(A)<v(B),若打开K2,A、B形成一个新的恒压体系,气体体积将变小.
(2)若再通入NO2,对于A相当于加压, ( http: / / www.21cnjy.com )原平衡向正反应方向移动,NO2的转化率增大.若再通入Ne,对于A,末改变体系中各物质的浓度,平衡不移动,转化率不变;对于B,其体积增大,相当于减小压强,平衡向逆反应方向移动,NO2的转化率减小.
(3)此时A为绝热体系,随反应的进行,体系温度升高,即TA>TB,A相对于B是升高温度,平衡向逆反应方向移动,A中颜色加深.
(4)=即n总==0.08 mo ( http: / / www.21cnjy.com )l,投入NO2的物质的量为=0.1 mol,根据”三段式“计算,平衡时N2O4的物质的量为0.02mol.
21-1.工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).
(1)在—定温度和压强下,CO(g)+2H2(g)CH3OH(g) ΔH=-128.8 kJ/mol.若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示).若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”).
(2)判断该反应达到平衡状态的依据是________(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
E.CH3OH、CO、H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 甲 乙 丙
反应物投入量 1 mol CO、2 mol H2 1 mol CH3OH 2 mol CH3OH
平衡时数据 反应能量变化的绝对值(kJ) a b c
反应物转化率 α1 α1 α3
体系压强(Pa) p1 p2 p3
则a+b=________;a1+a3________1(填“<”、“>”或“=”,下同);2p2________p3.
答案:(1) 正向移动 增大 (2)BE (3)128.8 < >
解析:(1) CO(g)+2H2(g)??CH3OH(g)
起始浓度(mol/L) 5a 10a 0
转化浓度(mol/L) 3a 6a 3a
平衡浓度(mol/L) 2a 4a 3a
所以平衡常数K==.若达平衡后再向容器中 ( http: / / www.21cnjy.com )投入10a mol CO、20a mol H2和10a mol CH3OH(g),则此时Qc
催化剂
高温
催化剂
高温
催化剂
高温
