2024年中考化学强化复习---金属和金属材料(含答案)
文档属性
| 名称 | 2024年中考化学强化复习---金属和金属材料(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 929.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-19 00:00:00 | ||
图片预览



文档简介
2024年中考化学强化复习金属和金属材料
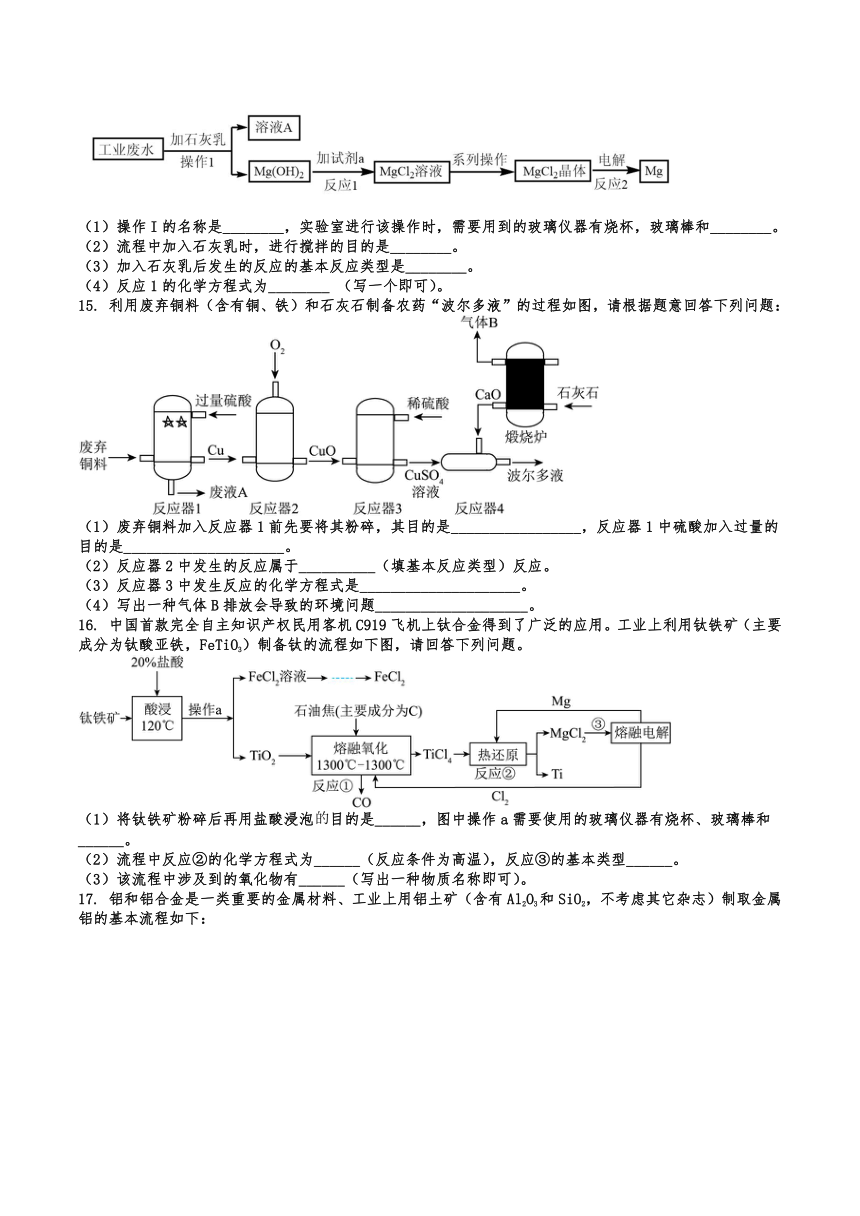
一、选择题
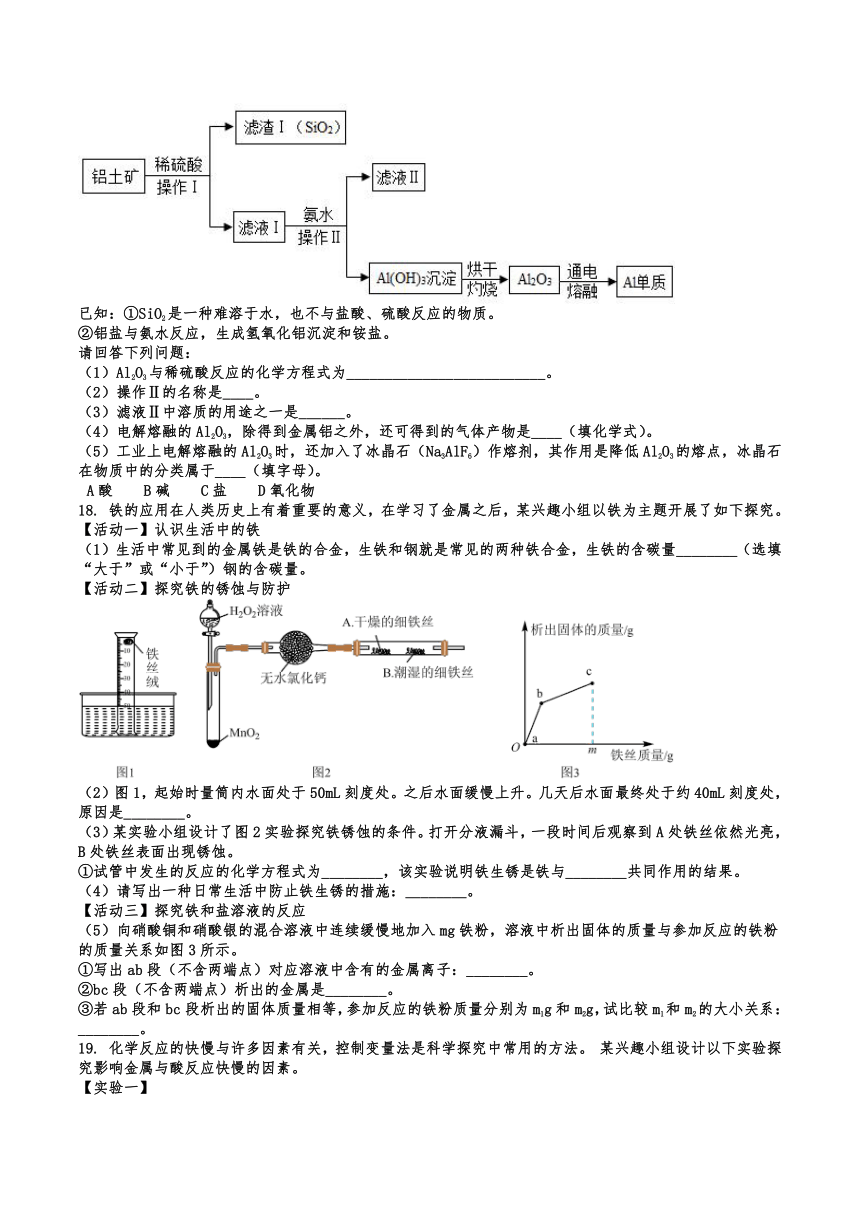
1. 下列有关金属及合金的说法错误的是
A. 金属在常温下都是固体 B. 铝合金的硬度比铝的硬度大
C. 铁制品在潮湿的空气中易生锈 D. 钢铁是使用最多的金属材料
2. 在刚刚结束的理科实验操作考试中,某同学抽到的实验为“金属的物理和化学性质”,下面是实验中出现的操作,正确的是
A. 加入铁钉 B. 倾倒稀盐酸
C. 滴加硫酸铜溶液 D. 胶头滴管清洗后放回滴瓶
3. 钪是种熔点高、密度小、抗腐蚀性能好的金属,主要用于国防、军工、航天、核能和超导体等尖端技术领域。如图是钪(Sc)元素在元素周期表中及粒子结构示意图的信息。下列有关X的说法正确的是
A. X属于非金属元素 B. X原子的质量为44.96g
C. X原子的核内质子数为21 D. X原子核外有3个电子层
4. 现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,X溶解并有气泡产生,而Y则没有任何现象;如果把Y和Z分别放入硝酸银溶液中,一会后,在Y的表面有银白色金属析出,而Z没有变化。则X、Y、Z三种金属的活动顺序为
A. Y>Z>X B. X>Y>Z C. X>Z>Y D. Z>Y>X
5. 兴趣小组同学用下图所示的“W”形玻璃管进行微型实验。下列说法正确的是
A. a处红色粉末变黑 B. a处的反应属于置换反应
C. b处的现象为紫色石蕊溶液变红 D. 该实验体现了CO的可燃性
6. 金元素在元素周期表中显示的信息如图所示。以下表述中错误的是
A. 金原子的中子数是79
B. 金属于金属元素
C. 金的相对原子质量为197.0
D. 金在自然界中以单质形式存在是因为金的化学性质比较稳定
7. 某小组用如图所示装置进行创新实验。一段时间后观察到蜡烛熄灭,将反应后的装置密封放置数天后,发现铁钉表面出现了锈迹。下列有关说法正确的是
A. 蜡烛燃烧前,容器中氧气的质量分数约为21%
B. 当铁钉不再锈蚀时,容器内气体均为二氧化碳
C. 实验说明只要有氧气,蜡烛就可被点燃
D. 由实验现象可知蜡烛燃烧会生成水
8. 某兴趣小组的同学做了一个实验,在甲试管中装入固体物质,乙试管装入某溶液,按如图所示组装好仪器.通过分液漏斗加入足量稀盐酸,同时打开止水夹,看到乙试管溶液中有气泡冒出:再关闭止水夹,发现一段时间后乙中有沉淀产生.符合此实验现象的一组试剂是:
A. 甲:Na2CO3 乙:KOH B. 甲:Mg 乙:AgNO3
C. 甲:KOH 乙:NaCl D. 甲:CuO 乙:NaOH
9. 如图是铁及其化合物的化合价和物质类别关系图(横坐标表示物质类别,纵坐标表示物质中铁元素的化合价),下列说法错误的是
A. A物质所属物质类别是单质
B. B物质的化学式为FeO
C. 可以用CO和C物质在高温下生成A物质
D. E物质溶于水所得溶液的颜色为黄色
10. 向AgNO3 和Cu(NO3)2的混合溶液中缓慢连续加入m克锌粉,析出固体的质量与加入锌粉的质量关系如图所示,下列分析不正确的是
A. 向N点对应溶液中加入氯化钠溶液,有白色沉淀产生
B. P点对应的固体一定有Cu,可能有Ag
C. Q点对应的溶液为无色,此时溶液的溶质无Cu(NO3)2,只有Zn(NO3)2
D. 加入m克锌粉后,过滤,向滤渣中加入稀盐酸,有气泡产生
二、非选择题
11.常温下铝、铁、铅的物理性质数据如表,据此可知高压输电线最好选用金属______;铁的合金通常可以做菜刀、锤子等,其合金的硬度_______5(填“>”、“<”或“=”)。人们常选用金属______和铋、锡、铬制作合金,用于保险丝。
金属 铝 铁 铅
导电性(以100为标准) 61 17 7.9
密度/(g·cm3) 2.70 7.86 11.3
熔点/℃ 660 1535 327
硬度(以10为标准) 2.7 5 1.5
12. 2021年1月13日,我国自主研发的高温超导高速磁浮工程化样车及试验线正式启用,列车的时速高达600公里每小时。
(1)制造列车使用了多种材料。下列列车的部件中,属于金属材料的是______。(填字母序号)
A. 有机玻璃车窗 B. 碳纤维车体
C. 钇铋镁合金超导材料 D. 涤纶座套
(2)车身表面烤漆的主要目的是______(答出1条即可)。
(3)铜用于制作列车刹车系统中的铜圈导线,是利用铜的导电性和______性。
13. 工厂从含铜废料中回收铜的生产流程如下。(提示:含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水)
(1)“酸浸”时发生反应的化学方程式_____。
(2)“酸浸”步骤最好需要加热的原因是________。
(3)操作Ⅰ的名称是_____,经操作Ⅰ分离所得溶液中含有的阳离子有_____。
(4)“酸浸”时所加硫酸溶液过量的原因是_________。
14. 某工业废水中含有大量的氯化镁和硝酸镁,某废水处理公司从该废水中提取回收金属镁的流程示意图如下。回答下列问题。
(1)操作I的名称是________,实验室进行该操作时,需要用到的玻璃仪器有烧杯,玻璃棒和________。
(2)流程中加入石灰乳时,进行搅拌的目的是________。
(3)加入石灰乳后发生的反应的基本反应类型是________。
(4)反应1的化学方程式为________ (写一个即可)。
15. 利用废弃铜料(含有铜、铁)和石灰石制备农药“波尔多液”的过程如图,请根据题意回答下列问题:
(1)废弃铜料加入反应器1前先要将其粉碎,其目的是_________________,反应器1中硫酸加入过量的目的是_____________________。
(2)反应器2中发生的反应属于__________(填基本反应类型)反应。
(3)反应器3中发生反应的化学方程式是_____________________。
(4)写出一种气体B排放会导致的环境问题____________________。
16. 中国首款完全自主知识产权民用客机C919飞机上钛合金得到了广泛的应用。工业上利用钛铁矿(主要成分为钛酸亚铁,FeTiO3)制备钛的流程如下图,请回答下列问题。
(1)将钛铁矿粉碎后再用盐酸浸泡目的是______,图中操作a需要使用的玻璃仪器有烧杯、玻璃棒和______。
(2)流程中反应②的化学方程式为______(反应条件为高温),反应③的基本类型______。
(3)该流程中涉及到的氧化物有______(写出一种物质名称即可)。
17. 铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3和SiO2,不考虑其它杂志)制取金属铝的基本流程如下:
已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质。
②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。
请回答下列问题:
(1)Al2O3与稀硫酸反应的化学方程式为__________________________。
(2)操作Ⅱ的名称是____。
(3)滤液Ⅱ中溶质的用途之一是______。
(4)电解熔融的Al2O3,除得到金属铝之外,还可得到的气体产物是____(填化学式)。
(5)工业上电解熔融的Al2O3时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低Al2O3的熔点,冰晶石在物质中的分类属于____(填字母)。
A酸 B碱 C盐 D氧化物
18. 铁的应用在人类历史上有着重要的意义,在学习了金属之后,某兴趣小组以铁为主题开展了如下探究。
【活动一】认识生活中的铁
(1)生活中常见到的金属铁是铁的合金,生铁和钢就是常见的两种铁合金,生铁的含碳量________(选填“大于”或“小于”)钢的含碳量。
【活动二】探究铁的锈蚀与防护
(2)图1,起始时量筒内水面处于50mL刻度处。之后水面缓慢上升。几天后水面最终处于约40mL刻度处,原因是________。
(3)某实验小组设计了图2实验探究铁锈蚀的条件。打开分液漏斗,一段时间后观察到A处铁丝依然光亮,B处铁丝表面出现锈蚀。
①试管中发生的反应的化学方程式为________,该实验说明铁生锈是铁与________共同作用的结果。
(4)请写出一种日常生活中防止铁生锈的措施:________。
【活动三】探究铁和盐溶液的反应
(5)向硝酸铜和硝酸银的混合溶液中连续缓慢地加入mg铁粉,溶液中析出固体的质量与参加反应的铁粉的质量关系如图3所示。
①写出ab段(不含两端点)对应溶液中含有的金属离子:________。
②bc段(不含两端点)析出的金属是________。
③若ab段和bc段析出的固体质量相等,参加反应的铁粉质量分别为m1g和m2g,试比较m1和m2的大小关系:________。
19. 化学反应的快慢与许多因素有关,控制变量法是科学探究中常用的方法。 某兴趣小组设计以下实验探究影响金属与酸反应快慢的因素。
【实验一】
取四份等质量的铁分别与足量的盐酸进行反应,实验条件如图1所示;图2为反应时间与产生气体体积的关系曲线。
(1)对比图 2 中实验 a 和 b 的曲线,得出的结论是 ___________,能得出相同结论的另一对比的组别是_________(用字母 a、b、c、d 表示);该实验中还有另外一组对比实验,能得出的结论是 ______。
(2)实验中观察到气体产生速率“逐渐变快又变慢”,“逐渐变快”的原因是 ________。
(3)该反应的化学方程式为 ________。
【实验二】
常温时,用足量的铁、锌、镁三种金属分别与等量同浓度的盐酸反应。 实验发生装置如图 3所示;压强变化如图4所示(压强越大,表示产生氢气的量越多)。
(4)实验中,还需要控制的变量是______________;
(5)实验得出结论是金属与酸反应的速率与 __________ 有关。
(6)该实验中发现镁片与盐酸反应,最终测得压强比锌和铁更大一点。忽略误差,其合理的原因是_______。
20. 文献记载:距今4000~5000年,我国古代劳动人民已开始冶铸铜器。出土的铜器表面通常会有一层绿色的铜锈[主要成分为]。兴趣小组的同学对铜锈的组成和铜生锈的条件进行如下探究。
已知:Ⅰ.无水硫酸铜遇水变为蓝色;Ⅱ.铜锈与盐酸反应的化学方程式为;Ⅲ.常温常压下,二氧化碳的密度是。
【活动一】探究铜锈的组成
用下图所示装置进实验,观察到试管中固体由绿色变为黑色,干燥管内无水硫酸铜变为蓝色,烧杯中澄清石灰水变浑浊。
(1)烧杯中发生的反应的化学程式为____。
(2)由实验现象推测,铜锈中至少含有____种元素。
【活动二】探究铜生锈的条件
【提出猜想】根据铜锈的组成元素推测,铜生锈可能与和有关。
【进行实验】实验小组的同学取直径、长度均相同的铜丝,打磨光亮,设计了下图所示的5个实验并持续观察。
编号 ① ② ③ ④ ⑤
操作
现象 无明显现象 无明显现象 铜丝表面有绿色物质析出 无明显现象 无明显现象
【解释与结论】
(3)实验中使用的蒸馏水是经煮沸迅速冷却的,其目的是________。
(4)对比实验②和③,得出的结论是_______。为验证猜想,实验⑤中应加入的物质为____。
(5)由上述实验可推知,铜生锈的条件是____。
【活动三】测定铜锈中的含量
将上述实验编号③试管中剩余物质过滤,洗涤,干燥,得到固体,连接图甲、图乙装置,检查装置气密性,加入固体与足量盐酸进行实验。
(6)完全反应后,常温常压下测得生成的气体体积为,则该固体中的含量为______(用含v、d、m的字母表示)。
(7)该实验条件下测得铜锈质量分数偏大的原因是______(写一点即可)。
21. 某兴趣小组的同学取2.8g铁粉,放入到盛有200g溶质质量分数为8%的硫酸铜溶液的烧杯中,一段时间后,反应停止。
(1)完全反应后,请在图中烧杯中,用类似 (表示水分子)的图形,画出溶液中存在的微粒_____。
(2)根据方程式进行计算,理论上可以得到多少克的铜
22. 将15g表面氧化的铝片放入足量稀盐酸中,完全反应后收集到氢气质量如图所示,回答下列问题。
(1)0~t时刻没有产生气体的原因是______。
(2)求该铝片中铝单质的质量分数。
23. 某课外兴趣小组同学取一定量含铜粉的氧化铜粉末,放入烧杯中,加入196g稀硫酸,搅拌,恰好完全反应后过滤(损耗忽略不计),烧杯中固体的质量随时间变化情况如图所示,试计算稀硫酸溶质质量分数。(规范写出计算过程)
24. 在烧杯中加入2.14g久置的铝箔,再倒入足量的稀硫酸,放出气体的质量如图所示。请回答下列问题:
(1)0~t时刻没有产生气体的原因是________;
(2)求该铝箔中铝单质的质量。
25. 铁、铜双金粉可用于生产机械零件。化学小组同学对某铁、铜双金粉进行实验:取10g铁、铜双金粉样品于试管中,将90g稀硫酸分三次加入试管中,充分反应后,测定生成氢气的质量数据见下表:
第一次 第二次 第二次
加入稀硫酸的质量/g 30 30 30
生成氢气的总质量/g 0.14 0.28 0.3
请回答下列问题:
(1)每次加入稀硫酸后,需用玻璃棒搅拌,其目的是_________。
(2)该样品中铁的质量分数为多少?
2024年中考化学强化复习金属和金属材料参考答案
一、选择题
1. 下列有关金属及合金的说法错误的是
A. 金属在常温下都是固体 B. 铝合金的硬度比铝的硬度大
C. 铁制品在潮湿的空气中易生锈 D. 钢铁是使用最多的金属材料
【答案】A
【解析】
【详解】A、金属汞在常温下是液体,A错误;
B、一般合金的硬度大于成分金属的硬度,B正确;
C、铁制品在干燥的环境中不容易生锈,在潮湿的空气中容易生锈,C正确;
D、钢铁有许多优良性能,是人类使用最多金属材料,D正确;
2. 在刚刚结束的理科实验操作考试中,某同学抽到的实验为“金属的物理和化学性质”,下面是实验中出现的操作,正确的是
A. 加入铁钉 B. 倾倒稀盐酸
C. 滴加硫酸铜溶液 D. 胶头滴管清洗后放回滴瓶
【答案】B
【解析】
【详解】A、把密度较大的块状药品或金属颗粒放入玻璃容器时,应该先把容器横放,把药品或金属颗粒放入容器口后,再把容器慢慢地竖起来,使药品或金属颗粒滑到容器底部,以免打破容器,不符合题意;
B、瓶塞倒放在桌上,标签对着手心以防止标签被腐蚀,瓶口要紧挨着试管口,试管倾斜,使液体缓缓地倒入试管,符合题意;
C、滴加液体时,滴管要竖直悬空,不能将胶头滴管伸进入试管内,以防污染试剂,使用完以后也不能横放或倒置以免腐蚀橡胶帽,不符合题意;
D、滴瓶中的胶头滴管不用清洗,以免污染、稀释滴瓶中的试剂,不符合题意;
故选B。
3. 钪是种熔点高、密度小、抗腐蚀性能好的金属,主要用于国防、军工、航天、核能和超导体等尖端技术领域。如图是钪(Sc)元素在元素周期表中及粒子结构示意图的信息。下列有关X的说法正确的是
A. X属于非金属元素 B. X原子的质量为44.96g
C. X原子的核内质子数为21 D. X原子核外有3个电子层
【答案】C
【解析】
【详解】A、元素周期表的单元格中的X是该元素的元素名称,即为钪;钪的汉字偏旁是“钅”字旁,则钪(Sc)元素属于金属元素,不符合题意;
B、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故X原子的相对原子质量是44.96,不是原子质量,不符合题意;
C、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数=21,即X原子的核内质子数为21,符合题意;
D、原子序数=质子数=核外电子数,则结合该粒子结构示意图可知,X原子核外应该有4个电子层,第一层有2个电子,第二层有8个电子,第三层有8个电子,第四层有3个电子,不符合题意;
故选C。
4. 现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,X溶解并有气泡产生,而Y则没有任何现象;如果把Y和Z分别放入硝酸银溶液中,一会后,在Y的表面有银白色金属析出,而Z没有变化。则X、Y、Z三种金属的活动顺序为
A. Y>Z>X B. X>Y>Z C. X>Z>Y D. Z>Y>X
【答案】B
【解析】
【详解】把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应,说明X的活动性比Y强;把Y和Z分别放入硝酸银溶液中,在Y表面有银析出,而Z没有变化,说明Y的活动性比Z强;综上,X、Y、Z的金属活动性顺序为X>Y>Z,故选:B。
5. 兴趣小组同学用下图所示的“W”形玻璃管进行微型实验。下列说法正确的是
A. a处红色粉末变黑 B. a处的反应属于置换反应
C. b处的现象为紫色石蕊溶液变红 D. 该实验体现了CO的可燃性
【答案】C
【解析】
【详解】A、一氧化碳和氧化铜反应生成铜和二氧化碳,固体由黑色变成红色,错误;
B、置换反应是单质和化合物生成另一种单质和另一种化合物,a处一氧化碳和氧化铜均是化合物,不属于置换反应,错误;
C、b处二氧化碳与水反应生成碳酸能使紫色石蕊试液变红,正确;
D、实验利用一氧化碳还原氧化铜,体现了一氧化碳的还原性,错误。
故选:C。
6. 金元素在元素周期表中显示的信息如图所示。以下表述中错误的是
A. 金原子的中子数是79
B. 金属于金属元素
C. 金的相对原子质量为197.0
D. 金在自然界中以单质形式存在是因为金的化学性质比较稳定
【答案】A
【解析】
【详解】A、根据元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数为79,汉字下面的数字表示相对原子质量,该元素的相对原子质量为197;由相对原子质量≈质子数+中子数,则金原子的中子数=197-79=118,故A错误;
B、中间的汉字表示元素名称,该元素的名称是金,属于金属元素,故B正确;
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为197,故C正确;
D、金的化学性质比较稳定,很难与其他物质发生反应,所以金在自然界中以单质形式,故D正确。
故选A。
7. 某小组用如图所示装置进行创新实验。一段时间后观察到蜡烛熄灭,将反应后的装置密封放置数天后,发现铁钉表面出现了锈迹。下列有关说法正确的是
A. 蜡烛燃烧前,容器中氧气的质量分数约为21%
B. 当铁钉不再锈蚀时,容器内气体均为二氧化碳
C. 实验说明只要有氧气,蜡烛就可被点燃
D. 由实验现象可知蜡烛燃烧会生成水
【答案】D
【解析】
【详解】A、蜡烛燃烧前,容器中的气体是空气,空气中氧气的体积分数约为21%,不是质量分数,不符合题意;
B、蜡烛在空气中燃烧生成二氧化碳和水,铁钉锈蚀消耗氧气,故当铁钉不再锈蚀时,容器内气体除了二氧化碳,还含不参与反应的氮气,稀有气体等,不符合题意;
C、蜡烛熄灭后,将反应后的装置密封放置数天后,发现铁钉表面出现了锈迹,铁生锈的条件是铁与氧气和水接触,说明蜡烛熄灭后,装置内还存在氧气,说明氧气浓度降低到一定程度,蜡烛就会熄灭,不符合题意;
D、蜡烛燃烧前,装置内是干燥空气,蜡烛熄灭后,将反应后的装置密封放置数天后,发现铁钉表面出现了锈迹,铁生锈的条件是铁与氧气和水接触,说明蜡烛燃烧会生成水,符合题意。
故选D。
8. 某兴趣小组的同学做了一个实验,在甲试管中装入固体物质,乙试管装入某溶液,按如图所示组装好仪器.通过分液漏斗加入足量稀盐酸,同时打开止水夹,看到乙试管溶液中有气泡冒出:再关闭止水夹,发现一段时间后乙中有沉淀产生.符合此实验现象的一组试剂是:
A. 甲:Na2CO3 乙:KOH B. 甲:Mg 乙:AgNO3
C. 甲:KOH 乙:NaCl D. 甲:CuO 乙:NaOH
【答案】B
【解析】
【详解】A、碳酸钠与盐酸反应生成二氧化碳气体,使乙中有气泡冒出,但生成的二氧化碳将盐酸压入乙试管与氢氧化钾反应,乙试管中不会产生沉淀,故A不符合题意;
B、镁与盐酸反应生成氯化镁和氢气,使乙中有气泡冒出,生成氢气将氯化镁压入乙试管与硝酸银生成氯化银沉淀,故B符合题意;
C、氢氧化钾与盐酸反应生成氯化钾和水,不能使乙中有气泡冒出,故C不符合题意;
D、氧化铜与盐酸反应生成氯化铜和水,不能使乙中有气泡冒出,故D不符合题意。
故选B。
9. 如图是铁及其化合物的化合价和物质类别关系图(横坐标表示物质类别,纵坐标表示物质中铁元素的化合价),下列说法错误的是
A. A物质所属物质类别是单质
B. B物质的化学式为FeO
C. 可以用CO和C物质在高温下生成A物质
D. E物质溶于水所得溶液的颜色为黄色
【答案】D
【解析】
【详解】A、A物质所属物质中元素化合价为零,类别是单质,正确;
B、氧化物含有两种元素的化合物中,其中一种元素为氧元素;B物质中铁元素为+2价,氧元素化合价为-2价,故化学式为FeO,正确;
C、C为+3价铁的氧化物,即氧化铁,可以用CO和氧化铁在高温下生成铁单质,正确;
D、E物质中含有+2价铁,而+3价可溶性铁盐溶于水所得溶液的颜色为黄色,错误。
故选D。
10. 向AgNO3 和Cu(NO3)2的混合溶液中缓慢连续加入m克锌粉,析出固体的质量与加入锌粉的质量关系如图所示,下列分析不正确的是
A. 向N点对应溶液中加入氯化钠溶液,有白色沉淀产生
B. P点对应的固体一定有Cu,可能有Ag
C. Q点对应的溶液为无色,此时溶液的溶质无Cu(NO3)2,只有Zn(NO3)2
D. 加入m克锌粉后,过滤,向滤渣中加入稀盐酸,有气泡产生
【答案】B
【解析】
【分析】向AgNO3 和Cu(NO3)2的混合溶液中缓慢连续加入m克锌粉,锌先和硝酸银反应生成硝酸锌和银,再和硝酸铜反应生成硝酸锌和铜,第一个拐点表示硝酸银恰好完全反应,第二个拐点表示硝酸铜恰好完全反应。
【详解】A、N点位于第一个拐点之前,表示硝酸银没有完全反应,加入氯化钠溶液,氯化钠和硝酸银生成氯化银沉淀和硝酸钠,分析正确。
B、P点为与两个拐点之间,表示硝酸银恰好完全反应,硝酸铜有剩余,对应的固体一定有Cu,Ag,分析错误。
C、Q点位于第二个拐点之后,表示硝酸银、硝酸铜完全反应,且锌粉过量,对应的溶液为无色,分析正确。
D、m克锌粉对应点在两拐点之后,表示硝酸银、硝酸铜完全反应,且锌粉过量,向滤渣中加入稀盐酸,盐酸和锌生成氯化锌和氢气,有气泡产生,分析正确。
故选:B。
二、非选择题
11.常温下铝、铁、铅的物理性质数据如表,据此可知高压输电线最好选用金属______;铁的合金通常可以做菜刀、锤子等,其合金的硬度_______5(填“>”、“<”或“=”)。人们常选用金属______和铋、锡、铬制作合金,用于保险丝。
金属 铝 铁 铅
导电性(以100为标准) 61 17 7.9
密度/(g·cm3) 2.70 7.86 11.3
熔点/℃ 660 1535 327
硬度(以10为标准) 2.7 5 1.5
【答案】 ①. 铝 ②. > ③. 铅
12. 2021年1月13日,我国自主研发的高温超导高速磁浮工程化样车及试验线正式启用,列车的时速高达600公里每小时。
(1)制造列车使用了多种材料。下列列车的部件中,属于金属材料的是______。(填字母序号)
A. 有机玻璃车窗 B. 碳纤维车体
C. 钇铋镁合金超导材料 D. 涤纶座套
(2)车身表面烤漆的主要目的是______(答出1条即可)。
(3)铜用于制作列车刹车系统中的铜圈导线,是利用铜的导电性和______性。
【答案】(1)C (2)隔绝铁与氧气和水的接触,防止车身锈蚀(答案合理即可)
(3)延展
13. 工厂从含铜废料中回收铜的生产流程如下。(提示:含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水)
(1)“酸浸”时发生反应的化学方程式_____。
(2)“酸浸”步骤最好需要加热的原因是________。
(3)操作Ⅰ的名称是_____,经操作Ⅰ分离所得溶液中含有的阳离子有_____。
(4)“酸浸”时所加硫酸溶液过量的原因是_________。
【答案】(1)CuO+H2SO4=CuSO4+H2O
(2)加快反应速率,使反应更充分
(3) ①. 过滤 ②. Cu2+、H+ (4)使氧化铜完全反应
14. 某工业废水中含有大量的氯化镁和硝酸镁,某废水处理公司从该废水中提取回收金属镁的流程示意图如下。回答下列问题。
(1)操作I的名称是________,实验室进行该操作时,需要用到的玻璃仪器有烧杯,玻璃棒和________。
(2)流程中加入石灰乳时,进行搅拌的目的是________。
(3)加入石灰乳后发生的反应的基本反应类型是________。
(4)反应1的化学方程式为________ (写一个即可)。
【答案】(1) ①. 过滤 ②. 漏斗
(2)使反应更快更充分
(3)复分解反应 (4)
15. 利用废弃铜料(含有铜、铁)和石灰石制备农药“波尔多液”的过程如图,请根据题意回答下列问题:
(1)废弃铜料加入反应器1前先要将其粉碎,其目的是_________________,反应器1中硫酸加入过量的目的是_____________________。
(2)反应器2中发生的反应属于__________(填基本反应类型)反应。
(3)反应器3中发生反应的化学方程式是_____________________。
(4)写出一种气体B排放会导致的环境问题____________________。
【答案】(1) ①. 增大反应物的接触面积,使反应更加充分 ②. 将废料中的铁反应完
(2)化合 (3)CuO+H2SO4=CuSO4+H2O
(4)温室效应(合理即可)
16. 中国首款完全自主知识产权民用客机C919飞机上钛合金得到了广泛的应用。工业上利用钛铁矿(主要成分为钛酸亚铁,FeTiO3)制备钛的流程如下图,请回答下列问题。
(1)将钛铁矿粉碎后再用盐酸浸泡目的是______,图中操作a需要使用的玻璃仪器有烧杯、玻璃棒和______。
(2)流程中反应②的化学方程式为______(反应条件为高温),反应③的基本类型______。
(3)该流程中涉及到的氧化物有______(写出一种物质名称即可)。
【答案】(1) ①. 增大反应物之间的接触面积,使反应更快更充分 ②. 漏斗
(2) ①. ②. 分解反应
(3)二氧化钛或一氧化碳
17. 铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3和SiO2,不考虑其它杂志)制取金属铝的基本流程如下:
已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质。
②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。
请回答下列问题:
(1)Al2O3与稀硫酸反应的化学方程式为__________________________。
(2)操作Ⅱ的名称是____。
(3)滤液Ⅱ中溶质的用途之一是______。
(4)电解熔融的Al2O3,除得到金属铝之外,还可得到的气体产物是____(填化学式)。
(5)工业上电解熔融的Al2O3时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低Al2O3的熔点,冰晶石在物质中的分类属于____(填字母)。
A酸 B碱 C盐 D氧化物
【答案】 ①. Al2O3+3H2SO4=Al2(SO4)3+3H2O ②. 过滤 ③. 氮肥 ④. O2 ⑤. C
18. 铁的应用在人类历史上有着重要的意义,在学习了金属之后,某兴趣小组以铁为主题开展了如下探究。
【活动一】认识生活中的铁
(1)生活中常见到的金属铁是铁的合金,生铁和钢就是常见的两种铁合金,生铁的含碳量________(选填“大于”或“小于”)钢的含碳量。
【活动二】探究铁的锈蚀与防护
(2)图1,起始时量筒内水面处于50mL刻度处。之后水面缓慢上升。几天后水面最终处于约40mL刻度处,原因是________。
(3)某实验小组设计了图2实验探究铁锈蚀的条件。打开分液漏斗,一段时间后观察到A处铁丝依然光亮,B处铁丝表面出现锈蚀。
①试管中发生的反应的化学方程式为________,该实验说明铁生锈是铁与________共同作用的结果。
(4)请写出一种日常生活中防止铁生锈的措施:________。
【活动三】探究铁和盐溶液的反应
(5)向硝酸铜和硝酸银的混合溶液中连续缓慢地加入mg铁粉,溶液中析出固体的质量与参加反应的铁粉的质量关系如图3所示。
①写出ab段(不含两端点)对应溶液中含有的金属离子:________。
②bc段(不含两端点)析出的金属是________。
③若ab段和bc段析出的固体质量相等,参加反应的铁粉质量分别为m1g和m2g,试比较m1和m2的大小关系:________。
【答案】(1)大于 (2)铁丝绒生锈消耗了约10mL氧气
(3) ①. ②. 氧气、水
(4)保持干燥 (5) ①. 银离子、铜离子、亚铁离子 ②. 铜 ③. m119. 化学反应的快慢与许多因素有关,控制变量法是科学探究中常用的方法。 某兴趣小组设计以下实验探究影响金属与酸反应快慢的因素。
【实验一】
取四份等质量的铁分别与足量的盐酸进行反应,实验条件如图1所示;图2为反应时间与产生气体体积的关系曲线。
(1)对比图 2 中实验 a 和 b 的曲线,得出的结论是 ___________,能得出相同结论的另一对比的组别是_________(用字母 a、b、c、d 表示);该实验中还有另外一组对比实验,能得出的结论是 ______。
(2)实验中观察到气体产生速率“逐渐变快又变慢”,“逐渐变快”的原因是 ________。
(3)该反应的化学方程式为 ________。
【实验二】
常温时,用足量的铁、锌、镁三种金属分别与等量同浓度的盐酸反应。 实验发生装置如图 3所示;压强变化如图4所示(压强越大,表示产生氢气的量越多)。
(4)实验中,还需要控制的变量是______________;
(5)实验得出结论是金属与酸反应的速率与 __________ 有关。
(6)该实验中发现镁片与盐酸反应,最终测得压强比锌和铁更大一点。忽略误差,其合理的原因是_______。
【答案】(1) ①. 相同条件下,温度越高,金属与酸反应速率越快 ②. cd或dc ③. 相同条件下,金属表面积越大,金属与酸反应速率越快
(2)铁与稀盐酸反应放热,反应速率加快
(3) (4)金属颗粒大小 (5)金属的活动性
(6)反应放热,使气体膨胀
20. 文献记载:距今4000~5000年,我国古代劳动人民已开始冶铸铜器。出土的铜器表面通常会有一层绿色的铜锈[主要成分为]。兴趣小组的同学对铜锈的组成和铜生锈的条件进行如下探究。
已知:Ⅰ.无水硫酸铜遇水变为蓝色;Ⅱ.铜锈与盐酸反应的化学方程式为;Ⅲ.常温常压下,二氧化碳的密度是。
【活动一】探究铜锈的组成
用下图所示装置进实验,观察到试管中固体由绿色变为黑色,干燥管内无水硫酸铜变为蓝色,烧杯中澄清石灰水变浑浊。
(1)烧杯中发生的反应的化学程式为____。
(2)由实验现象推测,铜锈中至少含有____种元素。
【活动二】探究铜生锈的条件
【提出猜想】根据铜锈的组成元素推测,铜生锈可能与和有关。
【进行实验】实验小组的同学取直径、长度均相同的铜丝,打磨光亮,设计了下图所示的5个实验并持续观察。
编号 ① ② ③ ④ ⑤
操作
现象 无明显现象 无明显现象 铜丝表面有绿色物质析出 无明显现象 无明显现象
【解释与结论】
(3)实验中使用的蒸馏水是经煮沸迅速冷却的,其目的是________。
(4)对比实验②和③,得出的结论是_______。为验证猜想,实验⑤中应加入的物质为____。
(5)由上述实验可推知,铜生锈的条件是____。
【活动三】测定铜锈中的含量
将上述实验编号③试管中剩余物质过滤,洗涤,干燥,得到固体,连接图甲、图乙装置,检查装置气密性,加入固体与足量盐酸进行实验。
(6)完全反应后,常温常压下测得生成的气体体积为,则该固体中的含量为______(用含v、d、m的字母表示)。
(7)该实验条件下测得铜锈质量分数偏大的原因是______(写一点即可)。
【答案】(1)CO2+Ca(OH)2=CaCO3↓+H2O
(2)4或四 (3)除去蒸馏水中的空气
(4) ①. 铜生锈与O2有关 ②. 干燥的O2和CO2
(5)铜与H2O、O2、CO2同时接触
(6)×100%
(7)稀盐酸占有一定的体积(合理即可)
21. 某兴趣小组的同学取2.8g铁粉,放入到盛有200g溶质质量分数为8%的硫酸铜溶液的烧杯中,一段时间后,反应停止。
(1)完全反应后,请在图中烧杯中,用类似 (表示水分子)的图形,画出溶液中存在的微粒_____。
(2)根据方程式进行计算,理论上可以得到多少克的铜
【答案】(1) (2)解:设理论上可以得到铜的质量为y
y=3.2g
答:理论上可以得到铜的质量为3.2g
22. 将15g表面氧化的铝片放入足量稀盐酸中,完全反应后收集到氢气质量如图所示,回答下列问题。
(1)0~t时刻没有产生气体的原因是______。
(2)求该铝片中铝单质的质量分数。
【答案】(1)铝片表面的氧化铝先与稀盐酸反应,生成氯化铝和水
(2)48%
解:设铝片中铝单质的质量为x,
铝片中铝单质的质量分数为×100%=48%;
答:铝片中铝单质的质量分数为48%。
23. 某课外兴趣小组同学取一定量含铜粉的氧化铜粉末,放入烧杯中,加入196g稀硫酸,搅拌,恰好完全反应后过滤(损耗忽略不计),烧杯中固体的质量随时间变化情况如图所示,试计算稀硫酸溶质质量分数。(规范写出计算过程)
【答案】氧化铜和稀硫酸反应生成硫酸铜和水,铜和稀硫酸不反应,故该粉末中氧化铜质量为:10g-2g=8g
解:设稀硫酸中溶质质量为x
x=9.8g
该稀硫酸中溶质质量分数=×100%=5%
答:稀硫酸中溶质质量分数为5%
24. 在烧杯中加入2.14g久置的铝箔,再倒入足量的稀硫酸,放出气体的质量如图所示。请回答下列问题:
(1)0~t时刻没有产生气体的原因是________;
(2)求该铝箔中铝单质的质量。
【答案】(1)久置的铝箔表面生成氧化铝,氧化铝先与稀硫酸反应生成硫酸铝和水
(2)解:设铝箔中Al的质量为x。
x=18g
答:铝箔中Al的质量的为1.8g。
25. 铁、铜双金粉可用于生产机械零件。化学小组同学对某铁、铜双金粉进行实验:取10g铁、铜双金粉样品于试管中,将90g稀硫酸分三次加入试管中,充分反应后,测定生成氢气的质量数据见下表:
第一次 第二次 第二次
加入稀硫酸的质量/g 30 30 30
生成氢气的总质量/g 0.14 0.28 0.3
请回答下列问题:
(1)每次加入稀硫酸后,需用玻璃棒搅拌,其目的是_________。
(2)该样品中铁的质量分数为多少?
【答案】(1)使反应更快更充分
(2)84%
解:设样品中铁的质量为x
所以样品中铁的质量分数为
答:该样品中铁的质量分数为84%。
一、选择题
1. 下列有关金属及合金的说法错误的是
A. 金属在常温下都是固体 B. 铝合金的硬度比铝的硬度大
C. 铁制品在潮湿的空气中易生锈 D. 钢铁是使用最多的金属材料
2. 在刚刚结束的理科实验操作考试中,某同学抽到的实验为“金属的物理和化学性质”,下面是实验中出现的操作,正确的是
A. 加入铁钉 B. 倾倒稀盐酸
C. 滴加硫酸铜溶液 D. 胶头滴管清洗后放回滴瓶
3. 钪是种熔点高、密度小、抗腐蚀性能好的金属,主要用于国防、军工、航天、核能和超导体等尖端技术领域。如图是钪(Sc)元素在元素周期表中及粒子结构示意图的信息。下列有关X的说法正确的是
A. X属于非金属元素 B. X原子的质量为44.96g
C. X原子的核内质子数为21 D. X原子核外有3个电子层
4. 现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,X溶解并有气泡产生,而Y则没有任何现象;如果把Y和Z分别放入硝酸银溶液中,一会后,在Y的表面有银白色金属析出,而Z没有变化。则X、Y、Z三种金属的活动顺序为
A. Y>Z>X B. X>Y>Z C. X>Z>Y D. Z>Y>X
5. 兴趣小组同学用下图所示的“W”形玻璃管进行微型实验。下列说法正确的是
A. a处红色粉末变黑 B. a处的反应属于置换反应
C. b处的现象为紫色石蕊溶液变红 D. 该实验体现了CO的可燃性
6. 金元素在元素周期表中显示的信息如图所示。以下表述中错误的是
A. 金原子的中子数是79
B. 金属于金属元素
C. 金的相对原子质量为197.0
D. 金在自然界中以单质形式存在是因为金的化学性质比较稳定
7. 某小组用如图所示装置进行创新实验。一段时间后观察到蜡烛熄灭,将反应后的装置密封放置数天后,发现铁钉表面出现了锈迹。下列有关说法正确的是
A. 蜡烛燃烧前,容器中氧气的质量分数约为21%
B. 当铁钉不再锈蚀时,容器内气体均为二氧化碳
C. 实验说明只要有氧气,蜡烛就可被点燃
D. 由实验现象可知蜡烛燃烧会生成水
8. 某兴趣小组的同学做了一个实验,在甲试管中装入固体物质,乙试管装入某溶液,按如图所示组装好仪器.通过分液漏斗加入足量稀盐酸,同时打开止水夹,看到乙试管溶液中有气泡冒出:再关闭止水夹,发现一段时间后乙中有沉淀产生.符合此实验现象的一组试剂是:
A. 甲:Na2CO3 乙:KOH B. 甲:Mg 乙:AgNO3
C. 甲:KOH 乙:NaCl D. 甲:CuO 乙:NaOH
9. 如图是铁及其化合物的化合价和物质类别关系图(横坐标表示物质类别,纵坐标表示物质中铁元素的化合价),下列说法错误的是
A. A物质所属物质类别是单质
B. B物质的化学式为FeO
C. 可以用CO和C物质在高温下生成A物质
D. E物质溶于水所得溶液的颜色为黄色
10. 向AgNO3 和Cu(NO3)2的混合溶液中缓慢连续加入m克锌粉,析出固体的质量与加入锌粉的质量关系如图所示,下列分析不正确的是
A. 向N点对应溶液中加入氯化钠溶液,有白色沉淀产生
B. P点对应的固体一定有Cu,可能有Ag
C. Q点对应的溶液为无色,此时溶液的溶质无Cu(NO3)2,只有Zn(NO3)2
D. 加入m克锌粉后,过滤,向滤渣中加入稀盐酸,有气泡产生
二、非选择题
11.常温下铝、铁、铅的物理性质数据如表,据此可知高压输电线最好选用金属______;铁的合金通常可以做菜刀、锤子等,其合金的硬度_______5(填“>”、“<”或“=”)。人们常选用金属______和铋、锡、铬制作合金,用于保险丝。
金属 铝 铁 铅
导电性(以100为标准) 61 17 7.9
密度/(g·cm3) 2.70 7.86 11.3
熔点/℃ 660 1535 327
硬度(以10为标准) 2.7 5 1.5
12. 2021年1月13日,我国自主研发的高温超导高速磁浮工程化样车及试验线正式启用,列车的时速高达600公里每小时。
(1)制造列车使用了多种材料。下列列车的部件中,属于金属材料的是______。(填字母序号)
A. 有机玻璃车窗 B. 碳纤维车体
C. 钇铋镁合金超导材料 D. 涤纶座套
(2)车身表面烤漆的主要目的是______(答出1条即可)。
(3)铜用于制作列车刹车系统中的铜圈导线,是利用铜的导电性和______性。
13. 工厂从含铜废料中回收铜的生产流程如下。(提示:含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水)
(1)“酸浸”时发生反应的化学方程式_____。
(2)“酸浸”步骤最好需要加热的原因是________。
(3)操作Ⅰ的名称是_____,经操作Ⅰ分离所得溶液中含有的阳离子有_____。
(4)“酸浸”时所加硫酸溶液过量的原因是_________。
14. 某工业废水中含有大量的氯化镁和硝酸镁,某废水处理公司从该废水中提取回收金属镁的流程示意图如下。回答下列问题。
(1)操作I的名称是________,实验室进行该操作时,需要用到的玻璃仪器有烧杯,玻璃棒和________。
(2)流程中加入石灰乳时,进行搅拌的目的是________。
(3)加入石灰乳后发生的反应的基本反应类型是________。
(4)反应1的化学方程式为________ (写一个即可)。
15. 利用废弃铜料(含有铜、铁)和石灰石制备农药“波尔多液”的过程如图,请根据题意回答下列问题:
(1)废弃铜料加入反应器1前先要将其粉碎,其目的是_________________,反应器1中硫酸加入过量的目的是_____________________。
(2)反应器2中发生的反应属于__________(填基本反应类型)反应。
(3)反应器3中发生反应的化学方程式是_____________________。
(4)写出一种气体B排放会导致的环境问题____________________。
16. 中国首款完全自主知识产权民用客机C919飞机上钛合金得到了广泛的应用。工业上利用钛铁矿(主要成分为钛酸亚铁,FeTiO3)制备钛的流程如下图,请回答下列问题。
(1)将钛铁矿粉碎后再用盐酸浸泡目的是______,图中操作a需要使用的玻璃仪器有烧杯、玻璃棒和______。
(2)流程中反应②的化学方程式为______(反应条件为高温),反应③的基本类型______。
(3)该流程中涉及到的氧化物有______(写出一种物质名称即可)。
17. 铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3和SiO2,不考虑其它杂志)制取金属铝的基本流程如下:
已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质。
②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。
请回答下列问题:
(1)Al2O3与稀硫酸反应的化学方程式为__________________________。
(2)操作Ⅱ的名称是____。
(3)滤液Ⅱ中溶质的用途之一是______。
(4)电解熔融的Al2O3,除得到金属铝之外,还可得到的气体产物是____(填化学式)。
(5)工业上电解熔融的Al2O3时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低Al2O3的熔点,冰晶石在物质中的分类属于____(填字母)。
A酸 B碱 C盐 D氧化物
18. 铁的应用在人类历史上有着重要的意义,在学习了金属之后,某兴趣小组以铁为主题开展了如下探究。
【活动一】认识生活中的铁
(1)生活中常见到的金属铁是铁的合金,生铁和钢就是常见的两种铁合金,生铁的含碳量________(选填“大于”或“小于”)钢的含碳量。
【活动二】探究铁的锈蚀与防护
(2)图1,起始时量筒内水面处于50mL刻度处。之后水面缓慢上升。几天后水面最终处于约40mL刻度处,原因是________。
(3)某实验小组设计了图2实验探究铁锈蚀的条件。打开分液漏斗,一段时间后观察到A处铁丝依然光亮,B处铁丝表面出现锈蚀。
①试管中发生的反应的化学方程式为________,该实验说明铁生锈是铁与________共同作用的结果。
(4)请写出一种日常生活中防止铁生锈的措施:________。
【活动三】探究铁和盐溶液的反应
(5)向硝酸铜和硝酸银的混合溶液中连续缓慢地加入mg铁粉,溶液中析出固体的质量与参加反应的铁粉的质量关系如图3所示。
①写出ab段(不含两端点)对应溶液中含有的金属离子:________。
②bc段(不含两端点)析出的金属是________。
③若ab段和bc段析出的固体质量相等,参加反应的铁粉质量分别为m1g和m2g,试比较m1和m2的大小关系:________。
19. 化学反应的快慢与许多因素有关,控制变量法是科学探究中常用的方法。 某兴趣小组设计以下实验探究影响金属与酸反应快慢的因素。
【实验一】
取四份等质量的铁分别与足量的盐酸进行反应,实验条件如图1所示;图2为反应时间与产生气体体积的关系曲线。
(1)对比图 2 中实验 a 和 b 的曲线,得出的结论是 ___________,能得出相同结论的另一对比的组别是_________(用字母 a、b、c、d 表示);该实验中还有另外一组对比实验,能得出的结论是 ______。
(2)实验中观察到气体产生速率“逐渐变快又变慢”,“逐渐变快”的原因是 ________。
(3)该反应的化学方程式为 ________。
【实验二】
常温时,用足量的铁、锌、镁三种金属分别与等量同浓度的盐酸反应。 实验发生装置如图 3所示;压强变化如图4所示(压强越大,表示产生氢气的量越多)。
(4)实验中,还需要控制的变量是______________;
(5)实验得出结论是金属与酸反应的速率与 __________ 有关。
(6)该实验中发现镁片与盐酸反应,最终测得压强比锌和铁更大一点。忽略误差,其合理的原因是_______。
20. 文献记载:距今4000~5000年,我国古代劳动人民已开始冶铸铜器。出土的铜器表面通常会有一层绿色的铜锈[主要成分为]。兴趣小组的同学对铜锈的组成和铜生锈的条件进行如下探究。
已知:Ⅰ.无水硫酸铜遇水变为蓝色;Ⅱ.铜锈与盐酸反应的化学方程式为;Ⅲ.常温常压下,二氧化碳的密度是。
【活动一】探究铜锈的组成
用下图所示装置进实验,观察到试管中固体由绿色变为黑色,干燥管内无水硫酸铜变为蓝色,烧杯中澄清石灰水变浑浊。
(1)烧杯中发生的反应的化学程式为____。
(2)由实验现象推测,铜锈中至少含有____种元素。
【活动二】探究铜生锈的条件
【提出猜想】根据铜锈的组成元素推测,铜生锈可能与和有关。
【进行实验】实验小组的同学取直径、长度均相同的铜丝,打磨光亮,设计了下图所示的5个实验并持续观察。
编号 ① ② ③ ④ ⑤
操作
现象 无明显现象 无明显现象 铜丝表面有绿色物质析出 无明显现象 无明显现象
【解释与结论】
(3)实验中使用的蒸馏水是经煮沸迅速冷却的,其目的是________。
(4)对比实验②和③,得出的结论是_______。为验证猜想,实验⑤中应加入的物质为____。
(5)由上述实验可推知,铜生锈的条件是____。
【活动三】测定铜锈中的含量
将上述实验编号③试管中剩余物质过滤,洗涤,干燥,得到固体,连接图甲、图乙装置,检查装置气密性,加入固体与足量盐酸进行实验。
(6)完全反应后,常温常压下测得生成的气体体积为,则该固体中的含量为______(用含v、d、m的字母表示)。
(7)该实验条件下测得铜锈质量分数偏大的原因是______(写一点即可)。
21. 某兴趣小组的同学取2.8g铁粉,放入到盛有200g溶质质量分数为8%的硫酸铜溶液的烧杯中,一段时间后,反应停止。
(1)完全反应后,请在图中烧杯中,用类似 (表示水分子)的图形,画出溶液中存在的微粒_____。
(2)根据方程式进行计算,理论上可以得到多少克的铜
22. 将15g表面氧化的铝片放入足量稀盐酸中,完全反应后收集到氢气质量如图所示,回答下列问题。
(1)0~t时刻没有产生气体的原因是______。
(2)求该铝片中铝单质的质量分数。
23. 某课外兴趣小组同学取一定量含铜粉的氧化铜粉末,放入烧杯中,加入196g稀硫酸,搅拌,恰好完全反应后过滤(损耗忽略不计),烧杯中固体的质量随时间变化情况如图所示,试计算稀硫酸溶质质量分数。(规范写出计算过程)
24. 在烧杯中加入2.14g久置的铝箔,再倒入足量的稀硫酸,放出气体的质量如图所示。请回答下列问题:
(1)0~t时刻没有产生气体的原因是________;
(2)求该铝箔中铝单质的质量。
25. 铁、铜双金粉可用于生产机械零件。化学小组同学对某铁、铜双金粉进行实验:取10g铁、铜双金粉样品于试管中,将90g稀硫酸分三次加入试管中,充分反应后,测定生成氢气的质量数据见下表:
第一次 第二次 第二次
加入稀硫酸的质量/g 30 30 30
生成氢气的总质量/g 0.14 0.28 0.3
请回答下列问题:
(1)每次加入稀硫酸后,需用玻璃棒搅拌,其目的是_________。
(2)该样品中铁的质量分数为多少?
2024年中考化学强化复习金属和金属材料参考答案
一、选择题
1. 下列有关金属及合金的说法错误的是
A. 金属在常温下都是固体 B. 铝合金的硬度比铝的硬度大
C. 铁制品在潮湿的空气中易生锈 D. 钢铁是使用最多的金属材料
【答案】A
【解析】
【详解】A、金属汞在常温下是液体,A错误;
B、一般合金的硬度大于成分金属的硬度,B正确;
C、铁制品在干燥的环境中不容易生锈,在潮湿的空气中容易生锈,C正确;
D、钢铁有许多优良性能,是人类使用最多金属材料,D正确;
2. 在刚刚结束的理科实验操作考试中,某同学抽到的实验为“金属的物理和化学性质”,下面是实验中出现的操作,正确的是
A. 加入铁钉 B. 倾倒稀盐酸
C. 滴加硫酸铜溶液 D. 胶头滴管清洗后放回滴瓶
【答案】B
【解析】
【详解】A、把密度较大的块状药品或金属颗粒放入玻璃容器时,应该先把容器横放,把药品或金属颗粒放入容器口后,再把容器慢慢地竖起来,使药品或金属颗粒滑到容器底部,以免打破容器,不符合题意;
B、瓶塞倒放在桌上,标签对着手心以防止标签被腐蚀,瓶口要紧挨着试管口,试管倾斜,使液体缓缓地倒入试管,符合题意;
C、滴加液体时,滴管要竖直悬空,不能将胶头滴管伸进入试管内,以防污染试剂,使用完以后也不能横放或倒置以免腐蚀橡胶帽,不符合题意;
D、滴瓶中的胶头滴管不用清洗,以免污染、稀释滴瓶中的试剂,不符合题意;
故选B。
3. 钪是种熔点高、密度小、抗腐蚀性能好的金属,主要用于国防、军工、航天、核能和超导体等尖端技术领域。如图是钪(Sc)元素在元素周期表中及粒子结构示意图的信息。下列有关X的说法正确的是
A. X属于非金属元素 B. X原子的质量为44.96g
C. X原子的核内质子数为21 D. X原子核外有3个电子层
【答案】C
【解析】
【详解】A、元素周期表的单元格中的X是该元素的元素名称,即为钪;钪的汉字偏旁是“钅”字旁,则钪(Sc)元素属于金属元素,不符合题意;
B、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故X原子的相对原子质量是44.96,不是原子质量,不符合题意;
C、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数=21,即X原子的核内质子数为21,符合题意;
D、原子序数=质子数=核外电子数,则结合该粒子结构示意图可知,X原子核外应该有4个电子层,第一层有2个电子,第二层有8个电子,第三层有8个电子,第四层有3个电子,不符合题意;
故选C。
4. 现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,X溶解并有气泡产生,而Y则没有任何现象;如果把Y和Z分别放入硝酸银溶液中,一会后,在Y的表面有银白色金属析出,而Z没有变化。则X、Y、Z三种金属的活动顺序为
A. Y>Z>X B. X>Y>Z C. X>Z>Y D. Z>Y>X
【答案】B
【解析】
【详解】把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应,说明X的活动性比Y强;把Y和Z分别放入硝酸银溶液中,在Y表面有银析出,而Z没有变化,说明Y的活动性比Z强;综上,X、Y、Z的金属活动性顺序为X>Y>Z,故选:B。
5. 兴趣小组同学用下图所示的“W”形玻璃管进行微型实验。下列说法正确的是
A. a处红色粉末变黑 B. a处的反应属于置换反应
C. b处的现象为紫色石蕊溶液变红 D. 该实验体现了CO的可燃性
【答案】C
【解析】
【详解】A、一氧化碳和氧化铜反应生成铜和二氧化碳,固体由黑色变成红色,错误;
B、置换反应是单质和化合物生成另一种单质和另一种化合物,a处一氧化碳和氧化铜均是化合物,不属于置换反应,错误;
C、b处二氧化碳与水反应生成碳酸能使紫色石蕊试液变红,正确;
D、实验利用一氧化碳还原氧化铜,体现了一氧化碳的还原性,错误。
故选:C。
6. 金元素在元素周期表中显示的信息如图所示。以下表述中错误的是
A. 金原子的中子数是79
B. 金属于金属元素
C. 金的相对原子质量为197.0
D. 金在自然界中以单质形式存在是因为金的化学性质比较稳定
【答案】A
【解析】
【详解】A、根据元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数为79,汉字下面的数字表示相对原子质量,该元素的相对原子质量为197;由相对原子质量≈质子数+中子数,则金原子的中子数=197-79=118,故A错误;
B、中间的汉字表示元素名称,该元素的名称是金,属于金属元素,故B正确;
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为197,故C正确;
D、金的化学性质比较稳定,很难与其他物质发生反应,所以金在自然界中以单质形式,故D正确。
故选A。
7. 某小组用如图所示装置进行创新实验。一段时间后观察到蜡烛熄灭,将反应后的装置密封放置数天后,发现铁钉表面出现了锈迹。下列有关说法正确的是
A. 蜡烛燃烧前,容器中氧气的质量分数约为21%
B. 当铁钉不再锈蚀时,容器内气体均为二氧化碳
C. 实验说明只要有氧气,蜡烛就可被点燃
D. 由实验现象可知蜡烛燃烧会生成水
【答案】D
【解析】
【详解】A、蜡烛燃烧前,容器中的气体是空气,空气中氧气的体积分数约为21%,不是质量分数,不符合题意;
B、蜡烛在空气中燃烧生成二氧化碳和水,铁钉锈蚀消耗氧气,故当铁钉不再锈蚀时,容器内气体除了二氧化碳,还含不参与反应的氮气,稀有气体等,不符合题意;
C、蜡烛熄灭后,将反应后的装置密封放置数天后,发现铁钉表面出现了锈迹,铁生锈的条件是铁与氧气和水接触,说明蜡烛熄灭后,装置内还存在氧气,说明氧气浓度降低到一定程度,蜡烛就会熄灭,不符合题意;
D、蜡烛燃烧前,装置内是干燥空气,蜡烛熄灭后,将反应后的装置密封放置数天后,发现铁钉表面出现了锈迹,铁生锈的条件是铁与氧气和水接触,说明蜡烛燃烧会生成水,符合题意。
故选D。
8. 某兴趣小组的同学做了一个实验,在甲试管中装入固体物质,乙试管装入某溶液,按如图所示组装好仪器.通过分液漏斗加入足量稀盐酸,同时打开止水夹,看到乙试管溶液中有气泡冒出:再关闭止水夹,发现一段时间后乙中有沉淀产生.符合此实验现象的一组试剂是:
A. 甲:Na2CO3 乙:KOH B. 甲:Mg 乙:AgNO3
C. 甲:KOH 乙:NaCl D. 甲:CuO 乙:NaOH
【答案】B
【解析】
【详解】A、碳酸钠与盐酸反应生成二氧化碳气体,使乙中有气泡冒出,但生成的二氧化碳将盐酸压入乙试管与氢氧化钾反应,乙试管中不会产生沉淀,故A不符合题意;
B、镁与盐酸反应生成氯化镁和氢气,使乙中有气泡冒出,生成氢气将氯化镁压入乙试管与硝酸银生成氯化银沉淀,故B符合题意;
C、氢氧化钾与盐酸反应生成氯化钾和水,不能使乙中有气泡冒出,故C不符合题意;
D、氧化铜与盐酸反应生成氯化铜和水,不能使乙中有气泡冒出,故D不符合题意。
故选B。
9. 如图是铁及其化合物的化合价和物质类别关系图(横坐标表示物质类别,纵坐标表示物质中铁元素的化合价),下列说法错误的是
A. A物质所属物质类别是单质
B. B物质的化学式为FeO
C. 可以用CO和C物质在高温下生成A物质
D. E物质溶于水所得溶液的颜色为黄色
【答案】D
【解析】
【详解】A、A物质所属物质中元素化合价为零,类别是单质,正确;
B、氧化物含有两种元素的化合物中,其中一种元素为氧元素;B物质中铁元素为+2价,氧元素化合价为-2价,故化学式为FeO,正确;
C、C为+3价铁的氧化物,即氧化铁,可以用CO和氧化铁在高温下生成铁单质,正确;
D、E物质中含有+2价铁,而+3价可溶性铁盐溶于水所得溶液的颜色为黄色,错误。
故选D。
10. 向AgNO3 和Cu(NO3)2的混合溶液中缓慢连续加入m克锌粉,析出固体的质量与加入锌粉的质量关系如图所示,下列分析不正确的是
A. 向N点对应溶液中加入氯化钠溶液,有白色沉淀产生
B. P点对应的固体一定有Cu,可能有Ag
C. Q点对应的溶液为无色,此时溶液的溶质无Cu(NO3)2,只有Zn(NO3)2
D. 加入m克锌粉后,过滤,向滤渣中加入稀盐酸,有气泡产生
【答案】B
【解析】
【分析】向AgNO3 和Cu(NO3)2的混合溶液中缓慢连续加入m克锌粉,锌先和硝酸银反应生成硝酸锌和银,再和硝酸铜反应生成硝酸锌和铜,第一个拐点表示硝酸银恰好完全反应,第二个拐点表示硝酸铜恰好完全反应。
【详解】A、N点位于第一个拐点之前,表示硝酸银没有完全反应,加入氯化钠溶液,氯化钠和硝酸银生成氯化银沉淀和硝酸钠,分析正确。
B、P点为与两个拐点之间,表示硝酸银恰好完全反应,硝酸铜有剩余,对应的固体一定有Cu,Ag,分析错误。
C、Q点位于第二个拐点之后,表示硝酸银、硝酸铜完全反应,且锌粉过量,对应的溶液为无色,分析正确。
D、m克锌粉对应点在两拐点之后,表示硝酸银、硝酸铜完全反应,且锌粉过量,向滤渣中加入稀盐酸,盐酸和锌生成氯化锌和氢气,有气泡产生,分析正确。
故选:B。
二、非选择题
11.常温下铝、铁、铅的物理性质数据如表,据此可知高压输电线最好选用金属______;铁的合金通常可以做菜刀、锤子等,其合金的硬度_______5(填“>”、“<”或“=”)。人们常选用金属______和铋、锡、铬制作合金,用于保险丝。
金属 铝 铁 铅
导电性(以100为标准) 61 17 7.9
密度/(g·cm3) 2.70 7.86 11.3
熔点/℃ 660 1535 327
硬度(以10为标准) 2.7 5 1.5
【答案】 ①. 铝 ②. > ③. 铅
12. 2021年1月13日,我国自主研发的高温超导高速磁浮工程化样车及试验线正式启用,列车的时速高达600公里每小时。
(1)制造列车使用了多种材料。下列列车的部件中,属于金属材料的是______。(填字母序号)
A. 有机玻璃车窗 B. 碳纤维车体
C. 钇铋镁合金超导材料 D. 涤纶座套
(2)车身表面烤漆的主要目的是______(答出1条即可)。
(3)铜用于制作列车刹车系统中的铜圈导线,是利用铜的导电性和______性。
【答案】(1)C (2)隔绝铁与氧气和水的接触,防止车身锈蚀(答案合理即可)
(3)延展
13. 工厂从含铜废料中回收铜的生产流程如下。(提示:含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水)
(1)“酸浸”时发生反应的化学方程式_____。
(2)“酸浸”步骤最好需要加热的原因是________。
(3)操作Ⅰ的名称是_____,经操作Ⅰ分离所得溶液中含有的阳离子有_____。
(4)“酸浸”时所加硫酸溶液过量的原因是_________。
【答案】(1)CuO+H2SO4=CuSO4+H2O
(2)加快反应速率,使反应更充分
(3) ①. 过滤 ②. Cu2+、H+ (4)使氧化铜完全反应
14. 某工业废水中含有大量的氯化镁和硝酸镁,某废水处理公司从该废水中提取回收金属镁的流程示意图如下。回答下列问题。
(1)操作I的名称是________,实验室进行该操作时,需要用到的玻璃仪器有烧杯,玻璃棒和________。
(2)流程中加入石灰乳时,进行搅拌的目的是________。
(3)加入石灰乳后发生的反应的基本反应类型是________。
(4)反应1的化学方程式为________ (写一个即可)。
【答案】(1) ①. 过滤 ②. 漏斗
(2)使反应更快更充分
(3)复分解反应 (4)
15. 利用废弃铜料(含有铜、铁)和石灰石制备农药“波尔多液”的过程如图,请根据题意回答下列问题:
(1)废弃铜料加入反应器1前先要将其粉碎,其目的是_________________,反应器1中硫酸加入过量的目的是_____________________。
(2)反应器2中发生的反应属于__________(填基本反应类型)反应。
(3)反应器3中发生反应的化学方程式是_____________________。
(4)写出一种气体B排放会导致的环境问题____________________。
【答案】(1) ①. 增大反应物的接触面积,使反应更加充分 ②. 将废料中的铁反应完
(2)化合 (3)CuO+H2SO4=CuSO4+H2O
(4)温室效应(合理即可)
16. 中国首款完全自主知识产权民用客机C919飞机上钛合金得到了广泛的应用。工业上利用钛铁矿(主要成分为钛酸亚铁,FeTiO3)制备钛的流程如下图,请回答下列问题。
(1)将钛铁矿粉碎后再用盐酸浸泡目的是______,图中操作a需要使用的玻璃仪器有烧杯、玻璃棒和______。
(2)流程中反应②的化学方程式为______(反应条件为高温),反应③的基本类型______。
(3)该流程中涉及到的氧化物有______(写出一种物质名称即可)。
【答案】(1) ①. 增大反应物之间的接触面积,使反应更快更充分 ②. 漏斗
(2) ①. ②. 分解反应
(3)二氧化钛或一氧化碳
17. 铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3和SiO2,不考虑其它杂志)制取金属铝的基本流程如下:
已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质。
②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。
请回答下列问题:
(1)Al2O3与稀硫酸反应的化学方程式为__________________________。
(2)操作Ⅱ的名称是____。
(3)滤液Ⅱ中溶质的用途之一是______。
(4)电解熔融的Al2O3,除得到金属铝之外,还可得到的气体产物是____(填化学式)。
(5)工业上电解熔融的Al2O3时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低Al2O3的熔点,冰晶石在物质中的分类属于____(填字母)。
A酸 B碱 C盐 D氧化物
【答案】 ①. Al2O3+3H2SO4=Al2(SO4)3+3H2O ②. 过滤 ③. 氮肥 ④. O2 ⑤. C
18. 铁的应用在人类历史上有着重要的意义,在学习了金属之后,某兴趣小组以铁为主题开展了如下探究。
【活动一】认识生活中的铁
(1)生活中常见到的金属铁是铁的合金,生铁和钢就是常见的两种铁合金,生铁的含碳量________(选填“大于”或“小于”)钢的含碳量。
【活动二】探究铁的锈蚀与防护
(2)图1,起始时量筒内水面处于50mL刻度处。之后水面缓慢上升。几天后水面最终处于约40mL刻度处,原因是________。
(3)某实验小组设计了图2实验探究铁锈蚀的条件。打开分液漏斗,一段时间后观察到A处铁丝依然光亮,B处铁丝表面出现锈蚀。
①试管中发生的反应的化学方程式为________,该实验说明铁生锈是铁与________共同作用的结果。
(4)请写出一种日常生活中防止铁生锈的措施:________。
【活动三】探究铁和盐溶液的反应
(5)向硝酸铜和硝酸银的混合溶液中连续缓慢地加入mg铁粉,溶液中析出固体的质量与参加反应的铁粉的质量关系如图3所示。
①写出ab段(不含两端点)对应溶液中含有的金属离子:________。
②bc段(不含两端点)析出的金属是________。
③若ab段和bc段析出的固体质量相等,参加反应的铁粉质量分别为m1g和m2g,试比较m1和m2的大小关系:________。
【答案】(1)大于 (2)铁丝绒生锈消耗了约10mL氧气
(3) ①. ②. 氧气、水
(4)保持干燥 (5) ①. 银离子、铜离子、亚铁离子 ②. 铜 ③. m1
【实验一】
取四份等质量的铁分别与足量的盐酸进行反应,实验条件如图1所示;图2为反应时间与产生气体体积的关系曲线。
(1)对比图 2 中实验 a 和 b 的曲线,得出的结论是 ___________,能得出相同结论的另一对比的组别是_________(用字母 a、b、c、d 表示);该实验中还有另外一组对比实验,能得出的结论是 ______。
(2)实验中观察到气体产生速率“逐渐变快又变慢”,“逐渐变快”的原因是 ________。
(3)该反应的化学方程式为 ________。
【实验二】
常温时,用足量的铁、锌、镁三种金属分别与等量同浓度的盐酸反应。 实验发生装置如图 3所示;压强变化如图4所示(压强越大,表示产生氢气的量越多)。
(4)实验中,还需要控制的变量是______________;
(5)实验得出结论是金属与酸反应的速率与 __________ 有关。
(6)该实验中发现镁片与盐酸反应,最终测得压强比锌和铁更大一点。忽略误差,其合理的原因是_______。
【答案】(1) ①. 相同条件下,温度越高,金属与酸反应速率越快 ②. cd或dc ③. 相同条件下,金属表面积越大,金属与酸反应速率越快
(2)铁与稀盐酸反应放热,反应速率加快
(3) (4)金属颗粒大小 (5)金属的活动性
(6)反应放热,使气体膨胀
20. 文献记载:距今4000~5000年,我国古代劳动人民已开始冶铸铜器。出土的铜器表面通常会有一层绿色的铜锈[主要成分为]。兴趣小组的同学对铜锈的组成和铜生锈的条件进行如下探究。
已知:Ⅰ.无水硫酸铜遇水变为蓝色;Ⅱ.铜锈与盐酸反应的化学方程式为;Ⅲ.常温常压下,二氧化碳的密度是。
【活动一】探究铜锈的组成
用下图所示装置进实验,观察到试管中固体由绿色变为黑色,干燥管内无水硫酸铜变为蓝色,烧杯中澄清石灰水变浑浊。
(1)烧杯中发生的反应的化学程式为____。
(2)由实验现象推测,铜锈中至少含有____种元素。
【活动二】探究铜生锈的条件
【提出猜想】根据铜锈的组成元素推测,铜生锈可能与和有关。
【进行实验】实验小组的同学取直径、长度均相同的铜丝,打磨光亮,设计了下图所示的5个实验并持续观察。
编号 ① ② ③ ④ ⑤
操作
现象 无明显现象 无明显现象 铜丝表面有绿色物质析出 无明显现象 无明显现象
【解释与结论】
(3)实验中使用的蒸馏水是经煮沸迅速冷却的,其目的是________。
(4)对比实验②和③,得出的结论是_______。为验证猜想,实验⑤中应加入的物质为____。
(5)由上述实验可推知,铜生锈的条件是____。
【活动三】测定铜锈中的含量
将上述实验编号③试管中剩余物质过滤,洗涤,干燥,得到固体,连接图甲、图乙装置,检查装置气密性,加入固体与足量盐酸进行实验。
(6)完全反应后,常温常压下测得生成的气体体积为,则该固体中的含量为______(用含v、d、m的字母表示)。
(7)该实验条件下测得铜锈质量分数偏大的原因是______(写一点即可)。
【答案】(1)CO2+Ca(OH)2=CaCO3↓+H2O
(2)4或四 (3)除去蒸馏水中的空气
(4) ①. 铜生锈与O2有关 ②. 干燥的O2和CO2
(5)铜与H2O、O2、CO2同时接触
(6)×100%
(7)稀盐酸占有一定的体积(合理即可)
21. 某兴趣小组的同学取2.8g铁粉,放入到盛有200g溶质质量分数为8%的硫酸铜溶液的烧杯中,一段时间后,反应停止。
(1)完全反应后,请在图中烧杯中,用类似 (表示水分子)的图形,画出溶液中存在的微粒_____。
(2)根据方程式进行计算,理论上可以得到多少克的铜
【答案】(1) (2)解:设理论上可以得到铜的质量为y
y=3.2g
答:理论上可以得到铜的质量为3.2g
22. 将15g表面氧化的铝片放入足量稀盐酸中,完全反应后收集到氢气质量如图所示,回答下列问题。
(1)0~t时刻没有产生气体的原因是______。
(2)求该铝片中铝单质的质量分数。
【答案】(1)铝片表面的氧化铝先与稀盐酸反应,生成氯化铝和水
(2)48%
解:设铝片中铝单质的质量为x,
铝片中铝单质的质量分数为×100%=48%;
答:铝片中铝单质的质量分数为48%。
23. 某课外兴趣小组同学取一定量含铜粉的氧化铜粉末,放入烧杯中,加入196g稀硫酸,搅拌,恰好完全反应后过滤(损耗忽略不计),烧杯中固体的质量随时间变化情况如图所示,试计算稀硫酸溶质质量分数。(规范写出计算过程)
【答案】氧化铜和稀硫酸反应生成硫酸铜和水,铜和稀硫酸不反应,故该粉末中氧化铜质量为:10g-2g=8g
解:设稀硫酸中溶质质量为x
x=9.8g
该稀硫酸中溶质质量分数=×100%=5%
答:稀硫酸中溶质质量分数为5%
24. 在烧杯中加入2.14g久置的铝箔,再倒入足量的稀硫酸,放出气体的质量如图所示。请回答下列问题:
(1)0~t时刻没有产生气体的原因是________;
(2)求该铝箔中铝单质的质量。
【答案】(1)久置的铝箔表面生成氧化铝,氧化铝先与稀硫酸反应生成硫酸铝和水
(2)解:设铝箔中Al的质量为x。
x=18g
答:铝箔中Al的质量的为1.8g。
25. 铁、铜双金粉可用于生产机械零件。化学小组同学对某铁、铜双金粉进行实验:取10g铁、铜双金粉样品于试管中,将90g稀硫酸分三次加入试管中,充分反应后,测定生成氢气的质量数据见下表:
第一次 第二次 第二次
加入稀硫酸的质量/g 30 30 30
生成氢气的总质量/g 0.14 0.28 0.3
请回答下列问题:
(1)每次加入稀硫酸后,需用玻璃棒搅拌,其目的是_________。
(2)该样品中铁的质量分数为多少?
【答案】(1)使反应更快更充分
(2)84%
解:设样品中铁的质量为x
所以样品中铁的质量分数为
答:该样品中铁的质量分数为84%。
同课章节目录
