江西省南昌市湾里区第一中学人教版高中化学选修四课件:2.3 化学平衡(共22张PPT)
文档属性
| 名称 | 江西省南昌市湾里区第一中学人教版高中化学选修四课件:2.3 化学平衡(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 282.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-10-30 00:00:00 | ||
图片预览



文档简介
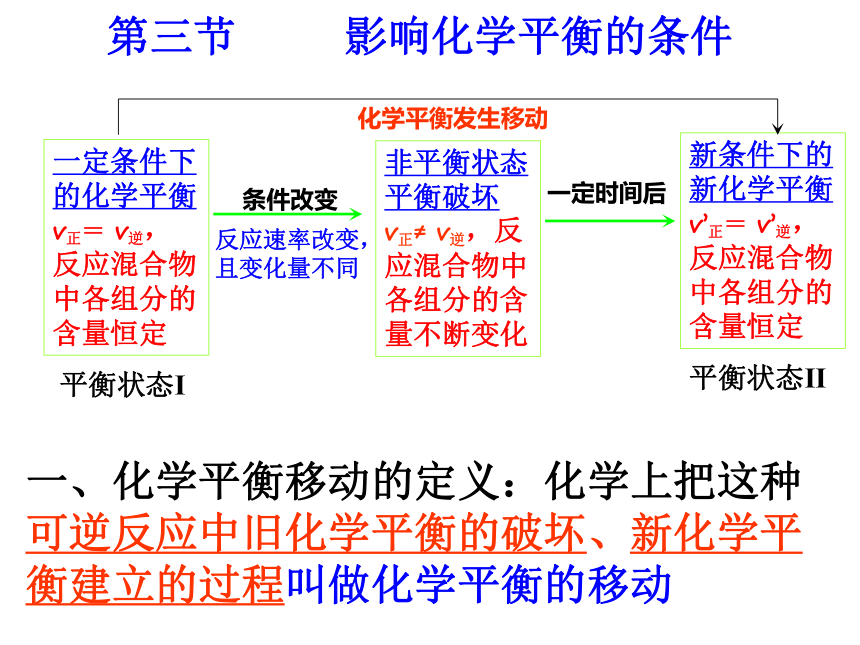
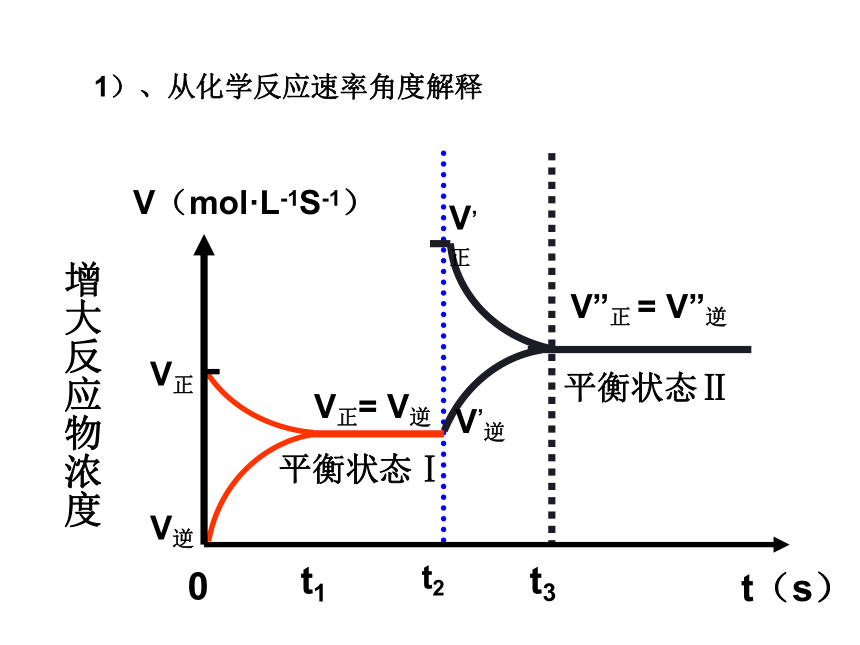
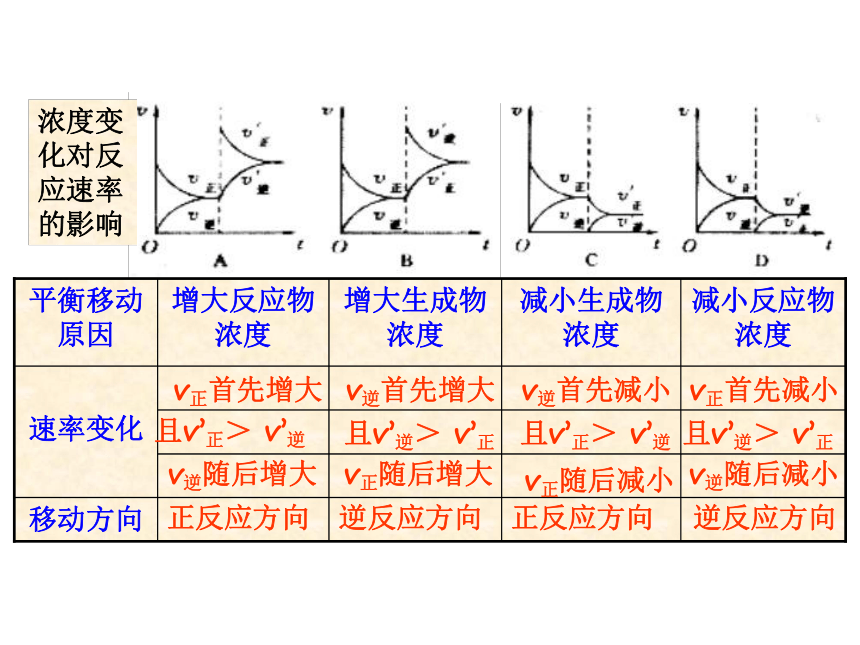
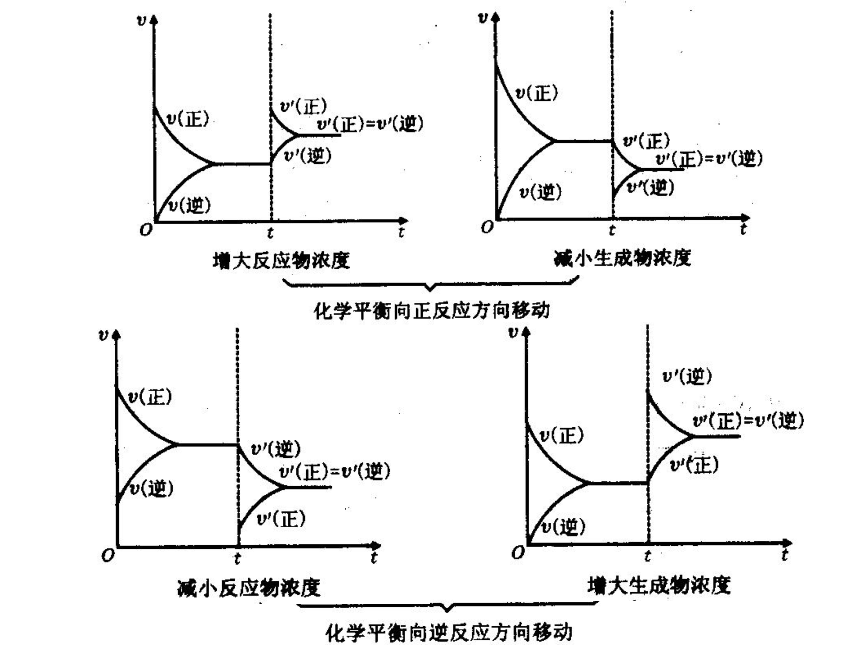
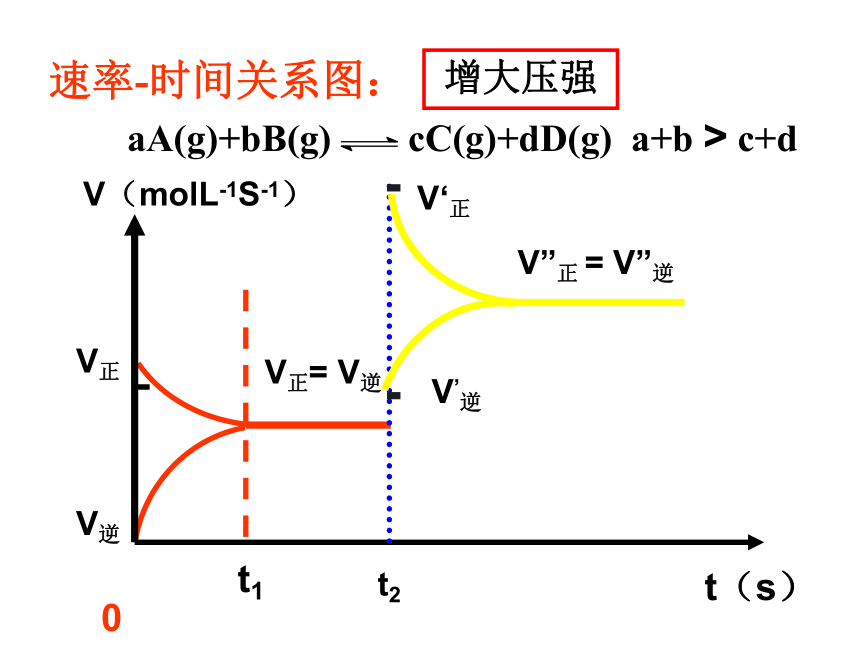
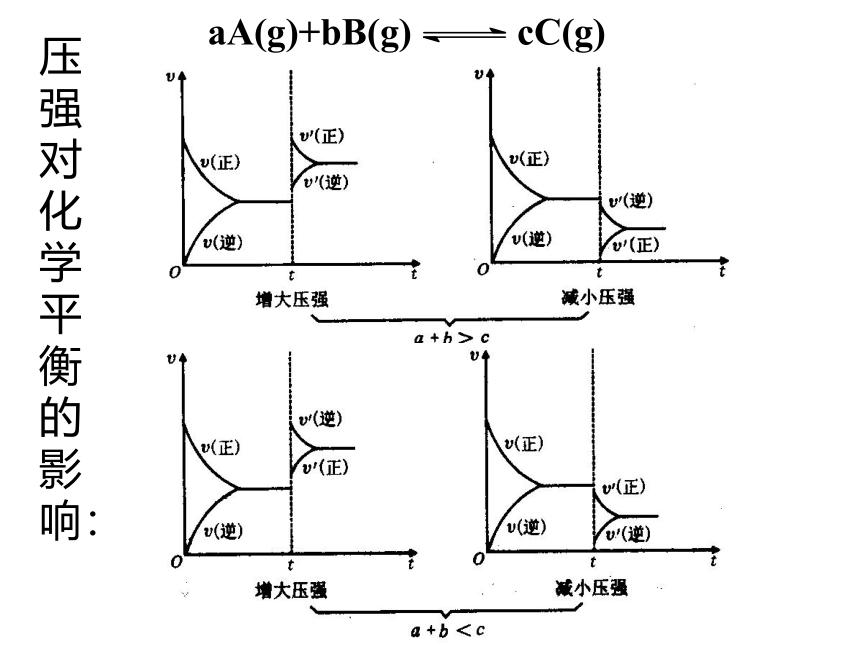
课件22张PPT。第二章 化学反应速率和化学平衡第三节 化学平衡(第3课时)第三节 影响化学平衡的条件一定条件下的化学平衡v正= v逆,反应混合物中各组分的含量恒定条件改变反应速率改变,且变化量不同非平衡状态平衡破坏 v正≠ v逆,反应混合物中各组分的含量不断变化一定时间后新条件下的新化学平衡v’正= v’逆,反应混合物中各组分的含量恒定平衡状态Ⅰ平衡状态Ⅱ化学平衡发生移动一、化学平衡移动的定义:化学上把这种可逆反应中旧化学平衡的破坏、新化学平衡建立的过程叫做化学平衡的移动化学平衡总往反应速率大的方向移动二、影响化学平衡的条件1、浓度对化学平衡的影响【实验2-4】FeCl3与KSCN的反应实验结论:增加FeCl3或增加KSCN,生成物浓度————,平衡向—— 反应方向移动,减小Fe3+的浓度,平衡向 反应方向移动。 增加正请从不同的角度解释该实验结论。逆t2V”正 = V”逆V’逆V,正t3平衡状态Ⅱ增大反应物浓度1)、从化学反应速率角度解释v正首先增大v逆随后增大且v’正> v’逆正反应方向v逆首先增大v正随后增大且v’逆> v’正逆反应方向 v逆首先减小 v正随后减小且v’正> v’逆正反应方向v正首先减小v逆随后减小且v’逆> v’正逆反应方向2、压强对化学平衡的影响讨论:压强的变化对化学反应速率如何影响?v正和 v逆怎样变化?会同等程度的增大或减小吗?N2(g)+3H2(g) 2NH3(g)反应中,压强变化和NH3含量的关系结论:压强增大, NH3%增大,平衡向正反应方向移动。即压强增大, v正和 v逆同时增大,但改变倍数不同, v正>v逆规律:增大压强,化学平衡向————————————————移动;减小压强,化学平衡向——————————————————移动;体积相等的气体反应,压强改变,化学平衡———————。 气体体积缩小方向气体体积扩大方向不移动 V(molL-1S-1)0t2V”正 = V”逆V’逆V‘正增大压强速率-时间关系图:aA(g)+bB(g) cC(g)+dD(g) a+b > c+d压强对化学平衡的影响:aA(g)+bB(g) cC(g)结论:压强变化不影响体积相等的气体反应的化学平衡讨论:压强的变化不会影响固体或液体物质的反应速率,压强的变化会使固体或液体反应的化学平衡移动吗?aA(g)+bB(g) cC(g) 当a+b=c时结论:无气体参加的反应,压强的改变,不能使化学平衡移动强调:压强变化若没有浓度的变化,化学反应速率——————,化学平衡——————。不变不移动不变不变不移动减小逆反应一定量的混合气体在密闭容器中发生反应:
m A (g) + n B (g) p C (g)达到平衡后,温度不变,将气体体积缩小到原来
的1/2,达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )A、m + n > p B、A 的转化率降低
C、平衡向正反应方向移动 D、C的体积分数增加 B 课堂练习【实验2-5】温度对平衡的影响:2NO2 N2O4(正反应放热)实验现象:温度升高,混合气体颜色加深,——————————,平衡向—————— 方向移动;温度降低,混合气体颜色变浅,
————————————,平衡向—————— 方向移动NO2浓度增大逆反应NO2浓度减小正反应V正= V逆V正V逆t1t(s)V(molL-1S-1)0T2升温V”正 = V”逆V’逆V‘正温度对化学平衡的影响:已知可逆反应2SO2+O2 2SO3的正反应为放热反应。升高温度产生的影响是( )
A、 v (正)增大, v (逆)减小
B、 v (正)、 v (逆)不同程度增大
C、 v (正)减小, v (逆)增大
D、 v (正)、 v (逆)同等程度增大
B练习已知高温下反应
(正反应为吸热反应)。要使混合气体颜色加深,可采取的方法是A、保持容积不变,加入HBr(g) B、降低温度C、升高温度D、保持容积不变,加入H2(g)( A C )2HBr(g) H2(g) + Br2(g)4、催化剂对化学平衡的影响催化剂同等程度地加快正、逆反应速率(v正= v逆);对化学平衡无影响。加催化剂(b)v逆v正′′催化剂能缩短平衡到达的时间小结: 正反应方向 使反应物浓度减小逆反应方向 使反应物浓度增大逆反应方向 使生成物浓度减小 正反应方向 使生成物浓度增大aA(g)+bB(g) cC(g)+dD(g) △H<0 a+b > c+d 正反应方向 体系压强减小逆反应方向 体系压强增大逆反应方向 体系温度减低 正反应方向 体系温度升高 如果改变影响平衡的一个条件(浓度、温度、压强等),
平衡就向能够使这种改变减弱的方向移动。4、化学平衡移动原理——勒夏特列原理原理:如果改变影响平衡的一个条件(浓度、温度、压强等),化学平衡就向减弱这种改变的方向移动⑴、此原理只适用于已达平衡的体系⑵、平衡移动方向与条件改变方向相反,例如:增大浓度,平衡移向减小这种浓度的方向;增大压强,向减小压强方向移动。说明:⑶、“减弱”的含义:平衡移动后结果变化的方向不变,但程度减小。例如,增加反应物浓度平衡移动后该反应物浓度仍增加,只是增加的程度比没有平衡移动时要小。①若N2的平衡浓度为a mol/L,其他条件不变时,充入N2使其浓度增大到b mol/L后平衡向——————方向移动,达到新平衡后, N2的浓度为c mol/L,则a、b、c的大小为———————;②若平衡体系的压强为P1 ,之后缩小反应体系体积使压强增大到P2 ,此时平衡向——————方向移动,达到新平衡后 体系的压强为P3 ,则P1 、 P2、 P3 的大小为——————————;③若平衡体系的温度为T1 ,之后将温度升高到 T2 ,此时平衡向——————方向移动,达到新平衡后 体系的温度为T3 ,则T1 、 T2、 T3 的大小为——————————。正反应 a< c < b正反应P1 < P3< P2逆反应T1 < T3< T2讨论:反应N2(g)+3H2 (g) 2NH3 (g)△H<0达到化学平衡,改变下列条件,根据反应体系中的变化填空:即:平衡移动的结果是减弱改变而不是抵消改变。课堂练习1.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
① 生成物的百分含量一定增加② 生成物的产量一定增加③ 反应物的转化率一定增大④ 反应物浓度一定降低⑤ 正反应速率一定大于逆反应速率⑥ 使用了合适的催化剂
A ① ② (B) ② ⑤ (C) ③ ⑤ (D) ④ ⑥
B2.恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是: A. a>b+c B. a<b+c C. a=b+c D. a=b=c A
m A (g) + n B (g) p C (g)达到平衡后,温度不变,将气体体积缩小到原来
的1/2,达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )A、m + n > p B、A 的转化率降低
C、平衡向正反应方向移动 D、C的体积分数增加 B 课堂练习【实验2-5】温度对平衡的影响:2NO2 N2O4(正反应放热)实验现象:温度升高,混合气体颜色加深,——————————,平衡向—————— 方向移动;温度降低,混合气体颜色变浅,
————————————,平衡向—————— 方向移动NO2浓度增大逆反应NO2浓度减小正反应V正= V逆V正V逆t1t(s)V(molL-1S-1)0T2升温V”正 = V”逆V’逆V‘正温度对化学平衡的影响:已知可逆反应2SO2+O2 2SO3的正反应为放热反应。升高温度产生的影响是( )
A、 v (正)增大, v (逆)减小
B、 v (正)、 v (逆)不同程度增大
C、 v (正)减小, v (逆)增大
D、 v (正)、 v (逆)同等程度增大
B练习已知高温下反应
(正反应为吸热反应)。要使混合气体颜色加深,可采取的方法是A、保持容积不变,加入HBr(g) B、降低温度C、升高温度D、保持容积不变,加入H2(g)( A C )2HBr(g) H2(g) + Br2(g)4、催化剂对化学平衡的影响催化剂同等程度地加快正、逆反应速率(v正= v逆);对化学平衡无影响。加催化剂(b)v逆v正′′催化剂能缩短平衡到达的时间小结: 正反应方向 使反应物浓度减小逆反应方向 使反应物浓度增大逆反应方向 使生成物浓度减小 正反应方向 使生成物浓度增大aA(g)+bB(g) cC(g)+dD(g) △H<0 a+b > c+d 正反应方向 体系压强减小逆反应方向 体系压强增大逆反应方向 体系温度减低 正反应方向 体系温度升高 如果改变影响平衡的一个条件(浓度、温度、压强等),
平衡就向能够使这种改变减弱的方向移动。4、化学平衡移动原理——勒夏特列原理原理:如果改变影响平衡的一个条件(浓度、温度、压强等),化学平衡就向减弱这种改变的方向移动⑴、此原理只适用于已达平衡的体系⑵、平衡移动方向与条件改变方向相反,例如:增大浓度,平衡移向减小这种浓度的方向;增大压强,向减小压强方向移动。说明:⑶、“减弱”的含义:平衡移动后结果变化的方向不变,但程度减小。例如,增加反应物浓度平衡移动后该反应物浓度仍增加,只是增加的程度比没有平衡移动时要小。①若N2的平衡浓度为a mol/L,其他条件不变时,充入N2使其浓度增大到b mol/L后平衡向——————方向移动,达到新平衡后, N2的浓度为c mol/L,则a、b、c的大小为———————;②若平衡体系的压强为P1 ,之后缩小反应体系体积使压强增大到P2 ,此时平衡向——————方向移动,达到新平衡后 体系的压强为P3 ,则P1 、 P2、 P3 的大小为——————————;③若平衡体系的温度为T1 ,之后将温度升高到 T2 ,此时平衡向——————方向移动,达到新平衡后 体系的温度为T3 ,则T1 、 T2、 T3 的大小为——————————。正反应 a< c < b正反应P1 < P3< P2逆反应T1 < T3< T2讨论:反应N2(g)+3H2 (g) 2NH3 (g)△H<0达到化学平衡,改变下列条件,根据反应体系中的变化填空:即:平衡移动的结果是减弱改变而不是抵消改变。课堂练习1.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
① 生成物的百分含量一定增加② 生成物的产量一定增加③ 反应物的转化率一定增大④ 反应物浓度一定降低⑤ 正反应速率一定大于逆反应速率⑥ 使用了合适的催化剂
A ① ② (B) ② ⑤ (C) ③ ⑤ (D) ④ ⑥
B2.恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是: A. a>b+c B. a<b+c C. a=b+c D. a=b=c A
