人教版(2019)必修第二册7.2.1乙烯(共36张ppt)
文档属性
| 名称 | 人教版(2019)必修第二册7.2.1乙烯(共36张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-20 00:00:00 | ||
图片预览









文档简介
(共36张PPT)
第七章 有机化合物
第二节 乙烯与有机高分子材料
第1课时 乙烯
核心素养】
1.宏观辨识与微观探析:能从原子、分子水平分析烯烃反应的微观特征,形成“结构决定性质”的观念。
2.证据推理与模型认知:根据乙烯的性质,独立完成其他烯烃的性质探究
3.科学精神与社会责任:激发学生透过现象探究本质的兴趣,尊重科学,学习科学的学习方法;通过参与探究,培养自身严谨的科学态度和辩证分析能力。为化学的发展尽自己的力量。
【教学重难点】
重点:认识乙烯的结构及其主要性质与应用。
难点:知道氧化、加成和聚合等有机反应类型。
“红柿摘下未熟,每篮用木瓜三枚放入,得气既发,并无涩味。”
——宋·苏轼《格物粗谈·果品》
这种气体就是我们今天即将学习的乙烯。
乙烯是石油化学工业重要的基本原料,通过一系列化学反应,可以从乙烯得到有机高分子材料、药物等成千上万种有用的物质。乙烯的用途广泛,其产量可以用来衡量一个国家石油化学工业的发展水平。
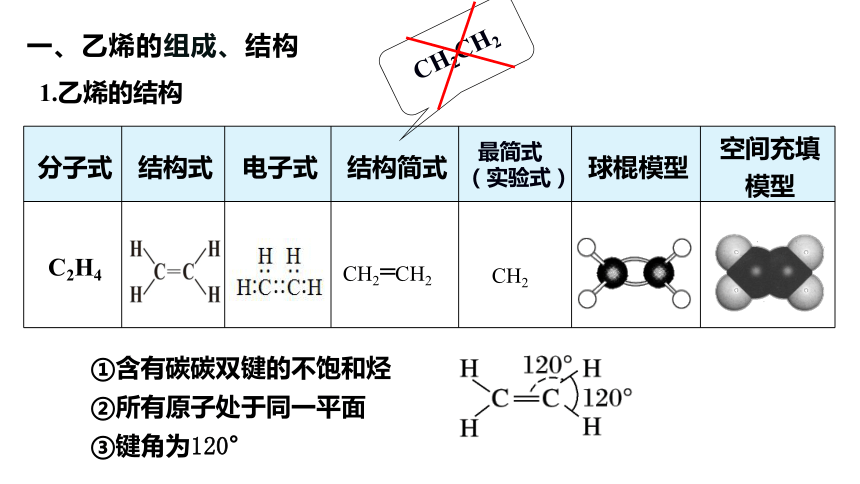
一、乙烯的组成、结构
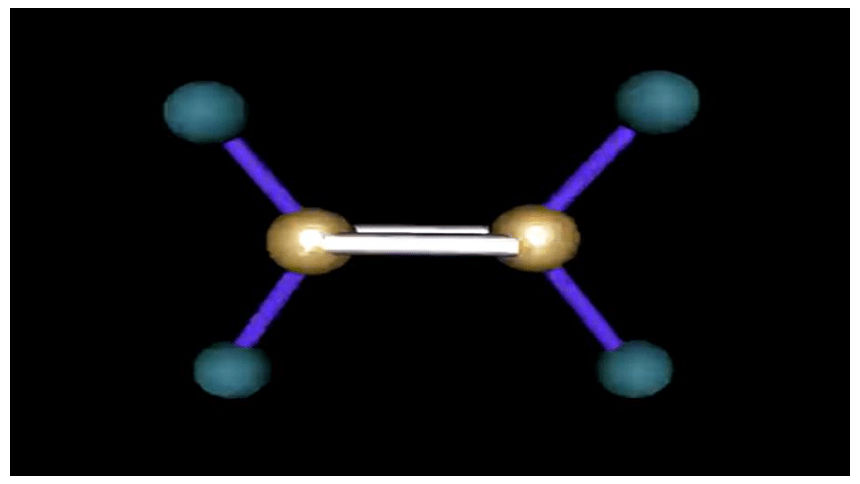
分子式 结构式 电子式 结构简式 最简式 (实验式) 球棍模型 空间充填模型
C2H4
CH2=CH2
1.乙烯的结构
CH2
①含有碳碳双键的不饱和烃
②所有原子处于同一平面
③键角为120°
CH2CH2
2.烯烃:含有C=C的烃叫做烯烃(烯烃属于不饱和烃)
3.烯烃通式:CnH2n(n≥2整数)
注意:
①含C=C的烃属于不饱和烃
②C═C中C原子不能绕键旋转(C—C可以)
③C═C不是两个C—C的简单组合
【课堂练习】
1.关于乙烯分子结构的描述正确的是( )
A.乙烯的结构简式为CH2CH2
B.乙烯的电子式为
C.乙烯分子中所有原子都在同一平面上
D.乙烯分子中所有原子都在一条直线上
E.乙烯的球棍模型为
C
2.下列属于烯烃的是 ( )
A.CH3CH2CH3
B.CH2=CHCH3
C.CH2=CHCH2Cl
D.CH3CHCH=CH2
BD
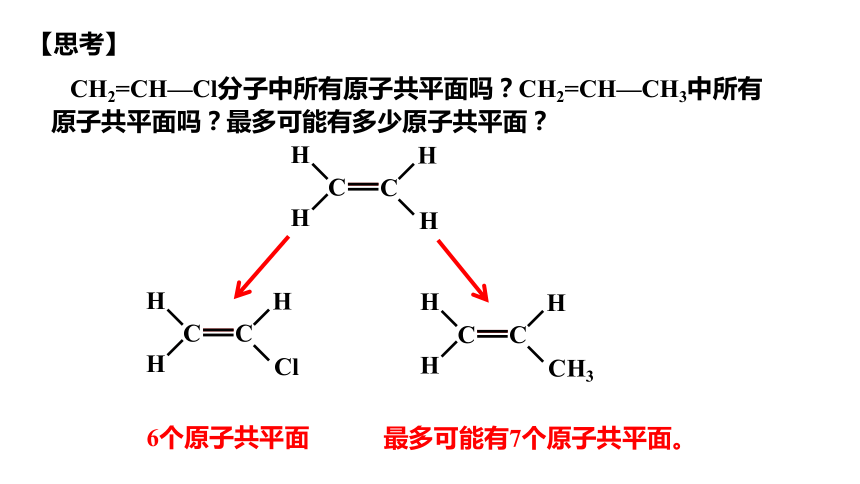
CH2=CH—Cl分子中所有原子共平面吗?CH2=CH—CH3中所有
原子共平面吗?最多可能有多少原子共平面?
最多可能有7个原子共平面。
【思考】
H
C
C
H
H
H
H
C
C
H
H
Cl
H
C
C
H
H
CH3
6个原子共平面
1.由乙烯推测丙烯的结构或性质,下列说法正确的是( )A.分子中3个碳原子在同一直线上B.分子中所有原子都在同一平面上C.分子中共价键的夹角均为120°D.分子中共价键数为8,其中有1个为碳碳双键
【课堂练习】
D
拓展:分子共线、共面问题
1.甲烷型:
2.乙烯型:
只要出现一个饱和碳原子 ,则分子中的所有原子不可能共面
有机物结构中每出现1个 ,则整个分子中至少有6个原子共面
名称 乙烷 乙烯
分子式 C2H6 C2H4
结构式
结构简式
碳碳键类别
碳原子价键是否饱和
空间各原子的位置
2C和4H在同一平面上
2C和6H不在同一平面上
4.乙烷和乙烯的结构比较
碳碳单键
CH2=CH2
CH3CH3
碳碳双键
饱和
不饱和
二、乙烯的物理性质
颜色 气味 状态 密度 溶解性 收集方法
无色 稍有气味 气体 比空气略小 难溶于水 排水法
1.氧化反应
①燃烧
C2H4+3O2 2CO2+2H2O
点燃
现象:火焰明亮,伴有黑烟。
产生黑烟是因为含碳量高,燃烧不充分
火焰明亮是碳微粒受灼热而发光
注意:①100℃以上时,反应前后气体体积不变
②乙烯点燃前需要验纯
三、乙烯的化学性质
②被酸性KMnO4氧化
CH2=CH2
CO2 + H2O
KMnO4(H+)
思考:①能用酸性KMnO4鉴别CH4和C2H4吗?
②能用酸性KMnO4除去甲烷中混有的乙烯吗?
现象:酸性高锰酸钾溶液紫红色褪去
可用于鉴别CH4和C2H4(烷烃和烯烃)
不能用酸性KMnO4溶液除去甲烷中混有的乙烯,酸性KMnO4将乙烯氧化为CO2,引入新杂质CO2。
【课堂练习】
1.判断正误
(1)乙烷的化学性质比乙烯活泼( )(2)某无色气体通入酸性KMnO4溶液中,溶液褪色,该气体一定是烯烃( )(3)甲烷和乙烯都是可燃性气体,点燃之前必须验纯,而且燃烧时现象相同( )(4)可用酸性高锰酸钾溶液或溴水鉴别甲烷和乙烯( )(5)可用酸性高锰酸钾溶液除去甲烷中的乙烯( )
×
×
×
×
√
2.长途运输水果时,常常将浸泡有高锰酸钾溶液的硅土放置在盛放水果的容器中,其目的是( )
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
D.利用高锰酸钾溶液的氧化性,催熟水果
C
简写:CH2=CH2 + Br2 → CH2BrCH2Br
可用于鉴别CH4和C2H4(烷烃和烯烃)
同时断键
1,2 – 二溴乙烷
H—C=C—H
H H
Br Br
Br Br
H—C C—H
H H
(无色油状液体,密度比水大,不溶于水)
第二节 乙烯与有机高分子材料
①定义:有机物分子中的不饱和碳原子(双键或三键两端的碳原子)
与其他原子或原子团直接结合生成新的化合物的反应。
②特点:只上不下
2.加成反应
+
一定条件
a
b
【模型】
3.乙烯可以与X2、H2 、 HCl、H2O、HCN等发生加成反应。
CH2=CH2 + H2 CH3CH3(乙烷)
催化剂
△
CH2=CH2 + H2O CH3CH2OH (乙醇)
催化剂
加热加压
CH2=CH2 + HCl CH3CH2Cl (氯乙烷)
催化剂
CH2 ─ CH2
CH2=CH2 + X─X
X X
△
1.写出丙烯(CH2=CHCH3)分别与H2、HCl在一定条件下发生加成反应的化学方程式
【课堂练习】
CH2=CHCH3 + H2 CH3CH2CH3
催化剂
△
CH2=CHCH3 + HCl CH3CHClCH3
催化剂
2.1molCH2=CH2与氯气完全加成后再与氯气取代,整个过程最多需Cl2的物质的量为( )
A.1mol B.4mol C.5mol D.6mol
C
3.某烯烃和氢气加成后的产物如图:
CH3—C—CH2—CH3
CH3
CH3
①
②
③
④
⑤
⑥
思考:该烯烃的双键在哪两个碳原子之间?
只能是③④之间
逆向思考:
从产物分子中相邻碳原子去掉两个氢,加一个碳碳键即是原来的烯烃。
【思考】1.乙烯使溴水褪色和酸性KMnO4褪色的原理相同吗
乙烯使溴水褪色是因为乙烯与溴单质发生了加成反应
乙烯使KMnO4(H+)褪色是因为乙烯与酸性KMnO4发生了氧化反应
乙烯
我能使酸性KMnO4褪色
3.如何除去乙烷中的乙烯?
可以将混合气体通过溴水洗气。
①不能用酸性KMnO4溶液,KMnO4溶液和乙烯反应生成CO2
②不能用溴的四氯化碳溶液,乙烯被溴反应的同时,乙烷也会溶于CCl4中。
2.如何鉴别乙烷和乙烯?
(1)分别点燃两种气体,燃烧时有黑烟的是乙烯
(2)分别通入KMnO4(H+)中,能使溶液褪色的是乙烯
(3)分别通入溴水中,能使溴水褪色的是乙烯
KMnO4溶液?
溴的CCl4?
溴水?
4.制取氯乙烷,采取CH3-CH3与Cl2取代反应好,还是采用CH2=CH2与HCl加成反应好?
用 C2H4 和 HCl 反应制取更好。
乙烷和 Cl2 发生的是取代反应,生成物中除 CH3CH2Cl 外,还有 C2H4Cl2、C2H3Cl3、C2H2Cl4、C2HCl5、C2Cl6、HCl,生成物不纯,产率低。
C2H4 和 HCl 发生的是加成反应,无副反应,生成物只有 CH3CH2Cl。
取 代 反 应 加 成 反 应
意 义
归 属
断键规律
产物特点
【小结】取代反应与加成反应的比较
取而代之,有上有下
加而成之,只上不下
烷烃的特征反应
烯烃的特征反应
C-H 断裂
C-C断裂
产物较纯净
加成1mol 双键,耗1mol Cl2
产物复杂,为混合物
取代1mol H,耗1molCl2
CH2=CH2 + CH2=CH2 + CH2=CH2 +……
……— CH2 —CH2 —CH2 —CH2 —CH2 —CH2 —……
聚乙烯
-CH2-CH2- + -CH2-CH2- + -CH2-CH2- +……
聚乙烯的分子结构模型(局部)
在适当的温度、压强和催化剂存在的条件下,乙烯分子中碳碳双键中的一个键断裂,分子间通过碳原子相互结合形成很长的碳链,生成相对分子质量很大的聚合物——聚乙烯。
乙烯分子之间可否发生加成反应呢
由相对分子质量小的化合物分子间相互结合成相对分子量大的聚合物的反应
四、聚合反应
n CH2=CH2
[ CH2—CH2 ]n
催化剂
(n不确定,混合物)
单体:CH2=CH2
链节:—CH2—CH2 —
聚合度: n
思考:聚乙烯能使Br2水褪色吗?
1.写出下列单体的聚合反应方程式
②nCH3-CH=CH-CH3
①nClCH=CH2
一定条件
一定条件
CH3
[CH —CH ]n
CH3
④丙烯在一定条件下加聚生成聚丙烯
【课堂练习】
[ CH2—CH ]n
Cl
[ CH2—CH ]n
CH3
nCH2=CH-CH3
一定条件
③nCF2=CF2
一定条件
F
[C—C ]n
F
F
F
2.下列关于乙烯和聚乙烯的叙述中正确的是( )
A.二者都能使溴水褪色 B.二者互为同系物
C.二者最简式相同 D.二者相对分子质量相同
3.下列关于乙烯和聚乙烯的说法正确的是( )
A.二者都属于烯烃
B.二者都能使酸性高锰酸钾溶液褪色
C.二者所含碳的质量分数相等
D.二者常温下呈气态
C
C
五、乙烯的用途
(1)衡量一个国家石油工业发展水平;
(2)有机化工原料;
(3)植物生长调节剂,催熟剂。
【课堂练习】1.某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,根据下图回答下列问题
(1)写出A、B、C、D的结构简式:
(2)写出①②两步反应的化学方程式,
并注明反应类型
A.CH2=CH2 B.CH3CH3
C.CH3CH2Cl D.CH3CH2OH
CH2=CH2 + H2 CH3CH3(加成反应)
催化剂
△
CH2=CH2 + HCl CH3CH2Cl (加成反应)
催化剂
2.能证明乙烯分子里含有一个碳碳双键的事实是( ) A.乙烯分子里碳、氢个数比为1∶2 B.乙烯完全燃烧生成的CO2和水的物质的量相等 C.乙烯能与Br2的CCl4溶液发生加成反应,且1 mol乙烯完全加成需消耗1 mol Br2 D.乙烯能使酸性高锰酸钾溶液褪色
C
3.某课外活动小组设计了以下四种方案除去乙烷中混有的少量乙烯,并得到纯净干燥的乙烷,合理的是( )
A.①②④ B.①②③ C.②③④ D.①②③④
D
第七章 有机化合物
第二节 乙烯与有机高分子材料
第1课时 乙烯
核心素养】
1.宏观辨识与微观探析:能从原子、分子水平分析烯烃反应的微观特征,形成“结构决定性质”的观念。
2.证据推理与模型认知:根据乙烯的性质,独立完成其他烯烃的性质探究
3.科学精神与社会责任:激发学生透过现象探究本质的兴趣,尊重科学,学习科学的学习方法;通过参与探究,培养自身严谨的科学态度和辩证分析能力。为化学的发展尽自己的力量。
【教学重难点】
重点:认识乙烯的结构及其主要性质与应用。
难点:知道氧化、加成和聚合等有机反应类型。
“红柿摘下未熟,每篮用木瓜三枚放入,得气既发,并无涩味。”
——宋·苏轼《格物粗谈·果品》
这种气体就是我们今天即将学习的乙烯。
乙烯是石油化学工业重要的基本原料,通过一系列化学反应,可以从乙烯得到有机高分子材料、药物等成千上万种有用的物质。乙烯的用途广泛,其产量可以用来衡量一个国家石油化学工业的发展水平。
一、乙烯的组成、结构
分子式 结构式 电子式 结构简式 最简式 (实验式) 球棍模型 空间充填模型
C2H4
CH2=CH2
1.乙烯的结构
CH2
①含有碳碳双键的不饱和烃
②所有原子处于同一平面
③键角为120°
CH2CH2
2.烯烃:含有C=C的烃叫做烯烃(烯烃属于不饱和烃)
3.烯烃通式:CnH2n(n≥2整数)
注意:
①含C=C的烃属于不饱和烃
②C═C中C原子不能绕键旋转(C—C可以)
③C═C不是两个C—C的简单组合
【课堂练习】
1.关于乙烯分子结构的描述正确的是( )
A.乙烯的结构简式为CH2CH2
B.乙烯的电子式为
C.乙烯分子中所有原子都在同一平面上
D.乙烯分子中所有原子都在一条直线上
E.乙烯的球棍模型为
C
2.下列属于烯烃的是 ( )
A.CH3CH2CH3
B.CH2=CHCH3
C.CH2=CHCH2Cl
D.CH3CHCH=CH2
BD
CH2=CH—Cl分子中所有原子共平面吗?CH2=CH—CH3中所有
原子共平面吗?最多可能有多少原子共平面?
最多可能有7个原子共平面。
【思考】
H
C
C
H
H
H
H
C
C
H
H
Cl
H
C
C
H
H
CH3
6个原子共平面
1.由乙烯推测丙烯的结构或性质,下列说法正确的是( )A.分子中3个碳原子在同一直线上B.分子中所有原子都在同一平面上C.分子中共价键的夹角均为120°D.分子中共价键数为8,其中有1个为碳碳双键
【课堂练习】
D
拓展:分子共线、共面问题
1.甲烷型:
2.乙烯型:
只要出现一个饱和碳原子 ,则分子中的所有原子不可能共面
有机物结构中每出现1个 ,则整个分子中至少有6个原子共面
名称 乙烷 乙烯
分子式 C2H6 C2H4
结构式
结构简式
碳碳键类别
碳原子价键是否饱和
空间各原子的位置
2C和4H在同一平面上
2C和6H不在同一平面上
4.乙烷和乙烯的结构比较
碳碳单键
CH2=CH2
CH3CH3
碳碳双键
饱和
不饱和
二、乙烯的物理性质
颜色 气味 状态 密度 溶解性 收集方法
无色 稍有气味 气体 比空气略小 难溶于水 排水法
1.氧化反应
①燃烧
C2H4+3O2 2CO2+2H2O
点燃
现象:火焰明亮,伴有黑烟。
产生黑烟是因为含碳量高,燃烧不充分
火焰明亮是碳微粒受灼热而发光
注意:①100℃以上时,反应前后气体体积不变
②乙烯点燃前需要验纯
三、乙烯的化学性质
②被酸性KMnO4氧化
CH2=CH2
CO2 + H2O
KMnO4(H+)
思考:①能用酸性KMnO4鉴别CH4和C2H4吗?
②能用酸性KMnO4除去甲烷中混有的乙烯吗?
现象:酸性高锰酸钾溶液紫红色褪去
可用于鉴别CH4和C2H4(烷烃和烯烃)
不能用酸性KMnO4溶液除去甲烷中混有的乙烯,酸性KMnO4将乙烯氧化为CO2,引入新杂质CO2。
【课堂练习】
1.判断正误
(1)乙烷的化学性质比乙烯活泼( )(2)某无色气体通入酸性KMnO4溶液中,溶液褪色,该气体一定是烯烃( )(3)甲烷和乙烯都是可燃性气体,点燃之前必须验纯,而且燃烧时现象相同( )(4)可用酸性高锰酸钾溶液或溴水鉴别甲烷和乙烯( )(5)可用酸性高锰酸钾溶液除去甲烷中的乙烯( )
×
×
×
×
√
2.长途运输水果时,常常将浸泡有高锰酸钾溶液的硅土放置在盛放水果的容器中,其目的是( )
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
D.利用高锰酸钾溶液的氧化性,催熟水果
C
简写:CH2=CH2 + Br2 → CH2BrCH2Br
可用于鉴别CH4和C2H4(烷烃和烯烃)
同时断键
1,2 – 二溴乙烷
H—C=C—H
H H
Br Br
Br Br
H—C C—H
H H
(无色油状液体,密度比水大,不溶于水)
第二节 乙烯与有机高分子材料
①定义:有机物分子中的不饱和碳原子(双键或三键两端的碳原子)
与其他原子或原子团直接结合生成新的化合物的反应。
②特点:只上不下
2.加成反应
+
一定条件
a
b
【模型】
3.乙烯可以与X2、H2 、 HCl、H2O、HCN等发生加成反应。
CH2=CH2 + H2 CH3CH3(乙烷)
催化剂
△
CH2=CH2 + H2O CH3CH2OH (乙醇)
催化剂
加热加压
CH2=CH2 + HCl CH3CH2Cl (氯乙烷)
催化剂
CH2 ─ CH2
CH2=CH2 + X─X
X X
△
1.写出丙烯(CH2=CHCH3)分别与H2、HCl在一定条件下发生加成反应的化学方程式
【课堂练习】
CH2=CHCH3 + H2 CH3CH2CH3
催化剂
△
CH2=CHCH3 + HCl CH3CHClCH3
催化剂
2.1molCH2=CH2与氯气完全加成后再与氯气取代,整个过程最多需Cl2的物质的量为( )
A.1mol B.4mol C.5mol D.6mol
C
3.某烯烃和氢气加成后的产物如图:
CH3—C—CH2—CH3
CH3
CH3
①
②
③
④
⑤
⑥
思考:该烯烃的双键在哪两个碳原子之间?
只能是③④之间
逆向思考:
从产物分子中相邻碳原子去掉两个氢,加一个碳碳键即是原来的烯烃。
【思考】1.乙烯使溴水褪色和酸性KMnO4褪色的原理相同吗
乙烯使溴水褪色是因为乙烯与溴单质发生了加成反应
乙烯使KMnO4(H+)褪色是因为乙烯与酸性KMnO4发生了氧化反应
乙烯
我能使酸性KMnO4褪色
3.如何除去乙烷中的乙烯?
可以将混合气体通过溴水洗气。
①不能用酸性KMnO4溶液,KMnO4溶液和乙烯反应生成CO2
②不能用溴的四氯化碳溶液,乙烯被溴反应的同时,乙烷也会溶于CCl4中。
2.如何鉴别乙烷和乙烯?
(1)分别点燃两种气体,燃烧时有黑烟的是乙烯
(2)分别通入KMnO4(H+)中,能使溶液褪色的是乙烯
(3)分别通入溴水中,能使溴水褪色的是乙烯
KMnO4溶液?
溴的CCl4?
溴水?
4.制取氯乙烷,采取CH3-CH3与Cl2取代反应好,还是采用CH2=CH2与HCl加成反应好?
用 C2H4 和 HCl 反应制取更好。
乙烷和 Cl2 发生的是取代反应,生成物中除 CH3CH2Cl 外,还有 C2H4Cl2、C2H3Cl3、C2H2Cl4、C2HCl5、C2Cl6、HCl,生成物不纯,产率低。
C2H4 和 HCl 发生的是加成反应,无副反应,生成物只有 CH3CH2Cl。
取 代 反 应 加 成 反 应
意 义
归 属
断键规律
产物特点
【小结】取代反应与加成反应的比较
取而代之,有上有下
加而成之,只上不下
烷烃的特征反应
烯烃的特征反应
C-H 断裂
C-C断裂
产物较纯净
加成1mol 双键,耗1mol Cl2
产物复杂,为混合物
取代1mol H,耗1molCl2
CH2=CH2 + CH2=CH2 + CH2=CH2 +……
……— CH2 —CH2 —CH2 —CH2 —CH2 —CH2 —……
聚乙烯
-CH2-CH2- + -CH2-CH2- + -CH2-CH2- +……
聚乙烯的分子结构模型(局部)
在适当的温度、压强和催化剂存在的条件下,乙烯分子中碳碳双键中的一个键断裂,分子间通过碳原子相互结合形成很长的碳链,生成相对分子质量很大的聚合物——聚乙烯。
乙烯分子之间可否发生加成反应呢
由相对分子质量小的化合物分子间相互结合成相对分子量大的聚合物的反应
四、聚合反应
n CH2=CH2
[ CH2—CH2 ]n
催化剂
(n不确定,混合物)
单体:CH2=CH2
链节:—CH2—CH2 —
聚合度: n
思考:聚乙烯能使Br2水褪色吗?
1.写出下列单体的聚合反应方程式
②nCH3-CH=CH-CH3
①nClCH=CH2
一定条件
一定条件
CH3
[CH —CH ]n
CH3
④丙烯在一定条件下加聚生成聚丙烯
【课堂练习】
[ CH2—CH ]n
Cl
[ CH2—CH ]n
CH3
nCH2=CH-CH3
一定条件
③nCF2=CF2
一定条件
F
[C—C ]n
F
F
F
2.下列关于乙烯和聚乙烯的叙述中正确的是( )
A.二者都能使溴水褪色 B.二者互为同系物
C.二者最简式相同 D.二者相对分子质量相同
3.下列关于乙烯和聚乙烯的说法正确的是( )
A.二者都属于烯烃
B.二者都能使酸性高锰酸钾溶液褪色
C.二者所含碳的质量分数相等
D.二者常温下呈气态
C
C
五、乙烯的用途
(1)衡量一个国家石油工业发展水平;
(2)有机化工原料;
(3)植物生长调节剂,催熟剂。
【课堂练习】1.某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,根据下图回答下列问题
(1)写出A、B、C、D的结构简式:
(2)写出①②两步反应的化学方程式,
并注明反应类型
A.CH2=CH2 B.CH3CH3
C.CH3CH2Cl D.CH3CH2OH
CH2=CH2 + H2 CH3CH3(加成反应)
催化剂
△
CH2=CH2 + HCl CH3CH2Cl (加成反应)
催化剂
2.能证明乙烯分子里含有一个碳碳双键的事实是( ) A.乙烯分子里碳、氢个数比为1∶2 B.乙烯完全燃烧生成的CO2和水的物质的量相等 C.乙烯能与Br2的CCl4溶液发生加成反应,且1 mol乙烯完全加成需消耗1 mol Br2 D.乙烯能使酸性高锰酸钾溶液褪色
C
3.某课外活动小组设计了以下四种方案除去乙烷中混有的少量乙烯,并得到纯净干燥的乙烷,合理的是( )
A.①②④ B.①②③ C.②③④ D.①②③④
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
