5.2.2氨课件(共17张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.2氨课件(共17张ppt)化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 07:29:32 | ||
图片预览






文档简介
(共17张PPT)
第二节 氮及其化合物
第2课时 氨
第五章 化学生产中的重要非金属元素
学习目标
1.了解哈伯法合成氨的历史,培养学生良好的道德情操、必备的品质和社会责任感。
2.通过喷泉实验帮助学生认识氨极易溶于水的性质,了解喷泉形成的原理,体会物理压强差在化学中的应用,加强与其他学科融合。
3.观察氨与酸反应的现象,探究反应的本质。
4.从化合价角度认识氨的还原性,联系化工生产,培养学生应用化学知识解决生活实际问题的能力。
导入
一.氨的物理性质
,常温下,1体积水能溶解700体积氨
现象
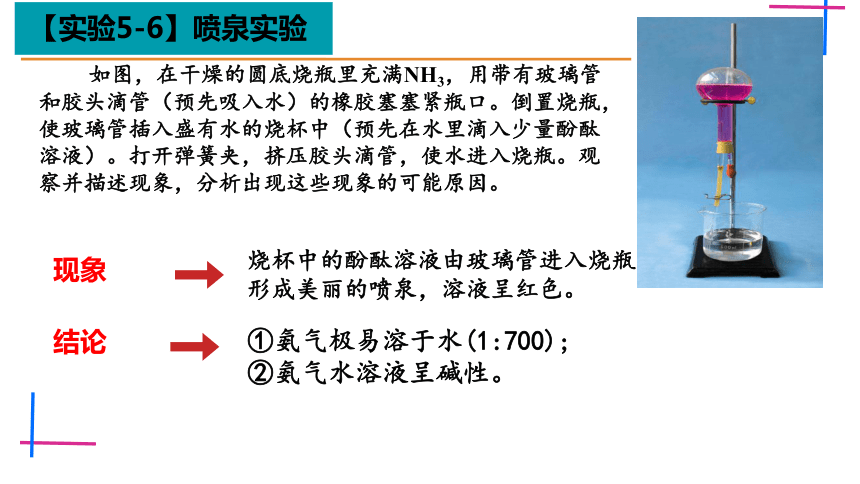
烧杯中的酚酞溶液由玻璃管进入烧瓶,形成美丽的喷泉,溶液呈红色。
如图,在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。观察并描述现象,分析出现这些现象的可能原因。
结论
①氨气极易溶于水(1:700);
②氨气水溶液呈碱性。
【实验5-6】喷泉实验
思考1:将胶头滴管水挤入烧瓶后,能形成喷泉的原因?
实验反思
思考2:某同学做该实验时,打开止水夹后将胶头滴管内的水挤入烧瓶内,并未产生喷泉,试分析他实验失败的可能原因是什么?
实验反思
①装置气密性不好
②收集的NH3纯度较低
③烧瓶不干燥等
实验反思
成功形成喷泉需要产生足够的压强差
①减少烧瓶内的压强
②增大外界的压强
思考3:前面学过的气体CO2和Cl2,在水中溶解度不大, 那么它们能不能与水也设计出喷泉实验呀?如果要成功实现喷泉,需要什么样的试剂?
Cl2或CO2
选择与气体能反应的溶液组合,也可以形成喷泉
实验反思
H2O
NaOH
思考4:下列装置中都收满了NH3,你认为他们能引发喷泉实验吗?如果能,要如何操作?
氨气
水
知识迁移
二.氨的化学性质
思考5:氨溶于水,有没有发生化学反应?
(1)与水反应
一水合氨
弱
碱性
使酚酞溶液变红
使湿润的红色石蕊试纸变蓝
检验氨气
思考6:氨气溶于水所得溶液叫氨水,你认为氨水的成分有哪些?
NH3 、H2O、NH3·H2O
NH4+、OH-、H+(少量)
二.氨的化学性质
对比:液氨和氨水有什么区别?
氨水的性质(多重性)
氨水实验室保存在密封阴暗处
2.呈碱性
1.不稳定性、易挥发
能够与哪些物质反应?
NH3+HCl=NH4Cl (白烟)
NH3+HNO3=NH4NO3 (白烟)
2NH3+H2SO4=(NH4)2SO4
(2)与酸反应
可用于检验氨气
Q:为什么两者不接触就能反应?
Q:如果将浓盐酸换成浓硝酸、浓硫酸呢?
硫酸是难挥发性的酸
演示实验:NH3与HCl反应
Q:氨与强酸反应的本质是什么?
二.氨的化学性质
(3)还原性
认识物质的性质还可以从组成元素的化合价视角,分析NH3分子中N元素的化合价,你认为NH3还可能具有怎样的性质?
NH3
N
-3
被氧化
0或+2等
反应条件不同,产物可能不同
二.氨的化学性质
工业制硝酸
刮刮乐
刮刮乐
刮刮乐
溶于水呈碱性
趣味活动2:快乐刮刮乐----下列事实体现了氨气的哪些性质?
氨气能使湿润红色石蕊试纸变蓝
氨气可与水设计喷泉实验
工业上用氨催化氧化法制硝酸
氨气遇浓硝酸冒白烟
极易溶于水
刮刮乐
能与酸反应
还原性
1
2
3
4
工厂可用蘸有浓氨水的刷子检验氯气管道,通过观察是否
有白烟来判断是否漏气。
你认为这一操作发生了怎样的反应,请写出化学方程式。
学以致用
液氨作制冷剂
设计喷泉实验
氨水成分
白烟 检验氨气
检验氨气泄漏
催化氧化法制硝酸
归纳总结
第二节 氮及其化合物
第2课时 氨
第五章 化学生产中的重要非金属元素
学习目标
1.了解哈伯法合成氨的历史,培养学生良好的道德情操、必备的品质和社会责任感。
2.通过喷泉实验帮助学生认识氨极易溶于水的性质,了解喷泉形成的原理,体会物理压强差在化学中的应用,加强与其他学科融合。
3.观察氨与酸反应的现象,探究反应的本质。
4.从化合价角度认识氨的还原性,联系化工生产,培养学生应用化学知识解决生活实际问题的能力。
导入
一.氨的物理性质
,常温下,1体积水能溶解700体积氨
现象
烧杯中的酚酞溶液由玻璃管进入烧瓶,形成美丽的喷泉,溶液呈红色。
如图,在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。观察并描述现象,分析出现这些现象的可能原因。
结论
①氨气极易溶于水(1:700);
②氨气水溶液呈碱性。
【实验5-6】喷泉实验
思考1:将胶头滴管水挤入烧瓶后,能形成喷泉的原因?
实验反思
思考2:某同学做该实验时,打开止水夹后将胶头滴管内的水挤入烧瓶内,并未产生喷泉,试分析他实验失败的可能原因是什么?
实验反思
①装置气密性不好
②收集的NH3纯度较低
③烧瓶不干燥等
实验反思
成功形成喷泉需要产生足够的压强差
①减少烧瓶内的压强
②增大外界的压强
思考3:前面学过的气体CO2和Cl2,在水中溶解度不大, 那么它们能不能与水也设计出喷泉实验呀?如果要成功实现喷泉,需要什么样的试剂?
Cl2或CO2
选择与气体能反应的溶液组合,也可以形成喷泉
实验反思
H2O
NaOH
思考4:下列装置中都收满了NH3,你认为他们能引发喷泉实验吗?如果能,要如何操作?
氨气
水
知识迁移
二.氨的化学性质
思考5:氨溶于水,有没有发生化学反应?
(1)与水反应
一水合氨
弱
碱性
使酚酞溶液变红
使湿润的红色石蕊试纸变蓝
检验氨气
思考6:氨气溶于水所得溶液叫氨水,你认为氨水的成分有哪些?
NH3 、H2O、NH3·H2O
NH4+、OH-、H+(少量)
二.氨的化学性质
对比:液氨和氨水有什么区别?
氨水的性质(多重性)
氨水实验室保存在密封阴暗处
2.呈碱性
1.不稳定性、易挥发
能够与哪些物质反应?
NH3+HCl=NH4Cl (白烟)
NH3+HNO3=NH4NO3 (白烟)
2NH3+H2SO4=(NH4)2SO4
(2)与酸反应
可用于检验氨气
Q:为什么两者不接触就能反应?
Q:如果将浓盐酸换成浓硝酸、浓硫酸呢?
硫酸是难挥发性的酸
演示实验:NH3与HCl反应
Q:氨与强酸反应的本质是什么?
二.氨的化学性质
(3)还原性
认识物质的性质还可以从组成元素的化合价视角,分析NH3分子中N元素的化合价,你认为NH3还可能具有怎样的性质?
NH3
N
-3
被氧化
0或+2等
反应条件不同,产物可能不同
二.氨的化学性质
工业制硝酸
刮刮乐
刮刮乐
刮刮乐
溶于水呈碱性
趣味活动2:快乐刮刮乐----下列事实体现了氨气的哪些性质?
氨气能使湿润红色石蕊试纸变蓝
氨气可与水设计喷泉实验
工业上用氨催化氧化法制硝酸
氨气遇浓硝酸冒白烟
极易溶于水
刮刮乐
能与酸反应
还原性
1
2
3
4
工厂可用蘸有浓氨水的刷子检验氯气管道,通过观察是否
有白烟来判断是否漏气。
你认为这一操作发生了怎样的反应,请写出化学方程式。
学以致用
液氨作制冷剂
设计喷泉实验
氨水成分
白烟 检验氨气
检验氨气泄漏
催化氧化法制硝酸
归纳总结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
