4.1原电池——化学电源课件(共19张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1原电池——化学电源课件(共19张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 07:41:32 | ||
图片预览


文档简介
(共19张PPT)
第四章
化学反应与电能
第一节 原电池
课题2 化学电源一
1. 了解常见电池的种类及特点。
2. 了解常见一次电池的工作原理,能分析书写电池的电极反应式。
3. 了解常见二次电池的工作原理,能分析书写电池的电极反应式。
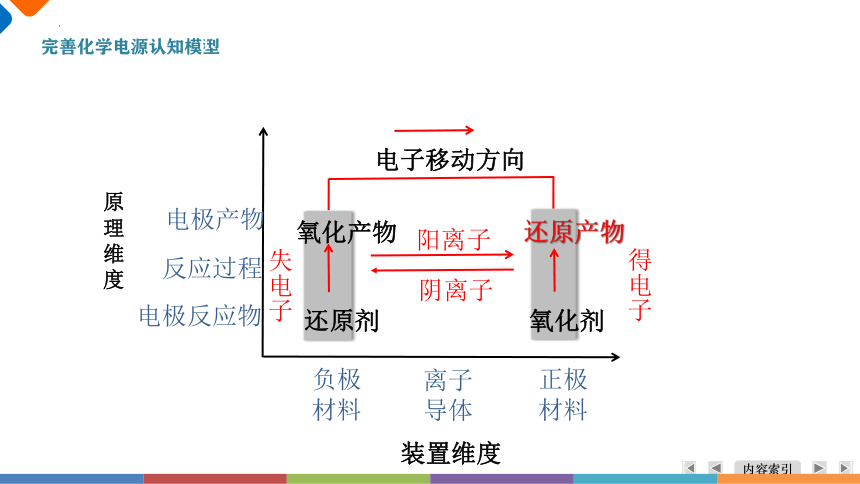
装置维度
原
理
维
度
负极
材料
正极
材料
离子
导体
电极反应物
反应过程
电极产物
还原剂
氧化剂
氧化产物
还原产物
失电子
得电子
电子移动方向
阳离子
阴离子
完善化学电源认知模型
回溯历史
模型建构
实践应用
总结提升
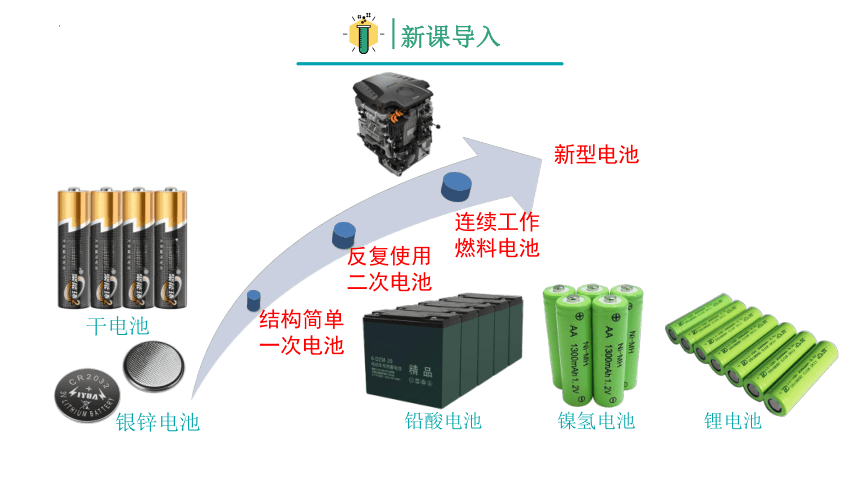
结构简单
一次电池
反复使用
二次电池
连续工作
燃料电池
新型电池
铅酸电池
干电池
银锌电池
镍氢电池
锂电池
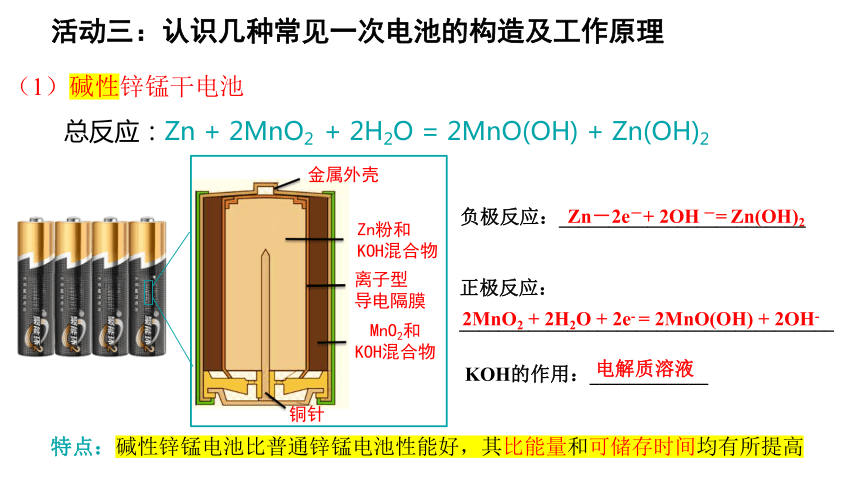
(1)碱性锌锰干电池
Zn-2e-+ 2OH -= Zn(OH)2
电解质溶液
2MnO2 + 2H2O + 2e- = 2MnO(OH) + 2OH-
总反应:Zn + 2MnO2 + 2H2O = 2MnO(OH) + Zn(OH)2
特点:碱性锌锰电池比普通锌锰电池性能好,其比能量和可储存时间均有所提高
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
MnO2和
KOH混合物
负极反应:_________________________
正极反应:
______________________________________
KOH的作用:____________
活动三:认识几种常见一次电池的构造及工作原理
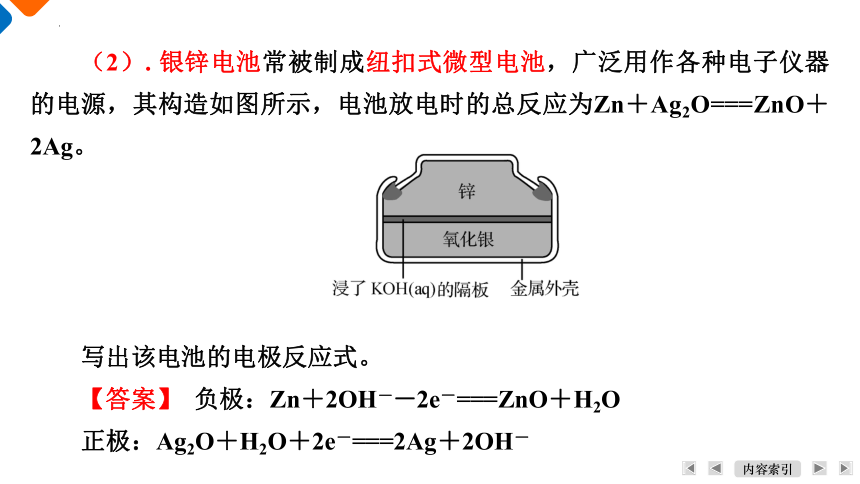
(2). 银锌电池常被制成纽扣式微型电池,广泛用作各种电子仪器的电源,其构造如图所示,电池放电时的总反应为Zn+Ag2O===ZnO+2Ag。
写出该电池的电极反应式。
【答案】 负极:Zn+2OH――2e-===ZnO+H2O
正极:Ag2O+H2O+2e-===2Ag+2OH-
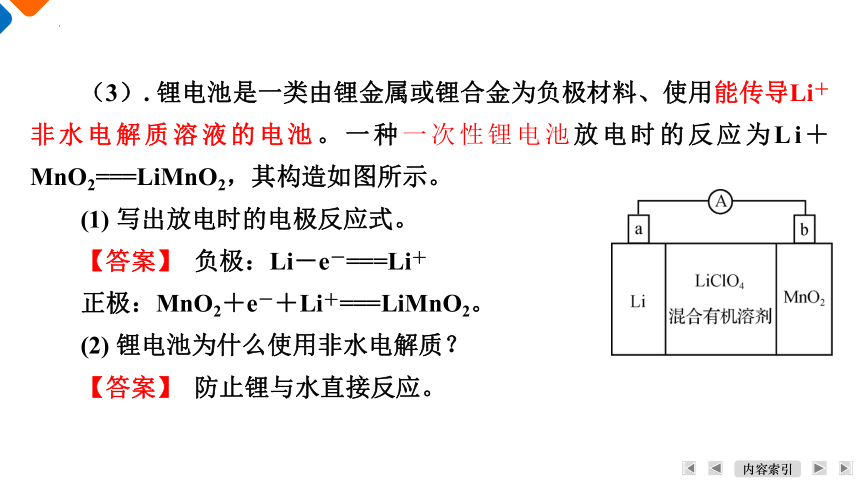
(3). 锂电池是一类由锂金属或锂合金为负极材料、使用能传导Li+非水电解质溶液的电池。一种一次性锂电池放电时的反应为Li+MnO2===LiMnO2,其构造如图所示。
(1) 写出放电时的电极反应式。
【答案】 负极:Li―e-===Li+
正极:MnO2+e-+Li+===LiMnO2。
(2) 锂电池为什么使用非水电解质?
【答案】 防止锂与水直接反应。
(3) 参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。从比能量的角度分析锂电池有什么优点?
【答案】 锂的摩尔质量小,单位质量的锂失电子数多,所以比能量大。由于一般的电池所含物质的质量一定,所以相同质量的锂可以产生更多的电能。
1. 铅蓄电池由两组栅状极板交替排列而成,正极板上覆盖有PbO2,负极板上覆盖有Pb,稀硫酸作电解液。其结构示意图如图所示。铅蓄电池是典型的可充型电池,它的电池总反应式为
活动三:认识几种常见二次电池的构造及工作原理
(1) 写出放电时的电极反应式。
(2) 已知充电时发生氧化反应的一极为阳极,发生还原反应的一极为阴极。写出充电时的电极反应式。
阳极:_______________________________________。
阴极:________________________________。
2. 锂离子电池是一种二次电池(手机),它主要依靠锂离子在正极和负极之间移动来工作。最早的锂离子是把锂离子嵌入炭中形成负极,正极材料用LiCoO2,电解液是溶有LiPF6的有机溶剂。该锂离子电池放电时的反应式为Li1-xCoO2+LixC===LiCoO2+C,其构造示意图如右图所示。
(1) 写出放电时的电极反应式。
负极:_________________________________。
正极:__________________________________。
(2) 写出充电时的电极反应式。
阳极:_______________________________________。
阴极:____________________________。
LixC-xe-===C+xLi+
Li1-xCoO2+xe-+xLi+===LiCoO2
LiCoO2-xe-===Li1-xCoO2+xLi+
C+xLi++xe-===LixC
2
4
5
1
3
6
1. 镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2===Mg2++2H2O。下列关于该电池的说法正确的是( )
A. 镁合金为电源负极,发生氧化反应
B. 放电时H+在正极反应得电子
C. 正极反应式为H2O2+2e-===2OH-
D. 放电时正极的pH降低
【答案】 A
2
4
5
1
3
6
A. Cd(OH)2 B. Ni(OH)2
C. Cd D. NiO(OH)
【答案】 C
2
4
5
3
6
3. 铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如右图所示。下列说法错误的是( )
A. 该装置可实现化学能向电能的转化
B. Al是负极
C. 电池工作时Ag2O得到电子
D. NaOH没有参加电池反应
1
【答案】 D
2
4
5
3
6
4. 被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边喷涂二氧化锰。在纸内的OH-“流过”水和氧化锌组成的电解液。电池总反应: Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法正确的是 ( )
A. 该电池的负极为锌,发生还原反应
B. 该电池反应中二氧化锰起催化剂作用
C. 当 0.1 mol Zn 完全溶解时,转移电子个数为 1.204×1023
D. 电池正极反应式:2MnO2+2e-+2H+===2MnOOH
1
【答案】 C
2
4
5
3
6
1
2
4
5
3
6
(1) 两次操作中电流表指针为什么会发生偏转,且方向相反?
________________________________________________________________________________________________________________________。
(2) 第一次操作中,C1棒上的反应为__________________。
(3) 第二次操作中,C2棒上的反应为__________________________ _____。
1
两次操作中均发生原电池反应,所以电流表指针均发生偏转;两次操作中,电极相反,电子流向相反,因而电流表指针偏转方向相反
2I--2e-===I2
+H2O
2
4
5
3
6
6. 高铁酸盐在能源、环保等方面有着广泛的用途。图1是高铁电池的模拟实验装置。
1
2
4
5
3
6
(1) 该电池放电时正极的电极反应式为_________________________ ____________________________。
(2) 盐桥中盛有饱和KCl溶液,此盐桥中氯离子向 ______ (填“左”或“右”)移动。
(3) 图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有哪些?
【答案】 使用时间长、工作电压稳定。
1
右
第四章
化学反应与电能
第一节 原电池
课题2 化学电源一
1. 了解常见电池的种类及特点。
2. 了解常见一次电池的工作原理,能分析书写电池的电极反应式。
3. 了解常见二次电池的工作原理,能分析书写电池的电极反应式。
装置维度
原
理
维
度
负极
材料
正极
材料
离子
导体
电极反应物
反应过程
电极产物
还原剂
氧化剂
氧化产物
还原产物
失电子
得电子
电子移动方向
阳离子
阴离子
完善化学电源认知模型
回溯历史
模型建构
实践应用
总结提升
结构简单
一次电池
反复使用
二次电池
连续工作
燃料电池
新型电池
铅酸电池
干电池
银锌电池
镍氢电池
锂电池
(1)碱性锌锰干电池
Zn-2e-+ 2OH -= Zn(OH)2
电解质溶液
2MnO2 + 2H2O + 2e- = 2MnO(OH) + 2OH-
总反应:Zn + 2MnO2 + 2H2O = 2MnO(OH) + Zn(OH)2
特点:碱性锌锰电池比普通锌锰电池性能好,其比能量和可储存时间均有所提高
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
MnO2和
KOH混合物
负极反应:_________________________
正极反应:
______________________________________
KOH的作用:____________
活动三:认识几种常见一次电池的构造及工作原理
(2). 银锌电池常被制成纽扣式微型电池,广泛用作各种电子仪器的电源,其构造如图所示,电池放电时的总反应为Zn+Ag2O===ZnO+2Ag。
写出该电池的电极反应式。
【答案】 负极:Zn+2OH――2e-===ZnO+H2O
正极:Ag2O+H2O+2e-===2Ag+2OH-
(3). 锂电池是一类由锂金属或锂合金为负极材料、使用能传导Li+非水电解质溶液的电池。一种一次性锂电池放电时的反应为Li+MnO2===LiMnO2,其构造如图所示。
(1) 写出放电时的电极反应式。
【答案】 负极:Li―e-===Li+
正极:MnO2+e-+Li+===LiMnO2。
(2) 锂电池为什么使用非水电解质?
【答案】 防止锂与水直接反应。
(3) 参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。从比能量的角度分析锂电池有什么优点?
【答案】 锂的摩尔质量小,单位质量的锂失电子数多,所以比能量大。由于一般的电池所含物质的质量一定,所以相同质量的锂可以产生更多的电能。
1. 铅蓄电池由两组栅状极板交替排列而成,正极板上覆盖有PbO2,负极板上覆盖有Pb,稀硫酸作电解液。其结构示意图如图所示。铅蓄电池是典型的可充型电池,它的电池总反应式为
活动三:认识几种常见二次电池的构造及工作原理
(1) 写出放电时的电极反应式。
(2) 已知充电时发生氧化反应的一极为阳极,发生还原反应的一极为阴极。写出充电时的电极反应式。
阳极:_______________________________________。
阴极:________________________________。
2. 锂离子电池是一种二次电池(手机),它主要依靠锂离子在正极和负极之间移动来工作。最早的锂离子是把锂离子嵌入炭中形成负极,正极材料用LiCoO2,电解液是溶有LiPF6的有机溶剂。该锂离子电池放电时的反应式为Li1-xCoO2+LixC===LiCoO2+C,其构造示意图如右图所示。
(1) 写出放电时的电极反应式。
负极:_________________________________。
正极:__________________________________。
(2) 写出充电时的电极反应式。
阳极:_______________________________________。
阴极:____________________________。
LixC-xe-===C+xLi+
Li1-xCoO2+xe-+xLi+===LiCoO2
LiCoO2-xe-===Li1-xCoO2+xLi+
C+xLi++xe-===LixC
2
4
5
1
3
6
1. 镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2===Mg2++2H2O。下列关于该电池的说法正确的是( )
A. 镁合金为电源负极,发生氧化反应
B. 放电时H+在正极反应得电子
C. 正极反应式为H2O2+2e-===2OH-
D. 放电时正极的pH降低
【答案】 A
2
4
5
1
3
6
A. Cd(OH)2 B. Ni(OH)2
C. Cd D. NiO(OH)
【答案】 C
2
4
5
3
6
3. 铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如右图所示。下列说法错误的是( )
A. 该装置可实现化学能向电能的转化
B. Al是负极
C. 电池工作时Ag2O得到电子
D. NaOH没有参加电池反应
1
【答案】 D
2
4
5
3
6
4. 被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边喷涂二氧化锰。在纸内的OH-“流过”水和氧化锌组成的电解液。电池总反应: Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法正确的是 ( )
A. 该电池的负极为锌,发生还原反应
B. 该电池反应中二氧化锰起催化剂作用
C. 当 0.1 mol Zn 完全溶解时,转移电子个数为 1.204×1023
D. 电池正极反应式:2MnO2+2e-+2H+===2MnOOH
1
【答案】 C
2
4
5
3
6
1
2
4
5
3
6
(1) 两次操作中电流表指针为什么会发生偏转,且方向相反?
________________________________________________________________________________________________________________________。
(2) 第一次操作中,C1棒上的反应为__________________。
(3) 第二次操作中,C2棒上的反应为__________________________ _____。
1
两次操作中均发生原电池反应,所以电流表指针均发生偏转;两次操作中,电极相反,电子流向相反,因而电流表指针偏转方向相反
2I--2e-===I2
+H2O
2
4
5
3
6
6. 高铁酸盐在能源、环保等方面有着广泛的用途。图1是高铁电池的模拟实验装置。
1
2
4
5
3
6
(1) 该电池放电时正极的电极反应式为_________________________ ____________________________。
(2) 盐桥中盛有饱和KCl溶液,此盐桥中氯离子向 ______ (填“左”或“右”)移动。
(3) 图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有哪些?
【答案】 使用时间长、工作电压稳定。
1
右
