2024届高三化学三轮复习-基于“能量观”的化学观念建构(共22张ppt)
文档属性
| 名称 | 2024届高三化学三轮复习-基于“能量观”的化学观念建构(共22张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 10:11:47 | ||
图片预览






文档简介
(共22张PPT)
高三基于“能量观”的化学观念建构
[目标]
1.以硼族化合物为载体,培养学生的批判思维和创新能力。
2.以电性作用、配位思想建构以“能量观”为核心的底层思维逻辑,提升陌生情境下的知识重组、迁移运用能力,达成学生以思考力解决问题的模式。
“提出一个问题往往比解决一个问题更重要”,提出新的问题,需要创造性的想象力。
创新力
发现问题
质疑和批判
知识关联的结构化
创新精神
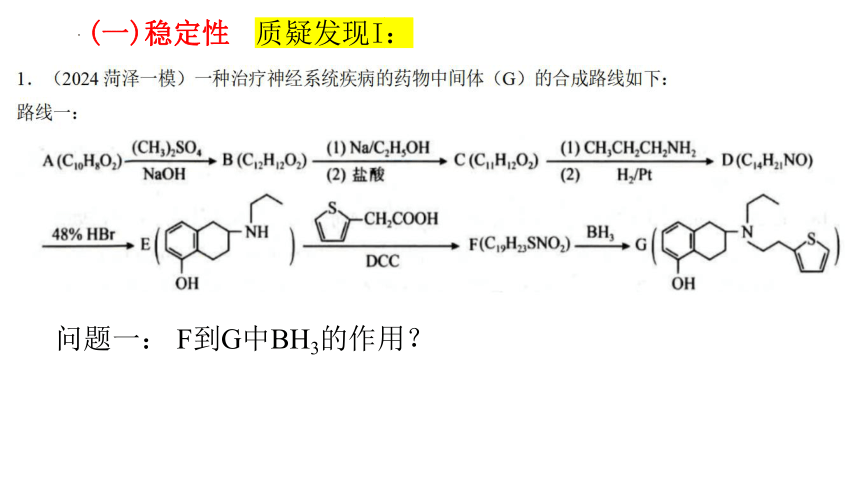
问题一: F到G中BH3的作用?
质疑发现I:
(一)稳定性
(1-1)BH3不存在的原因?
质疑发现:
(1-2)BF3存在的原因?
缺电子
形成大π键,原子轨道重叠程度大,降低了体系能量(离域能),增强体系的稳定性。
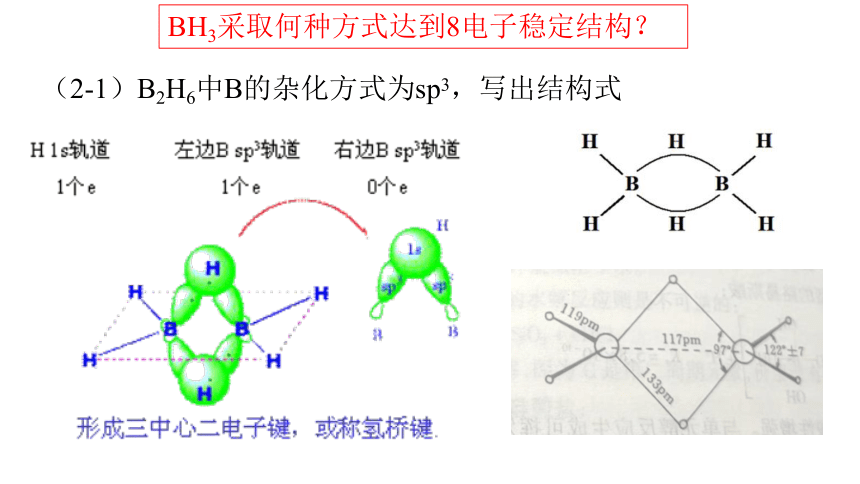
(2-1)B2H6中B的杂化方式为sp3,写出结构式
BH3采取何种方式达到8电子稳定结构?
总结:缺电子物质如何达到8电子稳定结构
(1)离域π键
(2)配位键
(3)特殊共价键
反思:如何解释价层电子数超过8个电子的物质稳定性(PCl5、SF6、IF7、XeF8)
d轨道参与成键;路易斯8电子理论缺陷、
价键理论、杂化轨道、价层电子互斥理论
BF3·4NH3
(3-3)写出格氏试剂CH3MgBr与BCl3发生反应方程式:
3CH3MgBr+BCl3=B(CH3)3+3MgBrCl
(3-2)写出B2Cl4与足量C2H5OH发生醇解反应
B2Cl4+4C2H5OH=B2(OC2H5)4+4HCl
(3-1)写出乙硼烷(B2H6)水解反应方程式
电性作用(异性相吸)
问题二:写出下列硼化物反应的方程式,思考反应的本质
(3-4)4BF3+6H2O=H3BO3+3H3O++3BF4-,H[BF4]是一元___酸,分析阴离子如何生成?
[BX4-]不存在的原因是?
X-空间位阻大
BF3+HF=H[BF4]
(3-5)CF3I水解反应方程式:________________________
CF3H溶于水的原因是________________________
CF3I+H2O=CF3H+HIO
三个氟原子增强了碳的电负性
与水形成分子间氢键C┄H-O
强
氟原子与水形成分子间氢键O-H┄F
C-H┄F
1.(2020山东,7) B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是
A. 其熔点主要取决于所含化学键的键能
B. 形成大π键的电子全部由N提供
C. 分子中B和N的杂化方式相同
D. 分子中所有原子共平面
A
提醒:电负性N>B
拓展:写出无机苯与盐酸反应化学方程式
问题三:硼氢化反应中BH3出现的原因?
(CH3 CH2CH2)3B
THF
H2O2,OH-,H2O
3 CH3 CH2CH2OH
烷基硼
3CH3CH=CH2 + BH3
RCOOH
CH3 CH2CH3
硼氢化反应,重要的有机合成反应之一。乙硼烷在醚类溶液中离解成的甲硼烷以B—H键与烯烃、炔烃的不饱和键加成,生成有机硼化合物的反应。其特点是:(1)反应过程不发生重排;(2)反应为顺式加成;(3)与不对称烯烃加成时,符合反马尔可夫尼可夫规则。
+
-
问题四:(2024山东)硼酸在水中存在平衡:
4-1.亚砷酸(H3AsO3)可以写成As(OH)3,常温下,Ka1=10-9.3,Ka2=10-12.1,Ka3=10-13.5,亚砷酸第三步电离方程式为:
问题四:(2024山东)硼酸在水中存在平衡:
4-2.(2023上海改编)写出Al3+第一步水解的离子方程式:
4-3.请写出[Fe(H2O)6]3+第一步水解离子方程式:
[Fe(H2O)6]3++H2O
[FeOH(H2O)5]2++H3O+
水分子中氧原子的孤对电子与金属离子形成配位键,削弱了水分子中的O-H键,因而氧氢键易断裂,配体变为OH-,释放出H+
4-4.(2023湖北,16)导致SiCl4比CCl4易水解的因素有_______(填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
abd
Si有空的3d轨道,可形成sp3d
杂化而接受水中氧原子的电
子对配位
(4-5)H3BO3热分解产物与水反应又生成硼酸,
反思1:硅酸热分解产物不与水反应的原因
B2O3+3H2O=H3BO3
(4-6)分析硼酸在水(冷水、热水)中的溶解性
反思:硼酸可作润滑剂的原因?
(5-1)立方烷(C8H8)中C的杂化方式为sp3,∠CCC=____,该结构稳定性____
90°
弱
偏离理想键角过大,物质不稳定。
(5-2)甲烷和白磷均为正四面体sp3杂化,白磷为什么活泼?
键角60°,键角小于理想键角,成键电子对排斥力大(张力大),不稳定
问题五:键角与稳定性关系
(5-3)
sp3d2杂化轨道可能产生的分子的空间结构
A—
中心原子
B—
配位原子
E—
孤电子对
(5-3)sp3d杂化可能的分子空间构型
(1)AX5无孤对电子,分子构型为__________;
(2)AX4含1对孤对电子,分子构型为___________,孤对电子所处位置 ;
(3)AX3含2对孤对电子,分子构型为___________,孤对电子所处位置 ;
(4)AX3含3对孤对电子,分子构型为___________,孤对电子所处位置 。
解疑合探
(5-3)sp3d杂化可能的分子空间构型
A—
中心原子
B—
配位原子
绿色—
孤电子对
多维视角下”能量观“解决问题途径分析
用途
性质
结构
能量
稳定
宏微结合
电性作用
平衡
(一切反应都是平衡移动的结果)
进
步
习
学
高三基于“能量观”的化学观念建构
[目标]
1.以硼族化合物为载体,培养学生的批判思维和创新能力。
2.以电性作用、配位思想建构以“能量观”为核心的底层思维逻辑,提升陌生情境下的知识重组、迁移运用能力,达成学生以思考力解决问题的模式。
“提出一个问题往往比解决一个问题更重要”,提出新的问题,需要创造性的想象力。
创新力
发现问题
质疑和批判
知识关联的结构化
创新精神
问题一: F到G中BH3的作用?
质疑发现I:
(一)稳定性
(1-1)BH3不存在的原因?
质疑发现:
(1-2)BF3存在的原因?
缺电子
形成大π键,原子轨道重叠程度大,降低了体系能量(离域能),增强体系的稳定性。
(2-1)B2H6中B的杂化方式为sp3,写出结构式
BH3采取何种方式达到8电子稳定结构?
总结:缺电子物质如何达到8电子稳定结构
(1)离域π键
(2)配位键
(3)特殊共价键
反思:如何解释价层电子数超过8个电子的物质稳定性(PCl5、SF6、IF7、XeF8)
d轨道参与成键;路易斯8电子理论缺陷、
价键理论、杂化轨道、价层电子互斥理论
BF3·4NH3
(3-3)写出格氏试剂CH3MgBr与BCl3发生反应方程式:
3CH3MgBr+BCl3=B(CH3)3+3MgBrCl
(3-2)写出B2Cl4与足量C2H5OH发生醇解反应
B2Cl4+4C2H5OH=B2(OC2H5)4+4HCl
(3-1)写出乙硼烷(B2H6)水解反应方程式
电性作用(异性相吸)
问题二:写出下列硼化物反应的方程式,思考反应的本质
(3-4)4BF3+6H2O=H3BO3+3H3O++3BF4-,H[BF4]是一元___酸,分析阴离子如何生成?
[BX4-]不存在的原因是?
X-空间位阻大
BF3+HF=H[BF4]
(3-5)CF3I水解反应方程式:________________________
CF3H溶于水的原因是________________________
CF3I+H2O=CF3H+HIO
三个氟原子增强了碳的电负性
与水形成分子间氢键C┄H-O
强
氟原子与水形成分子间氢键O-H┄F
C-H┄F
1.(2020山东,7) B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是
A. 其熔点主要取决于所含化学键的键能
B. 形成大π键的电子全部由N提供
C. 分子中B和N的杂化方式相同
D. 分子中所有原子共平面
A
提醒:电负性N>B
拓展:写出无机苯与盐酸反应化学方程式
问题三:硼氢化反应中BH3出现的原因?
(CH3 CH2CH2)3B
THF
H2O2,OH-,H2O
3 CH3 CH2CH2OH
烷基硼
3CH3CH=CH2 + BH3
RCOOH
CH3 CH2CH3
硼氢化反应,重要的有机合成反应之一。乙硼烷在醚类溶液中离解成的甲硼烷以B—H键与烯烃、炔烃的不饱和键加成,生成有机硼化合物的反应。其特点是:(1)反应过程不发生重排;(2)反应为顺式加成;(3)与不对称烯烃加成时,符合反马尔可夫尼可夫规则。
+
-
问题四:(2024山东)硼酸在水中存在平衡:
4-1.亚砷酸(H3AsO3)可以写成As(OH)3,常温下,Ka1=10-9.3,Ka2=10-12.1,Ka3=10-13.5,亚砷酸第三步电离方程式为:
问题四:(2024山东)硼酸在水中存在平衡:
4-2.(2023上海改编)写出Al3+第一步水解的离子方程式:
4-3.请写出[Fe(H2O)6]3+第一步水解离子方程式:
[Fe(H2O)6]3++H2O
[FeOH(H2O)5]2++H3O+
水分子中氧原子的孤对电子与金属离子形成配位键,削弱了水分子中的O-H键,因而氧氢键易断裂,配体变为OH-,释放出H+
4-4.(2023湖北,16)导致SiCl4比CCl4易水解的因素有_______(填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
abd
Si有空的3d轨道,可形成sp3d
杂化而接受水中氧原子的电
子对配位
(4-5)H3BO3热分解产物与水反应又生成硼酸,
反思1:硅酸热分解产物不与水反应的原因
B2O3+3H2O=H3BO3
(4-6)分析硼酸在水(冷水、热水)中的溶解性
反思:硼酸可作润滑剂的原因?
(5-1)立方烷(C8H8)中C的杂化方式为sp3,∠CCC=____,该结构稳定性____
90°
弱
偏离理想键角过大,物质不稳定。
(5-2)甲烷和白磷均为正四面体sp3杂化,白磷为什么活泼?
键角60°,键角小于理想键角,成键电子对排斥力大(张力大),不稳定
问题五:键角与稳定性关系
(5-3)
sp3d2杂化轨道可能产生的分子的空间结构
A—
中心原子
B—
配位原子
E—
孤电子对
(5-3)sp3d杂化可能的分子空间构型
(1)AX5无孤对电子,分子构型为__________;
(2)AX4含1对孤对电子,分子构型为___________,孤对电子所处位置 ;
(3)AX3含2对孤对电子,分子构型为___________,孤对电子所处位置 ;
(4)AX3含3对孤对电子,分子构型为___________,孤对电子所处位置 。
解疑合探
(5-3)sp3d杂化可能的分子空间构型
A—
中心原子
B—
配位原子
绿色—
孤电子对
多维视角下”能量观“解决问题途径分析
用途
性质
结构
能量
稳定
宏微结合
电性作用
平衡
(一切反应都是平衡移动的结果)
进
步
习
学
同课章节目录
