原子结构与元素的性质(教学设计)
文档属性
| 名称 | 原子结构与元素的性质(教学设计) |  | |
| 格式 | doc | ||
| 文件大小 | 825.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 10:40:04 | ||
图片预览

文档简介
第四章 第一节第3课时《原子结构与元素的性质》 教学设计
一、课程内容:人教版 《化学必修 第一册》
第四章第一节 《原子结构与元素周期表》
第3课时 《原子结构与元素的性质》
二、教学目标:
1. 以碱金属、卤族元素为例,基于元素在周期表中的位置和原子结构预测同主族元素的化学性质,运用实验及事实证据进行验证,总结同主族元素化学性质的相似性和递变性,并能用原子结构理论加以解释;
2. 渗透预测等科学研究方法和比较、归纳等信息加工的方法,培养分析、处理数据的能力;
3. 强化并运用“周期表位置(位)—原子结构(构)—元素性质(性)”的系统认知模型,发展“证据推理和模型认知”及“宏观辨识与微观探析”的学科核心素养。
三、教学重难点:
教学重点:碱金属、卤族元素性质的预测和验证;同主族元素性质的相似性和递变性规律;周期表位
置、原子结构与元素性质的关系;
教学难点:运用“位置—结构—性质”模型分析和解决同主族元素的问题。
四、教学过程
教学环节 教师活动 学生活动 设计意图
情境导入 1.师:播放 “嫦娥5号探月”之旅视频;2.师:了解月球土壤中有哪些元素,我们在周期表中可以知道它们的哪些信息?3.师:元素在周期表中的位置反应了它的原子结构,结构决定性质,那周期表中元素性质又有怎样的规律呢?今天,让我们通过碱金属元素、卤族元素的学习一起探究。 1.认真观看视频;2.思考并查找周期表中,知道它们的位置、相对原子质量等信息; 1激发民族自豪感;2.知道通过元素周期表了解元素的有关信息。
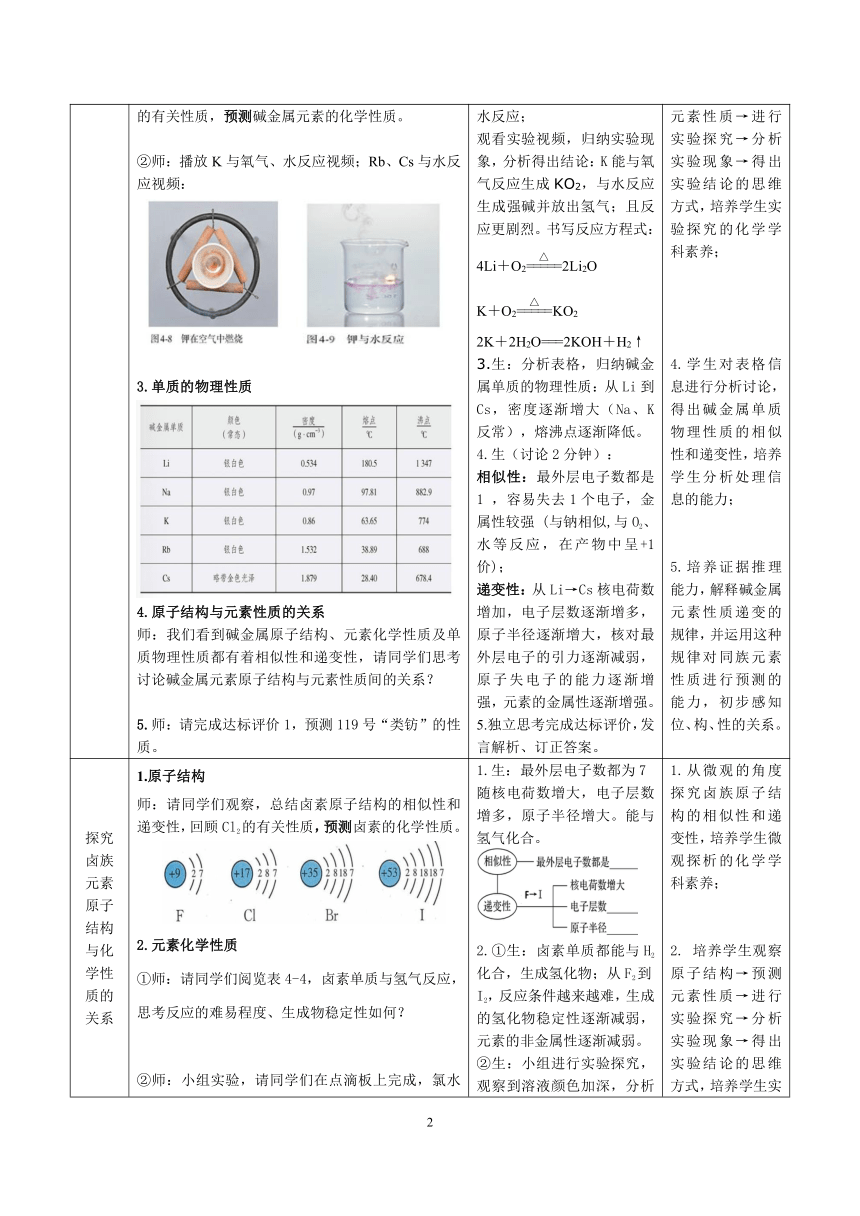
探究碱金属元素原子结构与化学性质的关系 原子结构师:请同学们填写P93表格,总结碱金属原子结构的相似性和递变性。元素化学性质①师:请同学们通过观察碱金属原子结构,回顾钠的有关性质,预测碱金属元素的化学性质。②师:播放K与氧气、水反应视频;Rb、Cs与水反应视频: ( 碱金属化学性质的比较.flv ) ( Ru和Cs与水反应.flv )3.单质的物理性质4.原子结构与元素性质的关系师:我们看到碱金属原子结构、元素化学性质及单质物理性质都有着相似性和递变性,请同学们思考讨论碱金属元素原子结构与元素性质间的关系?5.师:请完成达标评价1,预测119号“类钫”的性质。 1.填写课本P93思考与讨论表格,总结原子结构与元素性质的相似性和递变性,并发言。生:相似性:最外层电子数都为1递变性:随核电荷数增大,电子层数增多,原子半径增大。2.生:碱金属性质可能与钠相似有强金属性,能与氧气、水反应;观看实验视频,归纳实验现象,分析得出结论:K能与氧气反应生成KO2,与水反应生成强碱并放出氢气;且反应更剧烈。书写反应方程式:4Li+O22Li2OK+O2KO22K+2H2O===2KOH+H2↑3.生:分析表格,归纳碱金属单质的物理性质:从Li到Cs,密度逐渐增大(Na、K反常),熔沸点逐渐降低。4.生(讨论2分钟):相似性:最外层电子数都是1 ,容易失去1个电子,金属性较强 (与钠相似,与O2、水等反应,在产物中呈+1价);递变性:从Li→Cs核电荷数增加,电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的引力逐渐减弱,原子失电子的能力逐渐增强,元素的金属性逐渐增强。5.独立思考完成达标评价,发言解析、订正答案。 1.从微观的角度探究碱金属原子结构的相似性和递变性,培养学生微观探析的化学学科素养;2.学生填写表格信息,进行数据分析讨论,得出原子结构的相似性和递变性,培养学生分析处理数据的能力;3.培养学生观察原子结构→预测元素性质→进行实验探究→分析实验现象→得出实验结论的思维方式,培养学生实验探究的化学学科素养;4.学生对表格信息进行分析讨论,得出碱金属单质物理性质的相似性和递变性,培养学生分析处理信息的能力;5.培养证据推理能力,解释碱金属元素性质递变的规律,并运用这种规律对同族元素性质进行预测的能力,初步感知位、构、性的关系。
探究卤族元素原子结构与化学性质的关系 1.原子结构师:请同学们观察,总结卤素原子结构的相似性和递变性,回顾Cl2的有关性质,预测卤素的化学性质。2.元素化学性质①师:请同学们阅览表4-4,卤素单质与氢气反应,思考反应的难易程度、生成物稳定性如何?②师:小组实验,请同学们在点滴板上完成,氯水与NaBr、KI溶液的置换反应,溴水与KI溶液的置换反应。③师:若实验药品只有NaBr溶液、KI溶液、新制氯水,你能完成实验,并得到相同的实验结论吗?氯水的用量当如何?3.单质的物理性质4.原子结构与元素性质的关系师:我们看到碱金属原子结构、元素化学性质及单质物理性质都有着相似性和递变性,请同学们思考讨论卤素原子结构与元素性质间的关系?5.师:请完成达标评价2,预测At的性质。 1.生:最外层电子数都为7随核电荷数增大,电子层数增多,原子半径增大。能与氢气化合。2.①生:卤素单质都能与H2化合,生成氢化物;从F2到I2,反应条件越来越难,生成的氢化物稳定性逐渐减弱,元素的非金属性逐渐减弱。②生:小组进行实验探究,观察到溶液颜色加深,分析得出结论,写出反应方程式。2NaBr+Cl2=Br2+2NaCl2KI+Cl2=I2+2KCl2KI+Br2=I2+2KBr氧化性:Cl2>Br2>I2③生:设计实验方案→预测实验现象→进行实验验证。NaBr溶液溶液中滴加少量氯水,溶液颜色加深;继续滴入KI溶液,颜色进一步加深。氧化性:Cl2>Br2>I23.生:分析数据,归纳卤素单质的物理性质:都有颜色,密度小,熔沸点低。颜色加深,熔沸点逐渐增大,密度逐渐增大,水溶性逐渐减小。4.生(讨论2分钟):相似性:最外层电子数都是7 ,容易得到1个电子,非金属性较强;递变性:从F→I,核电荷数增加,电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的引力逐渐减弱,原子得电子能力逐渐减弱,元素的非金属性逐渐减弱。5.独立思考完成达标评价,发言解析、订正答案。 1.从微观的角度探究卤族原子结构的相似性和递变性,培养学生微观探析的化学学科素养;2. 培养学生观察原子结构→预测元素性质→进行实验探究→分析实验现象→得出实验结论的思维方式,培养学生实验探究的化学学科素养;3.培养学生设计实验、进行实验的能力;4.学生对表格信息进行分析讨论,得出卤素单质物理性质的相似性和递变性,培养学生分析处理信息的能力;5.培养证据推理能力,解释卤族元素性质递变的规律,并运用这种规律对同族元素性质进行预测的能力,深入认知位、构、性的关系。
课堂小结 在元素周期表中,同主族元素从上到下原子核外电子层数依次 增多 ,原子半径逐渐 增大 ,失电子能力逐渐 增强 ,得电子能力逐渐 减弱 。所以,金属性逐渐 增强 ,非金属性逐渐 减弱 。
五、板书设计
一、碱金属元素 二、卤族元素 三、位、构、性的关系
降低
Li
Na
K
Rb
Cs
失电子能力增强
金属性增强
F
Cl
Br
I
非金属性减弱
得电子能力减弱
2
一、课程内容:人教版 《化学必修 第一册》
第四章第一节 《原子结构与元素周期表》
第3课时 《原子结构与元素的性质》
二、教学目标:
1. 以碱金属、卤族元素为例,基于元素在周期表中的位置和原子结构预测同主族元素的化学性质,运用实验及事实证据进行验证,总结同主族元素化学性质的相似性和递变性,并能用原子结构理论加以解释;
2. 渗透预测等科学研究方法和比较、归纳等信息加工的方法,培养分析、处理数据的能力;
3. 强化并运用“周期表位置(位)—原子结构(构)—元素性质(性)”的系统认知模型,发展“证据推理和模型认知”及“宏观辨识与微观探析”的学科核心素养。
三、教学重难点:
教学重点:碱金属、卤族元素性质的预测和验证;同主族元素性质的相似性和递变性规律;周期表位
置、原子结构与元素性质的关系;
教学难点:运用“位置—结构—性质”模型分析和解决同主族元素的问题。
四、教学过程
教学环节 教师活动 学生活动 设计意图
情境导入 1.师:播放 “嫦娥5号探月”之旅视频;2.师:了解月球土壤中有哪些元素,我们在周期表中可以知道它们的哪些信息?3.师:元素在周期表中的位置反应了它的原子结构,结构决定性质,那周期表中元素性质又有怎样的规律呢?今天,让我们通过碱金属元素、卤族元素的学习一起探究。 1.认真观看视频;2.思考并查找周期表中,知道它们的位置、相对原子质量等信息; 1激发民族自豪感;2.知道通过元素周期表了解元素的有关信息。
探究碱金属元素原子结构与化学性质的关系 原子结构师:请同学们填写P93表格,总结碱金属原子结构的相似性和递变性。元素化学性质①师:请同学们通过观察碱金属原子结构,回顾钠的有关性质,预测碱金属元素的化学性质。②师:播放K与氧气、水反应视频;Rb、Cs与水反应视频: ( 碱金属化学性质的比较.flv ) ( Ru和Cs与水反应.flv )3.单质的物理性质4.原子结构与元素性质的关系师:我们看到碱金属原子结构、元素化学性质及单质物理性质都有着相似性和递变性,请同学们思考讨论碱金属元素原子结构与元素性质间的关系?5.师:请完成达标评价1,预测119号“类钫”的性质。 1.填写课本P93思考与讨论表格,总结原子结构与元素性质的相似性和递变性,并发言。生:相似性:最外层电子数都为1递变性:随核电荷数增大,电子层数增多,原子半径增大。2.生:碱金属性质可能与钠相似有强金属性,能与氧气、水反应;观看实验视频,归纳实验现象,分析得出结论:K能与氧气反应生成KO2,与水反应生成强碱并放出氢气;且反应更剧烈。书写反应方程式:4Li+O22Li2OK+O2KO22K+2H2O===2KOH+H2↑3.生:分析表格,归纳碱金属单质的物理性质:从Li到Cs,密度逐渐增大(Na、K反常),熔沸点逐渐降低。4.生(讨论2分钟):相似性:最外层电子数都是1 ,容易失去1个电子,金属性较强 (与钠相似,与O2、水等反应,在产物中呈+1价);递变性:从Li→Cs核电荷数增加,电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的引力逐渐减弱,原子失电子的能力逐渐增强,元素的金属性逐渐增强。5.独立思考完成达标评价,发言解析、订正答案。 1.从微观的角度探究碱金属原子结构的相似性和递变性,培养学生微观探析的化学学科素养;2.学生填写表格信息,进行数据分析讨论,得出原子结构的相似性和递变性,培养学生分析处理数据的能力;3.培养学生观察原子结构→预测元素性质→进行实验探究→分析实验现象→得出实验结论的思维方式,培养学生实验探究的化学学科素养;4.学生对表格信息进行分析讨论,得出碱金属单质物理性质的相似性和递变性,培养学生分析处理信息的能力;5.培养证据推理能力,解释碱金属元素性质递变的规律,并运用这种规律对同族元素性质进行预测的能力,初步感知位、构、性的关系。
探究卤族元素原子结构与化学性质的关系 1.原子结构师:请同学们观察,总结卤素原子结构的相似性和递变性,回顾Cl2的有关性质,预测卤素的化学性质。2.元素化学性质①师:请同学们阅览表4-4,卤素单质与氢气反应,思考反应的难易程度、生成物稳定性如何?②师:小组实验,请同学们在点滴板上完成,氯水与NaBr、KI溶液的置换反应,溴水与KI溶液的置换反应。③师:若实验药品只有NaBr溶液、KI溶液、新制氯水,你能完成实验,并得到相同的实验结论吗?氯水的用量当如何?3.单质的物理性质4.原子结构与元素性质的关系师:我们看到碱金属原子结构、元素化学性质及单质物理性质都有着相似性和递变性,请同学们思考讨论卤素原子结构与元素性质间的关系?5.师:请完成达标评价2,预测At的性质。 1.生:最外层电子数都为7随核电荷数增大,电子层数增多,原子半径增大。能与氢气化合。2.①生:卤素单质都能与H2化合,生成氢化物;从F2到I2,反应条件越来越难,生成的氢化物稳定性逐渐减弱,元素的非金属性逐渐减弱。②生:小组进行实验探究,观察到溶液颜色加深,分析得出结论,写出反应方程式。2NaBr+Cl2=Br2+2NaCl2KI+Cl2=I2+2KCl2KI+Br2=I2+2KBr氧化性:Cl2>Br2>I2③生:设计实验方案→预测实验现象→进行实验验证。NaBr溶液溶液中滴加少量氯水,溶液颜色加深;继续滴入KI溶液,颜色进一步加深。氧化性:Cl2>Br2>I23.生:分析数据,归纳卤素单质的物理性质:都有颜色,密度小,熔沸点低。颜色加深,熔沸点逐渐增大,密度逐渐增大,水溶性逐渐减小。4.生(讨论2分钟):相似性:最外层电子数都是7 ,容易得到1个电子,非金属性较强;递变性:从F→I,核电荷数增加,电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的引力逐渐减弱,原子得电子能力逐渐减弱,元素的非金属性逐渐减弱。5.独立思考完成达标评价,发言解析、订正答案。 1.从微观的角度探究卤族原子结构的相似性和递变性,培养学生微观探析的化学学科素养;2. 培养学生观察原子结构→预测元素性质→进行实验探究→分析实验现象→得出实验结论的思维方式,培养学生实验探究的化学学科素养;3.培养学生设计实验、进行实验的能力;4.学生对表格信息进行分析讨论,得出卤素单质物理性质的相似性和递变性,培养学生分析处理信息的能力;5.培养证据推理能力,解释卤族元素性质递变的规律,并运用这种规律对同族元素性质进行预测的能力,深入认知位、构、性的关系。
课堂小结 在元素周期表中,同主族元素从上到下原子核外电子层数依次 增多 ,原子半径逐渐 增大 ,失电子能力逐渐 增强 ,得电子能力逐渐 减弱 。所以,金属性逐渐 增强 ,非金属性逐渐 减弱 。
五、板书设计
一、碱金属元素 二、卤族元素 三、位、构、性的关系
降低
Li
Na
K
Rb
Cs
失电子能力增强
金属性增强
F
Cl
Br
I
非金属性减弱
得电子能力减弱
2
