2.1.3 外界条件对化学反应速率影响的理论探究课件(共27张PPT)2023-2024学年高二上学期人教版(2019)化学选择性必修1
文档属性
| 名称 | 2.1.3 外界条件对化学反应速率影响的理论探究课件(共27张PPT)2023-2024学年高二上学期人教版(2019)化学选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
第二章
化学反应速率与化学平衡
第一节 化学反应速率
课题3 外界条件对化学反应速率影响的理论探究
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 知道活化分子、有效碰撞、活化能的涵义及其对化学反应速率的影响。
2. 能用有效碰撞理论解释外界条件对化学反应速率的影响。
活 动 方 案
阅读下列资料,回答有关问题。
有效碰撞理论:研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而是往往经过多个反应步骤才能实现。例如,2HI===H2+I2实际上是经过下列两步反应完成的:
①2HI―→H2+2I·(I·是自由基,是指带单电子的原子或原子团);②2I·―→I2。
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI===H2+I2的反应历程(又称反应机理)。
活动一:通过“有效碰撞理论”认识活化分子、有效碰撞的涵义
(1) 基元反应发生的先决条件是反应物分子间必须发生碰撞,分子间碰撞的频率越高,则反应速率越大。(2) 反应物分子间并非每次碰撞都会导致反应的发生,只有少数碰撞会导致反应的发生,多数分子间的碰撞并不发生反应,能发生反应的碰撞称为有效碰撞。(3) 发生有效碰撞的分子必须具有足够的能量,这种分子叫作活化分子。(4) 发生有效碰撞的分子一定是活化分子,但活化分子只有在合适取向时发生的碰撞才称为有效碰撞。
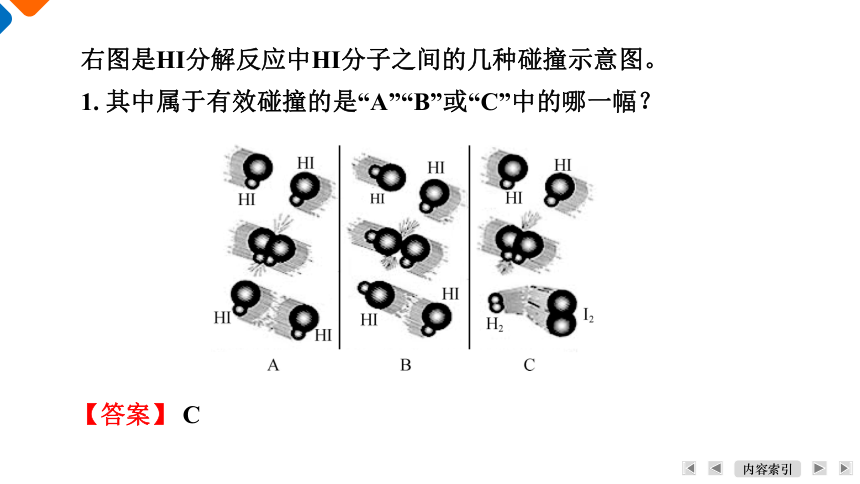
右图是HI分解反应中HI分子之间的几种碰撞示意图。
1. 其中属于有效碰撞的是“A”“B”或“C”中的哪一幅?
【答案】 C
2. 另外两种没有发生有效碰撞的原因可能是什么?(解释时必须使用“活化分子”“碰撞取向”等术语,下同)
【答案】 A中分子碰撞取向好,但分子能量较低,不是活化分子;B中的分子尽管可能是活化分子,但分子的碰撞取向不好。
3. 发生有效碰撞要具备的条件是什么?
【答案】 活化分子只有在合适的碰撞取向时发生的碰撞,才是有效碰撞。
【答案】 反应②
1. 阅读下列资料,然后回答问题。
过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。从反应物状态到过渡态所吸收的能量为发生该反应所需的活化能。活化能降低时,能量不足的分子就有可能变成活化分子,从而使有效碰撞的几率提高,反应速率增大。
活动二:通过“过渡态理论”认识活化能的涵义
右图是通常情况下,NO2和CO反应生成CO2和NO过程中能量变化示意图。
(1) 该反应的活化能是多少?
【答案】 134 kJ·mol-1
(2) 请写出NO2和CO反应的热化学方程式。
【答案】 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1
(3) 在图上用虚线画出使用催化剂后的物质能量与反应进程关系的曲线。
【答案】
2. 一个化学反应由几个基元反应完成,
每一个基元反应都经历一个过渡态,即达到
该过渡态所需要的活化能。基元反应活化能
越大,反应物到达过渡态就越不容易,该基
元反应的速率就越慢。一个化学反应的速率
就取决于速率最慢的基元反应。某反应A+
B→D由如下两步基元反应构成,每步基元反应的能量与反应过程的关系如右图所示。
①A+B→C;
②C→D。
上述两个基元反应中决定A+B→D反应速率的是哪一步反应?
【答案】 反应①
1. 请你使用有关概念解释其他条件相同时,为什么增大反应物浓度会使化学反应速率增大?
【答案】 其他条件相同时,反应物浓度增大,单位体积内活化分子数增多,单位时间内有效碰撞几率增加,化学反应速率增大。
2. 请你使用有关概念解释其他条件相同时,为什么通过缩小容器体积来增大压强会使化学反应速率增大?
【答案】 其他条件相同时,缩小容器体积,压强增大,单位体积内活化分子数增多,单位时间内有效碰撞几率增加,化学反应速率增大。
活动三:用活化分子、有效碰撞、活化能等概念解释影响化学反应速率的因素
3. 请你使用有关概念解释其他条件相同时,为什么升高温度会使化学反应速率增大?
【答案】 其他条件相同时,升高温度,一方面反应物分子的能量增加,一部分原来能量较低的分子变成活化分子,反应物分子中活化分子百分数提高(这是反应速率增大的主要原因);另一方面,升高温度,分子的运动加快,单位时间内反应物分子间的碰撞频率提高。这两方面原因都使分子间有效碰撞的几率提高,化学反应速率增大。
4. 请你使用有关概念解释其他条件相同时,为什么使用催化剂会使化学反应速率增大?
【答案】 在其他条件相同时,使用催化剂,使发生反应所需的活化能降低,反应体系中活化分子的百分数提高,有效碰撞几率提高,化学反应速率增大。
活动四:归纳提高化学反应速率所采取的途径
课 堂 反 馈
2
4
5
1
3
6
1. (2023宜宾四中开学考试)已知:CO(g)+2H2(g)===CH3OH(g) ΔH,反应过程中生成 1 mol CH3OH(g)的能量变化如图所示。曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况。下列判断正确的是( )
A. 加入催化剂,ΔH变小
B. ΔH=+91 kJ·mol-1
C. 正、逆反应的活化能相等
D. 曲线Ⅱ表示加入了催化剂
【答案】 D
2
4
5
1
3
6
2.下列说法不正确的是( )
A. 活化分子一定能发生有效碰撞
B. 升高温度增大了活化分子百分数
C. 催化剂能够改变化学反应途径
D. 增大压强能提高活化分子的浓度
【答案】 A
2
4
5
3
6
3.下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增加有效碰撞次数,增大反应速率
B. 对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大
C. 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率
D. 对于本来不能发生的化学反应,改变条件就可以使反应发生
1
【答案】 C
2
4
5
3
6
4.下列说法正确的是( )
A. Fe和Mg与0.1 mol·L-1的盐酸反应,反应速率相同
B. 0.1 mol·L-1盐酸与0.1 mol·L-1H2SO4分别与大小、形状相同的大理石反应,反应速率相同
C. 催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加
D. 100 mL 2 mol·L-1盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变
1
【答案】 C
2
4
5
3
6
下列有关说法正确的是( )
A. NO是反应①的催化剂
B. 反应①的活化能为196 kJ·mol-1
C. 反应速率与NO的浓度无关
D. 开始时加入NO2不能增大反应①的速率
1
【答案】 A
2
4
5
3
6
6.科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,CO(g)还原NO(g)得到1 mol N2(g)和2 mol CO2(g)的能量变化与反应过程的关系如图所示。
1
2
4
5
3
6
(1) 写出该反应的热化学方程式。
1
【答案】 2NO(g)+2CO(g)===2CO2(g)+N2(g) ΔH=(Ed-Ea)
kJ·mol-1
(2) 决定该反应快慢的是哪一步反应过程?
【答案】 过程①
谢谢观看
Thank you for watching
第二章
化学反应速率与化学平衡
第一节 化学反应速率
课题3 外界条件对化学反应速率影响的理论探究
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 知道活化分子、有效碰撞、活化能的涵义及其对化学反应速率的影响。
2. 能用有效碰撞理论解释外界条件对化学反应速率的影响。
活 动 方 案
阅读下列资料,回答有关问题。
有效碰撞理论:研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而是往往经过多个反应步骤才能实现。例如,2HI===H2+I2实际上是经过下列两步反应完成的:
①2HI―→H2+2I·(I·是自由基,是指带单电子的原子或原子团);②2I·―→I2。
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI===H2+I2的反应历程(又称反应机理)。
活动一:通过“有效碰撞理论”认识活化分子、有效碰撞的涵义
(1) 基元反应发生的先决条件是反应物分子间必须发生碰撞,分子间碰撞的频率越高,则反应速率越大。(2) 反应物分子间并非每次碰撞都会导致反应的发生,只有少数碰撞会导致反应的发生,多数分子间的碰撞并不发生反应,能发生反应的碰撞称为有效碰撞。(3) 发生有效碰撞的分子必须具有足够的能量,这种分子叫作活化分子。(4) 发生有效碰撞的分子一定是活化分子,但活化分子只有在合适取向时发生的碰撞才称为有效碰撞。
右图是HI分解反应中HI分子之间的几种碰撞示意图。
1. 其中属于有效碰撞的是“A”“B”或“C”中的哪一幅?
【答案】 C
2. 另外两种没有发生有效碰撞的原因可能是什么?(解释时必须使用“活化分子”“碰撞取向”等术语,下同)
【答案】 A中分子碰撞取向好,但分子能量较低,不是活化分子;B中的分子尽管可能是活化分子,但分子的碰撞取向不好。
3. 发生有效碰撞要具备的条件是什么?
【答案】 活化分子只有在合适的碰撞取向时发生的碰撞,才是有效碰撞。
【答案】 反应②
1. 阅读下列资料,然后回答问题。
过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。从反应物状态到过渡态所吸收的能量为发生该反应所需的活化能。活化能降低时,能量不足的分子就有可能变成活化分子,从而使有效碰撞的几率提高,反应速率增大。
活动二:通过“过渡态理论”认识活化能的涵义
右图是通常情况下,NO2和CO反应生成CO2和NO过程中能量变化示意图。
(1) 该反应的活化能是多少?
【答案】 134 kJ·mol-1
(2) 请写出NO2和CO反应的热化学方程式。
【答案】 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1
(3) 在图上用虚线画出使用催化剂后的物质能量与反应进程关系的曲线。
【答案】
2. 一个化学反应由几个基元反应完成,
每一个基元反应都经历一个过渡态,即达到
该过渡态所需要的活化能。基元反应活化能
越大,反应物到达过渡态就越不容易,该基
元反应的速率就越慢。一个化学反应的速率
就取决于速率最慢的基元反应。某反应A+
B→D由如下两步基元反应构成,每步基元反应的能量与反应过程的关系如右图所示。
①A+B→C;
②C→D。
上述两个基元反应中决定A+B→D反应速率的是哪一步反应?
【答案】 反应①
1. 请你使用有关概念解释其他条件相同时,为什么增大反应物浓度会使化学反应速率增大?
【答案】 其他条件相同时,反应物浓度增大,单位体积内活化分子数增多,单位时间内有效碰撞几率增加,化学反应速率增大。
2. 请你使用有关概念解释其他条件相同时,为什么通过缩小容器体积来增大压强会使化学反应速率增大?
【答案】 其他条件相同时,缩小容器体积,压强增大,单位体积内活化分子数增多,单位时间内有效碰撞几率增加,化学反应速率增大。
活动三:用活化分子、有效碰撞、活化能等概念解释影响化学反应速率的因素
3. 请你使用有关概念解释其他条件相同时,为什么升高温度会使化学反应速率增大?
【答案】 其他条件相同时,升高温度,一方面反应物分子的能量增加,一部分原来能量较低的分子变成活化分子,反应物分子中活化分子百分数提高(这是反应速率增大的主要原因);另一方面,升高温度,分子的运动加快,单位时间内反应物分子间的碰撞频率提高。这两方面原因都使分子间有效碰撞的几率提高,化学反应速率增大。
4. 请你使用有关概念解释其他条件相同时,为什么使用催化剂会使化学反应速率增大?
【答案】 在其他条件相同时,使用催化剂,使发生反应所需的活化能降低,反应体系中活化分子的百分数提高,有效碰撞几率提高,化学反应速率增大。
活动四:归纳提高化学反应速率所采取的途径
课 堂 反 馈
2
4
5
1
3
6
1. (2023宜宾四中开学考试)已知:CO(g)+2H2(g)===CH3OH(g) ΔH,反应过程中生成 1 mol CH3OH(g)的能量变化如图所示。曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况。下列判断正确的是( )
A. 加入催化剂,ΔH变小
B. ΔH=+91 kJ·mol-1
C. 正、逆反应的活化能相等
D. 曲线Ⅱ表示加入了催化剂
【答案】 D
2
4
5
1
3
6
2.下列说法不正确的是( )
A. 活化分子一定能发生有效碰撞
B. 升高温度增大了活化分子百分数
C. 催化剂能够改变化学反应途径
D. 增大压强能提高活化分子的浓度
【答案】 A
2
4
5
3
6
3.下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增加有效碰撞次数,增大反应速率
B. 对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大
C. 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率
D. 对于本来不能发生的化学反应,改变条件就可以使反应发生
1
【答案】 C
2
4
5
3
6
4.下列说法正确的是( )
A. Fe和Mg与0.1 mol·L-1的盐酸反应,反应速率相同
B. 0.1 mol·L-1盐酸与0.1 mol·L-1H2SO4分别与大小、形状相同的大理石反应,反应速率相同
C. 催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加
D. 100 mL 2 mol·L-1盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变
1
【答案】 C
2
4
5
3
6
下列有关说法正确的是( )
A. NO是反应①的催化剂
B. 反应①的活化能为196 kJ·mol-1
C. 反应速率与NO的浓度无关
D. 开始时加入NO2不能增大反应①的速率
1
【答案】 A
2
4
5
3
6
6.科学家结合实验和计算机模拟结果,研究了在贵重金属催化剂表面上的气态体系中,CO(g)还原NO(g)得到1 mol N2(g)和2 mol CO2(g)的能量变化与反应过程的关系如图所示。
1
2
4
5
3
6
(1) 写出该反应的热化学方程式。
1
【答案】 2NO(g)+2CO(g)===2CO2(g)+N2(g) ΔH=(Ed-Ea)
kJ·mol-1
(2) 决定该反应快慢的是哪一步反应过程?
【答案】 过程①
谢谢观看
Thank you for watching
