3.3.3电解质溶液中粒子浓度的大小比较与定量关系课件(共25张PPT)2023-2024学年高二上学期人教版(2019)化学选择性必修1
文档属性
| 名称 | 3.3.3电解质溶液中粒子浓度的大小比较与定量关系课件(共25张PPT)2023-2024学年高二上学期人教版(2019)化学选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 855.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 11:10:39 | ||
图片预览







文档简介
(共25张PPT)
第三章
水溶液中的离子反应与平衡
第三节 盐类的水解
课题3 电解质溶液中粒子浓度的大小比较与定量关系
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 能分析电解质溶液中粒子浓度的相对大小。
2. 能书写电解质溶液中粒子浓度的等量关系式。
活 动 方 案
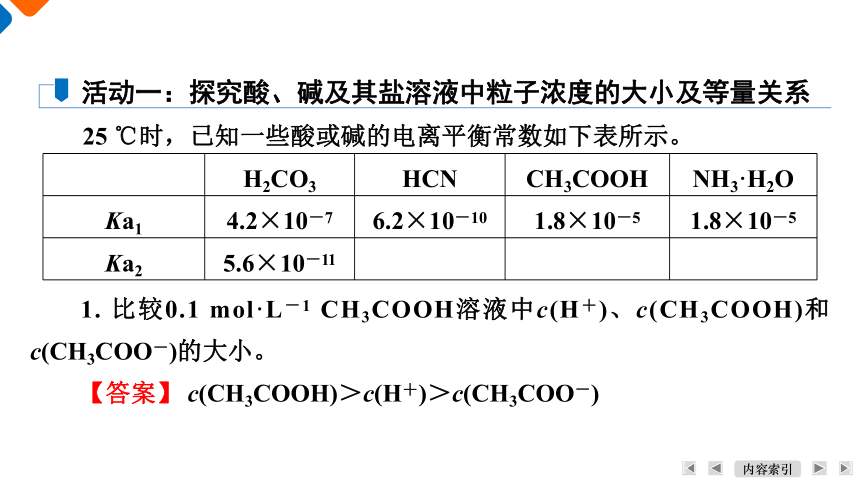
25 ℃时,已知一些酸或碱的电离平衡常数如下表所示。
活动一:探究酸、碱及其盐溶液中粒子浓度的大小及等量关系
H2CO3 HCN CH3COOH NH3·H2O
Ka1 4.2×10-7 6.2×10-10 1.8×10-5 1.8×10-5
Ka2 5.6×10-11
1. 比较0.1 mol·L-1 CH3COOH溶液中c(H+)、c(CH3COOH)和c(CH3COO-)的大小。
【答案】 c(CH3COOH)>c(H+)>c(CH3COO-)
2. 分析0.1 mol·L-1CH3COONa溶液中的守恒及等量关系。
(1) 将溶液中除H2O分子外的粒子(离子和分子)按照浓度由大到小的顺序排列。
【答案】 c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)
(2) 电解质溶液中阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。写出溶液中存在的电荷守恒式。
【答案】 c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
(3) 在电解质溶液中,由于某些离子发生电离或水解,离子的形式发生变化,就离子所含的某种元素而言,其物质的量在变化前后是相等的。写出溶液中存在的元素守恒式。
【答案】 c(Na+)=c(CH3COOH)+c(CH3COO-)
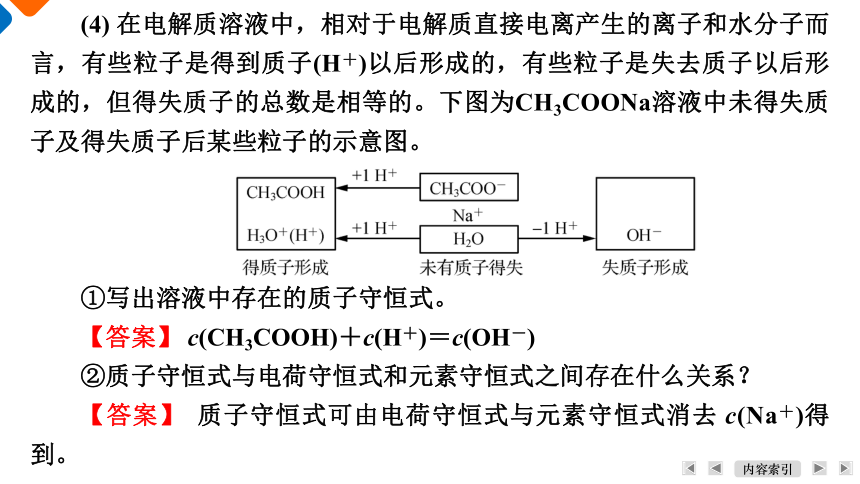
(4) 在电解质溶液中,相对于电解质直接电离产生的离子和水分子而言,有些粒子是得到质子(H+)以后形成的,有些粒子是失去质子以后形成的,但得失质子的总数是相等的。下图为CH3COONa溶液中未得失质子及得失质子后某些粒子的示意图。
①写出溶液中存在的质子守恒式。
【答案】 c(CH3COOH)+c(H+)=c(OH-)
②质子守恒式与电荷守恒式和元素守恒式之间存在什么关系?
【答案】 质子守恒式可由电荷守恒式与元素守恒式消去 c(Na+)得到。
3. 分析0.1 mol·L-1Na2CO3溶液中的守恒及等量关系。
(2) 分别写出溶液中的电荷守恒式、元素守恒式和质子守恒式。
5. 写出0.1 mol·L-1NH4Cl溶液中的质子守恒式。
【答案】 c(NH3·H2O)+c(OH-)=c(H+)
1. 将0.1 mol·L-1 CH3COOH溶液和0.1 mol·L-1CH3COONa溶液等体积混合,所得溶液pH<7。
(1) 将溶液中CH3COOH、Na+和CH3COO-按浓度由大到小的顺序排列。
【答案】 c(CH3COO-)>c(Na+)>c(CH3COOH)
(2) 写出溶液中的电荷守恒式和元素守恒式。
【答案】 电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
元素守恒:2c(Na+)=c(CH3COOH)+c(CH3COO-)
活动二:探究混合溶液中粒子浓度的大小及等量关系
2. 将0.1 mol·L-1 HCN溶液和0.1 mol·L-1NaCN溶液等体积混合,所得溶液pH>7。将溶液中HCN、Na+和CN-按浓度由大到小的顺序排列。
【答案】 c(HCN) >c(Na+) >c(CN-)
3. 将0.1 mol·L-1Na2CO3溶液和0.1 mol·L-1NaHCO3溶液等体积混合。写出溶液中的元素守恒式。
常温下 ,用 0.1000 mol·L-1 NaOH 溶液滴定 20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如上图所示。
活动三:探究中和滴定过程中粒子浓度的大小及等量关系
1. 比较点①所示溶液中CH3COOH、Na+和CH3COO-的相对大小,并写出物料守恒式。
【答案】 c(CH3COO-)>c(Na+)>c(CH3COOH)
2c(Na+)=c(CH3COO-)+c(CH3COOH)
2. 点②所示溶液中c(Na+)-c(CH3COO-)的数值等于多少?
【答案】 0
3. 将点③所示溶液中的Na+、H+、CH3COO-、CH3COOH、OH-按浓度由大到小的顺序排列。
【答案】 c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)
课 堂 反 馈
2
4
5
1
3
7
6
1.一定温度下,下列溶液的离子浓度关系式正确的是( )
D. pH相同的①CH3COONa、②NaOH、③NaClO三种溶液的 c(Na+)的大小:③>①>②
【答案】 B
2
4
5
1
3
7
6
2.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是( )
A. pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B. pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C. pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
【答案】 A
2
4
5
3
7
6
3.常温下,用 0.100 0 mol·L-1 NaOH 溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如右图所示。下列说法正确的是( )
A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
1
【答案】 D
2
4
5
3
7
6
4.下列溶液中各微粒的浓度关系正确的是( )
B. 0.1 mol·L-1 HCOOH溶液中:c(HCOO-)=c(H+)
C. 0.1 mol·L-1 CH3COONa溶液中,c(OH-)=c(CH3COOH)+ c(H+)
D. 0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
1
【答案】 C
2
4
5
3
7
6
5.下列溶液中,有关物质的量浓度关系不正确的是( )
A. pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
C. 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
1
【答案】 D
2
4
5
3
7
6
1
2
4
5
3
7
6
(1) 若溶液中只溶解了一种溶质,则该溶质是____________,上述四种离子浓度的大小顺序为____(填序号)。
(2) 若上述关系中③是正确的,则溶液中的溶质是________________ ___________;
若上述关系中④是正确的,则溶液中的溶质是_________________。
(3) 若该溶液是由体积相等的盐酸和氨水混合而成的,且恰好呈中性,则混合前c(HCl)______(填“>”“<”或“=”,下同)c(NH3·H2O),混合前盐酸中c(H+)和氨水中c(OH-)的关系 c(H+)______c(OH-)。
1
NH4Cl
①
NH4Cl、
NH3·H2O
NH4Cl、HCl
<
>
2
4
5
3
7
6
7.常温下,用0.10 mol·L-1 KOH溶液滴定 10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图所示(混合溶液的体积可看成混合前溶液体积之和)。
1
2
4
5
3
7
6
(1) 点①所示溶液的pH______(填“>”“<”或“=”)1。
(3) 点③所示溶液中,除OH-外其他各离子的浓度由大到小的顺序是__________________________________。
(4) 点⑤所示溶液中,c(OH-)-c(H+)=_____________________[式中不含c(K+)]。
(5) 滴定过程中始终成立的两个等式:
Ⅰ. c(K+)+c(H+)=______________________________。
1
>
0.10
谢谢观看
Thank you for watching
第三章
水溶液中的离子反应与平衡
第三节 盐类的水解
课题3 电解质溶液中粒子浓度的大小比较与定量关系
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 能分析电解质溶液中粒子浓度的相对大小。
2. 能书写电解质溶液中粒子浓度的等量关系式。
活 动 方 案
25 ℃时,已知一些酸或碱的电离平衡常数如下表所示。
活动一:探究酸、碱及其盐溶液中粒子浓度的大小及等量关系
H2CO3 HCN CH3COOH NH3·H2O
Ka1 4.2×10-7 6.2×10-10 1.8×10-5 1.8×10-5
Ka2 5.6×10-11
1. 比较0.1 mol·L-1 CH3COOH溶液中c(H+)、c(CH3COOH)和c(CH3COO-)的大小。
【答案】 c(CH3COOH)>c(H+)>c(CH3COO-)
2. 分析0.1 mol·L-1CH3COONa溶液中的守恒及等量关系。
(1) 将溶液中除H2O分子外的粒子(离子和分子)按照浓度由大到小的顺序排列。
【答案】 c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)
(2) 电解质溶液中阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。写出溶液中存在的电荷守恒式。
【答案】 c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
(3) 在电解质溶液中,由于某些离子发生电离或水解,离子的形式发生变化,就离子所含的某种元素而言,其物质的量在变化前后是相等的。写出溶液中存在的元素守恒式。
【答案】 c(Na+)=c(CH3COOH)+c(CH3COO-)
(4) 在电解质溶液中,相对于电解质直接电离产生的离子和水分子而言,有些粒子是得到质子(H+)以后形成的,有些粒子是失去质子以后形成的,但得失质子的总数是相等的。下图为CH3COONa溶液中未得失质子及得失质子后某些粒子的示意图。
①写出溶液中存在的质子守恒式。
【答案】 c(CH3COOH)+c(H+)=c(OH-)
②质子守恒式与电荷守恒式和元素守恒式之间存在什么关系?
【答案】 质子守恒式可由电荷守恒式与元素守恒式消去 c(Na+)得到。
3. 分析0.1 mol·L-1Na2CO3溶液中的守恒及等量关系。
(2) 分别写出溶液中的电荷守恒式、元素守恒式和质子守恒式。
5. 写出0.1 mol·L-1NH4Cl溶液中的质子守恒式。
【答案】 c(NH3·H2O)+c(OH-)=c(H+)
1. 将0.1 mol·L-1 CH3COOH溶液和0.1 mol·L-1CH3COONa溶液等体积混合,所得溶液pH<7。
(1) 将溶液中CH3COOH、Na+和CH3COO-按浓度由大到小的顺序排列。
【答案】 c(CH3COO-)>c(Na+)>c(CH3COOH)
(2) 写出溶液中的电荷守恒式和元素守恒式。
【答案】 电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
元素守恒:2c(Na+)=c(CH3COOH)+c(CH3COO-)
活动二:探究混合溶液中粒子浓度的大小及等量关系
2. 将0.1 mol·L-1 HCN溶液和0.1 mol·L-1NaCN溶液等体积混合,所得溶液pH>7。将溶液中HCN、Na+和CN-按浓度由大到小的顺序排列。
【答案】 c(HCN) >c(Na+) >c(CN-)
3. 将0.1 mol·L-1Na2CO3溶液和0.1 mol·L-1NaHCO3溶液等体积混合。写出溶液中的元素守恒式。
常温下 ,用 0.1000 mol·L-1 NaOH 溶液滴定 20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如上图所示。
活动三:探究中和滴定过程中粒子浓度的大小及等量关系
1. 比较点①所示溶液中CH3COOH、Na+和CH3COO-的相对大小,并写出物料守恒式。
【答案】 c(CH3COO-)>c(Na+)>c(CH3COOH)
2c(Na+)=c(CH3COO-)+c(CH3COOH)
2. 点②所示溶液中c(Na+)-c(CH3COO-)的数值等于多少?
【答案】 0
3. 将点③所示溶液中的Na+、H+、CH3COO-、CH3COOH、OH-按浓度由大到小的顺序排列。
【答案】 c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)
课 堂 反 馈
2
4
5
1
3
7
6
1.一定温度下,下列溶液的离子浓度关系式正确的是( )
D. pH相同的①CH3COONa、②NaOH、③NaClO三种溶液的 c(Na+)的大小:③>①>②
【答案】 B
2
4
5
1
3
7
6
2.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是( )
A. pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B. pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C. pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
【答案】 A
2
4
5
3
7
6
3.常温下,用 0.100 0 mol·L-1 NaOH 溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如右图所示。下列说法正确的是( )
A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
1
【答案】 D
2
4
5
3
7
6
4.下列溶液中各微粒的浓度关系正确的是( )
B. 0.1 mol·L-1 HCOOH溶液中:c(HCOO-)=c(H+)
C. 0.1 mol·L-1 CH3COONa溶液中,c(OH-)=c(CH3COOH)+ c(H+)
D. 0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
1
【答案】 C
2
4
5
3
7
6
5.下列溶液中,有关物质的量浓度关系不正确的是( )
A. pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
C. 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
1
【答案】 D
2
4
5
3
7
6
1
2
4
5
3
7
6
(1) 若溶液中只溶解了一种溶质,则该溶质是____________,上述四种离子浓度的大小顺序为____(填序号)。
(2) 若上述关系中③是正确的,则溶液中的溶质是________________ ___________;
若上述关系中④是正确的,则溶液中的溶质是_________________。
(3) 若该溶液是由体积相等的盐酸和氨水混合而成的,且恰好呈中性,则混合前c(HCl)______(填“>”“<”或“=”,下同)c(NH3·H2O),混合前盐酸中c(H+)和氨水中c(OH-)的关系 c(H+)______c(OH-)。
1
NH4Cl
①
NH4Cl、
NH3·H2O
NH4Cl、HCl
<
>
2
4
5
3
7
6
7.常温下,用0.10 mol·L-1 KOH溶液滴定 10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图所示(混合溶液的体积可看成混合前溶液体积之和)。
1
2
4
5
3
7
6
(1) 点①所示溶液的pH______(填“>”“<”或“=”)1。
(3) 点③所示溶液中,除OH-外其他各离子的浓度由大到小的顺序是__________________________________。
(4) 点⑤所示溶液中,c(OH-)-c(H+)=_____________________[式中不含c(K+)]。
(5) 滴定过程中始终成立的两个等式:
Ⅰ. c(K+)+c(H+)=______________________________。
1
>
0.10
谢谢观看
Thank you for watching
