3.3.2影响盐类水解的主要因素与盐类水解的应用课件(共27张PPT)2023-2024学年高二上学期人教版(2019)化学选择性必修1
文档属性
| 名称 | 3.3.2影响盐类水解的主要因素与盐类水解的应用课件(共27张PPT)2023-2024学年高二上学期人教版(2019)化学选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 794.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
第三章
水溶液中的离子反应与平衡
第三节 盐类的水解
课题2 影响盐类水解的主要因素与盐类水解的应用
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 知道外界条件对盐类水解平衡的影响。
2. 能说明盐类水解在生产、生活和实验中的应用。
活 动 方 案
1. 取两支小试管,分别加入2 mL 0.1 mol·L-1 Na2CO3溶液和0.1 mol·L-1 CH3COONa溶液,并滴入一滴酚酞试液,将两支试管分别加热。
(1) 两支试管前后颜色各发生了什么变化?由此可以得出什么结论?
【答案】 红色比加热前加深。Na2CO3、CH3COONa的水解是吸热反应。
(2) 盐类的水解反应是哪一类反应的逆反应,由此可以推倒水解反应的热效应吗?
【答案】 盐类的水解反应是中和反应的逆反应,中和反应是放热反应,所以盐类的水解反应是吸热反应。
活动一:探究外界条件的改变对盐类水解的影响
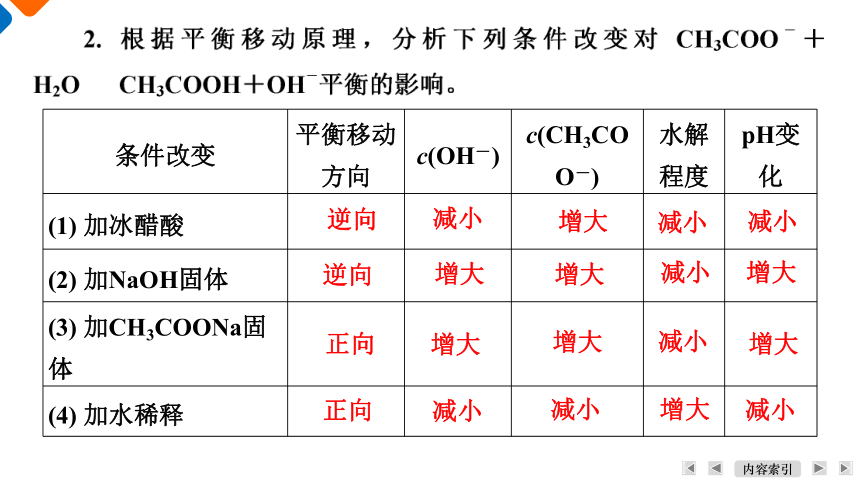
改改XXXXX
条件改变 平衡移动方向 c(OH-) c(CH3COO-) 水解程度 pH变化
(1) 加冰醋酸
(2) 加NaOH固体
(3) 加CH3COONa固体
(4) 加水稀释
逆向
减小
增大
减小
减小
逆向
增大
增大
减小
增大
正向
增大
增大
减小
增大
正向
减小
减小
增大
减小
3. 取一支试管,向其中加入2 mL 0.1 mol·L-1 Na2CO3溶液,并滴入一滴酚酞试液。向溶液中逐滴滴加 0.1 mol·L-1 CaCl2溶液。记录观察到的实验现象并解释。
1. 取少量FeCl3固体于烧杯中,边搅拌边加入足量蒸馏水。观察实验现象并进行解释。
【答案】 得到棕黄色的悬浊液,Fe3+易水解,生成了较多的Fe(OH)3难溶于水。
2. 实验室配制FeCl3溶液时,常将FeCl3固体溶于浓盐酸中,然后稀释。这样做的目的是什么?
【答案】 抑制FeCl3的水解。
活动二:认识盐类水解在实验中的应用
3. 实验室将MgCl2·6H2O加热脱水制无水MgCl2时,需在HCl气氛中进行(如图所示),请解释原因。
4. 实验室配制Fe(OH)3胶体时的操作如下:将25 mL蒸馏水加入50 mL烧杯中,加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,制得Fe(OH)3胶体。
(1) 制取Fe(OH)3胶体时加热的目的是什么?
【答案】 促进Fe3+的水解。
(2) 如果将溶液一直加热至干并灼烧,最终得到Fe2O3固体。为什么得到的是Fe2O3固体而不是FeCl3固体?
(3) 如果将Fe2(SO4)3溶液加热蒸发至干,为什么得到的是Fe2(SO4)3溶液而不是Fe2O3固体?
【答案】 Fe2(SO4)3水解可以生成H2SO4,H2SO4难挥发,H2SO4浓度增大后会抑制 Fe2(SO4)3水解。
(4) 如果要由FeCl3溶液获取FeCl3固体,应该如何操作?
【答案】 蒸发时应加入盐酸,析出固体时应通入HCl气体,在HCl的气氛中蒸干。
1. 用纯碱溶液清洗油污的原理是什么(用离子方程式表示)?热的纯碱溶液去污效果更好,为什么?
2. 自来水厂用铝盐(如明矾)、铁盐(如硫酸铁)作净水剂的原理是什么?请结合离子方程式描述。
活动三:分析生产、生活中与盐类水解有关的现象
3. 在工业生产中,合适的pH范围、合理的投料顺序都可以抑制或促进水解,减少副反应发生,提高原料利用率。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按离子浓度为1.0 mol·L-1算)。
Al3+ Fe3+ Fe2+ Cu2+
开始沉淀的pH 3.0 1.1 5.8 4.2
沉淀完全的pH 5.0 3.2 8.8 6.7
(1) 柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3===FeCO3↓+Na2SO4
FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O
制备FeCO3时,选用的加料方式是______(填字母)。原因是______ ___________________________________________________________。
A. 将FeSO4溶液与Na2CO3溶液同时加入反应容器中
B. 将FeSO4溶液缓慢加入盛有Na2CO3溶液的反应容器中
C. 将Na2CO3溶液缓慢加入盛有FeSO4溶液的反应容器中
C
因为
Na2CO3溶液显碱性,其他两种投料方式都会生成Fe(OH)2沉淀
(2) 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
①酸溶时加入稀硫酸应适当过量,除了将菱镁矿充分溶解外,还有什么作用?
【答案】 抑制金属离子的水解。
②调pH时也可以加入MgO。为什么加入MgO也可析出Fe(OH)3沉淀?
课 堂 反 馈
2
4
5
1
3
1.下列过程或现象与盐类水解无关的是( )
A. 加热氯化铁溶液颜色变深
B. 铁在潮湿的环境下生锈
C. 纯碱溶液存放在带橡皮塞的试剂瓶中
D. 浓硫化钠溶液有臭味
【答案】 B
2
4
5
1
3
【答案】 A
2
4
5
3
3.下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是( )
A. FeCl2、FeCl3 B. Na2CO3、NaHCO3
C. Na[Al(OH)4]、AlCl3 D. Mg(HCO3)2、MgCl2
1
【答案】 C
2
4
5
3
1
实验序号 实验操作 实验现象
① 在Na2CO3溶液中滴入2~3滴酚酞试液 溶液变红
② 将红色溶液加热 红色变深
③ 冷却后,______________________________ _____________
加入过量CaCl2溶液(或BaCl2溶液)
溶液中红色消失
2
4
5
3
问题讨论:
甲、乙两同学用相同的试剂做验证水解反应吸热的实验。甲同学加热时,溶液红色变深,冷却到室温时又变回原来的颜色;乙同学加热后,红色也变深,冷却到室温,红色稍变浅但比甲的颜色深。
乙同学出现该现象的原因可能是______________________________ _______。
1
加热时间太长,使溶液浓度增大
(浓缩)
2
4
5
3
5.请回答下列有关的问题。
(1) 以磷石膏(主要成分为CaSO4,杂质为SiO2、Al2O3等)为原料可制备轻质CaCO3的流程如下:
在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是_____________________________ _______________________________________。
1
溶液中c(H+)增大,促进固体中Ca2+浸出
2
4
5
3
(2) 实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液的流程如下:
若CaCO3的用量偏多,会使碱式硫酸铝中x值________(填“偏大”或“偏小”),理由是___________________________________________ ________。
1
偏小
CaCO3消耗更多的H+,促进Al3+水解,产生更
多的OH-
2
4
5
3
(3) 硫酸亚铁是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②将洗涤过的过量废铁屑加入稀硫酸,控制温度在50~80 ℃之间至反应停止。
……
实验步骤①的目的是________,加热的作用是__________________ _____________________________。
1
除油污
溶液碱性增强,去油污能力增强
2
4
5
3
(4) K2FeO4是一种高效水处理剂,具有强氧化性,在0~5 ℃、强碱性溶液中比较稳定,在酸性至弱碱性条件下,能与水反应生成O2和Fe(OH)3。实验室用饱和KClO溶液与饱和 Fe(NO3)3溶液混合制备K2FeO4时,混合方式为________________________________________________ ______________________。
1
在0~5 ℃、搅拌下,将饱和Fe(NO3)3溶液缓慢滴加到
饱和KClO溶液中
谢谢观看
Thank you for watching
第三章
水溶液中的离子反应与平衡
第三节 盐类的水解
课题2 影响盐类水解的主要因素与盐类水解的应用
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 知道外界条件对盐类水解平衡的影响。
2. 能说明盐类水解在生产、生活和实验中的应用。
活 动 方 案
1. 取两支小试管,分别加入2 mL 0.1 mol·L-1 Na2CO3溶液和0.1 mol·L-1 CH3COONa溶液,并滴入一滴酚酞试液,将两支试管分别加热。
(1) 两支试管前后颜色各发生了什么变化?由此可以得出什么结论?
【答案】 红色比加热前加深。Na2CO3、CH3COONa的水解是吸热反应。
(2) 盐类的水解反应是哪一类反应的逆反应,由此可以推倒水解反应的热效应吗?
【答案】 盐类的水解反应是中和反应的逆反应,中和反应是放热反应,所以盐类的水解反应是吸热反应。
活动一:探究外界条件的改变对盐类水解的影响
改改XXXXX
条件改变 平衡移动方向 c(OH-) c(CH3COO-) 水解程度 pH变化
(1) 加冰醋酸
(2) 加NaOH固体
(3) 加CH3COONa固体
(4) 加水稀释
逆向
减小
增大
减小
减小
逆向
增大
增大
减小
增大
正向
增大
增大
减小
增大
正向
减小
减小
增大
减小
3. 取一支试管,向其中加入2 mL 0.1 mol·L-1 Na2CO3溶液,并滴入一滴酚酞试液。向溶液中逐滴滴加 0.1 mol·L-1 CaCl2溶液。记录观察到的实验现象并解释。
1. 取少量FeCl3固体于烧杯中,边搅拌边加入足量蒸馏水。观察实验现象并进行解释。
【答案】 得到棕黄色的悬浊液,Fe3+易水解,生成了较多的Fe(OH)3难溶于水。
2. 实验室配制FeCl3溶液时,常将FeCl3固体溶于浓盐酸中,然后稀释。这样做的目的是什么?
【答案】 抑制FeCl3的水解。
活动二:认识盐类水解在实验中的应用
3. 实验室将MgCl2·6H2O加热脱水制无水MgCl2时,需在HCl气氛中进行(如图所示),请解释原因。
4. 实验室配制Fe(OH)3胶体时的操作如下:将25 mL蒸馏水加入50 mL烧杯中,加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,制得Fe(OH)3胶体。
(1) 制取Fe(OH)3胶体时加热的目的是什么?
【答案】 促进Fe3+的水解。
(2) 如果将溶液一直加热至干并灼烧,最终得到Fe2O3固体。为什么得到的是Fe2O3固体而不是FeCl3固体?
(3) 如果将Fe2(SO4)3溶液加热蒸发至干,为什么得到的是Fe2(SO4)3溶液而不是Fe2O3固体?
【答案】 Fe2(SO4)3水解可以生成H2SO4,H2SO4难挥发,H2SO4浓度增大后会抑制 Fe2(SO4)3水解。
(4) 如果要由FeCl3溶液获取FeCl3固体,应该如何操作?
【答案】 蒸发时应加入盐酸,析出固体时应通入HCl气体,在HCl的气氛中蒸干。
1. 用纯碱溶液清洗油污的原理是什么(用离子方程式表示)?热的纯碱溶液去污效果更好,为什么?
2. 自来水厂用铝盐(如明矾)、铁盐(如硫酸铁)作净水剂的原理是什么?请结合离子方程式描述。
活动三:分析生产、生活中与盐类水解有关的现象
3. 在工业生产中,合适的pH范围、合理的投料顺序都可以抑制或促进水解,减少副反应发生,提高原料利用率。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按离子浓度为1.0 mol·L-1算)。
Al3+ Fe3+ Fe2+ Cu2+
开始沉淀的pH 3.0 1.1 5.8 4.2
沉淀完全的pH 5.0 3.2 8.8 6.7
(1) 柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3===FeCO3↓+Na2SO4
FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O
制备FeCO3时,选用的加料方式是______(填字母)。原因是______ ___________________________________________________________。
A. 将FeSO4溶液与Na2CO3溶液同时加入反应容器中
B. 将FeSO4溶液缓慢加入盛有Na2CO3溶液的反应容器中
C. 将Na2CO3溶液缓慢加入盛有FeSO4溶液的反应容器中
C
因为
Na2CO3溶液显碱性,其他两种投料方式都会生成Fe(OH)2沉淀
(2) 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
①酸溶时加入稀硫酸应适当过量,除了将菱镁矿充分溶解外,还有什么作用?
【答案】 抑制金属离子的水解。
②调pH时也可以加入MgO。为什么加入MgO也可析出Fe(OH)3沉淀?
课 堂 反 馈
2
4
5
1
3
1.下列过程或现象与盐类水解无关的是( )
A. 加热氯化铁溶液颜色变深
B. 铁在潮湿的环境下生锈
C. 纯碱溶液存放在带橡皮塞的试剂瓶中
D. 浓硫化钠溶液有臭味
【答案】 B
2
4
5
1
3
【答案】 A
2
4
5
3
3.下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是( )
A. FeCl2、FeCl3 B. Na2CO3、NaHCO3
C. Na[Al(OH)4]、AlCl3 D. Mg(HCO3)2、MgCl2
1
【答案】 C
2
4
5
3
1
实验序号 实验操作 实验现象
① 在Na2CO3溶液中滴入2~3滴酚酞试液 溶液变红
② 将红色溶液加热 红色变深
③ 冷却后,______________________________ _____________
加入过量CaCl2溶液(或BaCl2溶液)
溶液中红色消失
2
4
5
3
问题讨论:
甲、乙两同学用相同的试剂做验证水解反应吸热的实验。甲同学加热时,溶液红色变深,冷却到室温时又变回原来的颜色;乙同学加热后,红色也变深,冷却到室温,红色稍变浅但比甲的颜色深。
乙同学出现该现象的原因可能是______________________________ _______。
1
加热时间太长,使溶液浓度增大
(浓缩)
2
4
5
3
5.请回答下列有关的问题。
(1) 以磷石膏(主要成分为CaSO4,杂质为SiO2、Al2O3等)为原料可制备轻质CaCO3的流程如下:
在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因是_____________________________ _______________________________________。
1
溶液中c(H+)增大,促进固体中Ca2+浸出
2
4
5
3
(2) 实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液的流程如下:
若CaCO3的用量偏多,会使碱式硫酸铝中x值________(填“偏大”或“偏小”),理由是___________________________________________ ________。
1
偏小
CaCO3消耗更多的H+,促进Al3+水解,产生更
多的OH-
2
4
5
3
(3) 硫酸亚铁是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②将洗涤过的过量废铁屑加入稀硫酸,控制温度在50~80 ℃之间至反应停止。
……
实验步骤①的目的是________,加热的作用是__________________ _____________________________。
1
除油污
溶液碱性增强,去油污能力增强
2
4
5
3
(4) K2FeO4是一种高效水处理剂,具有强氧化性,在0~5 ℃、强碱性溶液中比较稳定,在酸性至弱碱性条件下,能与水反应生成O2和Fe(OH)3。实验室用饱和KClO溶液与饱和 Fe(NO3)3溶液混合制备K2FeO4时,混合方式为________________________________________________ ______________________。
1
在0~5 ℃、搅拌下,将饱和Fe(NO3)3溶液缓慢滴加到
饱和KClO溶液中
谢谢观看
Thank you for watching
