1.1.1原子核外电子的运动状态课件 (共31张PPT)2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1.1原子核外电子的运动状态课件 (共31张PPT)2023-2024学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 946.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 13:45:31 | ||
图片预览











文档简介
(共31张PPT)
第一章
原子结构与性质
第一节 原子结构
第1课时 原子核外电子的运动状态
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 认识有关原子模型的历史发展过程,学习原子结构的玻尔模型和电子云模型。
2. 知道核外电子根据能量的不同,可处于不同的能层和能级。
3. 了解电子云和原子轨道的含义。
活 动 方 案
1. 原子结构模型的发展经历了道尔顿模型(1803年)、汤姆孙模型、卢瑟福模型、玻尔模型和电子云模型五个阶段。原子模型依据科学实验和理论分析的不断发展而逐步发展和完善。其中汤姆孙和卢瑟福分别有如下的实验和发现:
1897年汤姆孙发现阴极射线是带负电的粒子,最先提出电子,电子体积很小,质量只有氢原子质量的约二千分之一。
1909年,汉斯·盖革和恩斯特·马斯登(Jishi.Y)在欧内斯特·卢瑟福指导下,用α射线轰击薄金箔,发现绝大多数的α粒子(带正电)都畅通无阻地穿过,偏转角度很小,大约有1/8 000 的α粒子会发生大于90°甚至等于150°的大角散射,极少数被反弹回去。
请分别说明原子结构的道尔顿模型、汤姆孙模型和卢瑟福模型。
活动一:回顾已经学习的原子模型和结构的有关知识
【答案】 道尔顿模型:化学元素由不可分的基本微粒——原子构成,原子在一切化学变化中是不可再分的最小单位。同种元素的原子性质和质量都相同,不同元素原子的性质和质量各不相同。
汤姆孙模型:原子是球体,一个平均分布着正电荷的粒子球,带负电的电子镶嵌在球内,中和了正电荷,整个原子显中性。
卢瑟福模型:原子的中心有个原子核,体积很小,但是质量很大,带正电荷,电子像太阳系的行星围绕太阳转那样,围绕着原子核旋转。
2. 原子是由哪些粒子构成的?原子核是由哪些粒子构成的?元素的种类取决于哪一种粒子的数目?
【答案】 原子由原子核和核外电子构成。原子核由质子和中子构成。元素的种类取决于质子的数目。
3. 原子中的质子数、核外电子数、中子数、核电荷数、质量数之间有哪些定量关系?
【答案】 核电荷数=质子数=核外电子数。质量数=质子数+中子数。
1. 阅读下列资料,并回答问题。
玻尔在前人研究的基础上,进一步提出原子结构的玻尔模型:电子在一定能量的轨道上运动;正常情况下电子在离核较近、能量较低的轨道上运动,获得能量后可以跃迁到离核较远、能量较高的轨道上运动,也可以再跃迁回来。
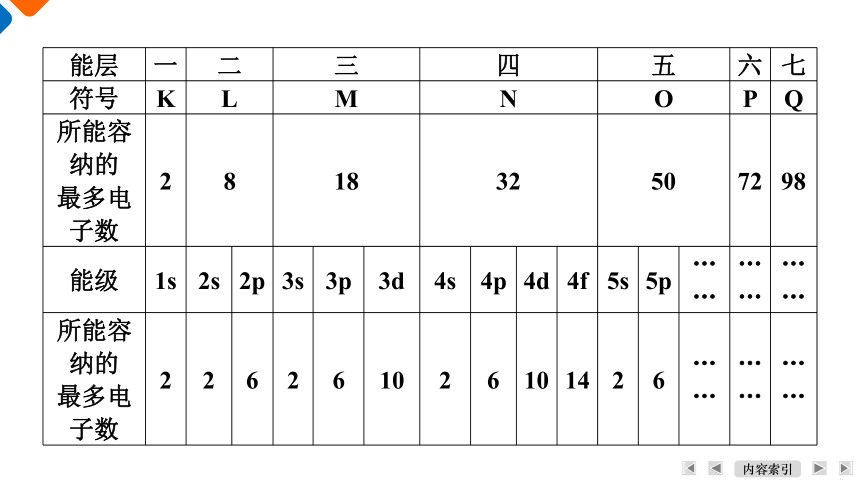
依据玻尔模型,将核外电子按能量不同分为不同能层,能层越高,电子的能量越高。同一能层的电子,还被分为不同能级,多电子原子中,同一能层各能级按s能级、p能级、d能级、f能级的顺序逐渐升高。核外电子的能层、能级及最多容纳电子数如下表所示。
活动二:认识原子结构的玻尔模型
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
所能容纳的 最多电子数 2 8 18 32 50 72 98
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …… …… ……
所能容纳的 最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …… …… ……
(1) 能层序数(n)与电子的能量高低是什么关系?原子核外电子每一能层所能容纳的最多电子数与能层序数(n)间存在什么关系?
【答案】 一般而言,n越大,电子离核的平均距离越远,电子具有的能量越高。每个电子层所能容纳的最多电子数为2n2。
(2) 每个能层所具有的能级数与能层序数(n)间存在什么关系?s、p、d、f能级上最多所能容纳的电子数分别是多少?
【答案】 每个能层的能级数等于能层序数(n)。s、p、d、f能级上最多所能容纳的电子数分别是2、6、10、14。
(3) 比较4s、4p、4d、4f能级中电子能量的高低。
【答案】 E(4s)<E(4p)<E(4d)<E(4f)
2. 电子排布式可以表示核外电子在不同能层、能级的排布情况。能级符号右上角的数字表示该能级的电子数。观察示例,然后写出指定基态原子的电子排布式。
例:H的基态电子排布式为1s1;B的基态电子排布式为1s22s22p1;S的基态电子排布式为1s22s22p63s23p4。
分别写出N、Ne、Na、Cl的基态原子的电子排布式。
【答案】 N的基态电子排布式为1s22s22p3;Ne的基态电子排布式为1s22s22p6;
Na的基态电子排布式为1s22s22p63s1;Cl的基态电子排布式为1s22s22p63s23p5。
1. 阅读下列资料,并回答问题。
活动三:认识原子结构的电子云模型
图1 氢原子的1s电子在原子核外出现的概率密度分布图
图2 电子云轮廓图的绘制过程
图3 同一原子的s电子的电子云轮廓图
(1) 图1中的小黑点是什么?小黑点越密,其表达的含义是什么?
【答案】 小黑点是1s电子在原子核外出现的概率密度的形象描述。小黑点越密,表明概率密度越大。
(2) s电子云的轮廓图为什么形状?同一原子不同能层s电子云有什么异同?
【答案】 为球形。形状均为球形,但半径:1s<2s<3s<4s。
(3) 图4所示为p电子云的轮廓图,右下标x、y、z分别是电子云在直角坐标系中的取向。
①p电子云轮廓像什么物体?
【答案】 哑铃。
②p电子云在空间上有几个取向、相互关系如何?
【答案】 3个取向、相互垂直。
图4 px、py、pz的电子云轮廓图
2. 量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。常用电子云轮廓图的形状和取向表示原子轨道的形状和取向。下表所示为1~4能层的能级、原子轨道数和原子轨道名称。
能层 能级 原子轨道数 原子轨道名称
一 1s 1 1s
二 2s 1 2s
2p 3 2px、2py、2pz
三 3s 1 3s
3p 3 3px、3py、3pz
3d 5 ……
四 4s 1 4s
4p 3 4px、4py、4pz
4d 5 ……
4f 7 ……
……
(1) s、p、d、f能级各含有多少原子轨道?
【答案】 1、3、5、7。
(2) 预测每个原子轨道中各含有多少电子?
【答案】 2个。
课 堂 反 馈
2
4
5
1
3
7
6
8
1. 下列能层中,不包含d能级的是( )
A. K B. Q
C. M D. N
【解析】 K能层是第一能层,只有1个1s能级,不包含d能级,A符合题意;Q能层是第七能层,含有7个能级,分别是7s、7p、7d、7f等能级,包含d能级,B不符合题意;M能层是第三能层,含有3个能级,分别是3s、3p、3d能级,包含d能级,C不符合题意;N能层是第四能层,含有4个能级,分别是4s、4p、4d、4f能级,包含d能级,D不符合题意。
【答案】 A
2
4
5
1
3
7
6
8
2. 符号为N的能层最多能容纳的电子数为( )
A. 18 B. 32
C. 50 D. 72
【解析】 符号为N的能层是第四能层,每一能层最多所能容纳的电子数为2n2,故N层最多能容纳的电子数为2×42=32。
【答案】 B
2
4
5
3
7
6
8
1
3. 下列有关电子云和原子轨道的说法正确的是( )
A. 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B. s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C. p能级的原子轨道呈哑铃形,随着能层的增加,p能级原子轨道也在增多
D. 与s电子的原子轨道相同,p电子的原子轨道的平均半径也随能层的增大而增大
2
4
5
3
7
6
8
1
【解析】 原子核外电子的概率密度分布看起来像一片云雾,而不是电子像云雾一样笼罩在原子核周围,A错误;处在s能级原子轨道上的电子,出现在球形内空间的概率为90%,B错误;无论是2p、3p、4p、5p,能级中原子轨道数目不变(都是3),只是能量增加,C错误。
【答案】 B
2
4
5
3
7
6
8
4. 某元素基态原子核外电子处于三个不同的能级,且每个能级中所含电子数相同。该元素是( )
A. Li B. C
C. Mg D. S
1
【答案】 B
2
4
5
3
7
6
8
5. 下列叙述正确的是( )
A. 能级就是电子层
B. 每个能层最多可容纳的电子数是2n2
C. 同一能层中的不同能级的能量高低相同
D. 不同能层中的s能级的能量高低相同
1
【解析】 能层是电子层,能级是电子能级,A错误;每个能层最多可容纳的电子数是2n2,但最外层不超过8个电子,次外层不超过18个电子,倒数第三层不超过32个电子,排列电子时这几条规律都要考虑,B正确;同一能层的不同能级能量不同,且按s、p、d…规律依次增大,C错误;不同能层中的s能级的能量高低不同,能层数越大,其s能级的能量越高,D错误。
【答案】 B
2
4
5
3
7
6
8
6. K层有______个能级,用符号表示为________;L层有______个能级,用符号表示为______________;M层有______个能级,用符号分别表示为____________________。由此可推知,n能层最多可能有____个能级,能量最低的两个能级的符号分别表示为______________,它们的原子轨道电子云形状分别为________、__________。
1
1
1s
2
2s、2p
3
3s、3p、3d
n
ns、np
球形
哑铃形
2
4
5
3
7
6
8
7. 下图是s能级和p能级的电子云轮廓图,试回答问题。
(1) s电子云轮廓图呈______形,每个s能级有______个原子轨道;p电子云轮廓图呈________________形,每个p能级有______个原子轨道,其能量________(填“相等”或“不等”)。
1
【解析】 ns能级各有1个轨道,np能级各有3个轨道,s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃状的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示,它们的能量完全相等。
球
1
哑铃(纺锤)
3
相等
2
4
5
3
7
6
8
(2) 元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是________电子,其电子云在空间有______________________方向;X
元素的元素符号是______,它的简单氢化物的电子式是________。
1
【解析】 因为元素X的原子最外层电子排布式为nsnnpn+1,np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3,则X是氮元素。
2p
三个互相垂直的伸展
N
2
4
5
3
7
6
8
8. 写出1~18号元素的基态原子的电子排布式。
【答案】 H:1s1 He:1s2 Li:1s22s1 Be:1s22s2
B:1s22s22p1 C:1s22s22p2 N:1s22s22p3
O:1s22s22p4 F:1s22s22p5 Ne:1s22s22p6
Na:1s22s22p63s1 Mg:1s22s22p63s2
Al:1s22s22p63s23p1 Si:1s22s22p63s23p2
P:1s22s22p63s23p3 S:1s22s22p63s23p4
Cl:1s22s22p63s23p5 Ar:1s22s22p63s23p6
1
谢谢观看
Thank you for watching
第一章
原子结构与性质
第一节 原子结构
第1课时 原子核外电子的运动状态
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 认识有关原子模型的历史发展过程,学习原子结构的玻尔模型和电子云模型。
2. 知道核外电子根据能量的不同,可处于不同的能层和能级。
3. 了解电子云和原子轨道的含义。
活 动 方 案
1. 原子结构模型的发展经历了道尔顿模型(1803年)、汤姆孙模型、卢瑟福模型、玻尔模型和电子云模型五个阶段。原子模型依据科学实验和理论分析的不断发展而逐步发展和完善。其中汤姆孙和卢瑟福分别有如下的实验和发现:
1897年汤姆孙发现阴极射线是带负电的粒子,最先提出电子,电子体积很小,质量只有氢原子质量的约二千分之一。
1909年,汉斯·盖革和恩斯特·马斯登(Jishi.Y)在欧内斯特·卢瑟福指导下,用α射线轰击薄金箔,发现绝大多数的α粒子(带正电)都畅通无阻地穿过,偏转角度很小,大约有1/8 000 的α粒子会发生大于90°甚至等于150°的大角散射,极少数被反弹回去。
请分别说明原子结构的道尔顿模型、汤姆孙模型和卢瑟福模型。
活动一:回顾已经学习的原子模型和结构的有关知识
【答案】 道尔顿模型:化学元素由不可分的基本微粒——原子构成,原子在一切化学变化中是不可再分的最小单位。同种元素的原子性质和质量都相同,不同元素原子的性质和质量各不相同。
汤姆孙模型:原子是球体,一个平均分布着正电荷的粒子球,带负电的电子镶嵌在球内,中和了正电荷,整个原子显中性。
卢瑟福模型:原子的中心有个原子核,体积很小,但是质量很大,带正电荷,电子像太阳系的行星围绕太阳转那样,围绕着原子核旋转。
2. 原子是由哪些粒子构成的?原子核是由哪些粒子构成的?元素的种类取决于哪一种粒子的数目?
【答案】 原子由原子核和核外电子构成。原子核由质子和中子构成。元素的种类取决于质子的数目。
3. 原子中的质子数、核外电子数、中子数、核电荷数、质量数之间有哪些定量关系?
【答案】 核电荷数=质子数=核外电子数。质量数=质子数+中子数。
1. 阅读下列资料,并回答问题。
玻尔在前人研究的基础上,进一步提出原子结构的玻尔模型:电子在一定能量的轨道上运动;正常情况下电子在离核较近、能量较低的轨道上运动,获得能量后可以跃迁到离核较远、能量较高的轨道上运动,也可以再跃迁回来。
依据玻尔模型,将核外电子按能量不同分为不同能层,能层越高,电子的能量越高。同一能层的电子,还被分为不同能级,多电子原子中,同一能层各能级按s能级、p能级、d能级、f能级的顺序逐渐升高。核外电子的能层、能级及最多容纳电子数如下表所示。
活动二:认识原子结构的玻尔模型
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
所能容纳的 最多电子数 2 8 18 32 50 72 98
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …… …… ……
所能容纳的 最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …… …… ……
(1) 能层序数(n)与电子的能量高低是什么关系?原子核外电子每一能层所能容纳的最多电子数与能层序数(n)间存在什么关系?
【答案】 一般而言,n越大,电子离核的平均距离越远,电子具有的能量越高。每个电子层所能容纳的最多电子数为2n2。
(2) 每个能层所具有的能级数与能层序数(n)间存在什么关系?s、p、d、f能级上最多所能容纳的电子数分别是多少?
【答案】 每个能层的能级数等于能层序数(n)。s、p、d、f能级上最多所能容纳的电子数分别是2、6、10、14。
(3) 比较4s、4p、4d、4f能级中电子能量的高低。
【答案】 E(4s)<E(4p)<E(4d)<E(4f)
2. 电子排布式可以表示核外电子在不同能层、能级的排布情况。能级符号右上角的数字表示该能级的电子数。观察示例,然后写出指定基态原子的电子排布式。
例:H的基态电子排布式为1s1;B的基态电子排布式为1s22s22p1;S的基态电子排布式为1s22s22p63s23p4。
分别写出N、Ne、Na、Cl的基态原子的电子排布式。
【答案】 N的基态电子排布式为1s22s22p3;Ne的基态电子排布式为1s22s22p6;
Na的基态电子排布式为1s22s22p63s1;Cl的基态电子排布式为1s22s22p63s23p5。
1. 阅读下列资料,并回答问题。
活动三:认识原子结构的电子云模型
图1 氢原子的1s电子在原子核外出现的概率密度分布图
图2 电子云轮廓图的绘制过程
图3 同一原子的s电子的电子云轮廓图
(1) 图1中的小黑点是什么?小黑点越密,其表达的含义是什么?
【答案】 小黑点是1s电子在原子核外出现的概率密度的形象描述。小黑点越密,表明概率密度越大。
(2) s电子云的轮廓图为什么形状?同一原子不同能层s电子云有什么异同?
【答案】 为球形。形状均为球形,但半径:1s<2s<3s<4s。
(3) 图4所示为p电子云的轮廓图,右下标x、y、z分别是电子云在直角坐标系中的取向。
①p电子云轮廓像什么物体?
【答案】 哑铃。
②p电子云在空间上有几个取向、相互关系如何?
【答案】 3个取向、相互垂直。
图4 px、py、pz的电子云轮廓图
2. 量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。常用电子云轮廓图的形状和取向表示原子轨道的形状和取向。下表所示为1~4能层的能级、原子轨道数和原子轨道名称。
能层 能级 原子轨道数 原子轨道名称
一 1s 1 1s
二 2s 1 2s
2p 3 2px、2py、2pz
三 3s 1 3s
3p 3 3px、3py、3pz
3d 5 ……
四 4s 1 4s
4p 3 4px、4py、4pz
4d 5 ……
4f 7 ……
……
(1) s、p、d、f能级各含有多少原子轨道?
【答案】 1、3、5、7。
(2) 预测每个原子轨道中各含有多少电子?
【答案】 2个。
课 堂 反 馈
2
4
5
1
3
7
6
8
1. 下列能层中,不包含d能级的是( )
A. K B. Q
C. M D. N
【解析】 K能层是第一能层,只有1个1s能级,不包含d能级,A符合题意;Q能层是第七能层,含有7个能级,分别是7s、7p、7d、7f等能级,包含d能级,B不符合题意;M能层是第三能层,含有3个能级,分别是3s、3p、3d能级,包含d能级,C不符合题意;N能层是第四能层,含有4个能级,分别是4s、4p、4d、4f能级,包含d能级,D不符合题意。
【答案】 A
2
4
5
1
3
7
6
8
2. 符号为N的能层最多能容纳的电子数为( )
A. 18 B. 32
C. 50 D. 72
【解析】 符号为N的能层是第四能层,每一能层最多所能容纳的电子数为2n2,故N层最多能容纳的电子数为2×42=32。
【答案】 B
2
4
5
3
7
6
8
1
3. 下列有关电子云和原子轨道的说法正确的是( )
A. 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B. s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C. p能级的原子轨道呈哑铃形,随着能层的增加,p能级原子轨道也在增多
D. 与s电子的原子轨道相同,p电子的原子轨道的平均半径也随能层的增大而增大
2
4
5
3
7
6
8
1
【解析】 原子核外电子的概率密度分布看起来像一片云雾,而不是电子像云雾一样笼罩在原子核周围,A错误;处在s能级原子轨道上的电子,出现在球形内空间的概率为90%,B错误;无论是2p、3p、4p、5p,能级中原子轨道数目不变(都是3),只是能量增加,C错误。
【答案】 B
2
4
5
3
7
6
8
4. 某元素基态原子核外电子处于三个不同的能级,且每个能级中所含电子数相同。该元素是( )
A. Li B. C
C. Mg D. S
1
【答案】 B
2
4
5
3
7
6
8
5. 下列叙述正确的是( )
A. 能级就是电子层
B. 每个能层最多可容纳的电子数是2n2
C. 同一能层中的不同能级的能量高低相同
D. 不同能层中的s能级的能量高低相同
1
【解析】 能层是电子层,能级是电子能级,A错误;每个能层最多可容纳的电子数是2n2,但最外层不超过8个电子,次外层不超过18个电子,倒数第三层不超过32个电子,排列电子时这几条规律都要考虑,B正确;同一能层的不同能级能量不同,且按s、p、d…规律依次增大,C错误;不同能层中的s能级的能量高低不同,能层数越大,其s能级的能量越高,D错误。
【答案】 B
2
4
5
3
7
6
8
6. K层有______个能级,用符号表示为________;L层有______个能级,用符号表示为______________;M层有______个能级,用符号分别表示为____________________。由此可推知,n能层最多可能有____个能级,能量最低的两个能级的符号分别表示为______________,它们的原子轨道电子云形状分别为________、__________。
1
1
1s
2
2s、2p
3
3s、3p、3d
n
ns、np
球形
哑铃形
2
4
5
3
7
6
8
7. 下图是s能级和p能级的电子云轮廓图,试回答问题。
(1) s电子云轮廓图呈______形,每个s能级有______个原子轨道;p电子云轮廓图呈________________形,每个p能级有______个原子轨道,其能量________(填“相等”或“不等”)。
1
【解析】 ns能级各有1个轨道,np能级各有3个轨道,s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃状的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示,它们的能量完全相等。
球
1
哑铃(纺锤)
3
相等
2
4
5
3
7
6
8
(2) 元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是________电子,其电子云在空间有______________________方向;X
元素的元素符号是______,它的简单氢化物的电子式是________。
1
【解析】 因为元素X的原子最外层电子排布式为nsnnpn+1,np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3,则X是氮元素。
2p
三个互相垂直的伸展
N
2
4
5
3
7
6
8
8. 写出1~18号元素的基态原子的电子排布式。
【答案】 H:1s1 He:1s2 Li:1s22s1 Be:1s22s2
B:1s22s22p1 C:1s22s22p2 N:1s22s22p3
O:1s22s22p4 F:1s22s22p5 Ne:1s22s22p6
Na:1s22s22p63s1 Mg:1s22s22p63s2
Al:1s22s22p63s23p1 Si:1s22s22p63s23p2
P:1s22s22p63s23p3 S:1s22s22p63s23p4
Cl:1s22s22p63s23p5 Ar:1s22s22p63s23p6
1
谢谢观看
Thank you for watching
