2.1.1共价键的形成与特征课件(共29张PPT) 2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1.1共价键的形成与特征课件(共29张PPT) 2023-2024学年高二下学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 14:13:53 | ||
图片预览








文档简介
(共29张PPT)
第二章
分子结构与性质
第一节 共价键
第1课时 共价键的形成与特征
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。
2. 知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
3. 知道共价键可分为极性和非极性共价键。
活 动 方 案
1. 通过用电子式表示共价键的形成过程,理解共价键的一个特征。
(1) 用电子式表示HCl、H2O、NH3、N2的形成过程。归纳出形成共价键的数目与原子核外未成对电子数之间存在着怎样的关系?
活动一:从不同角度认识共价键的形成
【答案】
一般地,形成共价键的数目等于原子核外未成对电子数。
(2) 我们生活的环境中一般不存在H3、Cl3、HCl2等分子,这是由共价键的什么性质决定的?
【答案】 共价键的饱和性。
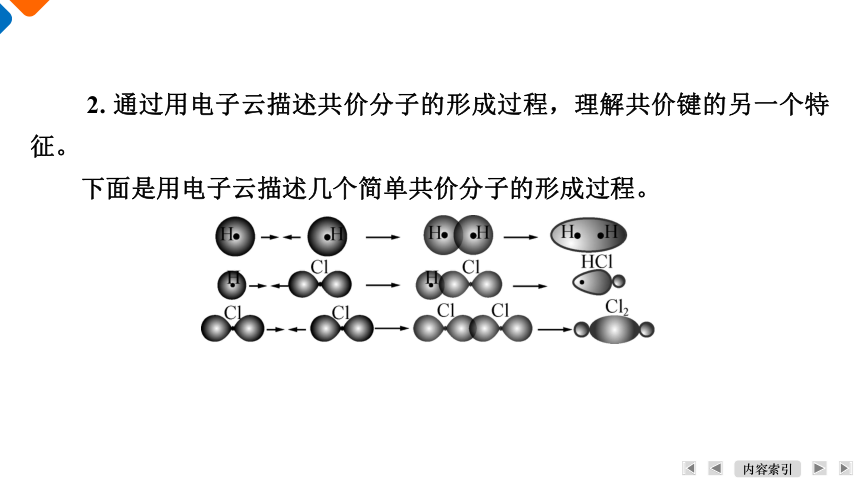
2. 通过用电子云描述共价分子的形成过程,理解共价键的另一个特征。
下面是用电子云描述几个简单共价分子的形成过程。
(1) 这些电子云分别是由什么原子轨道重叠而成的?
【答案】 ①H2:s原子轨道与s原子轨道;②HCl:s原子轨道与p原子轨道;③Cl2:p原子轨道与p原子轨道。
(2) 为何除s电子云与s电子云重叠时没有方向,而s电子云与p电子云、p电子云与p电子云均是沿p电子云轨道的键轴方向重叠?共价键的这种特征性质称为共价键的什么性?
【答案】 电子云沿这样的方向重叠的程度达到最大,最稳定;而s电子云呈球形对称,沿任何方向重叠都相同。共价键的这种特征性质称为共价键的方向性。
(3) 预测H2S分子中所形成的共价键之间的夹角约是多少度?
【答案】 90°(实际为92°)
3. 从能量的角度理解共价键形成的原因。
右图是某同学从网站上查阅到的氢气分子的能量与核间距的关系。你认为两个氢原子间为何能够通过共价键形成氢分子?
【答案】 两个氢原子通过共价键形成氢分子后,体系能量降低,氢分子比氢原子更稳定。
4. 从原子的电负性差别来理解共价键。
原子 Na Cl H Cl C O
电负性
电负性之差的绝对值 结论 0.9
3.0
2.1
3.0
2.5
3.5
2.1
0.9
1.0
当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是离子键;而电负性相差不大时,原子之间形成共价键
1. 根据共用电子对是否发生偏移,对共价键进行分类。
(1) 成键原子对共用电子对的吸引与拔河相似,H2O、NH3、HF分子中的氢原子相当于右图中的相扑师还是小孩?成键原子对共用电子对的吸引能力可用何种物理量来衡量?
【答案】 相当于图中的小孩 电负性
活动二:从不同角度对共价键进行分类
(2) 共用电子对不发生偏移的共价键是非极性
共价键。右图所示的H2O、O2、NH3、HF分子中,
何种分子中含有非极性共价键?
【答案】 O2
(3) 你认为非同种元素原子之间形成的极性共价键的极性强弱与两种原子的电负性差值存在着怎样的关系?
【答案】 形成极性共价键的原子的电负性差值越大,该共价键的极性就越强。
(4) OF2分子中氧元素的化合价是多少?
【答案】 +2价
2. 根据原子轨道的重叠方式,对共价键进行分类。
原子轨道以“头碰头”的方式重叠形成σ键,以“肩并肩”的方式重叠则形成π键。
(1) H2、HCl、Cl2分子所形成的共价键分别是什么类型的共价键?
【答案】 都是σ键。
(2) 下列p电子云重叠所形成的共价键属于什么类型的共价键?
【答案】 π键
(3) 若将σ键、π键分别进行旋转,是否会发生断裂?
【答案】 σ键的特征为轴对称,故旋转时不会断裂;π键的特征为镜面对称,若旋转则会断裂(也就是说π键不能旋转)。
(4) N原子中未成对电子的原子轨道如图所示。推测2个N原子沿x轴方向相互靠近,有几组原子轨道进行重叠?形成的共价键类型是什么?
【答案】 有3组原子轨道进行重叠(2px与2px头碰头重叠,2py与2py、2pz与2pz肩并肩重叠)。既有σ键(1个)又有π键(2个)。
3. 根据共价键中含共用电子对的数目,对共价键进行分类。
在N2H4和HCN分子中一个氮原子均形成3根共价键,请写出它们的结构式并指出每个分子中共价单键、共价双键或共价三键的数目。
(1) N2H4
【答案】 只有5个共价单键
(2) HCN
【答案】 H—C≡N 1个共价单键、1个共价三键
在下表中对应的位置填上乙烷、乙烯、乙炔分子中σ键和π键的数目。
活动三:寻找分子中单键、双键、三键与σ键和π键的关系
结构
名称 乙烷 乙烯 乙炔
σ键
π键
规律 7
5
3
0
1
2
共价单键都是σ键;共价双键中有1个σ键和1个π键;共价三键中有1个σ键和2个π键
课 堂 反 馈
2
4
5
1
3
7
6
1. 根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是( )
A. 两者都为s-s σ键
B. 两者都为p-p σ键
C. 前者为p-p σ键,后者为s-p σ键
D. 前者为s-s σ键,后者为s-p σ键
【解析】 H原子的1个电子排布在1s轨道,F原子的最外层7个电子的排布为2s、2p轨道,F2单质中共价键是p-p σ键,而HF分子中是H原子的1s轨道与F原子的2p轨道头碰头重叠,形成 s-p σ 键。
【答案】 C
2
4
5
1
3
7
6
2. 下列说法不正确的是( )
A. 一般地,σ键比π键重叠程度大,稳定性强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质分子中,一定有σ键,可能有π键
D. HClO分子中有s-p σ键和p-p σ键
【解析】 原子轨道以“头碰头”方式相互重叠形成的共价键为σ键,以“肩并肩”方式相互重叠形成的共价键为π键,一般地,σ键比π键重叠程度大,稳定性强,A正确;双键、三键中,只有一个σ键,其他为π键,B正确;气体单质分子中,可能有σ键,如Cl2,可能有π键,如N2,也可能没有化学键,如稀有气体,C错误;H—O—Cl分子中,H—O键是 s-p σ 键,O—Cl键是p-p σ键,D正确。
【答案】 C
2
4
5
3
7
6
3. 下列说法正确的是( )
A. 所有共价键都有方向性
B. HCHO分子中σ键与π键个数比为2∶1
C. 若把H2S分子写成H3S分子,违背了共价键的饱和性
D. 两个原子轨道发生重叠后,两核间的电子仅存在于两核之间
1
【解析】 共价键通常具有方向性,但并非所有的共价键都具有方向性,比如H2的共价键没有方向性,A错误;HCHO中含有两个单键和一个双键,则σ键与π键个数之比为3∶1,B错误;S原子最外层只有6个电子,可与两个电子形成共价键,与H形成的化合物为H2S,否则违背了共价键的饱和性,C正确;两原子形成共价键后,两核间电子是绕两核运动的,D错误。
【答案】 C
2
4
5
3
7
6
4. 下列对共价键的描述中,不正确的是( )
A. 共价键是通过共用电子对形成的
B. 形成共价键的原子之间电负性相同或相差不大
C. 一般情况下,一个原子有几个未成对电子就会与几个自旋相反的未成对电子成键
D. 共价键是通过共用电子对形成的,不属于电性作用
1
2
4
5
3
7
6
1
【解析】 通常情况下,吸引电子能力相同(或相近)的原子之间通过共用电子对形成共价键,A正确;形成共价键的原子之间的电负性相同或相差不大,B正确;由于共价键具有饱和性,一般情况下,一个原子有几个未成对电子就会与几个自旋状态相反的未成对电子成键,C正确;共价键是通过共用电子对形成的,共价键也是一种电性作用,D错误。
【答案】 D
2
4
5
3
7
6
5. 在下列分子中:①HF ②Cl2 ③BF3 ④N2 ⑤CS2 ⑥H2 ⑦C2H2 ⑧HCN(H—C≡N)
(1) 分子中只有σ键的是________________(填序号,下同)。
(2) 分子中所有原子都满足最外层8e-稳定结构的是____________。
(3) 分子中既含有极性键、又含有非极性键的是______。
1
①②③⑥
②④⑤
⑦
2
4
5
3
7
6
6. 分析下列化学式中加点的元素,选出符合要求的物质填空。
(1) 所有的价电子都参与形成共价键的是________(填字母,下同)。
(2) 只有1个价电子参与形成共价键的是______。
(3) 最外层有未参与成键的电子对的是____________。
1
DE
C
ABCF
2
4
5
3
7
6
1
【解析】 (1) 原子的最外层电子数与共价键的数目相同时,所有的价电子都参与形成共价键,CH4中碳原子与4个氢原子形成4个σ键,C2H6中碳原子分别与3个氢原子及另1个碳原子形成4个σ键,所有的价电子都参与形成共价键,故选DE。(2) 只有一个价电子参与形成共价键,则分子中只有1个共价键,HCl中只含有1个H—Cl键,即氯原子与1个氢原子形成1个σ键,故选C。(3) 最外层有未参与成键的电子对,则最外层电子数大于共价键数,NH3中氮原子与3个氢原子形成3个σ键,还有1个孤电子对,H2O中氧原子与2个氢原子形成2个σ键,还有2个孤电子对,HCl中氯原子与1个氢原子形成1个σ键,还有3个孤电子对,N2中氮原子与另一个氮原子形成1个σ键,2个π键,每个N原子含有1个孤电子对,故选ABCF。
2
4
5
3
7
6
7. 有三种物质AC2、B2C2、AD4,元素A的最高正价和负价的绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子的相同,则:
(1) A、B、C、D的元素名称分别为_____、_____、_____、_____。
(2) AD4分子中含有的共价键类型为_______(填“σ键”或“π键”)。
(3) D的负一价阴离子的电子排布式为_________________,B2C2的
电子式为______________________,B2C2属于______________(填“离子
化合物”或“共价化合物”)。
1
碳
钠
氧
氯
σ键
1s22s22p63s23p6
离子化合物
2
4
5
3
7
6
1
【解析】 根据元素A的最高正价和负价绝对值相等知,元素A是碳元素,根据淡黄色固体B2C2和火焰呈黄色知,B元素是钠元素,C元素是氧元素,元素D的负一价阴离子电子层结构与氩原子相同,D是氯元素。
谢谢观看
Thank you for watching
第二章
分子结构与性质
第一节 共价键
第1课时 共价键的形成与特征
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。
2. 知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。
3. 知道共价键可分为极性和非极性共价键。
活 动 方 案
1. 通过用电子式表示共价键的形成过程,理解共价键的一个特征。
(1) 用电子式表示HCl、H2O、NH3、N2的形成过程。归纳出形成共价键的数目与原子核外未成对电子数之间存在着怎样的关系?
活动一:从不同角度认识共价键的形成
【答案】
一般地,形成共价键的数目等于原子核外未成对电子数。
(2) 我们生活的环境中一般不存在H3、Cl3、HCl2等分子,这是由共价键的什么性质决定的?
【答案】 共价键的饱和性。
2. 通过用电子云描述共价分子的形成过程,理解共价键的另一个特征。
下面是用电子云描述几个简单共价分子的形成过程。
(1) 这些电子云分别是由什么原子轨道重叠而成的?
【答案】 ①H2:s原子轨道与s原子轨道;②HCl:s原子轨道与p原子轨道;③Cl2:p原子轨道与p原子轨道。
(2) 为何除s电子云与s电子云重叠时没有方向,而s电子云与p电子云、p电子云与p电子云均是沿p电子云轨道的键轴方向重叠?共价键的这种特征性质称为共价键的什么性?
【答案】 电子云沿这样的方向重叠的程度达到最大,最稳定;而s电子云呈球形对称,沿任何方向重叠都相同。共价键的这种特征性质称为共价键的方向性。
(3) 预测H2S分子中所形成的共价键之间的夹角约是多少度?
【答案】 90°(实际为92°)
3. 从能量的角度理解共价键形成的原因。
右图是某同学从网站上查阅到的氢气分子的能量与核间距的关系。你认为两个氢原子间为何能够通过共价键形成氢分子?
【答案】 两个氢原子通过共价键形成氢分子后,体系能量降低,氢分子比氢原子更稳定。
4. 从原子的电负性差别来理解共价键。
原子 Na Cl H Cl C O
电负性
电负性之差的绝对值 结论 0.9
3.0
2.1
3.0
2.5
3.5
2.1
0.9
1.0
当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是离子键;而电负性相差不大时,原子之间形成共价键
1. 根据共用电子对是否发生偏移,对共价键进行分类。
(1) 成键原子对共用电子对的吸引与拔河相似,H2O、NH3、HF分子中的氢原子相当于右图中的相扑师还是小孩?成键原子对共用电子对的吸引能力可用何种物理量来衡量?
【答案】 相当于图中的小孩 电负性
活动二:从不同角度对共价键进行分类
(2) 共用电子对不发生偏移的共价键是非极性
共价键。右图所示的H2O、O2、NH3、HF分子中,
何种分子中含有非极性共价键?
【答案】 O2
(3) 你认为非同种元素原子之间形成的极性共价键的极性强弱与两种原子的电负性差值存在着怎样的关系?
【答案】 形成极性共价键的原子的电负性差值越大,该共价键的极性就越强。
(4) OF2分子中氧元素的化合价是多少?
【答案】 +2价
2. 根据原子轨道的重叠方式,对共价键进行分类。
原子轨道以“头碰头”的方式重叠形成σ键,以“肩并肩”的方式重叠则形成π键。
(1) H2、HCl、Cl2分子所形成的共价键分别是什么类型的共价键?
【答案】 都是σ键。
(2) 下列p电子云重叠所形成的共价键属于什么类型的共价键?
【答案】 π键
(3) 若将σ键、π键分别进行旋转,是否会发生断裂?
【答案】 σ键的特征为轴对称,故旋转时不会断裂;π键的特征为镜面对称,若旋转则会断裂(也就是说π键不能旋转)。
(4) N原子中未成对电子的原子轨道如图所示。推测2个N原子沿x轴方向相互靠近,有几组原子轨道进行重叠?形成的共价键类型是什么?
【答案】 有3组原子轨道进行重叠(2px与2px头碰头重叠,2py与2py、2pz与2pz肩并肩重叠)。既有σ键(1个)又有π键(2个)。
3. 根据共价键中含共用电子对的数目,对共价键进行分类。
在N2H4和HCN分子中一个氮原子均形成3根共价键,请写出它们的结构式并指出每个分子中共价单键、共价双键或共价三键的数目。
(1) N2H4
【答案】 只有5个共价单键
(2) HCN
【答案】 H—C≡N 1个共价单键、1个共价三键
在下表中对应的位置填上乙烷、乙烯、乙炔分子中σ键和π键的数目。
活动三:寻找分子中单键、双键、三键与σ键和π键的关系
结构
名称 乙烷 乙烯 乙炔
σ键
π键
规律 7
5
3
0
1
2
共价单键都是σ键;共价双键中有1个σ键和1个π键;共价三键中有1个σ键和2个π键
课 堂 反 馈
2
4
5
1
3
7
6
1. 根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是( )
A. 两者都为s-s σ键
B. 两者都为p-p σ键
C. 前者为p-p σ键,后者为s-p σ键
D. 前者为s-s σ键,后者为s-p σ键
【解析】 H原子的1个电子排布在1s轨道,F原子的最外层7个电子的排布为2s、2p轨道,F2单质中共价键是p-p σ键,而HF分子中是H原子的1s轨道与F原子的2p轨道头碰头重叠,形成 s-p σ 键。
【答案】 C
2
4
5
1
3
7
6
2. 下列说法不正确的是( )
A. 一般地,σ键比π键重叠程度大,稳定性强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质分子中,一定有σ键,可能有π键
D. HClO分子中有s-p σ键和p-p σ键
【解析】 原子轨道以“头碰头”方式相互重叠形成的共价键为σ键,以“肩并肩”方式相互重叠形成的共价键为π键,一般地,σ键比π键重叠程度大,稳定性强,A正确;双键、三键中,只有一个σ键,其他为π键,B正确;气体单质分子中,可能有σ键,如Cl2,可能有π键,如N2,也可能没有化学键,如稀有气体,C错误;H—O—Cl分子中,H—O键是 s-p σ 键,O—Cl键是p-p σ键,D正确。
【答案】 C
2
4
5
3
7
6
3. 下列说法正确的是( )
A. 所有共价键都有方向性
B. HCHO分子中σ键与π键个数比为2∶1
C. 若把H2S分子写成H3S分子,违背了共价键的饱和性
D. 两个原子轨道发生重叠后,两核间的电子仅存在于两核之间
1
【解析】 共价键通常具有方向性,但并非所有的共价键都具有方向性,比如H2的共价键没有方向性,A错误;HCHO中含有两个单键和一个双键,则σ键与π键个数之比为3∶1,B错误;S原子最外层只有6个电子,可与两个电子形成共价键,与H形成的化合物为H2S,否则违背了共价键的饱和性,C正确;两原子形成共价键后,两核间电子是绕两核运动的,D错误。
【答案】 C
2
4
5
3
7
6
4. 下列对共价键的描述中,不正确的是( )
A. 共价键是通过共用电子对形成的
B. 形成共价键的原子之间电负性相同或相差不大
C. 一般情况下,一个原子有几个未成对电子就会与几个自旋相反的未成对电子成键
D. 共价键是通过共用电子对形成的,不属于电性作用
1
2
4
5
3
7
6
1
【解析】 通常情况下,吸引电子能力相同(或相近)的原子之间通过共用电子对形成共价键,A正确;形成共价键的原子之间的电负性相同或相差不大,B正确;由于共价键具有饱和性,一般情况下,一个原子有几个未成对电子就会与几个自旋状态相反的未成对电子成键,C正确;共价键是通过共用电子对形成的,共价键也是一种电性作用,D错误。
【答案】 D
2
4
5
3
7
6
5. 在下列分子中:①HF ②Cl2 ③BF3 ④N2 ⑤CS2 ⑥H2 ⑦C2H2 ⑧HCN(H—C≡N)
(1) 分子中只有σ键的是________________(填序号,下同)。
(2) 分子中所有原子都满足最外层8e-稳定结构的是____________。
(3) 分子中既含有极性键、又含有非极性键的是______。
1
①②③⑥
②④⑤
⑦
2
4
5
3
7
6
6. 分析下列化学式中加点的元素,选出符合要求的物质填空。
(1) 所有的价电子都参与形成共价键的是________(填字母,下同)。
(2) 只有1个价电子参与形成共价键的是______。
(3) 最外层有未参与成键的电子对的是____________。
1
DE
C
ABCF
2
4
5
3
7
6
1
【解析】 (1) 原子的最外层电子数与共价键的数目相同时,所有的价电子都参与形成共价键,CH4中碳原子与4个氢原子形成4个σ键,C2H6中碳原子分别与3个氢原子及另1个碳原子形成4个σ键,所有的价电子都参与形成共价键,故选DE。(2) 只有一个价电子参与形成共价键,则分子中只有1个共价键,HCl中只含有1个H—Cl键,即氯原子与1个氢原子形成1个σ键,故选C。(3) 最外层有未参与成键的电子对,则最外层电子数大于共价键数,NH3中氮原子与3个氢原子形成3个σ键,还有1个孤电子对,H2O中氧原子与2个氢原子形成2个σ键,还有2个孤电子对,HCl中氯原子与1个氢原子形成1个σ键,还有3个孤电子对,N2中氮原子与另一个氮原子形成1个σ键,2个π键,每个N原子含有1个孤电子对,故选ABCF。
2
4
5
3
7
6
7. 有三种物质AC2、B2C2、AD4,元素A的最高正价和负价的绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子的相同,则:
(1) A、B、C、D的元素名称分别为_____、_____、_____、_____。
(2) AD4分子中含有的共价键类型为_______(填“σ键”或“π键”)。
(3) D的负一价阴离子的电子排布式为_________________,B2C2的
电子式为______________________,B2C2属于______________(填“离子
化合物”或“共价化合物”)。
1
碳
钠
氧
氯
σ键
1s22s22p63s23p6
离子化合物
2
4
5
3
7
6
1
【解析】 根据元素A的最高正价和负价绝对值相等知,元素A是碳元素,根据淡黄色固体B2C2和火焰呈黄色知,B元素是钠元素,C元素是氧元素,元素D的负一价阴离子电子层结构与氩原子相同,D是氯元素。
谢谢观看
Thank you for watching
