2.1.2共价键的参数——键能、键长与键角课件 (共27张PPT)2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1.2共价键的参数——键能、键长与键角课件 (共27张PPT)2023-2024学年高二下学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 14:14:54 | ||
图片预览








文档简介
(共27张PPT)
第二章
分子结构与性质
第一节 共价键
第2课时 共价键的参数——键能、键长与键角
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 知道共价键的键能、键长、键角可以用来描述键的强弱和分子的空间结构。
2. 知道σ键和π键强度的相对大小。
活 动 方 案
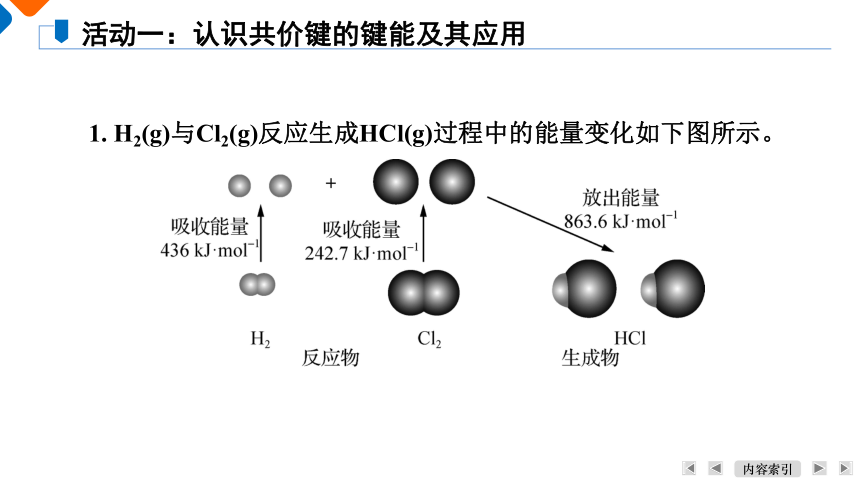
1. H2(g)与Cl2(g)反应生成HCl(g)过程中的能量变化如下图所示。
活动一:认识共价键的键能及其应用
(1) 上图中的“436 kJ·mol-1”“242.7 kJ·mol-1”分别是H—H、Cl—Cl的键能,请用自己的话给键能下一个定义,并说明共价键的稳定性与键能的大小有什么关系?
【答案】 键能是指气态分子中1 mol化学键解离成气态原子所吸收的能量(或键能是气态基态原子形成 1 mol 化学键释放的能量)。共价键越稳定,键能越大;反之键能越小。
(2) “H—Cl” 的键能是多少?
【答案】 431.8 kJ·mol-1
(3) 写出上述反应的热化学方程式。
【答案】 H2(g)+Cl2(g)===2HCl(g) ΔH=-184.9 kJ·mol-1
2. (1) 比较HF、HCl、HBr、HI的热稳定性。
【答案】 热稳定性:HF>HCl>HBr>HI
(2) N的非金属性与Cl相近,为什么N2的化学性质非常稳定,而Cl2的化学性质却很活泼?
【答案】 N≡N键的键能远大于Cl—Cl键的键能,化学反应中很难被破坏,所以N2化学性质稳定。
(3) 计算反应N2(g)+3H2(g) 2NH3(g)的ΔH。
【答案】 ΔH=946 kJ·mol-1+3×436 kJ·mol-1-6×390.8 kJ·mol-1 =-90.8 kJ·mol-1
3. C===C键的键能小于C—C键的键能的2倍。
(1) 请你据此分析,σ键与π键哪个更稳定?
【答案】 碳碳双键中有一个σ键和一个π键,碳碳单键只有σ键,而C===C的键能小于C—C键能的2倍,说明σ键的键能比π键的键能大,即σ键比π键稳定。
(2) 乙烷为何不能与Br2的CCl4溶液反应,而乙烯能与Br2的CCl4溶液发生加成反应?
【答案】 乙烷分子中的C—C键为σ键,强度较大,难断裂;而乙烯分子含有的C===C中有一个是π键,强度较小,容易断裂,所以能发生加成反应。
1. (1) 根据图片①和②,用自己的话给键长下定义,并说说图②的含义。
【答案】 键长是指构成共价键的两个原子的核间距。分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。图②中显示H—I的键长为162 pm。
活动二:认识共价键的键长及其应用
(2) 根据下列图片,用自己的话给原子的共价半径下定义。
【答案】 共价半径是指相同原子的共价键键长的一半。
2. 查阅有关共价键键能、键长的数据,归纳键长与键能之间的关系。
【答案】 化学键的键长与键能是相关的。键长越短,往往键能越大;反之,键长越长,往往键能越小。
3. 预测金刚石与晶体硅中C—C、Si—Si的键长、键能的相对大小,再据此进一步预测金刚石与晶体硅的熔点高低(提示:这两种晶体熔化时均需破坏共价键),课后查阅资料,看看你的预测是否准确。
【答案】 键长:C—C<Si—Si,键能:C—C>Si—Si。金刚石的熔点比晶体硅高。
晶体 键长/pm 键能/(kJ·mol-1) 熔点/℃
金刚石 154 347.7 >3 500
晶体硅 235 226 1 410
1. 下面是中心原子不含孤电子对的一类AXn型分子(n=2~6)的理想空间结构模型。请你将这些模型空间结构的名称,理解模型与键角的关系。
活动三:认识共价键的键角及其应用
2. 在多原子分子中,两个相邻共价键之间的夹角称为键角,它是描述分子空间结构的重要参数。请你用泡沫小球(或用橡皮泥捏成的小球)、小木棍(或牙签)等材料,根据下列分子的空间填充模型制作它们的球棍模型。(已知:NH3、H2O分子中的键角分别为107°和105°)
【答案】
3. 已知:H2O2分子中O—O、H—O的键长分别为147.5 pm和95.0 pm;H—O—O键的键角为96°52′,2个“H—O—O”平面之间的夹角为93°52′。试画出H2O2分子的结构式(要求标出有关键长、键角数据,以体现其空间结构)。
4. 你知道键长和键角的数值可通过何种实验获得吗?
【答案】 X射线衍射实验。
【答案】
课 堂 反 馈
2
4
1
3
1. 现有下列数据,下列说法不正确的是( )
A. 成键原子的半径越小,键长越短
B. 化学键的键长小于成键原子的半径之和
C. 键长的大小不仅与成键原子半径有关,还与电子云重叠程度有关
D. 键长越短,化学键越牢固,含有该键的物质越稳定
化学键或原子 C—H N—H O—H C N O H
键长或半径/pm 109 101 96 77 75 74 37
2
4
1
3
【解析】 从表格数据可知r(C)>r(N)>r(O),形成的C—H键、N—H键、O—H键依次变短,A正确;如r(C)+r(H)=77+37>109,B正确;从表中数据可分析得出,键长的大小与成键原子半径有关,当然键长的大小与电子云重叠程度也有关系,如r(C—C)>r(C===C),C正确;键长越短,键能越大,键越牢固,必须强调可比性,如表格中的 C—H、N—H、O—H可以比较,但如果根据键长比较C—C、C===C的稳定性就是错误的,D错误。
【答案】 D
2
4
1
3
2. 已知:H—H键能为436 kJ·mol-1,O===O键能为497.3 kJ·mol-1,Cl—Cl键能为 242.7 kJ·mol-1,N≡N 键能为946 kJ·mol-1,则下列叙述正确的是( )
B. 氮气分子中共价键的键长比氢气分子中的短
C. 氧气分子中氧原子是以共价单键结合的
D. 氮气分子比氯气分子稳定
2
4
1
3
【答案】 D
2
4
3
3. 由短周期前10号元素组成的物质T和X,有如图所示的转化。T为有机物,X是一种不稳定的酸。下列有关说法正确的是( )
A. 三种短周期元素为H、C、O
B. 等物质的量的T、X分子中含有π键的数目均为6.02×1023个
C. X分子中含有的σ键个数是T分子中含有的σ键个数的2倍
D. X分子中既含有极性键又含有非极性键
1
2
4
3
1
【解析】 1个T、X分子中各含有1个π键,但含有等物质的量并不一定是1 mol,B错误;X分子中含有的σ键个数为5,T分子中含有的σ键个数为3,C错误;T、X分子中均只含有极性键,无非极性键,D错误。
【答案】 A
2
4
3
4. 已知白磷(P4)分子是正四面体结构,P原子位于四个顶点。
(1) 1个白磷分子中有______个P—P键,这些键都是______(填“σ”或“π”)键,每个键的键长________(填“相等”或“不相等”),键与键之间的夹角为__________。
1
6
σ
相等
60°
2
4
3
(2) 有两种常见的磷氧化物,一种是P4O6,另一种是P4O10(即五氧化二磷)。P4O6可看作在白磷分子中每两个磷原子间插入一个氧原子,请在左下的方框中画出它的结构式。
1
【答案】
2
4
3
1
(3) P4O6中每个磷原子再各与一个氧原子结合即得P4O10(其中磷原子最外层有10个电子),请在右上的方框中画出其结构式,并从两个不同的角度,对P4O10分子中的共价键进行分类。
【答案】 从电子云的重叠方式看,有σ键和π键;从两核间形成共用电子对的数目看,有单键和双键。
谢谢观看
Thank you for watching
第二章
分子结构与性质
第一节 共价键
第2课时 共价键的参数——键能、键长与键角
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 知道共价键的键能、键长、键角可以用来描述键的强弱和分子的空间结构。
2. 知道σ键和π键强度的相对大小。
活 动 方 案
1. H2(g)与Cl2(g)反应生成HCl(g)过程中的能量变化如下图所示。
活动一:认识共价键的键能及其应用
(1) 上图中的“436 kJ·mol-1”“242.7 kJ·mol-1”分别是H—H、Cl—Cl的键能,请用自己的话给键能下一个定义,并说明共价键的稳定性与键能的大小有什么关系?
【答案】 键能是指气态分子中1 mol化学键解离成气态原子所吸收的能量(或键能是气态基态原子形成 1 mol 化学键释放的能量)。共价键越稳定,键能越大;反之键能越小。
(2) “H—Cl” 的键能是多少?
【答案】 431.8 kJ·mol-1
(3) 写出上述反应的热化学方程式。
【答案】 H2(g)+Cl2(g)===2HCl(g) ΔH=-184.9 kJ·mol-1
2. (1) 比较HF、HCl、HBr、HI的热稳定性。
【答案】 热稳定性:HF>HCl>HBr>HI
(2) N的非金属性与Cl相近,为什么N2的化学性质非常稳定,而Cl2的化学性质却很活泼?
【答案】 N≡N键的键能远大于Cl—Cl键的键能,化学反应中很难被破坏,所以N2化学性质稳定。
(3) 计算反应N2(g)+3H2(g) 2NH3(g)的ΔH。
【答案】 ΔH=946 kJ·mol-1+3×436 kJ·mol-1-6×390.8 kJ·mol-1 =-90.8 kJ·mol-1
3. C===C键的键能小于C—C键的键能的2倍。
(1) 请你据此分析,σ键与π键哪个更稳定?
【答案】 碳碳双键中有一个σ键和一个π键,碳碳单键只有σ键,而C===C的键能小于C—C键能的2倍,说明σ键的键能比π键的键能大,即σ键比π键稳定。
(2) 乙烷为何不能与Br2的CCl4溶液反应,而乙烯能与Br2的CCl4溶液发生加成反应?
【答案】 乙烷分子中的C—C键为σ键,强度较大,难断裂;而乙烯分子含有的C===C中有一个是π键,强度较小,容易断裂,所以能发生加成反应。
1. (1) 根据图片①和②,用自己的话给键长下定义,并说说图②的含义。
【答案】 键长是指构成共价键的两个原子的核间距。分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。图②中显示H—I的键长为162 pm。
活动二:认识共价键的键长及其应用
(2) 根据下列图片,用自己的话给原子的共价半径下定义。
【答案】 共价半径是指相同原子的共价键键长的一半。
2. 查阅有关共价键键能、键长的数据,归纳键长与键能之间的关系。
【答案】 化学键的键长与键能是相关的。键长越短,往往键能越大;反之,键长越长,往往键能越小。
3. 预测金刚石与晶体硅中C—C、Si—Si的键长、键能的相对大小,再据此进一步预测金刚石与晶体硅的熔点高低(提示:这两种晶体熔化时均需破坏共价键),课后查阅资料,看看你的预测是否准确。
【答案】 键长:C—C<Si—Si,键能:C—C>Si—Si。金刚石的熔点比晶体硅高。
晶体 键长/pm 键能/(kJ·mol-1) 熔点/℃
金刚石 154 347.7 >3 500
晶体硅 235 226 1 410
1. 下面是中心原子不含孤电子对的一类AXn型分子(n=2~6)的理想空间结构模型。请你将这些模型空间结构的名称,理解模型与键角的关系。
活动三:认识共价键的键角及其应用
2. 在多原子分子中,两个相邻共价键之间的夹角称为键角,它是描述分子空间结构的重要参数。请你用泡沫小球(或用橡皮泥捏成的小球)、小木棍(或牙签)等材料,根据下列分子的空间填充模型制作它们的球棍模型。(已知:NH3、H2O分子中的键角分别为107°和105°)
【答案】
3. 已知:H2O2分子中O—O、H—O的键长分别为147.5 pm和95.0 pm;H—O—O键的键角为96°52′,2个“H—O—O”平面之间的夹角为93°52′。试画出H2O2分子的结构式(要求标出有关键长、键角数据,以体现其空间结构)。
4. 你知道键长和键角的数值可通过何种实验获得吗?
【答案】 X射线衍射实验。
【答案】
课 堂 反 馈
2
4
1
3
1. 现有下列数据,下列说法不正确的是( )
A. 成键原子的半径越小,键长越短
B. 化学键的键长小于成键原子的半径之和
C. 键长的大小不仅与成键原子半径有关,还与电子云重叠程度有关
D. 键长越短,化学键越牢固,含有该键的物质越稳定
化学键或原子 C—H N—H O—H C N O H
键长或半径/pm 109 101 96 77 75 74 37
2
4
1
3
【解析】 从表格数据可知r(C)>r(N)>r(O),形成的C—H键、N—H键、O—H键依次变短,A正确;如r(C)+r(H)=77+37>109,B正确;从表中数据可分析得出,键长的大小与成键原子半径有关,当然键长的大小与电子云重叠程度也有关系,如r(C—C)>r(C===C),C正确;键长越短,键能越大,键越牢固,必须强调可比性,如表格中的 C—H、N—H、O—H可以比较,但如果根据键长比较C—C、C===C的稳定性就是错误的,D错误。
【答案】 D
2
4
1
3
2. 已知:H—H键能为436 kJ·mol-1,O===O键能为497.3 kJ·mol-1,Cl—Cl键能为 242.7 kJ·mol-1,N≡N 键能为946 kJ·mol-1,则下列叙述正确的是( )
B. 氮气分子中共价键的键长比氢气分子中的短
C. 氧气分子中氧原子是以共价单键结合的
D. 氮气分子比氯气分子稳定
2
4
1
3
【答案】 D
2
4
3
3. 由短周期前10号元素组成的物质T和X,有如图所示的转化。T为有机物,X是一种不稳定的酸。下列有关说法正确的是( )
A. 三种短周期元素为H、C、O
B. 等物质的量的T、X分子中含有π键的数目均为6.02×1023个
C. X分子中含有的σ键个数是T分子中含有的σ键个数的2倍
D. X分子中既含有极性键又含有非极性键
1
2
4
3
1
【解析】 1个T、X分子中各含有1个π键,但含有等物质的量并不一定是1 mol,B错误;X分子中含有的σ键个数为5,T分子中含有的σ键个数为3,C错误;T、X分子中均只含有极性键,无非极性键,D错误。
【答案】 A
2
4
3
4. 已知白磷(P4)分子是正四面体结构,P原子位于四个顶点。
(1) 1个白磷分子中有______个P—P键,这些键都是______(填“σ”或“π”)键,每个键的键长________(填“相等”或“不相等”),键与键之间的夹角为__________。
1
6
σ
相等
60°
2
4
3
(2) 有两种常见的磷氧化物,一种是P4O6,另一种是P4O10(即五氧化二磷)。P4O6可看作在白磷分子中每两个磷原子间插入一个氧原子,请在左下的方框中画出它的结构式。
1
【答案】
2
4
3
1
(3) P4O6中每个磷原子再各与一个氧原子结合即得P4O10(其中磷原子最外层有10个电子),请在右上的方框中画出其结构式,并从两个不同的角度,对P4O10分子中的共价键进行分类。
【答案】 从电子云的重叠方式看,有σ键和π键;从两核间形成共用电子对的数目看,有单键和双键。
谢谢观看
Thank you for watching
