2.3.1键的极性与分子的极性及其对化学性质的影响课件(共32张PPT) 2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.1键的极性与分子的极性及其对化学性质的影响课件(共32张PPT) 2023-2024学年高二下学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 834.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 14:18:06 | ||
图片预览










文档简介
(共32张PPT)
第二章
分子结构与性质
第三节 分子结构与物质的性质
第1课时 键的极性与分子的极性及其对化学性质的影响
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 能利用电负性判断共价键的极性,认识键的极性对物质化学性质的影响。
2. 能根据分子的空间结构和键的极性判断分子的极性,并据此对分子的一些典型性质和应用作出解释。
活 动 方 案
1. 学会判断共价键的极性。
(1) 什么是极性共价键和非极性共价键?
【答案】 由不同原子形成的共价键,电子对会发生偏移,是极性共价键;由相同原子形成的共价键,电子对不发生偏移,是非极性共价键。
(2) 极性共价键(A—B)中的两个键合原子,A原子呈正电性(δ+),B原子呈负电性(δ-),则A、B两个原子中哪个的电负性更大?
【答案】 B原子的电负性更大。
活动一:学会判断键的极性和分子的极性
2. 学会判断双原子分子是否具有极性。
右图是某学习小组同学查得的3种分子中共价键的极性与正、负电荷中心之间的关系。我们将分子中正、负电荷中心不重合的称为极性分子,重合的则称为非极性分子。
(1) 3种分子中分别属于极性分子和非极性分子的是哪些?
【答案】 HCl是极性分子,H2、Cl2是非极性分子。
(2) 请归纳出判断双原子分子是极性分子还是非极性分子的简单方法。
【答案】 双原子的化合物分子为极性分子;双原子的单质分子为非极性分子。
(3) BrCl是一种常见的卤素互化物,你认为该互化物是极性分子还是非极性分子?
【答案】 极性分子。
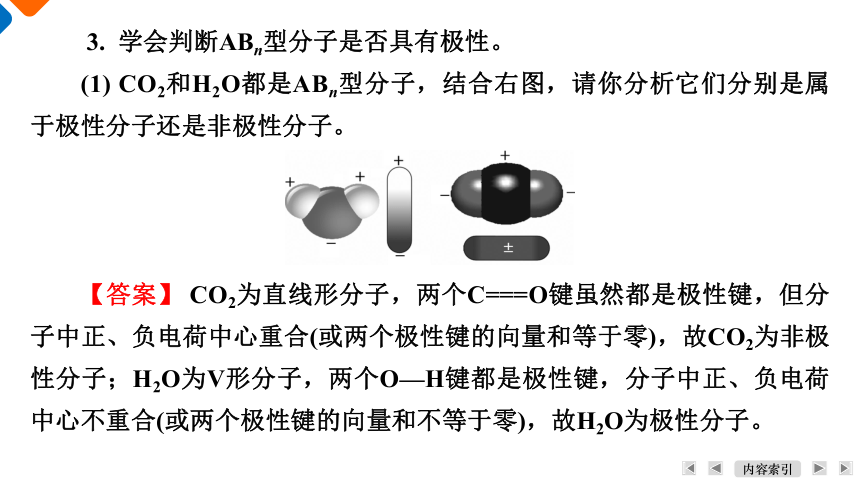
3. 学会判断ABn型分子是否具有极性。
(1) CO2和H2O都是ABn型分子,结合右图,请你分析它们分别是属于极性分子还是非极性分子。
【答案】 CO2为直线形分子,两个C===O键虽然都是极性键,但分子中正、负电荷中心重合(或两个极性键的向量和等于零),故CO2为非极性分子;H2O为V形分子,两个O—H键都是极性键,分子中正、负电荷中心不重合(或两个极性键的向量和不等于零),故H2O为极性分子。
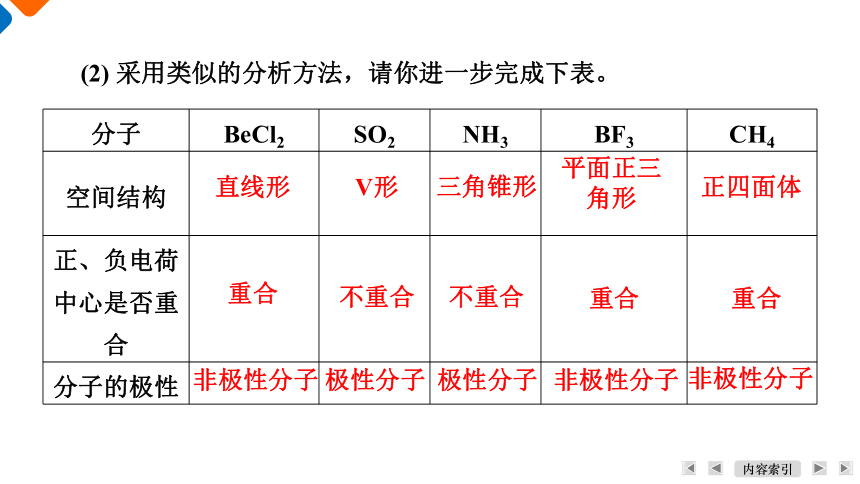
(2) 采用类似的分析方法,请你进一步完成下表。
分子 BeCl2 SO2 NH3 BF3 CH4
空间结构
正、负电荷中心是否重合
分子的极性
直线形
V形
三角锥形
平面正三
角形
正四面体
重合
不重合
不重合
重合
重合
非极性分子
极性分子
极性分子
非极性分子
非极性分子
(3) 认真研究“(2)”中各分子中心元素的化合价,寻找中心元素化合价与分子极性的关系。
【答案】 ABn型分子中心元素的化合价的绝对值等于中心元素原子的最外层电子数时,为非极性分子,否则为极性分子。
4. 学会判断较为复杂的分子是否具有极性。
通过小组合作,探究下列分子是极性分子还是非极性分子。
(1) P4(白磷) (2) HCN (3) CH3Cl (4) CH≡CH (5) C60
(6)
【答案】 (1) 非极性分子 (2) 极性分子 (3) 极性分子 (4) 非极性分子 (5) 非极性分子 (6) 非极性分子
1. 阅读下列信息,回答问题。
羧基电离出的H+来自所含羟基H—O键的断裂,如果H—O键的极性越强,则H—O键越容易断裂,H—O键的极性受所连基团的影响,如果连有吸电子基团,则H—O键的电子云更偏向于O,H—O键间的电子云密度减小,H—O键的极性增强,如果连有推电子基团,则H—O键间的电子云密度增大, H—O键的极性减弱。
活动二:认识键的极性对物质化学性质的影响
羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa(pKa=-lgKa)的大小来衡量,pKa越小,酸性越强。几种羧酸的pKa如下表所示。
羧酸 pKa 羧酸 pKa
丙酸(C2H5COOH) 4.88 氯乙酸(CH2ClCOOH) 2.86
乙酸(CH3COOH) 4.76 二氯乙酸(CHCl2COOH) 1.29
甲酸(HCOOH) 3.75 三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
(1) 表中所示羧酸中,酸性最强、最弱的酸分别是哪一个?
【答案】 酸性最强的是CF3COOH,酸性最弱的是C2H5COOH。
(2) 以氢原子(H—)作参照,强于氢原子的供电子基团有哪些,供电子能力大小如何排序?强于氢原子的吸电子基团有哪些,吸电子能力大小如何排序?
【答案】 供电子基团及能力大小:C2H5—>CH3—>H—。
吸电子基团及能力大小:CF3—>CCl3—>CHCl2—>CH2Cl—>H—。
(3) 为什么三氟乙酸的酸性强于三氯乙酸?
【答案】 F的电负性强于Cl,使得CF3—吸引电子能力强于CCl3—,则CF3COOH中羟基键的极性更强,更容易断裂。
1. 将下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒(或带有静电的橡胶棒)靠近液体细流时,请你仔细观察细流是否发生偏移?
活动三:认识极性分子与非极性分子的一些性质
物质 H2O CCl4 CS2 C2H5OH
分子有无极性
细流是否偏移
有
无
无
有
偏移
不偏移
不偏移
偏移
2. 探究分子的极性对溶解性的影响。
(1) 向盛有少量下列固体或液体物质的试管中,分别加入2 mL水和2 mL四氯化碳,振荡,观察其溶解情况。
物质 固体碘 蔗糖 植物油 食盐
分子有无 极性 极性很小 离子键
水
四氯化碳
实验结论 注:离子键可以理解成更为“极端”的极性键。
无
有
难溶
易溶
难溶
易溶
易溶
难溶
易溶
难溶
一般地,非极性溶质能溶于非极性溶剂,极性溶质能溶于极性溶剂
(2) 下表为一些气体在水中的溶解度[气体的压强为101 kPa,温度为293 K,在100 g水中溶解的质量(g)],请你完成下表。
气体 H2 SO2 N2 NH3 HCl CH4 C2H4 C2H2
有无 极性
溶解度 0.000 16 11.28 0.001 9 52.9 81.4 0.002 3 0.014 9 0.117
结论 无
有
无
有
有
无
无
无
极性分子气体易溶于水,非极性分子气体难溶于水
课 堂 反 馈
2
4
5
1
3
7
9
6
8
10
1. 下列化学键中,键的极性最小的是( )
A. C—N B. C—F
C. C—O D. C—C
【解析】 形成共用电子对的两元素的非金属性强弱相差越大,形成的共价键的极性越强。四个选项中,都含有碳原子,其他元素的非金属性大小关系为F>O>N>C,所以极性键的极性大小关系为C—F>C—O>C—N>C—C。
【答案】 D
2
4
5
1
3
7
9
6
8
10
2. 下列分子中,属于含有极性键的非极性分子的是( )
A. PCl3 B. H2S
C. P4 D. C2H4
【解析】 PCl3只含P—Cl极性键,立体构型为三角锥形,属于极性分子,A不符合题意;H2S只含H—S极性键,立体构型为V形,属于极性分子,B不符合题意;P4只含P—P非极性键,立体构型为正四面体形,属于非极性分子,C不符合题意;C2H4含C—H极性键和C===C非极性键,立体构型为平面形结构,属于非极性分子,故选D。
【答案】 D
2
4
5
3
7
9
6
8
10
3. 下列各组分子中,按共价键极性由强到弱排序正确的是( )
A. HF H2O NH3 CH4 B. CH4 NH3 H2O HF
C. H2O HF CH4 NH3 D. HF H2O CH4 NH3
1
【解析】 与氢元素相比,得电子能力越强的元素跟氢原子形成的化学键极性越强。C、N、O、F四种元素得电子能力逐渐增强,跟氢原子形成的化学键极性也逐渐增强,A正确。
【答案】 A
2
4
5
3
7
9
6
8
10
4. 下列叙述正确的是( )
A. 以非极性键结合起来的双原子分子一定是非极性分子
B. 以极性键结合起来的分子一定是极性分子
C. 非极性分子只能是双原子单质分子
D. 非极性分子中,一定含有非极性共价键
1
【解析】 以非极性键结合起来的双原子分子一定是非极性分子,如O2、H2、N2等,A正确;以极性键结合起来的分子不一定是极性分子,若分子的空间结构对称,正、负电荷中心重合,就是非极性分子,如CH4、CO2、CCl4、CS2等,B错误;某些共价化合物如C2H4等也是非极性分子,C错误;非极性分子中不一定含有非极性键,如CH4、CO2,D错误。
【答案】 A
2
4
5
3
7
9
6
8
10
5. X、Y为两种不同元素,由它们组成的下列物质的分子中,肯定具有极性的是( )
A. XY4 B. XY3
C. XY2 D. XY
1
【解析】 XY4空间结构可以是正四面体,XY3空间结构可以是平面三角形,XY2空间结构可以是直线形,此类分子均没有极性。XY一定是极性分子。故选D。
【答案】 D
2
4
5
3
7
9
6
8
10
6. 下列叙述正确的是( )
A. NH3、CO、CO2都是极性分子
B. CH4、SO3都是含有极性键的非极性分子
C. H2O、C2H2都是直线形分子
D. BCl3、H2S、CCl4中的中心原子都是sp3杂化
1
【解析】 CO2属于非极性分子,A错误;CH4、SO3均含有极性键,CH4的空间结构为正四面体形,SO3的空间结构为平面正三角形,均为非极性分子,B正确;H2O属于V形分子,C错误;BCl3中B是sp2杂化,D错误。
【答案】 B
2
4
5
3
7
9
6
8
10
7. 已知BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,则BeCl2属于( )
A. 由极性键构成的极性分子
B. 由极性键构成的非极性分子
C. 由非极性键构成的极性分子
D. 由非极性键构成的非极性分子
1
【解析】 BeCl2中Be—Cl键是不同元素形成的共价键,为极性键,两个Be—Cl键间的夹角为180°,说明分子是对称的,正电荷中心与负电荷的中心重合,BeCl2属于非极性分子,故BeCl2是由极性键形成的非极性分子,故选B。
【答案】 B
2
4
5
3
7
9
6
8
10
8. 经验性的“相似相溶”规律:极性溶质一般能溶于极性溶剂,非极性溶质一般能溶于非极性溶剂。下列事实不能用“相似相溶”规律解释的是( )
A. HCl易溶于水 B. I2易溶于CCl4
C. Cl2可溶于水 D. NH3难溶于苯
1
【解析】 HCl是极性分子,水是极性分子,HCl易溶于水,可以用相似相溶规律解释;I2是非极性分子,CCl4是非极性分子,I2易溶于CCl4,可以用相似相溶规律解释;Cl2是非极性分子,水是极性分子,Cl2可溶于水,不可以用相似相溶规律解释;NH3是极性分子,苯是非极性分子,NH3难溶于苯,可以用相似相溶规律解释。
【答案】 C
2
4
5
3
7
9
6
8
10
9. 已知含氧酸可用通式(HO)nXOm来表示,如X是S,则m=2,n=2,这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的( )
A. HClO4 B. H2SeO3
C. H3BO3 D. H3PO4
1
【解析】 根据题目所给通式,HClO4表示为(HO)ClO3,m=3;H2SeO3表示为(HO)2SeO,m=1;H3BO3表示为(HO)3B,m=0;H3PO4表示为(HO)3PO,m=1。则HClO4的m值最大,酸性最强。
【答案】 A
2
4
5
3
7
9
6
8
10
10. 在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1) 以非极性键结合的非极性分子是________(填化学式,下同)。
(2) 以极性键相结合,具有正四面体形结构的非极性分子是__________。
(3) 以极性键相结合,具有三角锥形结构的极性分子是__________。
(4) 以极性键相结合,具有V形结构的极性分子是__________。
(5) 以极性键相结合,而且分子极性最大的是________。
(6) 用VSEPR 理论判断,H2O的孤电子对数为______。
1
N2
CH4
NH3
H2O
HF
2
2
4
5
3
7
9
6
8
10
1
谢谢观看
Thank you for watching
第二章
分子结构与性质
第三节 分子结构与物质的性质
第1课时 键的极性与分子的极性及其对化学性质的影响
内容索引
学习目标
活动方案
课堂反馈
学 习 目 标
1. 能利用电负性判断共价键的极性,认识键的极性对物质化学性质的影响。
2. 能根据分子的空间结构和键的极性判断分子的极性,并据此对分子的一些典型性质和应用作出解释。
活 动 方 案
1. 学会判断共价键的极性。
(1) 什么是极性共价键和非极性共价键?
【答案】 由不同原子形成的共价键,电子对会发生偏移,是极性共价键;由相同原子形成的共价键,电子对不发生偏移,是非极性共价键。
(2) 极性共价键(A—B)中的两个键合原子,A原子呈正电性(δ+),B原子呈负电性(δ-),则A、B两个原子中哪个的电负性更大?
【答案】 B原子的电负性更大。
活动一:学会判断键的极性和分子的极性
2. 学会判断双原子分子是否具有极性。
右图是某学习小组同学查得的3种分子中共价键的极性与正、负电荷中心之间的关系。我们将分子中正、负电荷中心不重合的称为极性分子,重合的则称为非极性分子。
(1) 3种分子中分别属于极性分子和非极性分子的是哪些?
【答案】 HCl是极性分子,H2、Cl2是非极性分子。
(2) 请归纳出判断双原子分子是极性分子还是非极性分子的简单方法。
【答案】 双原子的化合物分子为极性分子;双原子的单质分子为非极性分子。
(3) BrCl是一种常见的卤素互化物,你认为该互化物是极性分子还是非极性分子?
【答案】 极性分子。
3. 学会判断ABn型分子是否具有极性。
(1) CO2和H2O都是ABn型分子,结合右图,请你分析它们分别是属于极性分子还是非极性分子。
【答案】 CO2为直线形分子,两个C===O键虽然都是极性键,但分子中正、负电荷中心重合(或两个极性键的向量和等于零),故CO2为非极性分子;H2O为V形分子,两个O—H键都是极性键,分子中正、负电荷中心不重合(或两个极性键的向量和不等于零),故H2O为极性分子。
(2) 采用类似的分析方法,请你进一步完成下表。
分子 BeCl2 SO2 NH3 BF3 CH4
空间结构
正、负电荷中心是否重合
分子的极性
直线形
V形
三角锥形
平面正三
角形
正四面体
重合
不重合
不重合
重合
重合
非极性分子
极性分子
极性分子
非极性分子
非极性分子
(3) 认真研究“(2)”中各分子中心元素的化合价,寻找中心元素化合价与分子极性的关系。
【答案】 ABn型分子中心元素的化合价的绝对值等于中心元素原子的最外层电子数时,为非极性分子,否则为极性分子。
4. 学会判断较为复杂的分子是否具有极性。
通过小组合作,探究下列分子是极性分子还是非极性分子。
(1) P4(白磷) (2) HCN (3) CH3Cl (4) CH≡CH (5) C60
(6)
【答案】 (1) 非极性分子 (2) 极性分子 (3) 极性分子 (4) 非极性分子 (5) 非极性分子 (6) 非极性分子
1. 阅读下列信息,回答问题。
羧基电离出的H+来自所含羟基H—O键的断裂,如果H—O键的极性越强,则H—O键越容易断裂,H—O键的极性受所连基团的影响,如果连有吸电子基团,则H—O键的电子云更偏向于O,H—O键间的电子云密度减小,H—O键的极性增强,如果连有推电子基团,则H—O键间的电子云密度增大, H—O键的极性减弱。
活动二:认识键的极性对物质化学性质的影响
羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa(pKa=-lgKa)的大小来衡量,pKa越小,酸性越强。几种羧酸的pKa如下表所示。
羧酸 pKa 羧酸 pKa
丙酸(C2H5COOH) 4.88 氯乙酸(CH2ClCOOH) 2.86
乙酸(CH3COOH) 4.76 二氯乙酸(CHCl2COOH) 1.29
甲酸(HCOOH) 3.75 三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
(1) 表中所示羧酸中,酸性最强、最弱的酸分别是哪一个?
【答案】 酸性最强的是CF3COOH,酸性最弱的是C2H5COOH。
(2) 以氢原子(H—)作参照,强于氢原子的供电子基团有哪些,供电子能力大小如何排序?强于氢原子的吸电子基团有哪些,吸电子能力大小如何排序?
【答案】 供电子基团及能力大小:C2H5—>CH3—>H—。
吸电子基团及能力大小:CF3—>CCl3—>CHCl2—>CH2Cl—>H—。
(3) 为什么三氟乙酸的酸性强于三氯乙酸?
【答案】 F的电负性强于Cl,使得CF3—吸引电子能力强于CCl3—,则CF3COOH中羟基键的极性更强,更容易断裂。
1. 将下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒(或带有静电的橡胶棒)靠近液体细流时,请你仔细观察细流是否发生偏移?
活动三:认识极性分子与非极性分子的一些性质
物质 H2O CCl4 CS2 C2H5OH
分子有无极性
细流是否偏移
有
无
无
有
偏移
不偏移
不偏移
偏移
2. 探究分子的极性对溶解性的影响。
(1) 向盛有少量下列固体或液体物质的试管中,分别加入2 mL水和2 mL四氯化碳,振荡,观察其溶解情况。
物质 固体碘 蔗糖 植物油 食盐
分子有无 极性 极性很小 离子键
水
四氯化碳
实验结论 注:离子键可以理解成更为“极端”的极性键。
无
有
难溶
易溶
难溶
易溶
易溶
难溶
易溶
难溶
一般地,非极性溶质能溶于非极性溶剂,极性溶质能溶于极性溶剂
(2) 下表为一些气体在水中的溶解度[气体的压强为101 kPa,温度为293 K,在100 g水中溶解的质量(g)],请你完成下表。
气体 H2 SO2 N2 NH3 HCl CH4 C2H4 C2H2
有无 极性
溶解度 0.000 16 11.28 0.001 9 52.9 81.4 0.002 3 0.014 9 0.117
结论 无
有
无
有
有
无
无
无
极性分子气体易溶于水,非极性分子气体难溶于水
课 堂 反 馈
2
4
5
1
3
7
9
6
8
10
1. 下列化学键中,键的极性最小的是( )
A. C—N B. C—F
C. C—O D. C—C
【解析】 形成共用电子对的两元素的非金属性强弱相差越大,形成的共价键的极性越强。四个选项中,都含有碳原子,其他元素的非金属性大小关系为F>O>N>C,所以极性键的极性大小关系为C—F>C—O>C—N>C—C。
【答案】 D
2
4
5
1
3
7
9
6
8
10
2. 下列分子中,属于含有极性键的非极性分子的是( )
A. PCl3 B. H2S
C. P4 D. C2H4
【解析】 PCl3只含P—Cl极性键,立体构型为三角锥形,属于极性分子,A不符合题意;H2S只含H—S极性键,立体构型为V形,属于极性分子,B不符合题意;P4只含P—P非极性键,立体构型为正四面体形,属于非极性分子,C不符合题意;C2H4含C—H极性键和C===C非极性键,立体构型为平面形结构,属于非极性分子,故选D。
【答案】 D
2
4
5
3
7
9
6
8
10
3. 下列各组分子中,按共价键极性由强到弱排序正确的是( )
A. HF H2O NH3 CH4 B. CH4 NH3 H2O HF
C. H2O HF CH4 NH3 D. HF H2O CH4 NH3
1
【解析】 与氢元素相比,得电子能力越强的元素跟氢原子形成的化学键极性越强。C、N、O、F四种元素得电子能力逐渐增强,跟氢原子形成的化学键极性也逐渐增强,A正确。
【答案】 A
2
4
5
3
7
9
6
8
10
4. 下列叙述正确的是( )
A. 以非极性键结合起来的双原子分子一定是非极性分子
B. 以极性键结合起来的分子一定是极性分子
C. 非极性分子只能是双原子单质分子
D. 非极性分子中,一定含有非极性共价键
1
【解析】 以非极性键结合起来的双原子分子一定是非极性分子,如O2、H2、N2等,A正确;以极性键结合起来的分子不一定是极性分子,若分子的空间结构对称,正、负电荷中心重合,就是非极性分子,如CH4、CO2、CCl4、CS2等,B错误;某些共价化合物如C2H4等也是非极性分子,C错误;非极性分子中不一定含有非极性键,如CH4、CO2,D错误。
【答案】 A
2
4
5
3
7
9
6
8
10
5. X、Y为两种不同元素,由它们组成的下列物质的分子中,肯定具有极性的是( )
A. XY4 B. XY3
C. XY2 D. XY
1
【解析】 XY4空间结构可以是正四面体,XY3空间结构可以是平面三角形,XY2空间结构可以是直线形,此类分子均没有极性。XY一定是极性分子。故选D。
【答案】 D
2
4
5
3
7
9
6
8
10
6. 下列叙述正确的是( )
A. NH3、CO、CO2都是极性分子
B. CH4、SO3都是含有极性键的非极性分子
C. H2O、C2H2都是直线形分子
D. BCl3、H2S、CCl4中的中心原子都是sp3杂化
1
【解析】 CO2属于非极性分子,A错误;CH4、SO3均含有极性键,CH4的空间结构为正四面体形,SO3的空间结构为平面正三角形,均为非极性分子,B正确;H2O属于V形分子,C错误;BCl3中B是sp2杂化,D错误。
【答案】 B
2
4
5
3
7
9
6
8
10
7. 已知BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,则BeCl2属于( )
A. 由极性键构成的极性分子
B. 由极性键构成的非极性分子
C. 由非极性键构成的极性分子
D. 由非极性键构成的非极性分子
1
【解析】 BeCl2中Be—Cl键是不同元素形成的共价键,为极性键,两个Be—Cl键间的夹角为180°,说明分子是对称的,正电荷中心与负电荷的中心重合,BeCl2属于非极性分子,故BeCl2是由极性键形成的非极性分子,故选B。
【答案】 B
2
4
5
3
7
9
6
8
10
8. 经验性的“相似相溶”规律:极性溶质一般能溶于极性溶剂,非极性溶质一般能溶于非极性溶剂。下列事实不能用“相似相溶”规律解释的是( )
A. HCl易溶于水 B. I2易溶于CCl4
C. Cl2可溶于水 D. NH3难溶于苯
1
【解析】 HCl是极性分子,水是极性分子,HCl易溶于水,可以用相似相溶规律解释;I2是非极性分子,CCl4是非极性分子,I2易溶于CCl4,可以用相似相溶规律解释;Cl2是非极性分子,水是极性分子,Cl2可溶于水,不可以用相似相溶规律解释;NH3是极性分子,苯是非极性分子,NH3难溶于苯,可以用相似相溶规律解释。
【答案】 C
2
4
5
3
7
9
6
8
10
9. 已知含氧酸可用通式(HO)nXOm来表示,如X是S,则m=2,n=2,这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的( )
A. HClO4 B. H2SeO3
C. H3BO3 D. H3PO4
1
【解析】 根据题目所给通式,HClO4表示为(HO)ClO3,m=3;H2SeO3表示为(HO)2SeO,m=1;H3BO3表示为(HO)3B,m=0;H3PO4表示为(HO)3PO,m=1。则HClO4的m值最大,酸性最强。
【答案】 A
2
4
5
3
7
9
6
8
10
10. 在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1) 以非极性键结合的非极性分子是________(填化学式,下同)。
(2) 以极性键相结合,具有正四面体形结构的非极性分子是__________。
(3) 以极性键相结合,具有三角锥形结构的极性分子是__________。
(4) 以极性键相结合,具有V形结构的极性分子是__________。
(5) 以极性键相结合,而且分子极性最大的是________。
(6) 用VSEPR 理论判断,H2O的孤电子对数为______。
1
N2
CH4
NH3
H2O
HF
2
2
4
5
3
7
9
6
8
10
1
谢谢观看
Thank you for watching
