课后提分练29 空气(一)(含解析)
文档属性
| 名称 | 课后提分练29 空气(一)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 333.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-04-22 13:49:09 | ||
图片预览



文档简介
聚焦新中考·2024第一轮复习练习
课后提分练29 空气(一)
A组 基础排查练
1.如果没有大气层,下列现象不会在地球上存在的是( )
A.重物下落 B.雄伟的高山
C.火山喷发 D.细雨绵绵
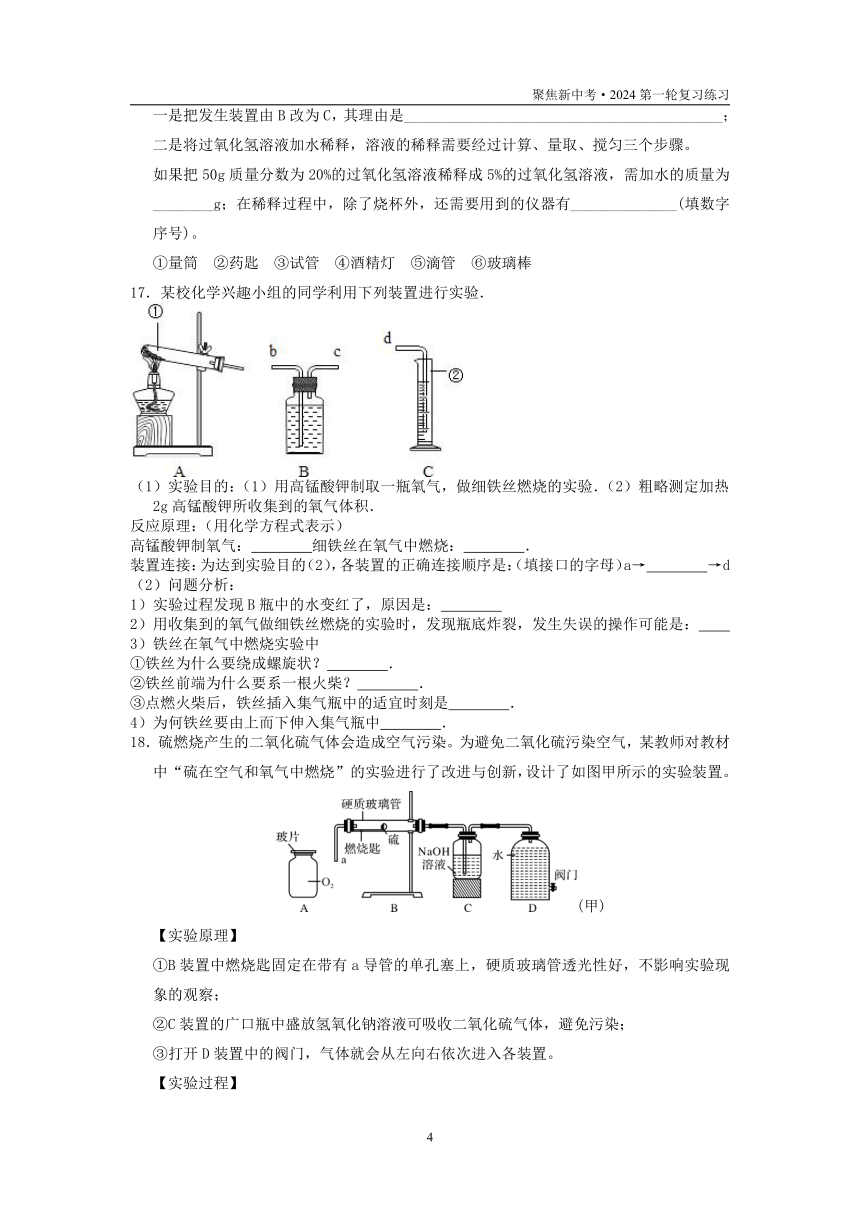
2.空气是生命赖以存在的物质基础,也是人类生产活动的重要资源,下列有关空气的说法正确的是( )
A.空气中分离出的氮气化学性质不活泼,可作食品保护气
B.空气主要是由氧气和氮气组成,其中氧气的质量约占空气质量的
C.空气质量报告中所列的空气质量级别数值越大,说明空气的质量越好
D.空气中的稀有气体化学性质很稳定,所以常用于制造多种用途的电光源
3.空气中体积分数占78%的气体是( )
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
4.如图所示,某同学为验证空气中含有少量二氧化碳,将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化。据此,你认为该同学应该( )
A.得出空气中没有二氧化碳的结论
B.得出空气中含有少量二氧化碳的结论
C.继续用大针筒向澄清石灰水压入空气
D.撤去大针筒,用嘴向澄清石灰水吹气
5.如图装置常用来测定空气中氧气的含量。下列对该实验的认识中正确的是( )
A.红磷燃烧产生大量白色烟雾
B.燃烧匙中的红磷可以换成细铁丝
C.该实验可说明N2难溶于水
D.红磷的量不足会导致进入集气瓶中水的体积大于1/5
6.在验证大气压存在的覆杯实验中,小柯认为:“实验中纸片不掉落完全是因为纸片被杯口的水粘住了,而与大气压无关”。下列能帮助小柯改变这种想法的实验是( )
A.如图甲,换用不同种类的纸片做覆杯实验,纸片都不掉落
B.如图乙,覆杯实验中将杯口朝向不同方向,纸片均不掉落
C.如图丙,将一张湿纸覆盖在空杯子的杯口,倒转杯子纸片不掉落
D.如图丁,在密闭钟罩内做覆杯实验,抽出钟罩内空气的过程中纸片掉落
7.用推拉注射器活塞的方法可以检查下图装置的气密性。当缓慢拉动活塞时,如果装置气密性良好,则能观察到( )
A.注射器内有液体 B.瓶中液面明显上升
C.长颈漏斗内液面上升 D.长颈漏斗下端管口产生气泡
8. 2015年6月1日晚,载有456人的“东方之星”客船在长江中游遇龙卷风翻沉。党和国家高度重视,全力抢救,从翻沉客船中成功搜救出幸存者。说明沉船内残存空气中的氧气,具有的用途是( )
A.作还原剂 B.作保护气
C.供给呼吸 D.支持呼吸
9.实验室用如图所示装置制取氧气,下列实验操作正确的是( )
A.加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中
B.先将导管口移入集气瓶,再开始加热
C.收集O2后,将集气瓶移出水槽,然后盖上玻璃片
D.停止加热时,先熄灭酒精灯,再移出导气管
10.下列关于物质的燃烧现象描述正确的是( )
A.铝箔在氧气中燃烧发出耀眼的白光,生成白色固体物质
B.硫在氧气中燃烧发出淡蓝色火焰,生成有刺激性气味的气体
C.磷在氧气中剧烈燃烧放出热量,产生大量的白色烟雾
D.铁在氧气中燃烧火星四射,生成红褐色固体物质
11.实验室制取氧气,下列说法错误的是( )
A.装置①可用于高锰酸钾制取氧气
B.装置②可用于过氧化氢溶液制取氧气
C.装置③可用于收集氧气
D.装置④可用于收集氧气
12.食品保鲜的措施有添加防腐剂、充填气体、放置干燥剂和脱氧剂等。根据物质的性质选用合适的物质用于食品保鲜,对于保证食品安全和人体健康具有重要的意义。
(1)氮气是常用的充填气体。你认为选用氮气的主要原因是_________________________
___________________________________________________________________________。
(2)生石灰是常用的干燥剂。请你用化学方程式表示选用生石灰的原因_______________
___________________________________________________________________________。
13.根据如图的实验,并阅读小资料,回答问题
(1)甲实验中应预先在集气瓶底部铺设水或细沙,这样做的目的是 。
(2)二氧化硫是一种大气污染物。根据小资料,集气瓶乙中添加的液体是水(或氢氧化钠),其目的是 。
14.下列是实验室制取气体和收集气体的实验装置,根据装置图回答问题。
(1)实验室用氯酸钾与二氧化锰制取氧气,发生装置应选择________(填编号),装置中还缺少的玻璃仪器是________。
(2)实验室用过氧化氢溶液与二氧化锰制取氧气,其化学反应方程式是_______________,为了便于观察氧气是否集满,应选用的收集装置是________(填编号)。
15.某校研究性学习小组用右下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
(1)如图A仪器的名称是 _,燃烧、冷却后打开止水夹,水能进入集气瓶的原因是 ;
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 _%。现进入集气瓶中水的体积约为其容积70%,根据空气的组成可推出减少的气体中有氮气。
该校研究性学习小组想通过自己的研究探究其中的奥妙:
【发现问题】氮气是怎样减少的呢?
【假设一】氮气与镁条反应而减少;
【假设二】 _。
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体。氮化镁中氮元素的化合价为 _ 。镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁。
(3)通过以上探究,你对燃烧的有关知识有了什么新的认识: _ (写出一点即可)。
B组 深化突破练
16.如图是实验室常用气体制备装置,据图回答问题:
(1)实验室用高锰酸钾制氧气的化学方程式是____________________________________,
应选择的收集装置是________(填字母代号),如果选用如图2装置收集氧气,气体应从________(填“a”或“b”)端导入。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为____________________。
某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用B装置来制氧气。实验中,同学们发现不能得到平稳的氧气流。大家提出从两个方面加以改进:
一是把发生装置由B改为C,其理由是__________________________________________;
二是将过氧化氢溶液加水稀释,溶液的稀释需要经过计算、量取、搅匀三个步骤。
如果把50g质量分数为20%的过氧化氢溶液稀释成5%的过氧化氢溶液,需加水的质量为________g;在稀释过程中,除了烧杯外,还需要用到的仪器有______________(填数字序号)。
①量筒 ②药匙 ③试管 ④酒精灯 ⑤滴管 ⑥玻璃棒
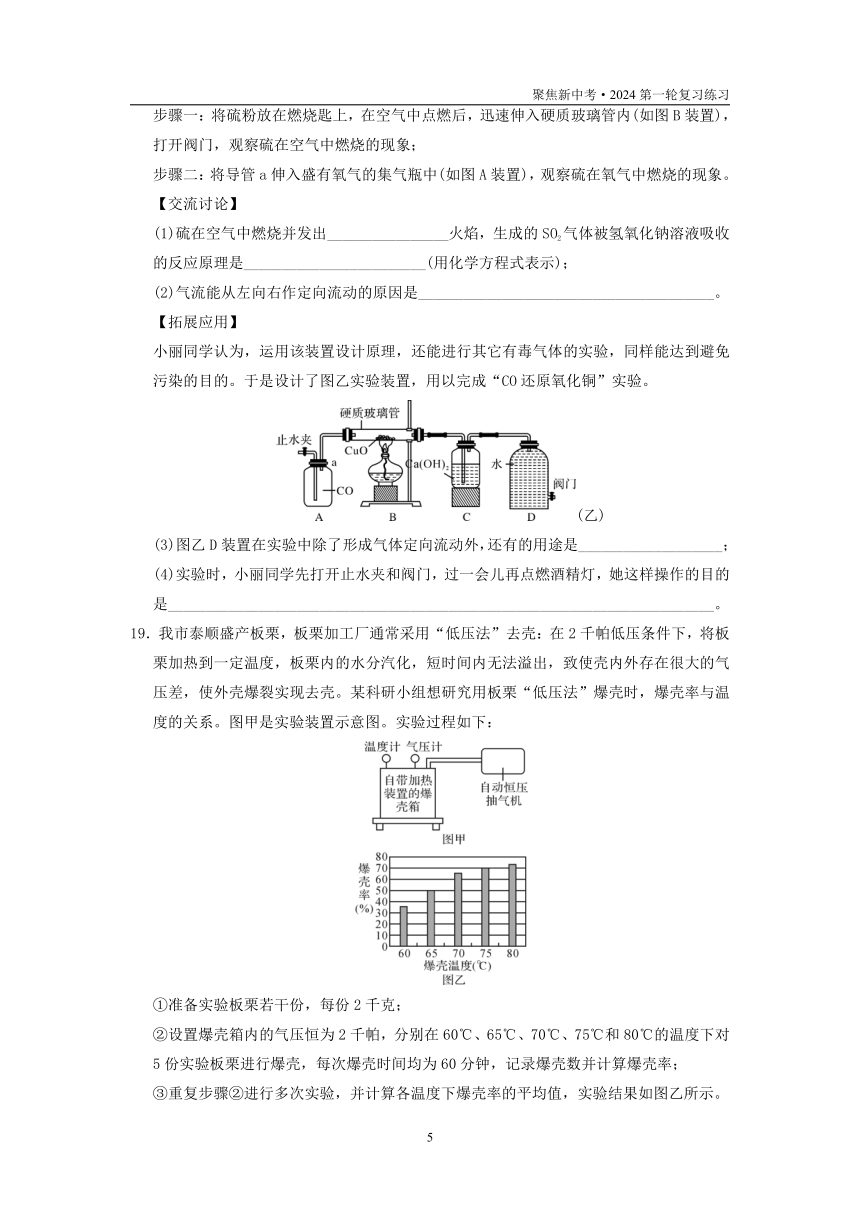
17.某校化学兴趣小组的同学利用下列装置进行实验.
(1)实验目的:(1)用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验.(2)粗略测定加热2g高锰酸钾所收集到的氧气体积.
反应原理:(用化学方程式表示)
高锰酸钾制氧气: 细铁丝在氧气中燃烧: .
装置连接:为达到实验目的(2),各装置的正确连接顺序是:(填接口的字母)a→ →d
(2)问题分析:
1)实验过程发现B瓶中的水变红了,原因是:
2)用收集到的氧气做细铁丝燃烧的实验时,发现瓶底炸裂,发生失误的操作可能是:
3)铁丝在氧气中燃烧实验中
①铁丝为什么要绕成螺旋状? .
②铁丝前端为什么要系一根火柴? .
③点燃火柴后,铁丝插入集气瓶中的适宜时刻是 .
4)为何铁丝要由上而下伸入集气瓶中 .
18.硫燃烧产生的二氧化硫气体会造成空气污染。为避免二氧化硫污染空气,某教师对教材中“硫在空气和氧气中燃烧”的实验进行了改进与创新,设计了如图甲所示的实验装置。
(甲)
【实验原理】
①B装置中燃烧匙固定在带有a导管的单孔塞上,硬质玻璃管透光性好,不影响实验现象的观察;
②C装置的广口瓶中盛放氢氧化钠溶液可吸收二氧化硫气体,避免污染;
③打开D装置中的阀门,气体就会从左向右依次进入各装置。
【实验过程】
步骤一:将硫粉放在燃烧匙上,在空气中点燃后,迅速伸入硬质玻璃管内(如图B装置),打开阀门,观察硫在空气中燃烧的现象;
步骤二:将导管a伸入盛有氧气的集气瓶中(如图A装置),观察硫在氧气中燃烧的现象。
【交流讨论】
(1)硫在空气中燃烧并发出________________火焰,生成的SO2气体被氢氧化钠溶液吸收的反应原理是________________________(用化学方程式表示);
(2)气流能从左向右作定向流动的原因是_______________________________________。
【拓展应用】
小丽同学认为,运用该装置设计原理,还能进行其它有毒气体的实验,同样能达到避免污染的目的。于是设计了图乙实验装置,用以完成“CO还原氧化铜”实验。
(乙)
(3)图乙D装置在实验中除了形成气体定向流动外,还有的用途是___________________;
(4)实验时,小丽同学先打开止水夹和阀门,过一会儿再点燃酒精灯,她这样操作的目的是________________________________________________________________________。
19.我市泰顺盛产板栗,板栗加工厂通常采用“低压法”去壳:在2千帕低压条件下,将板栗加热到一定温度,板栗内的水分汽化,短时间内无法溢出,致使壳内外存在很大的气压差,使外壳爆裂实现去壳。某科研小组想研究用板栗“低压法”爆壳时,爆壳率与温度的关系。图甲是实验装置示意图。实验过程如下:
①准备实验板栗若干份,每份2千克;
②设置爆壳箱内的气压恒为2千帕,分别在60℃、65℃、70℃、75℃和80℃的温度下对5份实验板栗进行爆壳,每次爆壳时间均为60分钟,记录爆壳数并计算爆壳率;
③重复步骤②进行多次实验,并计算各温度下爆壳率的平均值,实验结果如图乙所示。
(1)实验板栗除了品种相同外,还需控制哪些因素相同?
__________________________________________________________________。(写2点)
(2)分析图乙可以得出的结论是________________________________________________。
(3)查阅资料得知:板栗内外气压差越大爆壳率越大,同时壳内气体更容易逸出。科研小组又进行如下实验:取2千克实验板栗,先在气压恒为101千帕、温度恒为80℃的条件下预热30分钟,然后立刻放入气压恒为2千帕、温度恒为80℃爆壳箱中进行30分钟爆壳,多次实验发现爆壳率上升为90%。请解释其原因:_____________________________
___________________________________________________________________________。
课后提分练29 空气(一)
A组 基础排查练
1.如果没有大气层,下列现象不会在地球上存在的是( )
A.重物下落 B.雄伟的高山
C.火山喷发 D.细雨绵绵
【解析】“细雨绵绵”是由水蒸气凝结成水滴而形成的;符合题意;雄伟的高山、火山喷发、重物下落与大气层无关.故D正确.
【答案】D
2.空气是生命赖以存在的物质基础,也是人类生产活动的重要资源,下列有关空气的说法正确的是( )
A.空气中分离出的氮气化学性质不活泼,可作食品保护气
B.空气主要是由氧气和氮气组成,其中氧气的质量约占空气质量的
C.空气质量报告中所列的空气质量级别数值越大,说明空气的质量越好
D.空气中的稀有气体化学性质很稳定,所以常用于制造多种用途的电光源
【解析】 氮气的化学性质不活泼,可作食品保护气;空气中,氧气约占空气体积的五分之一;空气质量报告中所列的空气质量级别数值越小,说明空气的质量越好;性质稳定与可作电光源没有直接的关系。
【答案】 A
3.空气中体积分数占78%的气体是( )
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
【解析】由空气的成分及其体积分数(氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、其他气体和杂质0.03%),可以推断出:空气中体积分数最大的气体是氮气或N2。
【答案】B
4.如图所示,某同学为验证空气中含有少量二氧化碳,将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化。据此,你认为该同学应该( )
A.得出空气中没有二氧化碳的结论
B.得出空气中含有少量二氧化碳的结论
C.继续用大针筒向澄清石灰水压入空气
D.撤去大针筒,用嘴向澄清石灰水吹气
【解析】 选项D首先可以排除,因为用嘴吹入的气体不再是空气,无论现象如何,都无法得出空气中二氧化碳的含量情况;而将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化,仅通过这一次实验不能得出空气中是否含有二氧化碳的结论,所以应该继续用大针筒向澄清石灰水压入空气。
【答案】 C
5.如图装置常用来测定空气中氧气的含量。下列对该实验的认识中正确的是( )
A.红磷燃烧产生大量白色烟雾
B.燃烧匙中的红磷可以换成细铁丝
C.该实验可说明N2难溶于水
D.红磷的量不足会导致进入集气瓶中水的体积大于1/5
【解析】 红磷燃烧产生大量的白烟,而不是白色烟雾;细铁丝在空气中不能燃烧,不能用于测定空气中氧气的含量;实验中当装置内进入水以后,氮气依然能够存在,说明氮气难溶于水;红磷的量不足时,燃烧时就无法将瓶内氧气全部消耗掉,进入水偏少,无法准确测定空气中氧气的含量。
【答案】 C
6.在验证大气压存在的覆杯实验中,小柯认为:“实验中纸片不掉落完全是因为纸片被杯口的水粘住了,而与大气压无关”。下列能帮助小柯改变这种想法的实验是( )
A.如图甲,换用不同种类的纸片做覆杯实验,纸片都不掉落
B.如图乙,覆杯实验中将杯口朝向不同方向,纸片均不掉落
C.如图丙,将一张湿纸覆盖在空杯子的杯口,倒转杯子纸片不掉落
D.如图丁,在密闭钟罩内做覆杯实验,抽出钟罩内空气的过程中纸片掉落
【解析】 图甲中,换用不同种类的纸片做覆杯实验,纸片都不掉落,可以证明大气压的存在,不能反驳小柯的想法;图乙中,覆杯实验中将杯口朝向不同方向,纸片均不掉落,可证明大气向各个方向都有压强,不能反驳小柯的想法;图丙中,将一张湿纸覆盖在空杯子的杯口,倒转杯子纸片不掉落,可证明大气存在向上的压强,不能反驳小柯的想法;图丁中,在密闭钟罩内做覆杯实验,抽出钟罩内空气的过程中纸片掉落,说明没有空气时,没有了气压,也就无法托住水和纸片,这说明实验中纸片不掉落是因为受到大气压的作用,而不是纸片被杯口的水粘住了,可反驳小柯的想法。
【答案】 D
7.用推拉注射器活塞的方法可以检查下图装置的气密性。当缓慢拉动活塞时,如果装置气密性良好,则能观察到( )
A.注射器内有液体 B.瓶中液面明显上升
C.长颈漏斗内液面上升 D.长颈漏斗下端管口产生气泡
【分析】根据检查装置气密性的原理分析即可.装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏。
【解析】向外拉活塞时广口瓶中气体体积减小,外界大气压迫使外边的空气通过长颈漏斗进入锥形瓶,从而观察到长颈漏斗下端口有气泡冒出;故选D。
【点睛】装置气密性的检验是常考的实验题,也是难点,需要多总结,多思考,这类题目不要死记硬背,关键是理解。需要注意,检验装置气密性时可以通过两种方法来改变体系内的压强,①升温:用手掌捂热装置或用酒精灯微热装置;②充气:常用注射器充气;③抽气:常用注射器抽出装置中的一部分气体;可以根据不同的实验装置来选择恰当的方法。
【答案】D
8. 2015年6月1日晚,载有456人的“东方之星”客船在长江中游遇龙卷风翻沉。党和国家高度重视,全力抢救,从翻沉客船中成功搜救出幸存者。说明沉船内残存空气中的氧气,具有的用途是( )
A.作还原剂 B.作保护气
C.供给呼吸 D.支持呼吸
【解析】 氧气能供给呼吸,人体缺少氧气会发生窒息。
【答案】 C
9.实验室用如图所示装置制取氧气,下列实验操作正确的是( )
A.加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中
B.先将导管口移入集气瓶,再开始加热
C.收集O2后,将集气瓶移出水槽,然后盖上玻璃片
D.停止加热时,先熄灭酒精灯,再移出导气管
【解析】 用排水法收集氧气时,加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中。用排水法收集氧气时,当气泡均匀连续地放出时,才开始收集氧气,不能先将导管口移入集气瓶,再开始加热。用排水法收集氧气后,用玻璃片将瓶盖好后,移出水面正放在桌子上。氧气收集完毕,如果先将酒精灯熄灭,则试管内压强变小,水会沿导管倒流进试管。
【答案】 A
10.下列关于物质的燃烧现象描述正确的是( )
A.铝箔在氧气中燃烧发出耀眼的白光,生成白色固体物质
B.硫在氧气中燃烧发出淡蓝色火焰,生成有刺激性气味的气体
C.磷在氧气中剧烈燃烧放出热量,产生大量的白色烟雾
D.铁在氧气中燃烧火星四射,生成红褐色固体物质
【解析】A、铝箔在氧气中燃烧,发出耀眼的白光,生成一种白色固体物质,故选项说法正确;
B、硫在氧气中燃烧,发出明亮的蓝紫色火焰,产生一种具有刺激性气味的气体,故选项说法错误;
C、磷在氧气中燃烧,产生大量的白烟,而不是白色烟雾,故选项说法错误;
D、铁在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,故选项说法错误。
【答案】A
11.实验室制取氧气,下列说法错误的是( )
A.装置①可用于高锰酸钾制取氧气
B.装置②可用于过氧化氢溶液制取氧气
C.装置③可用于收集氧气
D.装置④可用于收集氧气
【解析】 制取气体的装置的选择取决于反应物的状态和反应条件,收集气体的方法取决于气体的密度和溶解能力。高锰酸钾固体需要在加热的条件下分解制取氧气,故装置①可用于高锰酸钾制取氧气。过氧化氢溶液在二氧化锰的催化作用下分解产生氧气,属于固液常温制气体,故装置②可用于过氧化氢溶液制取氧气。氧气的密度比空气大,应该用向上排空气来收集。氧气不易溶于水,故可用排水法来收集。
【答案】 C
12.食品保鲜的措施有添加防腐剂、充填气体、放置干燥剂和脱氧剂等。根据物质的性质选用合适的物质用于食品保鲜,对于保证食品安全和人体健康具有重要的意义。
(1)氮气是常用的充填气体。你认为选用氮气的主要原因是_________________________
___________________________________________________________________________。
(2)生石灰是常用的干燥剂。请你用化学方程式表示选用生石灰的原因_______________
___________________________________________________________________________。
答案 (1)氮气的化学性质不活泼,对人体无害,原料易得,价格经济 (2)生石灰和水反应的化学方程式为:CaO+H2O===Ca(OH)2
13.根据如图的实验,并阅读小资料,回答问题
(1)甲实验中应预先在集气瓶底部铺设水或细沙,这样做的目的是 。
(2)二氧化硫是一种大气污染物。根据小资料,集气瓶乙中添加的液体是水(或氢氧化钠),其目的是 。
【答案】 防止反应生成的熔融物掉落瓶底使瓶底受热不均匀而破裂 利用水或氢氧化钠溶液吸收二氧化硫防止其污染空气
【解析】(1)铁丝燃烧放出大量的热,能使固体熔化为液体落到集气瓶中而炸裂集气瓶底部。甲实验中应预先在集气瓶底部铺设水或细沙,这样做的目的是:防止反应生成的熔融物掉落瓶底使瓶底受热不均匀而破裂。
(2)二氧化硫是一种大气污染物。根据小资料,集气瓶乙中添加的液体是水(或氢氧化钠),其目的是:利用水或氢氧化钠溶液吸收二氧化硫,防止其污染空气。
14.下列是实验室制取气体和收集气体的实验装置,根据装置图回答问题。
(1)实验室用氯酸钾与二氧化锰制取氧气,发生装置应选择________(填编号),装置中还缺少的玻璃仪器是________。
(2)实验室用过氧化氢溶液与二氧化锰制取氧气,其化学反应方程式是_______________,为了便于观察氧气是否集满,应选用的收集装置是________(填编号)。
【解析】 (1)实验室用氯酸钾与二氧化锰制取氧气需要加热,应该用A装置作为发生装置;装置中还缺少的玻璃仪器是酒精灯,酒精灯用来加热反应物。
(2)实验室用过氧化氢溶液与二氧化锰制取氧气,其化学反应方程式为:2H2O22H2O+O2↑。因为氧气的密度比空气大,可以用向上排空气法收集,即用C装置收集;氧气不易溶于水,可以用排水法收集,即用E装置收集;为了便于观察氧气是否集满,应选用的收集装置是E,当观察到气泡从集气瓶口出向外逸出时,说明气体已经收集满。
【答案】 (1)A 酒精灯 (2)2H2O22H2O+O2↑ E
15.某校研究性学习小组用右下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
(1)如图A仪器的名称是 _,燃烧、冷却后打开止水夹,水能进入集气瓶的原因是 ;
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 _%。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气。
该校研究性学习小组想通过自己的研究探究其中的奥妙:
【发现问题】氮气是怎样减少的呢?
【假设一】氮气与镁条反应而减少;
【假设二】 _。
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体。氮化镁中氮元素的化合价为 _。镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁。
(3)通过以上探究,你对燃烧的有关知识有了什么新的认识: _ (写出一点即可)。
【答案】(1)烧杯,集气瓶中气体减少,气压下降,烧杯中的水在大气压的作用下进入集气瓶
(2)21%、只要符合题意就给分、-3
(3)燃烧不一定需要氧气
【解析】解:(1)据图可知仪器A是烧杯;镁燃烧后,烧杯内外形成气压差,所以水会进入烧杯;
(2)①如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的21%,现进入集气瓶中水的体积约为其容积的70%,②根据空气的组成可推出减少的气体中有氮气,及镁除了与氧气反应,还和氮气反应,③根据化合物中元素的化合价的代数和为零,所以氮化镁(Mg3N2)固体氮元素的化合价为-3价;
(3)镁与氮气和二氧化碳都能发生燃烧,说明燃烧不一定需要氧气。
B组 深化突破练
16.如图是实验室常用气体制备装置,据图回答问题:
(1)实验室用高锰酸钾制氧气的化学方程式是____________________________________,
应选择的收集装置是________(填字母代号),如果选用如图2装置收集氧气,气体应从________(填“a”或“b”)端导入。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为____________________。
某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用B装置来制氧气。实验中,同学们发现不能得到平稳的氧气流。大家提出从两个方面加以改进:
一是把发生装置由B改为C,其理由是__________________________________________;
二是将过氧化氢溶液加水稀释,溶液的稀释需要经过计算、量取、搅匀三个步骤。
如果把50g质量分数为20%的过氧化氢溶液稀释成5%的过氧化氢溶液,需加水的质量为________g;在稀释过程中,除了烧杯外,还需要用到的仪器有______________(填数字序号)。
①量筒 ②药匙 ③试管 ④酒精灯 ⑤滴管 ⑥玻璃棒
解析 (1)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4K2MnO4+MnO2+O2↑,氧气的密度比空气大,不易溶于水,所以应选择的收集装置是D或F。选用如图2装置收集氧气,气体应从a端导入。
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O22H2O+O2↑。
注射器可以控制液体的滴加速度,所以把发生装置由B改为C,其理由是:可以控制液体的滴加速度。
把50g质量分数为20%的过氧化氢溶液稀释成5%的过氧化氢溶液,得到溶液的质量为:=200g,所以需加水的质量为200g-50g=150g,在稀释过程中,除了烧杯外,还需要用到的仪器有:量筒、滴管、玻璃棒。
答案 (1)2KMnO4K2MnO4+MnO2+O2↑ D或F a (2)2H2O22H2O+O2↑ 可以控制液体的滴加速度 150g ①⑤⑥
17.某校化学兴趣小组的同学利用下列装置进行实验.
(1)实验目的:(1)用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验.(2)粗略测定加热2g高锰酸钾所收集到的氧气体积.
反应原理:(用化学方程式表示)
高锰酸钾制氧气: 细铁丝在氧气中燃烧: .
装置连接:为达到实验目的(2),各装置的正确连接顺序是:(填接口的字母)a→ →d
(2)问题分析:
1)实验过程发现B瓶中的水变红了,原因是:
2)用收集到的氧气做细铁丝燃烧的实验时,发现瓶底炸裂,发生失误的操作可能是:
3)铁丝在氧气中燃烧实验中
①铁丝为什么要绕成螺旋状? .
②铁丝前端为什么要系一根火柴? .
③点燃火柴后,铁丝插入集气瓶中的适宜时刻是 .
4)为何铁丝要由上而下伸入集气瓶中 .
【答案】 2KMnO4 K2MnO4+MnO2+O2↑ 3Fe+2O2 Fe3O4 c→b 试管口没有放一团棉花 瓶中没有留少量水 增大铁丝的受热面积 引燃铁丝 待火柴临近烧完时 防止细铁丝燃烧时放热使氧气从集气瓶口逸出,保证有充足的氧气与细铁丝反应
【解析】(1)反应原理:高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO4K2MnO4+MnO2+O2↑;铁丝与氧气在点燃的条件下生成四氧化三铁,方程式是
3Fe+2O2Fe3O4;
故答案为2KMnO4K2MnO4+MnO2+O2↑;3Fe+2O2Fe3O4;
装置连接:因为氧气的密度比水小,因此氧气应该从c进入。故答案为c→b;
(2)问题分析:
1)高锰酸钾溶于水显红色,试管口放一个棉花团,是为了防止高锰酸钾粉末进入导管,进入瓶中,故答案为试管口没有放一团棉花;
2)做细铁丝燃烧的实验时,集气瓶底应放少量的水或铺一层细沙,防止燃烧后的熔融物溅落集气瓶底,使集气瓶炸裂。故答案为集气瓶底没有放少量的水或铺一层细沙;
3)①铁丝绕成螺旋状的目的是增大铁丝的受热面积;
②铁丝前端系一根火柴头的目的是引燃且提高铁丝局部的温度,以利于铁丝顺利燃烧;
③点燃火柴后,铁丝插入集气瓶内的适宜时刻是待火柴临近烧完时.
(4)铁丝燃烧放出热量,使瓶中气体受热膨胀逸出,因此要把细铁丝由上向下慢慢插入盛有氧气的集气瓶中.
18.硫燃烧产生的二氧化硫气体会造成空气污染。为避免二氧化硫污染空气,某教师对教材中“硫在空气和氧气中燃烧”的实验进行了改进与创新,设计了如图甲所示的实验装置。
(甲)
【实验原理】
①B装置中燃烧匙固定在带有a导管的单孔塞上,硬质玻璃管透光性好,不影响实验现象的观察;
②C装置的广口瓶中盛放氢氧化钠溶液可吸收二氧化硫气体,避免污染;
③打开D装置中的阀门,气体就会从左向右依次进入各装置。
【实验过程】
步骤一:将硫粉放在燃烧匙上,在空气中点燃后,迅速伸入硬质玻璃管内(如图B装置),打开阀门,观察硫在空气中燃烧的现象;
步骤二:将导管a伸入盛有氧气的集气瓶中(如图A装置),观察硫在氧气中燃烧的现象。
【交流讨论】
(1)硫在空气中燃烧并发出________________火焰,生成的SO2气体被氢氧化钠溶液吸收的反应原理是________________________(用化学方程式表示);
(2)气流能从左向右作定向流动的原因是_______________________________________。
【拓展应用】
小丽同学认为,运用该装置设计原理,还能进行其它有毒气体的实验,同样能达到避免污染的目的。于是设计了图乙实验装置,用以完成“CO还原氧化铜”实验。
(乙)
(3)图乙D装置在实验中除了形成气体定向流动外,还有的用途是___________________;
(4)实验时,小丽同学先打开止水夹和阀门,过一会儿再点燃酒精灯,她这样操作的目的是________________________________________________________________________。
答案 (1)微弱的淡蓝色 2NaOH+SO2===Na2SO3+H2O (2)水位下降,压强减小,形成内外压强差 (3)储存气体(或收集气体) (4)排尽装置中的空气,防止爆炸
19.我市泰顺盛产板栗,板栗加工厂通常采用“低压法”去壳:在2千帕低压条件下,将板栗加热到一定温度,板栗内的水分汽化,短时间内无法溢出,致使壳内外存在很大的气压差,使外壳爆裂实现去壳。某科研小组想研究用板栗“低压法”爆壳时,爆壳率与温度的关系。图甲是实验装置示意图。实验过程如下:
①准备实验板栗若干份,每份2千克;
②设置爆壳箱内的气压恒为2千帕,分别在60℃、65℃、70℃、75℃和80℃的温度下对5份实验板栗进行爆壳,每次爆壳时间均为60分钟,记录爆壳数并计算爆壳率;
③重复步骤②进行多次实验,并计算各温度下爆壳率的平均值,实验结果如图乙所示。
(1)实验板栗除了品种相同外,还需控制哪些因素相同?
__________________________________________________________________。(写2点)
(2)分析图乙可以得出的结论是________________________________________________。
(3)查阅资料得知:板栗内外气压差越大爆壳率越大,同时壳内气体更容易逸出。科研小组又进行如下实验:取2千克实验板栗,先在气压恒为101千帕、温度恒为80℃的条件下预热30分钟,然后立刻放入气压恒为2千帕、温度恒为80℃爆壳箱中进行30分钟爆壳,多次实验发现爆壳率上升为90%。请解释其原因:_____________________________
___________________________________________________________________________。
答案 (1)板栗形状、板栗的新鲜度、板栗大小(其它合理的表述也可) (2)爆壳箱内的气压一定时,温度越高板栗的爆壳率越高 (3)101千帕远大于爆壳箱内的气压,板栗在101千帕下预热时壳内产生的水蒸气漏失少,当将预热好的板栗放入爆壳箱时,板栗壳内外的气压差变得更大,从而提高爆壳率(其它合理的表述也可)
9
课后提分练29 空气(一)
A组 基础排查练
1.如果没有大气层,下列现象不会在地球上存在的是( )
A.重物下落 B.雄伟的高山
C.火山喷发 D.细雨绵绵
2.空气是生命赖以存在的物质基础,也是人类生产活动的重要资源,下列有关空气的说法正确的是( )
A.空气中分离出的氮气化学性质不活泼,可作食品保护气
B.空气主要是由氧气和氮气组成,其中氧气的质量约占空气质量的
C.空气质量报告中所列的空气质量级别数值越大,说明空气的质量越好
D.空气中的稀有气体化学性质很稳定,所以常用于制造多种用途的电光源
3.空气中体积分数占78%的气体是( )
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
4.如图所示,某同学为验证空气中含有少量二氧化碳,将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化。据此,你认为该同学应该( )
A.得出空气中没有二氧化碳的结论
B.得出空气中含有少量二氧化碳的结论
C.继续用大针筒向澄清石灰水压入空气
D.撤去大针筒,用嘴向澄清石灰水吹气
5.如图装置常用来测定空气中氧气的含量。下列对该实验的认识中正确的是( )
A.红磷燃烧产生大量白色烟雾
B.燃烧匙中的红磷可以换成细铁丝
C.该实验可说明N2难溶于水
D.红磷的量不足会导致进入集气瓶中水的体积大于1/5
6.在验证大气压存在的覆杯实验中,小柯认为:“实验中纸片不掉落完全是因为纸片被杯口的水粘住了,而与大气压无关”。下列能帮助小柯改变这种想法的实验是( )
A.如图甲,换用不同种类的纸片做覆杯实验,纸片都不掉落
B.如图乙,覆杯实验中将杯口朝向不同方向,纸片均不掉落
C.如图丙,将一张湿纸覆盖在空杯子的杯口,倒转杯子纸片不掉落
D.如图丁,在密闭钟罩内做覆杯实验,抽出钟罩内空气的过程中纸片掉落
7.用推拉注射器活塞的方法可以检查下图装置的气密性。当缓慢拉动活塞时,如果装置气密性良好,则能观察到( )
A.注射器内有液体 B.瓶中液面明显上升
C.长颈漏斗内液面上升 D.长颈漏斗下端管口产生气泡
8. 2015年6月1日晚,载有456人的“东方之星”客船在长江中游遇龙卷风翻沉。党和国家高度重视,全力抢救,从翻沉客船中成功搜救出幸存者。说明沉船内残存空气中的氧气,具有的用途是( )
A.作还原剂 B.作保护气
C.供给呼吸 D.支持呼吸
9.实验室用如图所示装置制取氧气,下列实验操作正确的是( )
A.加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中
B.先将导管口移入集气瓶,再开始加热
C.收集O2后,将集气瓶移出水槽,然后盖上玻璃片
D.停止加热时,先熄灭酒精灯,再移出导气管
10.下列关于物质的燃烧现象描述正确的是( )
A.铝箔在氧气中燃烧发出耀眼的白光,生成白色固体物质
B.硫在氧气中燃烧发出淡蓝色火焰,生成有刺激性气味的气体
C.磷在氧气中剧烈燃烧放出热量,产生大量的白色烟雾
D.铁在氧气中燃烧火星四射,生成红褐色固体物质
11.实验室制取氧气,下列说法错误的是( )
A.装置①可用于高锰酸钾制取氧气
B.装置②可用于过氧化氢溶液制取氧气
C.装置③可用于收集氧气
D.装置④可用于收集氧气
12.食品保鲜的措施有添加防腐剂、充填气体、放置干燥剂和脱氧剂等。根据物质的性质选用合适的物质用于食品保鲜,对于保证食品安全和人体健康具有重要的意义。
(1)氮气是常用的充填气体。你认为选用氮气的主要原因是_________________________
___________________________________________________________________________。
(2)生石灰是常用的干燥剂。请你用化学方程式表示选用生石灰的原因_______________
___________________________________________________________________________。
13.根据如图的实验,并阅读小资料,回答问题
(1)甲实验中应预先在集气瓶底部铺设水或细沙,这样做的目的是 。
(2)二氧化硫是一种大气污染物。根据小资料,集气瓶乙中添加的液体是水(或氢氧化钠),其目的是 。
14.下列是实验室制取气体和收集气体的实验装置,根据装置图回答问题。
(1)实验室用氯酸钾与二氧化锰制取氧气,发生装置应选择________(填编号),装置中还缺少的玻璃仪器是________。
(2)实验室用过氧化氢溶液与二氧化锰制取氧气,其化学反应方程式是_______________,为了便于观察氧气是否集满,应选用的收集装置是________(填编号)。
15.某校研究性学习小组用右下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
(1)如图A仪器的名称是 _,燃烧、冷却后打开止水夹,水能进入集气瓶的原因是 ;
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 _%。现进入集气瓶中水的体积约为其容积70%,根据空气的组成可推出减少的气体中有氮气。
该校研究性学习小组想通过自己的研究探究其中的奥妙:
【发现问题】氮气是怎样减少的呢?
【假设一】氮气与镁条反应而减少;
【假设二】 _。
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体。氮化镁中氮元素的化合价为 _ 。镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁。
(3)通过以上探究,你对燃烧的有关知识有了什么新的认识: _ (写出一点即可)。
B组 深化突破练
16.如图是实验室常用气体制备装置,据图回答问题:
(1)实验室用高锰酸钾制氧气的化学方程式是____________________________________,
应选择的收集装置是________(填字母代号),如果选用如图2装置收集氧气,气体应从________(填“a”或“b”)端导入。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为____________________。
某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用B装置来制氧气。实验中,同学们发现不能得到平稳的氧气流。大家提出从两个方面加以改进:
一是把发生装置由B改为C,其理由是__________________________________________;
二是将过氧化氢溶液加水稀释,溶液的稀释需要经过计算、量取、搅匀三个步骤。
如果把50g质量分数为20%的过氧化氢溶液稀释成5%的过氧化氢溶液,需加水的质量为________g;在稀释过程中,除了烧杯外,还需要用到的仪器有______________(填数字序号)。
①量筒 ②药匙 ③试管 ④酒精灯 ⑤滴管 ⑥玻璃棒
17.某校化学兴趣小组的同学利用下列装置进行实验.
(1)实验目的:(1)用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验.(2)粗略测定加热2g高锰酸钾所收集到的氧气体积.
反应原理:(用化学方程式表示)
高锰酸钾制氧气: 细铁丝在氧气中燃烧: .
装置连接:为达到实验目的(2),各装置的正确连接顺序是:(填接口的字母)a→ →d
(2)问题分析:
1)实验过程发现B瓶中的水变红了,原因是:
2)用收集到的氧气做细铁丝燃烧的实验时,发现瓶底炸裂,发生失误的操作可能是:
3)铁丝在氧气中燃烧实验中
①铁丝为什么要绕成螺旋状? .
②铁丝前端为什么要系一根火柴? .
③点燃火柴后,铁丝插入集气瓶中的适宜时刻是 .
4)为何铁丝要由上而下伸入集气瓶中 .
18.硫燃烧产生的二氧化硫气体会造成空气污染。为避免二氧化硫污染空气,某教师对教材中“硫在空气和氧气中燃烧”的实验进行了改进与创新,设计了如图甲所示的实验装置。
(甲)
【实验原理】
①B装置中燃烧匙固定在带有a导管的单孔塞上,硬质玻璃管透光性好,不影响实验现象的观察;
②C装置的广口瓶中盛放氢氧化钠溶液可吸收二氧化硫气体,避免污染;
③打开D装置中的阀门,气体就会从左向右依次进入各装置。
【实验过程】
步骤一:将硫粉放在燃烧匙上,在空气中点燃后,迅速伸入硬质玻璃管内(如图B装置),打开阀门,观察硫在空气中燃烧的现象;
步骤二:将导管a伸入盛有氧气的集气瓶中(如图A装置),观察硫在氧气中燃烧的现象。
【交流讨论】
(1)硫在空气中燃烧并发出________________火焰,生成的SO2气体被氢氧化钠溶液吸收的反应原理是________________________(用化学方程式表示);
(2)气流能从左向右作定向流动的原因是_______________________________________。
【拓展应用】
小丽同学认为,运用该装置设计原理,还能进行其它有毒气体的实验,同样能达到避免污染的目的。于是设计了图乙实验装置,用以完成“CO还原氧化铜”实验。
(乙)
(3)图乙D装置在实验中除了形成气体定向流动外,还有的用途是___________________;
(4)实验时,小丽同学先打开止水夹和阀门,过一会儿再点燃酒精灯,她这样操作的目的是________________________________________________________________________。
19.我市泰顺盛产板栗,板栗加工厂通常采用“低压法”去壳:在2千帕低压条件下,将板栗加热到一定温度,板栗内的水分汽化,短时间内无法溢出,致使壳内外存在很大的气压差,使外壳爆裂实现去壳。某科研小组想研究用板栗“低压法”爆壳时,爆壳率与温度的关系。图甲是实验装置示意图。实验过程如下:
①准备实验板栗若干份,每份2千克;
②设置爆壳箱内的气压恒为2千帕,分别在60℃、65℃、70℃、75℃和80℃的温度下对5份实验板栗进行爆壳,每次爆壳时间均为60分钟,记录爆壳数并计算爆壳率;
③重复步骤②进行多次实验,并计算各温度下爆壳率的平均值,实验结果如图乙所示。
(1)实验板栗除了品种相同外,还需控制哪些因素相同?
__________________________________________________________________。(写2点)
(2)分析图乙可以得出的结论是________________________________________________。
(3)查阅资料得知:板栗内外气压差越大爆壳率越大,同时壳内气体更容易逸出。科研小组又进行如下实验:取2千克实验板栗,先在气压恒为101千帕、温度恒为80℃的条件下预热30分钟,然后立刻放入气压恒为2千帕、温度恒为80℃爆壳箱中进行30分钟爆壳,多次实验发现爆壳率上升为90%。请解释其原因:_____________________________
___________________________________________________________________________。
课后提分练29 空气(一)
A组 基础排查练
1.如果没有大气层,下列现象不会在地球上存在的是( )
A.重物下落 B.雄伟的高山
C.火山喷发 D.细雨绵绵
【解析】“细雨绵绵”是由水蒸气凝结成水滴而形成的;符合题意;雄伟的高山、火山喷发、重物下落与大气层无关.故D正确.
【答案】D
2.空气是生命赖以存在的物质基础,也是人类生产活动的重要资源,下列有关空气的说法正确的是( )
A.空气中分离出的氮气化学性质不活泼,可作食品保护气
B.空气主要是由氧气和氮气组成,其中氧气的质量约占空气质量的
C.空气质量报告中所列的空气质量级别数值越大,说明空气的质量越好
D.空气中的稀有气体化学性质很稳定,所以常用于制造多种用途的电光源
【解析】 氮气的化学性质不活泼,可作食品保护气;空气中,氧气约占空气体积的五分之一;空气质量报告中所列的空气质量级别数值越小,说明空气的质量越好;性质稳定与可作电光源没有直接的关系。
【答案】 A
3.空气中体积分数占78%的气体是( )
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
【解析】由空气的成分及其体积分数(氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、其他气体和杂质0.03%),可以推断出:空气中体积分数最大的气体是氮气或N2。
【答案】B
4.如图所示,某同学为验证空气中含有少量二氧化碳,将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化。据此,你认为该同学应该( )
A.得出空气中没有二氧化碳的结论
B.得出空气中含有少量二氧化碳的结论
C.继续用大针筒向澄清石灰水压入空气
D.撤去大针筒,用嘴向澄清石灰水吹气
【解析】 选项D首先可以排除,因为用嘴吹入的气体不再是空气,无论现象如何,都无法得出空气中二氧化碳的含量情况;而将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化,仅通过这一次实验不能得出空气中是否含有二氧化碳的结论,所以应该继续用大针筒向澄清石灰水压入空气。
【答案】 C
5.如图装置常用来测定空气中氧气的含量。下列对该实验的认识中正确的是( )
A.红磷燃烧产生大量白色烟雾
B.燃烧匙中的红磷可以换成细铁丝
C.该实验可说明N2难溶于水
D.红磷的量不足会导致进入集气瓶中水的体积大于1/5
【解析】 红磷燃烧产生大量的白烟,而不是白色烟雾;细铁丝在空气中不能燃烧,不能用于测定空气中氧气的含量;实验中当装置内进入水以后,氮气依然能够存在,说明氮气难溶于水;红磷的量不足时,燃烧时就无法将瓶内氧气全部消耗掉,进入水偏少,无法准确测定空气中氧气的含量。
【答案】 C
6.在验证大气压存在的覆杯实验中,小柯认为:“实验中纸片不掉落完全是因为纸片被杯口的水粘住了,而与大气压无关”。下列能帮助小柯改变这种想法的实验是( )
A.如图甲,换用不同种类的纸片做覆杯实验,纸片都不掉落
B.如图乙,覆杯实验中将杯口朝向不同方向,纸片均不掉落
C.如图丙,将一张湿纸覆盖在空杯子的杯口,倒转杯子纸片不掉落
D.如图丁,在密闭钟罩内做覆杯实验,抽出钟罩内空气的过程中纸片掉落
【解析】 图甲中,换用不同种类的纸片做覆杯实验,纸片都不掉落,可以证明大气压的存在,不能反驳小柯的想法;图乙中,覆杯实验中将杯口朝向不同方向,纸片均不掉落,可证明大气向各个方向都有压强,不能反驳小柯的想法;图丙中,将一张湿纸覆盖在空杯子的杯口,倒转杯子纸片不掉落,可证明大气存在向上的压强,不能反驳小柯的想法;图丁中,在密闭钟罩内做覆杯实验,抽出钟罩内空气的过程中纸片掉落,说明没有空气时,没有了气压,也就无法托住水和纸片,这说明实验中纸片不掉落是因为受到大气压的作用,而不是纸片被杯口的水粘住了,可反驳小柯的想法。
【答案】 D
7.用推拉注射器活塞的方法可以检查下图装置的气密性。当缓慢拉动活塞时,如果装置气密性良好,则能观察到( )
A.注射器内有液体 B.瓶中液面明显上升
C.长颈漏斗内液面上升 D.长颈漏斗下端管口产生气泡
【分析】根据检查装置气密性的原理分析即可.装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏。
【解析】向外拉活塞时广口瓶中气体体积减小,外界大气压迫使外边的空气通过长颈漏斗进入锥形瓶,从而观察到长颈漏斗下端口有气泡冒出;故选D。
【点睛】装置气密性的检验是常考的实验题,也是难点,需要多总结,多思考,这类题目不要死记硬背,关键是理解。需要注意,检验装置气密性时可以通过两种方法来改变体系内的压强,①升温:用手掌捂热装置或用酒精灯微热装置;②充气:常用注射器充气;③抽气:常用注射器抽出装置中的一部分气体;可以根据不同的实验装置来选择恰当的方法。
【答案】D
8. 2015年6月1日晚,载有456人的“东方之星”客船在长江中游遇龙卷风翻沉。党和国家高度重视,全力抢救,从翻沉客船中成功搜救出幸存者。说明沉船内残存空气中的氧气,具有的用途是( )
A.作还原剂 B.作保护气
C.供给呼吸 D.支持呼吸
【解析】 氧气能供给呼吸,人体缺少氧气会发生窒息。
【答案】 C
9.实验室用如图所示装置制取氧气,下列实验操作正确的是( )
A.加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中
B.先将导管口移入集气瓶,再开始加热
C.收集O2后,将集气瓶移出水槽,然后盖上玻璃片
D.停止加热时,先熄灭酒精灯,再移出导气管
【解析】 用排水法收集氧气时,加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中。用排水法收集氧气时,当气泡均匀连续地放出时,才开始收集氧气,不能先将导管口移入集气瓶,再开始加热。用排水法收集氧气后,用玻璃片将瓶盖好后,移出水面正放在桌子上。氧气收集完毕,如果先将酒精灯熄灭,则试管内压强变小,水会沿导管倒流进试管。
【答案】 A
10.下列关于物质的燃烧现象描述正确的是( )
A.铝箔在氧气中燃烧发出耀眼的白光,生成白色固体物质
B.硫在氧气中燃烧发出淡蓝色火焰,生成有刺激性气味的气体
C.磷在氧气中剧烈燃烧放出热量,产生大量的白色烟雾
D.铁在氧气中燃烧火星四射,生成红褐色固体物质
【解析】A、铝箔在氧气中燃烧,发出耀眼的白光,生成一种白色固体物质,故选项说法正确;
B、硫在氧气中燃烧,发出明亮的蓝紫色火焰,产生一种具有刺激性气味的气体,故选项说法错误;
C、磷在氧气中燃烧,产生大量的白烟,而不是白色烟雾,故选项说法错误;
D、铁在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,故选项说法错误。
【答案】A
11.实验室制取氧气,下列说法错误的是( )
A.装置①可用于高锰酸钾制取氧气
B.装置②可用于过氧化氢溶液制取氧气
C.装置③可用于收集氧气
D.装置④可用于收集氧气
【解析】 制取气体的装置的选择取决于反应物的状态和反应条件,收集气体的方法取决于气体的密度和溶解能力。高锰酸钾固体需要在加热的条件下分解制取氧气,故装置①可用于高锰酸钾制取氧气。过氧化氢溶液在二氧化锰的催化作用下分解产生氧气,属于固液常温制气体,故装置②可用于过氧化氢溶液制取氧气。氧气的密度比空气大,应该用向上排空气来收集。氧气不易溶于水,故可用排水法来收集。
【答案】 C
12.食品保鲜的措施有添加防腐剂、充填气体、放置干燥剂和脱氧剂等。根据物质的性质选用合适的物质用于食品保鲜,对于保证食品安全和人体健康具有重要的意义。
(1)氮气是常用的充填气体。你认为选用氮气的主要原因是_________________________
___________________________________________________________________________。
(2)生石灰是常用的干燥剂。请你用化学方程式表示选用生石灰的原因_______________
___________________________________________________________________________。
答案 (1)氮气的化学性质不活泼,对人体无害,原料易得,价格经济 (2)生石灰和水反应的化学方程式为:CaO+H2O===Ca(OH)2
13.根据如图的实验,并阅读小资料,回答问题
(1)甲实验中应预先在集气瓶底部铺设水或细沙,这样做的目的是 。
(2)二氧化硫是一种大气污染物。根据小资料,集气瓶乙中添加的液体是水(或氢氧化钠),其目的是 。
【答案】 防止反应生成的熔融物掉落瓶底使瓶底受热不均匀而破裂 利用水或氢氧化钠溶液吸收二氧化硫防止其污染空气
【解析】(1)铁丝燃烧放出大量的热,能使固体熔化为液体落到集气瓶中而炸裂集气瓶底部。甲实验中应预先在集气瓶底部铺设水或细沙,这样做的目的是:防止反应生成的熔融物掉落瓶底使瓶底受热不均匀而破裂。
(2)二氧化硫是一种大气污染物。根据小资料,集气瓶乙中添加的液体是水(或氢氧化钠),其目的是:利用水或氢氧化钠溶液吸收二氧化硫,防止其污染空气。
14.下列是实验室制取气体和收集气体的实验装置,根据装置图回答问题。
(1)实验室用氯酸钾与二氧化锰制取氧气,发生装置应选择________(填编号),装置中还缺少的玻璃仪器是________。
(2)实验室用过氧化氢溶液与二氧化锰制取氧气,其化学反应方程式是_______________,为了便于观察氧气是否集满,应选用的收集装置是________(填编号)。
【解析】 (1)实验室用氯酸钾与二氧化锰制取氧气需要加热,应该用A装置作为发生装置;装置中还缺少的玻璃仪器是酒精灯,酒精灯用来加热反应物。
(2)实验室用过氧化氢溶液与二氧化锰制取氧气,其化学反应方程式为:2H2O22H2O+O2↑。因为氧气的密度比空气大,可以用向上排空气法收集,即用C装置收集;氧气不易溶于水,可以用排水法收集,即用E装置收集;为了便于观察氧气是否集满,应选用的收集装置是E,当观察到气泡从集气瓶口出向外逸出时,说明气体已经收集满。
【答案】 (1)A 酒精灯 (2)2H2O22H2O+O2↑ E
15.某校研究性学习小组用右下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
(1)如图A仪器的名称是 _,燃烧、冷却后打开止水夹,水能进入集气瓶的原因是 ;
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 _%。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气。
该校研究性学习小组想通过自己的研究探究其中的奥妙:
【发现问题】氮气是怎样减少的呢?
【假设一】氮气与镁条反应而减少;
【假设二】 _。
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体。氮化镁中氮元素的化合价为 _。镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁。
(3)通过以上探究,你对燃烧的有关知识有了什么新的认识: _ (写出一点即可)。
【答案】(1)烧杯,集气瓶中气体减少,气压下降,烧杯中的水在大气压的作用下进入集气瓶
(2)21%、只要符合题意就给分、-3
(3)燃烧不一定需要氧气
【解析】解:(1)据图可知仪器A是烧杯;镁燃烧后,烧杯内外形成气压差,所以水会进入烧杯;
(2)①如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的21%,现进入集气瓶中水的体积约为其容积的70%,②根据空气的组成可推出减少的气体中有氮气,及镁除了与氧气反应,还和氮气反应,③根据化合物中元素的化合价的代数和为零,所以氮化镁(Mg3N2)固体氮元素的化合价为-3价;
(3)镁与氮气和二氧化碳都能发生燃烧,说明燃烧不一定需要氧气。
B组 深化突破练
16.如图是实验室常用气体制备装置,据图回答问题:
(1)实验室用高锰酸钾制氧气的化学方程式是____________________________________,
应选择的收集装置是________(填字母代号),如果选用如图2装置收集氧气,气体应从________(填“a”或“b”)端导入。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为____________________。
某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用B装置来制氧气。实验中,同学们发现不能得到平稳的氧气流。大家提出从两个方面加以改进:
一是把发生装置由B改为C,其理由是__________________________________________;
二是将过氧化氢溶液加水稀释,溶液的稀释需要经过计算、量取、搅匀三个步骤。
如果把50g质量分数为20%的过氧化氢溶液稀释成5%的过氧化氢溶液,需加水的质量为________g;在稀释过程中,除了烧杯外,还需要用到的仪器有______________(填数字序号)。
①量筒 ②药匙 ③试管 ④酒精灯 ⑤滴管 ⑥玻璃棒
解析 (1)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4K2MnO4+MnO2+O2↑,氧气的密度比空气大,不易溶于水,所以应选择的收集装置是D或F。选用如图2装置收集氧气,气体应从a端导入。
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O22H2O+O2↑。
注射器可以控制液体的滴加速度,所以把发生装置由B改为C,其理由是:可以控制液体的滴加速度。
把50g质量分数为20%的过氧化氢溶液稀释成5%的过氧化氢溶液,得到溶液的质量为:=200g,所以需加水的质量为200g-50g=150g,在稀释过程中,除了烧杯外,还需要用到的仪器有:量筒、滴管、玻璃棒。
答案 (1)2KMnO4K2MnO4+MnO2+O2↑ D或F a (2)2H2O22H2O+O2↑ 可以控制液体的滴加速度 150g ①⑤⑥
17.某校化学兴趣小组的同学利用下列装置进行实验.
(1)实验目的:(1)用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验.(2)粗略测定加热2g高锰酸钾所收集到的氧气体积.
反应原理:(用化学方程式表示)
高锰酸钾制氧气: 细铁丝在氧气中燃烧: .
装置连接:为达到实验目的(2),各装置的正确连接顺序是:(填接口的字母)a→ →d
(2)问题分析:
1)实验过程发现B瓶中的水变红了,原因是:
2)用收集到的氧气做细铁丝燃烧的实验时,发现瓶底炸裂,发生失误的操作可能是:
3)铁丝在氧气中燃烧实验中
①铁丝为什么要绕成螺旋状? .
②铁丝前端为什么要系一根火柴? .
③点燃火柴后,铁丝插入集气瓶中的适宜时刻是 .
4)为何铁丝要由上而下伸入集气瓶中 .
【答案】 2KMnO4 K2MnO4+MnO2+O2↑ 3Fe+2O2 Fe3O4 c→b 试管口没有放一团棉花 瓶中没有留少量水 增大铁丝的受热面积 引燃铁丝 待火柴临近烧完时 防止细铁丝燃烧时放热使氧气从集气瓶口逸出,保证有充足的氧气与细铁丝反应
【解析】(1)反应原理:高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应方程式是:2KMnO4K2MnO4+MnO2+O2↑;铁丝与氧气在点燃的条件下生成四氧化三铁,方程式是
3Fe+2O2Fe3O4;
故答案为2KMnO4K2MnO4+MnO2+O2↑;3Fe+2O2Fe3O4;
装置连接:因为氧气的密度比水小,因此氧气应该从c进入。故答案为c→b;
(2)问题分析:
1)高锰酸钾溶于水显红色,试管口放一个棉花团,是为了防止高锰酸钾粉末进入导管,进入瓶中,故答案为试管口没有放一团棉花;
2)做细铁丝燃烧的实验时,集气瓶底应放少量的水或铺一层细沙,防止燃烧后的熔融物溅落集气瓶底,使集气瓶炸裂。故答案为集气瓶底没有放少量的水或铺一层细沙;
3)①铁丝绕成螺旋状的目的是增大铁丝的受热面积;
②铁丝前端系一根火柴头的目的是引燃且提高铁丝局部的温度,以利于铁丝顺利燃烧;
③点燃火柴后,铁丝插入集气瓶内的适宜时刻是待火柴临近烧完时.
(4)铁丝燃烧放出热量,使瓶中气体受热膨胀逸出,因此要把细铁丝由上向下慢慢插入盛有氧气的集气瓶中.
18.硫燃烧产生的二氧化硫气体会造成空气污染。为避免二氧化硫污染空气,某教师对教材中“硫在空气和氧气中燃烧”的实验进行了改进与创新,设计了如图甲所示的实验装置。
(甲)
【实验原理】
①B装置中燃烧匙固定在带有a导管的单孔塞上,硬质玻璃管透光性好,不影响实验现象的观察;
②C装置的广口瓶中盛放氢氧化钠溶液可吸收二氧化硫气体,避免污染;
③打开D装置中的阀门,气体就会从左向右依次进入各装置。
【实验过程】
步骤一:将硫粉放在燃烧匙上,在空气中点燃后,迅速伸入硬质玻璃管内(如图B装置),打开阀门,观察硫在空气中燃烧的现象;
步骤二:将导管a伸入盛有氧气的集气瓶中(如图A装置),观察硫在氧气中燃烧的现象。
【交流讨论】
(1)硫在空气中燃烧并发出________________火焰,生成的SO2气体被氢氧化钠溶液吸收的反应原理是________________________(用化学方程式表示);
(2)气流能从左向右作定向流动的原因是_______________________________________。
【拓展应用】
小丽同学认为,运用该装置设计原理,还能进行其它有毒气体的实验,同样能达到避免污染的目的。于是设计了图乙实验装置,用以完成“CO还原氧化铜”实验。
(乙)
(3)图乙D装置在实验中除了形成气体定向流动外,还有的用途是___________________;
(4)实验时,小丽同学先打开止水夹和阀门,过一会儿再点燃酒精灯,她这样操作的目的是________________________________________________________________________。
答案 (1)微弱的淡蓝色 2NaOH+SO2===Na2SO3+H2O (2)水位下降,压强减小,形成内外压强差 (3)储存气体(或收集气体) (4)排尽装置中的空气,防止爆炸
19.我市泰顺盛产板栗,板栗加工厂通常采用“低压法”去壳:在2千帕低压条件下,将板栗加热到一定温度,板栗内的水分汽化,短时间内无法溢出,致使壳内外存在很大的气压差,使外壳爆裂实现去壳。某科研小组想研究用板栗“低压法”爆壳时,爆壳率与温度的关系。图甲是实验装置示意图。实验过程如下:
①准备实验板栗若干份,每份2千克;
②设置爆壳箱内的气压恒为2千帕,分别在60℃、65℃、70℃、75℃和80℃的温度下对5份实验板栗进行爆壳,每次爆壳时间均为60分钟,记录爆壳数并计算爆壳率;
③重复步骤②进行多次实验,并计算各温度下爆壳率的平均值,实验结果如图乙所示。
(1)实验板栗除了品种相同外,还需控制哪些因素相同?
__________________________________________________________________。(写2点)
(2)分析图乙可以得出的结论是________________________________________________。
(3)查阅资料得知:板栗内外气压差越大爆壳率越大,同时壳内气体更容易逸出。科研小组又进行如下实验:取2千克实验板栗,先在气压恒为101千帕、温度恒为80℃的条件下预热30分钟,然后立刻放入气压恒为2千帕、温度恒为80℃爆壳箱中进行30分钟爆壳,多次实验发现爆壳率上升为90%。请解释其原因:_____________________________
___________________________________________________________________________。
答案 (1)板栗形状、板栗的新鲜度、板栗大小(其它合理的表述也可) (2)爆壳箱内的气压一定时,温度越高板栗的爆壳率越高 (3)101千帕远大于爆壳箱内的气压,板栗在101千帕下预热时壳内产生的水蒸气漏失少,当将预热好的板栗放入爆壳箱时,板栗壳内外的气压差变得更大,从而提高爆壳率(其它合理的表述也可)
9
同课章节目录
