第八单元金属和金属材料练习题2023---2024学年人教版九年级化学下册(含解析)
文档属性
| 名称 | 第八单元金属和金属材料练习题2023---2024学年人教版九年级化学下册(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 472.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 20:11:07 | ||
图片预览




文档简介
第八单元金属和金属材料练习题
一、选择题
1.下列关于资源、能源的叙述错误的是
A.宝贵的金属资源主要分布在地壳和海洋中
B.海洋是地球上巨大的资源宝库,海水中含有80多种化学物质
C.回收废旧金属可以节约金属资源,还可以节约能源
D.人们正在开发和利用的新能源有太阳能、风能、地热能等
2.下列说法正确的是
A.点燃可燃性气体和空气的混合气体不一定会爆炸
B.燃料若能完全燃烧,则其产物就不会污染空气
C.生铁的含碳量小于钢的含碳量
D.钢可全部溶解于过量稀盐酸
3.从《中国成语大会》到《中国诗词大会》,中国的诗词文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理。下列说法中错误的是
A.“百炼成钢”与“沙里淘金”所涉及的变化相同
B.“不经一番寒彻骨,怎得梅花扑鼻香”,“扑鼻香”说明分子在不断地运动
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“松叶堪为酒,春来酿几多”指清香的美酒来自于粮食的缓慢氧化
4.生产生活中的下列变化,属于物理变化的是
A.植物的光合作用 B.秸秆、杂草、粪便等在沼气池中发酵制得甲烷
C.生铁百炼成钢 D.二氧化碳气体经降温、加压制得干冰
5.为了增强市民的环保意识,变废为宝,某市已实行垃圾分类回收。设置的垃圾箱、蓝色箱装可回收垃圾,黄色箱装不可回收垃圾,以下哪些物质能扔进蓝色垃圾箱
①废报纸 ②口香糖 ③菜叶 ④易拉罐 ⑤果皮
A.①③④⑤ B.②③⑤ C.①④⑤ D.①④
6.在点燃条件下,甲、乙反应的微观示意图如下。下列说法错误的是
A.反应中甲、乙的分子数比为1∶1 B.一定条件下,丁可转化为乙
C.该反应属于置换反应 D.反应中只有氢的化合价不变
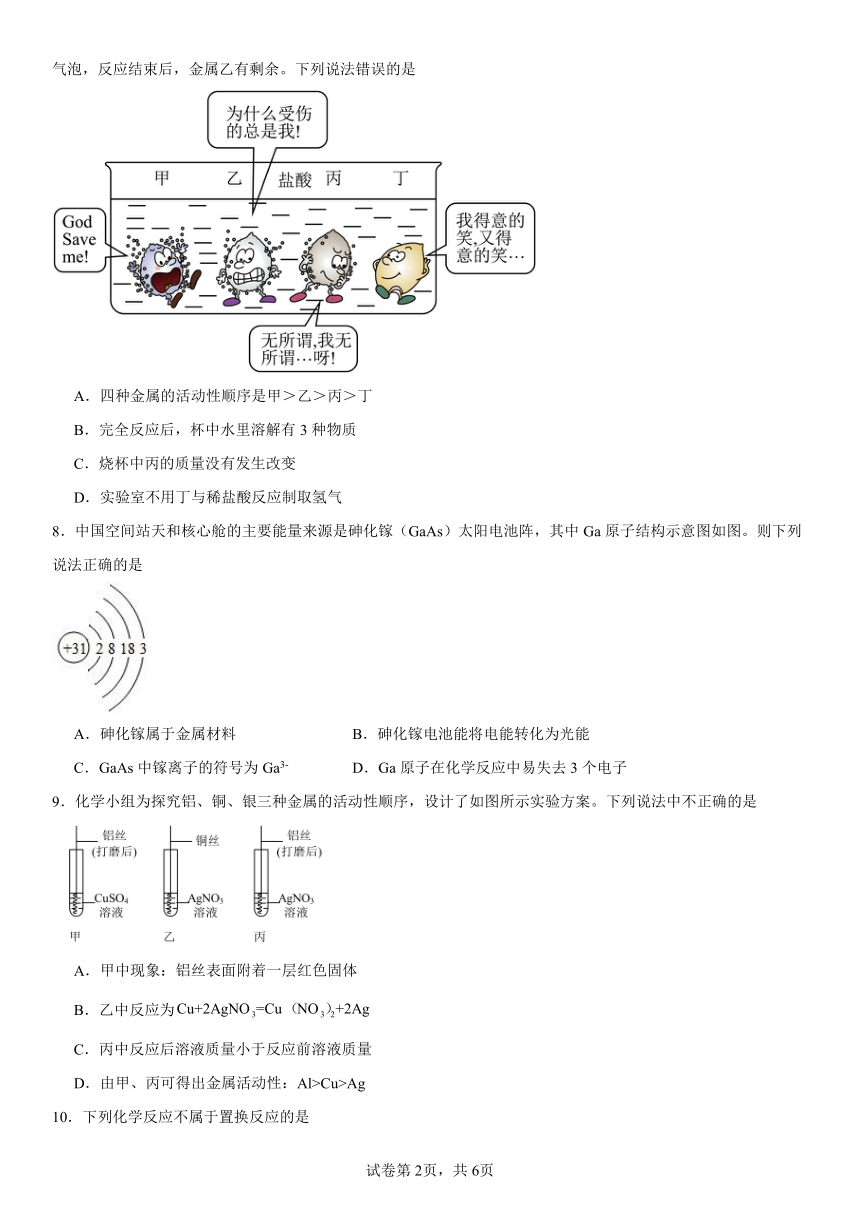
7.如图所示,甲、乙、丙、丁四种常见金属在容器中与盐酸的反应情况,卡通人周围 的小黑点表小反应中生成的气泡,反应结束后,金属乙有剩余。下列说法错误的是
A.四种金属的活动性顺序是甲>乙>丙>丁
B.完全反应后,杯中水里溶解有3种物质
C.烧杯中丙的质量没有发生改变
D.实验室不用丁与稀盐酸反应制取氢气
8.中国空间站天和核心舱的主要能量来源是砷化镓(GaAs)太阳电池阵,其中Ga原子结构示意图如图。则下列说法正确的是
A.砷化镓属于金属材料 B.砷化镓电池能将电能转化为光能
C.GaAs中镓离子的符号为Ga3- D.Ga原子在化学反应中易失去3个电子
9.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了如图所示实验方案。下列说法中不正确的是
A.甲中现象:铝丝表面附着一层红色固体
B.乙中反应为
C.丙中反应后溶液质量小于反应前溶液质量
D.由甲、丙可得出金属活动性:Al>Cu>Ag
10.下列化学反应不属于置换反应的是
A.H2+CuOCu+H2O B.2A1+6HCl=2AlCl3+3H2↑
C.CO+CuOCu+CO2 D.C+2CuO2Cu+ CO2↑、
11.谚语诗词中蕴含着丰富的科学道理。下列说法中,不正确的是
A.“众人拾柴火焰高”是指可燃物越多,着火点越低
B.“满架蔷薇一院香”的原因是分子在不停地运动
C.“真金不怕火炼”是说明金的化学性质比较稳定
D.“百炼成钢”与“铁杵磨成针”蕴含的化学原理不同
12.回收含铜废料中的铜,部分实验流程如图所示。含铜废料灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。下列关于该流程的说法错误的是
A.“还原”过程能发生说明铁的活动性比铜强
B.“酸溶”过程中发生的反应属于置换反应
C.滤液X中含的离子为Fe2+和
D.从Cu、Fe混合物中回收Cu的方法是:加入足量稀硫酸,充分反应后过滤、洗涤、干燥
二、填空与简答
13.某化工厂的废液中主要含有硝酸银、硝酸铜。取一定量的该废液样品,加入镁粉和铜粉,充分反应后过滤,得到滤液和滤渣。请填写下列空格:
(1)若滤渣中有镁粉,则滤渣中除镁粉外还含有 (填写化学式,下同)。
(2)若滤渣中有铜粉,则滤液中的溶质一定含有 ,可能含有 。
(3)反应后得到滤液的质量 (选填“小于”、“大于”或“等于”)反应前所取废液样品的质量。
14.如图测所示,弹簧秤下挂着一重物A,烧杯中盛有溶液B,试根据要求回答下列问题:
(1)若A为铁块,B为稀硫酸,则将A放入B中,过一会儿,弹簧秤的读数将(填 “变大”、“变小”或“不变”,下同 ) ;
(2) 若A为铁块,B为硫酸铜溶液,则将A放入B中,过一会儿,弹簧秤的读数将 。
15.金属在生产、生活中应用广泛。
(1)灯泡里的灯丝用钨制而不用锡制的原因是 ;
(2)地壳中含量最高的元素是 ;
(3)波尔多液由硫酸铜、生石灰加水配制而成,配制过程中为什么不能选用铁质容器? (用化学方程式回答)。
(4)世界上铝的年产量仅次于铁,位居第二位。铝制品能被广泛地使用,其中一个原因是铝具有很好的抗腐蚀性能,与气中的氧气反应生成薄膜阻止铝进一步反应,其化学反应方程式为 。
16.2021年4月29日,我国用长征五号B遥二运载火箭成功发射中国空间站天和核心舱,为我国空间站建设迈出重要一步,化学材料在其中起到了重要作用。
(1)铝合金和钛合金被广泛用于航天工业。
①工业制钛的一个反应为:,X的化学式为 ,TiO2中Ti的化合价为 。
②室温下,钛与水、稀盐酸和稀硫酸均不反应,可判断钛的金属活动性比铝的 (填“强”或“弱”)。
③一般情况下,铝合金的强度和硬度比纯铝的 (填“高”或“低”)。
(2)已知火箭将卫星送入预定轨道需要40t液氢,则使液氢完全燃烧需要提供液氧 吨?
17.完成下列变化的化学方程式,填写(1)和(3)的基本反应类型。
(1)铁丝在氧气中燃烧: ; 。
(2)将铁钉放入硫酸铜溶液中: 。
(3)煅烧石灰石: ; 。
(4)一氧化碳还原氧化铁: 。
18.钢铁是重要的金属材料,在生产、生活中有广泛的用途。建造北京奥运会主体育场“鸟巢”,就是用了大量的钢铁。
(1)某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,打开包装后即会缓慢放出热量。
①其发热原理是 。
②推测发热剂成分中氯化钠的作用是 。
(2)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,请写出最后炼铁的化学方程式:
(3)硅酸盐是构成地壳岩石的主要成分。化学上常用二氧化硅和氧化物的形式表示其组成。例如:镁橄榄石(Mg2SiO4)常以2MgO·SiO2表示。依照上法表示下列硅酸盐的组成:
高岭石Al2(Si2O5)(OH)4 。滑石Mg3(Si4O10)(OH)2 。
19.下图表示某些物质间转化关系(反应条件和部分产物已省略)。其中A、B、D、E都属于氧化物,且A、E为黑色固体;B、D是由相同元素组成;C、Y、Z为无色气体,其中Y有毒;X是最常见的金属。请回答下列问题:
(1)反应①中A物质的作用是 ;
(2)反应③中具有还原性的物质的化学式 ;
(3)反应④的化学方程式为: ;
(4)反应⑤中G物质除有机物(如甲烷)外,还可能是 。
20.硅(Si)是太阳能电池和电脑芯片不可缺少的材料。利用石英砂(主要成分为二氧化硅)生产高纯硅的流程图如图(整个制备过程必须达到无水、无氧气)。
回答下列问题:
(1)三氯硅烷是由 元素(填数字)组成的化合物,请写出由纯SiHCl3制备高纯硅的化学反应方程式为 ,反应的基本类型为 。
(2)整个制备过程必须严格控制无水无氧气。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出化学反应方程式为 ;H2还原SiHCl3过程中若混入O2,可能引起的后果是 。
(3)以上生产高纯硅的流程中,可循环使用的物质是 。
三、科学探究题
21.在研究化学反应伴随热量变化实验时,有的同学发现镁和铁都可以与酸反应,但反应的快慢有明显差异,提出问题并进行探究。
【提出问题】酸的浓度、金属的种类、金属的形状是否会影响金属与酸反应的快慢?
【进行实验】分别取20mL盐酸、2g金属。
实验编号 盐酸的浓度 金属种类 金属形状 收集50mL氢气所需时间/s
① 10% 镁 粉末 60
② 10% 铁 片状 120
③ 10% 镁 片状 102
④ 20% 铁 片状 110
【解释与结论】
(1)镁与盐酸反应的实验现象是固体逐渐消失、放出大量热、 。
(2)镁、铁与盐酸发生的反应相似(都生成+2价的化合物),补全化学反应方程式:
(3)对比实验①和③,得到的结论是 。
(4)要比较不同种类的金属对反应快慢的影响,应选择的实验编号是 。
(5)由上述实验可推知,影响金属与酸反应快慢的因素是 。
【反思与评价】
(6)该实验除了用收集等体积氢气所用时间来衡量反应的快慢外,其他实验方法是 。
四、计算题
22.根据图示实验过程和所提供的数据进行计算:
(1)生成氢气的质量为 g。
(2)Cu﹣Zn合金中铜的质量分数。(写出计算过程)【反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑】
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、金属资源主要分布在地壳和海洋中,不符合题意;
B、海水中含有80多种元素,不是80多种化学物质,符合题意;
C、回收废旧金属可以增加金属的利用率,有利于节约资源和能源,不符合题意;
D、太阳能、风能、地热能等属于新能源,不符合题意;
故选B。
2.A
【详解】A、点燃可燃性气体和空气的混合物,达到爆炸极限,才会爆炸,符合题意;
B、燃料完全燃烧,也可能产生二氧化硫等污染物,污染空气,不符合题意;
C、生铁和钢都是铁的合金,但是含碳量不同,生铁的含碳量为2%-4.3%,钢的含碳量为0.03%-2%,故生铁的含碳量大于钢的含碳量,不符合题意;
D、钢是铁、碳合金,铁能与稀盐酸反应生成氯化亚铁和氢气,碳和稀盐酸不反应,故钢不能全部溶解于过量稀盐酸,不符合题意。
故选A。
3.A
【详解】A. 有新物质生成的变化是化学变化,无新物质生成的变化是物理变化。“百炼成钢”是指生铁经锤炼后其中的碳转化为二氧化碳,发生的是化学变化;“沙里淘金”发生的是物理变化;所涉及的变化类型不相同,此选项错误;
B. “不经一番寒彻骨,怎得梅花扑鼻香”,“扑鼻香”说明分子在不断地运动,此选项正确;
C. “真金不怕火炼”是指金即使在高温下也不与氧气反应,说明金的化学性质非常稳定,此选项正确;
D. “松叶堪为酒,春来酿几多”指清香的美酒来自于粮食的酿造,属于缓慢氧化,此选项正确。
故选A。
4.D
【详解】A、植物的光合作用过程中生成葡萄糖和氧气,有新物质生成属于化学变化,不符合题意;
B、秸秆、杂草、粪便等在沼气池中发酵制得甲烷,有新物质生成属于化学变化,不符合题意;
C、生铁百炼成钢过程中,碳与氧气反应生成二氧化碳,有新物质生成属于化学变化,不符合题意;
D、二氧化碳气体经降温、加压制得干冰,是二氧化碳的状态改变没有新物质生成属于物理变化,符合题意。
故选:D。
5.D
【详解】蓝色垃圾箱用来回收再利用垃圾,可回收再利用的垃圾包括纸类、塑料、橡胶、金属、玻璃等,所以废旧报纸、易拉罐是属于可回收垃圾,故能放入绿色垃圾箱的是①④,故选D。
【点睛】(1) 不可回收垃圾:主要是厨房垃圾,包括果皮、菜皮、剩饭菜等; (2) 可回收垃圾:纸类、塑料、橡胶、金属、玻璃等;(3) 有毒有害垃圾:电池、荧光灯管、水银温度计、油漆桶、药品等。
6.A
【详解】A、由图可知,发生反应为。所以反应中甲、乙的分子数比为4:3,错误。
B、丁是水,水在通电条件下可以分解为氢气和乙氧气,正确。
C、该反应是单质和化合物反应生成单质和化合物的反应,是置换反应。正确。
D、化合物中各元素化合价代数和为0,单质中元素化合价为0,化合物中氧元素通常为-2价,氢元素通常为+1价。所以反应前氮元素为-3价,氢元素为+1价,氧元素为0价,反应后氮元素为0价,氢元素为+1价,氧元素为-2价,反应中只有氢的化合价不变,正确。
7.B
【详解】A、图中金属甲表面气泡最多,其次为金属乙,最少的为金属丙,金属丁表面无气泡,所以甲乙丙丁四种金属活动性由强到弱的顺序为:甲、乙、丙、丁,正确;
B、根据图中的现象可知,甲、乙、丙会与酸反应,丁不会与酸反应,乙有剩余,乙会将丙从其盐溶液中置换出来,所以溶液中只有甲、乙的盐溶液,所以此时溶液中的溶质有2种;错误;
C、反应结束后,金属乙有剩余,说明盐酸完全消耗,故丙没有和盐酸反应,丙的质量没有发生改变,正确;
D、丁不会与酸反应,实验室不用丁与稀盐酸反应制取氢气,正确;
故选B。
8.D
【详解】A、金属材料包括纯金属和合金,砷化镓属于化合物,不属于金属材料,故A错误;
B、砷化镓电池能将光能转化为电能,故B错误;
C、根据镓的原子结构示意图,最外层电子数为3,易失去3个电子,形成带3个单位正电荷的离子,符号为Ga3+,故C错误;
D、根据镓的原子结构示意图,最外层电子数为3,易失去3个电子,故D正确。
故选D。
9.D
【详解】A、铝能与CuSO4溶液发生置换反应生成金属Cu,因此,铝丝表面附着一层红色固体。A正确;
B、乙中反应为铜与硝酸银反应生成银和硝酸铜,化学方程式为。B正确;
C、丙中是铝与硝酸银反应生成银和硝酸铜溶液,化学方程式,根据化学方程式的数量关系可以看出,每510份质量的硝酸银反应后生成213份质量的硝酸铝,溶质质量减小,溶剂质量不变,所以丙中反应后溶液质量小于反应前溶液质量。C正确;
D、由甲可得出金属活动性:Al>Cu;由乙可得出金属活动性:Cu>Ag。所以由甲、乙可得出金属活动性:Al>Cu>Ag。D不正确。
综上所述:选择D。
10.C
【详解】由单质与化合物反应生成新的单质和新的化合物的反应是置换反应。
反应A、B、D符合置换反应的特点,故属于置换反应;故选C。
【点睛】由单质与化合物反应生成新的单质和新的化合物的反应是置换反应。
11.A
【详解】A. 着火点为物质的固有属性,不能改变,且“众人拾柴火焰高”是指增加可燃物,使物质燃烧更旺盛,该选项说法不正确;
B. “满架蔷薇一院香”的原因是分子在不停地运动,该选项说法正确;
C. 在金属活动性顺序表中金排在最后,金的化学性质很稳定,“真金不怕火炼”是说明金的化学性质比较稳定,该选项说法正确;
D. “百炼成钢”指的是通过灼烧将铁中的碳反应掉,从而将生铁转化为钢,发生的是化学变化,而“铁杵磨成针”是通过打磨来改变铁的形状,发生的是物理变化,故二者蕴含的化学原理不同,该选项说法正确。
故选A。
12.B
【详解】A、含铜废料灼烧即铜与空气在的氧气反应生成黑色的氧化铜,氧化铜与稀硫酸反应生成硫酸铜和水,然后硫酸铜与过量的铁屑反应生成铜和硫酸亚铁,活泼金属能将不活泼金属从其盐溶液中置换出来,故“还原”过程能发生说明铁的活动性比铜强,故A正确,不符合题意;
B、酸溶是氧化铜与硫酸反应生成硫酸铜和水,是两种化合物相互交换成分生成另外两种化合物的反应,是复分解反应;还原过程是铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,该反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,是置换反应。故B错误,符合题意;
C、酸溶是氧化铜与硫酸反应生成硫酸铜和水,过滤得到硫酸铜溶液;还原是过量的铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,再次过滤,则滤液X中的溶质为硫酸亚铁,滤液X中含的离子为Fe2+和,故C正确,不符合题意;
D、将Cu、Fe混合物加入足量稀硫酸中,铜不与稀硫酸反应,铁能与稀硫酸反应生成硫酸亚铁溶液和氢气,充分反应后过滤、洗涤、干燥得铜,故D正确,不符合题意;
故选B。
13.(1)Ag、Cu
(2) 硝酸镁/Mg(NO3)2 硝酸铜/Cu(NO3)2
(3)小于
【分析】根据金属活动性顺序:镁>氢>铜>银,某化工厂的废液中主要含有硝酸银、硝酸铜,取一定量的该废液样品,加入镁粉和铜粉,镁先与硝酸银反应生成银和硝酸镁,待硝酸银反应完全,若镁有剩余,则镁会与硝酸铜反应生成铜和硝酸镁。
【详解】(1)若滤渣中有镁粉,说明镁粉过量,因此硝酸银、硝酸铜都被置换,所以滤渣中除镁粉外一定还含有Ag、Cu;
(2)若滤渣中有铜粉,说明硝酸银一定反应完全,镁是否过量不能确定,但镁一定参加反应生成硝酸镁,硝酸铜是否反反应也不能确定,因此滤液中一定含有硝酸镁,可能含有硝酸铜,一定没有硝酸银;
(3)根据金属活动性顺序:镁>氢>铜>银,某化工厂的废液中主要含有硝酸银、硝酸铜,取一定量的该废液样品,加入镁粉和铜粉,可能发生的反应为:
镁与硝酸银反应生成银和硝酸镁,该反应方程式为,每24份质量的镁置换出216份质量的银,反应后溶液质量减小;
镁与硝酸铜反应生成铜和硝酸镁,该反应方程式为,每24份质量的镁置换出64份质量的铜,反应后溶液质量减小,
铜与硝酸银反应生成硝酸铜和银,该反应方程式为,每64份质量的镁置换出216份质量的银,反应后溶液质量减小;
综上反应后得到滤液的质量小于反应前所取废液样品的质量。
14. 变小 变大
【详解】(1)若A为铁块,B为稀硫酸,则将A放入B中时铁与硫酸反应使溶液的溶质变成了硫酸亚铁,溶液的溶质质量分数变大,密度增加。浮力变大,则弹簧秤的读数将变小。
(2)若A为铁块,B为硫酸铜溶液,则将A放入B中,铁置换出铜,铜依附在铁表面,铜比铁相对原子质量大,故铁块重量增加,读数变大。
15. 钨的熔点高,锡的熔点低 O Fe+CuSO4═FeSO4+Cu 4Al+3O2=2Al2O3
【详解】(1)物质的性质决定物质的用途,所以灯泡里的灯丝用钨制而不用锡制的原因是:钨的熔点高,锡的熔点低;
(2)地壳中含量最高的元素是氧元素,化学式为O;
(3)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═FeSO4+Cu;
(4)铝和氧气反应生成氧化铝,化学方程式为:4Al+3O2=2Al2O3。
【点睛】本题考查了常见金属的应用以及金属活动性顺序的判断,完成此题,可以依据已有的知识进行。
16.(1) SO3 +4价 弱 高
(2)320
【详解】(1)①根据化学反应方程式,反应前含有1个Ti原子,4个F原子,4个H原子,2个S原子,8个O原子,反应后含有4个H原子,4个F原子,2个S原子,8个O原子,反应后含有4个H原子,4个F原子,1个Ti原子,2个O原子,故2X中含有2个S原子,6个O 原子,故X的化学式为SO3;TiO2中氧元素化合价是-2,根据化合物中元素化合价代数和为零可知,Ti的化合价为+4价;②铝和盐酸反应生成氯化铝和氢气,钛与水、稀盐酸和稀硫酸均不反应,可判断钛的金属活动性比铝的弱;③根据合金的基本性质可知,一般情况下,合金的硬度比组成它们的纯金属的硬度大,故铝合金的强度和硬度比纯铝的高;
(2)设使液氢完全燃烧需要提供液氧的质量为x
x=320t
答:使液氢完全燃烧需要提供液氧的质量为320吨。
【点睛】
17.(1) 化合反应
(2)
(3) 分解反应
【详解】(1)铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为:,两种或两种以上的物质发生化学反应生成另一种物质的反应是化合反应,该反应属于化合反应;
(2)将铁钉放入硫酸铜溶液中,发生反应生成铜和硫酸亚铁,反应的化学方程式为:,由一种单质与一种化合物反应生成另一种单质与另一种化合物的反应是置换反应,该反应属于置换反应;
(3)石灰石主要成分是碳酸钙,煅烧石灰石生成氧化钙和二氧化碳气体,反应的化学方程式为:,,由一种物质发生化学反应生成两种或两种以上物质的反应是分解反应,该反应属于分解反应;
18. 铁生锈缓慢氧化放出热量 加快铁生锈 Al2O3 2SiO2 2H2O 3MgO 4SiO2 H2O
【详解】(1)“取暖片”中有铁粉、活性炭、氯化钠、水等,打开包装后,铁粉发生缓慢氧化放出热量。 ①故其发热原理是铁生锈缓慢氧化放出热量。②铁生锈是铁与氧气、水发生一系列复杂的化学变化,发热剂成分中氯化钠的作用是加快铁生锈。
(2)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,炼铁时是以一氧化碳为还原剂
(3)硅酸盐常用二氧化硅和氧化物的形式表示,依据物质的化学式中各种原子个数相等,
高岭石Al2(Si2O5)(OH)4可表示为Al2O3 2SiO2 2H2O。滑石Mg3(Si4O10)(OH)2可表示为3MgO 4SiO2 H2O。
19. 催化作用 CO Fe +2HCl=FeCl2+H2↑(H2SO4也可) 碳酸
【分析】A、B、D、E都属于氧化物,A、E为黑色固体,黑色固体有碳粉、铁粉、和氧化铜、二氧化锰、四氧化三铁;B、D是由相同元素组成,常考的有H2O和H2O2的组合和CO和CO2的组合;C、Y、Z为无色气体,其中Y有毒,可推测Y是CO或者SO2;X是最常见的金属,为铁。综上,A为MnO2,B为H2O2,C为O2,D为H2O,E为Fe3O4;F为亚铁盐的溶液(如FeCl2);G为H2CO3(合理即可);X为CO2,Y为CO。
【详解】(1)MnO2为催化作用;
(2)CO获得Fe3O4的氧元素变成CO2,具有还原性;
(3)可以是Fe和HCl或者Fe和H2SO4;
(4)G能生成水和二氧化碳,那么可以是燃烧反应,含有碳元素和氢元素的甲烷,乙醇,蜡烛等,也可以是分解反应,如碳酸。
20. 3 SiHCl3+H2Si+3HCl 置换反应 SiHCl3+3H2O=H2SiO3+3HCl+H2↑ 发生爆炸 HCl
【详解】(1)三氯硅烷是由硅、氢、氯3种元素组成的化合物,由纯SiHCl3与氢气高温条件下反应产生硅单质和氯化氢的化学反应方程式为:SiHCl3+H2Si+3HCl,该反应符合“单质+化合物=新单质+新化合物”,属于置换反应;
(2)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气的化学反应方程式为:SiHCl3+3H2O=H2SiO3+3HCl+H2↑;氢气具有可燃性,H2还原SiHCl3过程中若混入O2,可能引起的后果是:发生爆炸;
(3)粗硅与氯化氢反应产生SiHCl3,SiHCl3与氢气反应产生氯化氢和硅,生产高纯硅的流程中,可循环使用的物质是:氯化氢(HCl)。
21. 产生大量气泡 FeCl2 金属的形状对金属与酸反应的速率有影响,粉末状金属比片状金属反应速率快 ②③ 盐酸的浓度、金属种类和金属形状 用相同时间内收集氧气的体积
【详解】(1)镁与盐酸反应会生成氢气,故实验现象为固体逐渐消失、放出大量热、产生大量的气泡;
(2)根据化学反应前后原子的种类、数目不变,故空缺处应填FeCl2;
(3)本实验采用控制变量法,故对比实验①和③,变量是金属形状,可以得到的结论是金属的形状对金属与酸反应的速率有影响,粉末状金属比片状金属反应速率快;
(4)本实验采用控制变量法,要比较不同种类的金属对反应快慢的影响,应保证其他因素都相同,故应选择的实验编号是②③;
(5)对比实验①和③,可以得出金属的形状对金属与酸反应的速率有影响;对比实验②和③,可以得出金属的种类对金属与酸反应的速率有影响;对比实验②和④,可以得出盐酸的浓度对金属与酸反应的速率有影响;故由上述实验可推知,影响金属与酸反应快慢的因素是盐酸的浓度、金属种类和金属形状;
(6)该实验除了用收集等体积氢气所用时间来衡量反应的快慢外,还可以用相同时间内收集氧气的体积来衡量反应的快慢。
22.(1)0.2
(2)解:设合金中锌的质量为x,
=
x=6.5g
Cu﹣Zn合金中铜的质量分数为:×100%=75%
答:Cu﹣Zn合金中铜的质量分数为75%。
【详解】(1)根据锌和稀硫酸反应生成硫酸锌和氢气,铜与稀硫酸不反应,利用质量守恒定律进行分析, 生成氢气的质量为:100g+26g﹣125.8g=0.2g。
(2)根据氢气的质量和反应的化学方程式及其提供数据可以进行相关方面的计算;详细解析见答案。
【点睛】本题主要考查学生根据化学方程式进行计算和推断的能力,计算时要注意规范性和准确性。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.下列关于资源、能源的叙述错误的是
A.宝贵的金属资源主要分布在地壳和海洋中
B.海洋是地球上巨大的资源宝库,海水中含有80多种化学物质
C.回收废旧金属可以节约金属资源,还可以节约能源
D.人们正在开发和利用的新能源有太阳能、风能、地热能等
2.下列说法正确的是
A.点燃可燃性气体和空气的混合气体不一定会爆炸
B.燃料若能完全燃烧,则其产物就不会污染空气
C.生铁的含碳量小于钢的含碳量
D.钢可全部溶解于过量稀盐酸
3.从《中国成语大会》到《中国诗词大会》,中国的诗词文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理。下列说法中错误的是
A.“百炼成钢”与“沙里淘金”所涉及的变化相同
B.“不经一番寒彻骨,怎得梅花扑鼻香”,“扑鼻香”说明分子在不断地运动
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“松叶堪为酒,春来酿几多”指清香的美酒来自于粮食的缓慢氧化
4.生产生活中的下列变化,属于物理变化的是
A.植物的光合作用 B.秸秆、杂草、粪便等在沼气池中发酵制得甲烷
C.生铁百炼成钢 D.二氧化碳气体经降温、加压制得干冰
5.为了增强市民的环保意识,变废为宝,某市已实行垃圾分类回收。设置的垃圾箱、蓝色箱装可回收垃圾,黄色箱装不可回收垃圾,以下哪些物质能扔进蓝色垃圾箱
①废报纸 ②口香糖 ③菜叶 ④易拉罐 ⑤果皮
A.①③④⑤ B.②③⑤ C.①④⑤ D.①④
6.在点燃条件下,甲、乙反应的微观示意图如下。下列说法错误的是
A.反应中甲、乙的分子数比为1∶1 B.一定条件下,丁可转化为乙
C.该反应属于置换反应 D.反应中只有氢的化合价不变
7.如图所示,甲、乙、丙、丁四种常见金属在容器中与盐酸的反应情况,卡通人周围 的小黑点表小反应中生成的气泡,反应结束后,金属乙有剩余。下列说法错误的是
A.四种金属的活动性顺序是甲>乙>丙>丁
B.完全反应后,杯中水里溶解有3种物质
C.烧杯中丙的质量没有发生改变
D.实验室不用丁与稀盐酸反应制取氢气
8.中国空间站天和核心舱的主要能量来源是砷化镓(GaAs)太阳电池阵,其中Ga原子结构示意图如图。则下列说法正确的是
A.砷化镓属于金属材料 B.砷化镓电池能将电能转化为光能
C.GaAs中镓离子的符号为Ga3- D.Ga原子在化学反应中易失去3个电子
9.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了如图所示实验方案。下列说法中不正确的是
A.甲中现象:铝丝表面附着一层红色固体
B.乙中反应为
C.丙中反应后溶液质量小于反应前溶液质量
D.由甲、丙可得出金属活动性:Al>Cu>Ag
10.下列化学反应不属于置换反应的是
A.H2+CuOCu+H2O B.2A1+6HCl=2AlCl3+3H2↑
C.CO+CuOCu+CO2 D.C+2CuO2Cu+ CO2↑、
11.谚语诗词中蕴含着丰富的科学道理。下列说法中,不正确的是
A.“众人拾柴火焰高”是指可燃物越多,着火点越低
B.“满架蔷薇一院香”的原因是分子在不停地运动
C.“真金不怕火炼”是说明金的化学性质比较稳定
D.“百炼成钢”与“铁杵磨成针”蕴含的化学原理不同
12.回收含铜废料中的铜,部分实验流程如图所示。含铜废料灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。下列关于该流程的说法错误的是
A.“还原”过程能发生说明铁的活动性比铜强
B.“酸溶”过程中发生的反应属于置换反应
C.滤液X中含的离子为Fe2+和
D.从Cu、Fe混合物中回收Cu的方法是:加入足量稀硫酸,充分反应后过滤、洗涤、干燥
二、填空与简答
13.某化工厂的废液中主要含有硝酸银、硝酸铜。取一定量的该废液样品,加入镁粉和铜粉,充分反应后过滤,得到滤液和滤渣。请填写下列空格:
(1)若滤渣中有镁粉,则滤渣中除镁粉外还含有 (填写化学式,下同)。
(2)若滤渣中有铜粉,则滤液中的溶质一定含有 ,可能含有 。
(3)反应后得到滤液的质量 (选填“小于”、“大于”或“等于”)反应前所取废液样品的质量。
14.如图测所示,弹簧秤下挂着一重物A,烧杯中盛有溶液B,试根据要求回答下列问题:
(1)若A为铁块,B为稀硫酸,则将A放入B中,过一会儿,弹簧秤的读数将(填 “变大”、“变小”或“不变”,下同 ) ;
(2) 若A为铁块,B为硫酸铜溶液,则将A放入B中,过一会儿,弹簧秤的读数将 。
15.金属在生产、生活中应用广泛。
(1)灯泡里的灯丝用钨制而不用锡制的原因是 ;
(2)地壳中含量最高的元素是 ;
(3)波尔多液由硫酸铜、生石灰加水配制而成,配制过程中为什么不能选用铁质容器? (用化学方程式回答)。
(4)世界上铝的年产量仅次于铁,位居第二位。铝制品能被广泛地使用,其中一个原因是铝具有很好的抗腐蚀性能,与气中的氧气反应生成薄膜阻止铝进一步反应,其化学反应方程式为 。
16.2021年4月29日,我国用长征五号B遥二运载火箭成功发射中国空间站天和核心舱,为我国空间站建设迈出重要一步,化学材料在其中起到了重要作用。
(1)铝合金和钛合金被广泛用于航天工业。
①工业制钛的一个反应为:,X的化学式为 ,TiO2中Ti的化合价为 。
②室温下,钛与水、稀盐酸和稀硫酸均不反应,可判断钛的金属活动性比铝的 (填“强”或“弱”)。
③一般情况下,铝合金的强度和硬度比纯铝的 (填“高”或“低”)。
(2)已知火箭将卫星送入预定轨道需要40t液氢,则使液氢完全燃烧需要提供液氧 吨?
17.完成下列变化的化学方程式,填写(1)和(3)的基本反应类型。
(1)铁丝在氧气中燃烧: ; 。
(2)将铁钉放入硫酸铜溶液中: 。
(3)煅烧石灰石: ; 。
(4)一氧化碳还原氧化铁: 。
18.钢铁是重要的金属材料,在生产、生活中有广泛的用途。建造北京奥运会主体育场“鸟巢”,就是用了大量的钢铁。
(1)某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,打开包装后即会缓慢放出热量。
①其发热原理是 。
②推测发热剂成分中氯化钠的作用是 。
(2)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,请写出最后炼铁的化学方程式:
(3)硅酸盐是构成地壳岩石的主要成分。化学上常用二氧化硅和氧化物的形式表示其组成。例如:镁橄榄石(Mg2SiO4)常以2MgO·SiO2表示。依照上法表示下列硅酸盐的组成:
高岭石Al2(Si2O5)(OH)4 。滑石Mg3(Si4O10)(OH)2 。
19.下图表示某些物质间转化关系(反应条件和部分产物已省略)。其中A、B、D、E都属于氧化物,且A、E为黑色固体;B、D是由相同元素组成;C、Y、Z为无色气体,其中Y有毒;X是最常见的金属。请回答下列问题:
(1)反应①中A物质的作用是 ;
(2)反应③中具有还原性的物质的化学式 ;
(3)反应④的化学方程式为: ;
(4)反应⑤中G物质除有机物(如甲烷)外,还可能是 。
20.硅(Si)是太阳能电池和电脑芯片不可缺少的材料。利用石英砂(主要成分为二氧化硅)生产高纯硅的流程图如图(整个制备过程必须达到无水、无氧气)。
回答下列问题:
(1)三氯硅烷是由 元素(填数字)组成的化合物,请写出由纯SiHCl3制备高纯硅的化学反应方程式为 ,反应的基本类型为 。
(2)整个制备过程必须严格控制无水无氧气。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出化学反应方程式为 ;H2还原SiHCl3过程中若混入O2,可能引起的后果是 。
(3)以上生产高纯硅的流程中,可循环使用的物质是 。
三、科学探究题
21.在研究化学反应伴随热量变化实验时,有的同学发现镁和铁都可以与酸反应,但反应的快慢有明显差异,提出问题并进行探究。
【提出问题】酸的浓度、金属的种类、金属的形状是否会影响金属与酸反应的快慢?
【进行实验】分别取20mL盐酸、2g金属。
实验编号 盐酸的浓度 金属种类 金属形状 收集50mL氢气所需时间/s
① 10% 镁 粉末 60
② 10% 铁 片状 120
③ 10% 镁 片状 102
④ 20% 铁 片状 110
【解释与结论】
(1)镁与盐酸反应的实验现象是固体逐渐消失、放出大量热、 。
(2)镁、铁与盐酸发生的反应相似(都生成+2价的化合物),补全化学反应方程式:
(3)对比实验①和③,得到的结论是 。
(4)要比较不同种类的金属对反应快慢的影响,应选择的实验编号是 。
(5)由上述实验可推知,影响金属与酸反应快慢的因素是 。
【反思与评价】
(6)该实验除了用收集等体积氢气所用时间来衡量反应的快慢外,其他实验方法是 。
四、计算题
22.根据图示实验过程和所提供的数据进行计算:
(1)生成氢气的质量为 g。
(2)Cu﹣Zn合金中铜的质量分数。(写出计算过程)【反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑】
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、金属资源主要分布在地壳和海洋中,不符合题意;
B、海水中含有80多种元素,不是80多种化学物质,符合题意;
C、回收废旧金属可以增加金属的利用率,有利于节约资源和能源,不符合题意;
D、太阳能、风能、地热能等属于新能源,不符合题意;
故选B。
2.A
【详解】A、点燃可燃性气体和空气的混合物,达到爆炸极限,才会爆炸,符合题意;
B、燃料完全燃烧,也可能产生二氧化硫等污染物,污染空气,不符合题意;
C、生铁和钢都是铁的合金,但是含碳量不同,生铁的含碳量为2%-4.3%,钢的含碳量为0.03%-2%,故生铁的含碳量大于钢的含碳量,不符合题意;
D、钢是铁、碳合金,铁能与稀盐酸反应生成氯化亚铁和氢气,碳和稀盐酸不反应,故钢不能全部溶解于过量稀盐酸,不符合题意。
故选A。
3.A
【详解】A. 有新物质生成的变化是化学变化,无新物质生成的变化是物理变化。“百炼成钢”是指生铁经锤炼后其中的碳转化为二氧化碳,发生的是化学变化;“沙里淘金”发生的是物理变化;所涉及的变化类型不相同,此选项错误;
B. “不经一番寒彻骨,怎得梅花扑鼻香”,“扑鼻香”说明分子在不断地运动,此选项正确;
C. “真金不怕火炼”是指金即使在高温下也不与氧气反应,说明金的化学性质非常稳定,此选项正确;
D. “松叶堪为酒,春来酿几多”指清香的美酒来自于粮食的酿造,属于缓慢氧化,此选项正确。
故选A。
4.D
【详解】A、植物的光合作用过程中生成葡萄糖和氧气,有新物质生成属于化学变化,不符合题意;
B、秸秆、杂草、粪便等在沼气池中发酵制得甲烷,有新物质生成属于化学变化,不符合题意;
C、生铁百炼成钢过程中,碳与氧气反应生成二氧化碳,有新物质生成属于化学变化,不符合题意;
D、二氧化碳气体经降温、加压制得干冰,是二氧化碳的状态改变没有新物质生成属于物理变化,符合题意。
故选:D。
5.D
【详解】蓝色垃圾箱用来回收再利用垃圾,可回收再利用的垃圾包括纸类、塑料、橡胶、金属、玻璃等,所以废旧报纸、易拉罐是属于可回收垃圾,故能放入绿色垃圾箱的是①④,故选D。
【点睛】(1) 不可回收垃圾:主要是厨房垃圾,包括果皮、菜皮、剩饭菜等; (2) 可回收垃圾:纸类、塑料、橡胶、金属、玻璃等;(3) 有毒有害垃圾:电池、荧光灯管、水银温度计、油漆桶、药品等。
6.A
【详解】A、由图可知,发生反应为。所以反应中甲、乙的分子数比为4:3,错误。
B、丁是水,水在通电条件下可以分解为氢气和乙氧气,正确。
C、该反应是单质和化合物反应生成单质和化合物的反应,是置换反应。正确。
D、化合物中各元素化合价代数和为0,单质中元素化合价为0,化合物中氧元素通常为-2价,氢元素通常为+1价。所以反应前氮元素为-3价,氢元素为+1价,氧元素为0价,反应后氮元素为0价,氢元素为+1价,氧元素为-2价,反应中只有氢的化合价不变,正确。
7.B
【详解】A、图中金属甲表面气泡最多,其次为金属乙,最少的为金属丙,金属丁表面无气泡,所以甲乙丙丁四种金属活动性由强到弱的顺序为:甲、乙、丙、丁,正确;
B、根据图中的现象可知,甲、乙、丙会与酸反应,丁不会与酸反应,乙有剩余,乙会将丙从其盐溶液中置换出来,所以溶液中只有甲、乙的盐溶液,所以此时溶液中的溶质有2种;错误;
C、反应结束后,金属乙有剩余,说明盐酸完全消耗,故丙没有和盐酸反应,丙的质量没有发生改变,正确;
D、丁不会与酸反应,实验室不用丁与稀盐酸反应制取氢气,正确;
故选B。
8.D
【详解】A、金属材料包括纯金属和合金,砷化镓属于化合物,不属于金属材料,故A错误;
B、砷化镓电池能将光能转化为电能,故B错误;
C、根据镓的原子结构示意图,最外层电子数为3,易失去3个电子,形成带3个单位正电荷的离子,符号为Ga3+,故C错误;
D、根据镓的原子结构示意图,最外层电子数为3,易失去3个电子,故D正确。
故选D。
9.D
【详解】A、铝能与CuSO4溶液发生置换反应生成金属Cu,因此,铝丝表面附着一层红色固体。A正确;
B、乙中反应为铜与硝酸银反应生成银和硝酸铜,化学方程式为。B正确;
C、丙中是铝与硝酸银反应生成银和硝酸铜溶液,化学方程式,根据化学方程式的数量关系可以看出,每510份质量的硝酸银反应后生成213份质量的硝酸铝,溶质质量减小,溶剂质量不变,所以丙中反应后溶液质量小于反应前溶液质量。C正确;
D、由甲可得出金属活动性:Al>Cu;由乙可得出金属活动性:Cu>Ag。所以由甲、乙可得出金属活动性:Al>Cu>Ag。D不正确。
综上所述:选择D。
10.C
【详解】由单质与化合物反应生成新的单质和新的化合物的反应是置换反应。
反应A、B、D符合置换反应的特点,故属于置换反应;故选C。
【点睛】由单质与化合物反应生成新的单质和新的化合物的反应是置换反应。
11.A
【详解】A. 着火点为物质的固有属性,不能改变,且“众人拾柴火焰高”是指增加可燃物,使物质燃烧更旺盛,该选项说法不正确;
B. “满架蔷薇一院香”的原因是分子在不停地运动,该选项说法正确;
C. 在金属活动性顺序表中金排在最后,金的化学性质很稳定,“真金不怕火炼”是说明金的化学性质比较稳定,该选项说法正确;
D. “百炼成钢”指的是通过灼烧将铁中的碳反应掉,从而将生铁转化为钢,发生的是化学变化,而“铁杵磨成针”是通过打磨来改变铁的形状,发生的是物理变化,故二者蕴含的化学原理不同,该选项说法正确。
故选A。
12.B
【详解】A、含铜废料灼烧即铜与空气在的氧气反应生成黑色的氧化铜,氧化铜与稀硫酸反应生成硫酸铜和水,然后硫酸铜与过量的铁屑反应生成铜和硫酸亚铁,活泼金属能将不活泼金属从其盐溶液中置换出来,故“还原”过程能发生说明铁的活动性比铜强,故A正确,不符合题意;
B、酸溶是氧化铜与硫酸反应生成硫酸铜和水,是两种化合物相互交换成分生成另外两种化合物的反应,是复分解反应;还原过程是铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,该反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,是置换反应。故B错误,符合题意;
C、酸溶是氧化铜与硫酸反应生成硫酸铜和水,过滤得到硫酸铜溶液;还原是过量的铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,再次过滤,则滤液X中的溶质为硫酸亚铁,滤液X中含的离子为Fe2+和,故C正确,不符合题意;
D、将Cu、Fe混合物加入足量稀硫酸中,铜不与稀硫酸反应,铁能与稀硫酸反应生成硫酸亚铁溶液和氢气,充分反应后过滤、洗涤、干燥得铜,故D正确,不符合题意;
故选B。
13.(1)Ag、Cu
(2) 硝酸镁/Mg(NO3)2 硝酸铜/Cu(NO3)2
(3)小于
【分析】根据金属活动性顺序:镁>氢>铜>银,某化工厂的废液中主要含有硝酸银、硝酸铜,取一定量的该废液样品,加入镁粉和铜粉,镁先与硝酸银反应生成银和硝酸镁,待硝酸银反应完全,若镁有剩余,则镁会与硝酸铜反应生成铜和硝酸镁。
【详解】(1)若滤渣中有镁粉,说明镁粉过量,因此硝酸银、硝酸铜都被置换,所以滤渣中除镁粉外一定还含有Ag、Cu;
(2)若滤渣中有铜粉,说明硝酸银一定反应完全,镁是否过量不能确定,但镁一定参加反应生成硝酸镁,硝酸铜是否反反应也不能确定,因此滤液中一定含有硝酸镁,可能含有硝酸铜,一定没有硝酸银;
(3)根据金属活动性顺序:镁>氢>铜>银,某化工厂的废液中主要含有硝酸银、硝酸铜,取一定量的该废液样品,加入镁粉和铜粉,可能发生的反应为:
镁与硝酸银反应生成银和硝酸镁,该反应方程式为,每24份质量的镁置换出216份质量的银,反应后溶液质量减小;
镁与硝酸铜反应生成铜和硝酸镁,该反应方程式为,每24份质量的镁置换出64份质量的铜,反应后溶液质量减小,
铜与硝酸银反应生成硝酸铜和银,该反应方程式为,每64份质量的镁置换出216份质量的银,反应后溶液质量减小;
综上反应后得到滤液的质量小于反应前所取废液样品的质量。
14. 变小 变大
【详解】(1)若A为铁块,B为稀硫酸,则将A放入B中时铁与硫酸反应使溶液的溶质变成了硫酸亚铁,溶液的溶质质量分数变大,密度增加。浮力变大,则弹簧秤的读数将变小。
(2)若A为铁块,B为硫酸铜溶液,则将A放入B中,铁置换出铜,铜依附在铁表面,铜比铁相对原子质量大,故铁块重量增加,读数变大。
15. 钨的熔点高,锡的熔点低 O Fe+CuSO4═FeSO4+Cu 4Al+3O2=2Al2O3
【详解】(1)物质的性质决定物质的用途,所以灯泡里的灯丝用钨制而不用锡制的原因是:钨的熔点高,锡的熔点低;
(2)地壳中含量最高的元素是氧元素,化学式为O;
(3)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═FeSO4+Cu;
(4)铝和氧气反应生成氧化铝,化学方程式为:4Al+3O2=2Al2O3。
【点睛】本题考查了常见金属的应用以及金属活动性顺序的判断,完成此题,可以依据已有的知识进行。
16.(1) SO3 +4价 弱 高
(2)320
【详解】(1)①根据化学反应方程式,反应前含有1个Ti原子,4个F原子,4个H原子,2个S原子,8个O原子,反应后含有4个H原子,4个F原子,2个S原子,8个O原子,反应后含有4个H原子,4个F原子,1个Ti原子,2个O原子,故2X中含有2个S原子,6个O 原子,故X的化学式为SO3;TiO2中氧元素化合价是-2,根据化合物中元素化合价代数和为零可知,Ti的化合价为+4价;②铝和盐酸反应生成氯化铝和氢气,钛与水、稀盐酸和稀硫酸均不反应,可判断钛的金属活动性比铝的弱;③根据合金的基本性质可知,一般情况下,合金的硬度比组成它们的纯金属的硬度大,故铝合金的强度和硬度比纯铝的高;
(2)设使液氢完全燃烧需要提供液氧的质量为x
x=320t
答:使液氢完全燃烧需要提供液氧的质量为320吨。
【点睛】
17.(1) 化合反应
(2)
(3) 分解反应
【详解】(1)铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为:,两种或两种以上的物质发生化学反应生成另一种物质的反应是化合反应,该反应属于化合反应;
(2)将铁钉放入硫酸铜溶液中,发生反应生成铜和硫酸亚铁,反应的化学方程式为:,由一种单质与一种化合物反应生成另一种单质与另一种化合物的反应是置换反应,该反应属于置换反应;
(3)石灰石主要成分是碳酸钙,煅烧石灰石生成氧化钙和二氧化碳气体,反应的化学方程式为:,,由一种物质发生化学反应生成两种或两种以上物质的反应是分解反应,该反应属于分解反应;
18. 铁生锈缓慢氧化放出热量 加快铁生锈 Al2O3 2SiO2 2H2O 3MgO 4SiO2 H2O
【详解】(1)“取暖片”中有铁粉、活性炭、氯化钠、水等,打开包装后,铁粉发生缓慢氧化放出热量。 ①故其发热原理是铁生锈缓慢氧化放出热量。②铁生锈是铁与氧气、水发生一系列复杂的化学变化,发热剂成分中氯化钠的作用是加快铁生锈。
(2)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,炼铁时是以一氧化碳为还原剂
(3)硅酸盐常用二氧化硅和氧化物的形式表示,依据物质的化学式中各种原子个数相等,
高岭石Al2(Si2O5)(OH)4可表示为Al2O3 2SiO2 2H2O。滑石Mg3(Si4O10)(OH)2可表示为3MgO 4SiO2 H2O。
19. 催化作用 CO Fe +2HCl=FeCl2+H2↑(H2SO4也可) 碳酸
【分析】A、B、D、E都属于氧化物,A、E为黑色固体,黑色固体有碳粉、铁粉、和氧化铜、二氧化锰、四氧化三铁;B、D是由相同元素组成,常考的有H2O和H2O2的组合和CO和CO2的组合;C、Y、Z为无色气体,其中Y有毒,可推测Y是CO或者SO2;X是最常见的金属,为铁。综上,A为MnO2,B为H2O2,C为O2,D为H2O,E为Fe3O4;F为亚铁盐的溶液(如FeCl2);G为H2CO3(合理即可);X为CO2,Y为CO。
【详解】(1)MnO2为催化作用;
(2)CO获得Fe3O4的氧元素变成CO2,具有还原性;
(3)可以是Fe和HCl或者Fe和H2SO4;
(4)G能生成水和二氧化碳,那么可以是燃烧反应,含有碳元素和氢元素的甲烷,乙醇,蜡烛等,也可以是分解反应,如碳酸。
20. 3 SiHCl3+H2Si+3HCl 置换反应 SiHCl3+3H2O=H2SiO3+3HCl+H2↑ 发生爆炸 HCl
【详解】(1)三氯硅烷是由硅、氢、氯3种元素组成的化合物,由纯SiHCl3与氢气高温条件下反应产生硅单质和氯化氢的化学反应方程式为:SiHCl3+H2Si+3HCl,该反应符合“单质+化合物=新单质+新化合物”,属于置换反应;
(2)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气的化学反应方程式为:SiHCl3+3H2O=H2SiO3+3HCl+H2↑;氢气具有可燃性,H2还原SiHCl3过程中若混入O2,可能引起的后果是:发生爆炸;
(3)粗硅与氯化氢反应产生SiHCl3,SiHCl3与氢气反应产生氯化氢和硅,生产高纯硅的流程中,可循环使用的物质是:氯化氢(HCl)。
21. 产生大量气泡 FeCl2 金属的形状对金属与酸反应的速率有影响,粉末状金属比片状金属反应速率快 ②③ 盐酸的浓度、金属种类和金属形状 用相同时间内收集氧气的体积
【详解】(1)镁与盐酸反应会生成氢气,故实验现象为固体逐渐消失、放出大量热、产生大量的气泡;
(2)根据化学反应前后原子的种类、数目不变,故空缺处应填FeCl2;
(3)本实验采用控制变量法,故对比实验①和③,变量是金属形状,可以得到的结论是金属的形状对金属与酸反应的速率有影响,粉末状金属比片状金属反应速率快;
(4)本实验采用控制变量法,要比较不同种类的金属对反应快慢的影响,应保证其他因素都相同,故应选择的实验编号是②③;
(5)对比实验①和③,可以得出金属的形状对金属与酸反应的速率有影响;对比实验②和③,可以得出金属的种类对金属与酸反应的速率有影响;对比实验②和④,可以得出盐酸的浓度对金属与酸反应的速率有影响;故由上述实验可推知,影响金属与酸反应快慢的因素是盐酸的浓度、金属种类和金属形状;
(6)该实验除了用收集等体积氢气所用时间来衡量反应的快慢外,还可以用相同时间内收集氧气的体积来衡量反应的快慢。
22.(1)0.2
(2)解:设合金中锌的质量为x,
=
x=6.5g
Cu﹣Zn合金中铜的质量分数为:×100%=75%
答:Cu﹣Zn合金中铜的质量分数为75%。
【详解】(1)根据锌和稀硫酸反应生成硫酸锌和氢气,铜与稀硫酸不反应,利用质量守恒定律进行分析, 生成氢气的质量为:100g+26g﹣125.8g=0.2g。
(2)根据氢气的质量和反应的化学方程式及其提供数据可以进行相关方面的计算;详细解析见答案。
【点睛】本题主要考查学生根据化学方程式进行计算和推断的能力,计算时要注意规范性和准确性。
答案第1页,共2页
答案第1页,共2页
同课章节目录
