2024年中考化学专题训练——溶液的浓度(含解析)
文档属性
| 名称 | 2024年中考化学专题训练——溶液的浓度(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 488.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-21 20:45:09 | ||
图片预览



文档简介
2024年中考化学专题训练——溶液的浓度
一、选择题
1.20℃NaCl的溶解度为36g,20℃时把18gNaCl加入到36g水中,充分溶解后,所得溶液的溶质质量分数为
A.50% B.33.3% C.26.5% D.36%
2.下列说法不正确的是
A.碱溶液中都含 OH,因此碱具有相似的化学性质
B.浓盐酸和浓硫酸在空气中敞口放置,溶质质量分数都变小
C.用湿润的 pH 试纸测定某酸性溶液的酸碱度
D.配制 16%的氯化钠溶液,量取水时俯视量筒读数,会造成溶质质量分数偏大
3.下列说法正确的是
A.单质是由同种元素组成的纯净物,则由同种元素组成的物质不一定是单质
B.用氯化钠固体配制50克10%的氯化钠溶液的主要步骤:计算、量取、溶解
C.合金的熔点和硬度均高于组成它们的纯金属
D.缺钙引起贫血
4.用NaOH固体配制200g10%的NaOH溶液,下列装置或操作正确的是
A.用细口瓶保存NaOH固体
B.用托盘天平称取NaOH固体
C.用烧杯溶解NaOH固体
D.用广口瓶存放NaOH溶液
5.若要使溶质质量分数为10%的200克氯化钠溶液的溶质质量分数增大一倍,以下操作可以实现该目的的是
A.加入20克氯化钠固体 B.加入25克氯化钠固体
C.倒掉100克溶液 D.蒸发掉90克溶剂
6.某溶液的溶质质量分数为15%,下列有关说法正确的是
①在100份质量的溶液中含有15份质量的溶质
②在115份质量的溶液中含有15份质量的溶质
③在100份质量的溶剂中溶入15份质量的溶质
④在85份质量的溶剂中溶入15份质量的溶质
A.①② B.③④ C.②③ D.①④
7.某化学小组配制了100克16%的食盐溶液,结果老师实验后发现浓度偏大,原因可能是
A.食盐不够干燥 B.称量时指针偏向天平右侧
C.俯视取水 D.配制后转移时溶液溅出
8.误差分析是定量实验的一个重要内容,下列分析正确的是
A.用量筒量取10mL水,仰视读数会导致水的实际体积偏小
B.测定溶液的pH,先用水将pH试纸润湿,会导致测出的pH偏大
C.用红磷燃烧测定空气中氧气的体积分数,红磷的量不足会导致结果偏小
D.配制溶质量分数为6%的氯化钠溶液,氯化钠中含有杂物,导致氯化钠的质量分数偏大
9.下列说法合理的有
①高炉炼铁得的是纯铁
②配制溶液的过程中,用量筒量取液体时仰视读数,会造成所配溶液溶质质量分数偏小
③1.6克某物质完全燃烧后,生成4.4克二氧化碳和3.6克水,则该物质可能是H2和CO的混合物
④向装有CO2的软塑料瓶中加入适量KOH溶液,充分振荡后软塑料瓶变瘪,证明KOH和CO2发生了反应
⑤金刚石和石墨由于碳原子的排列方式不同导致了它们化学性质有很大差异
A.1个 B.2个 C.3个 D.4个
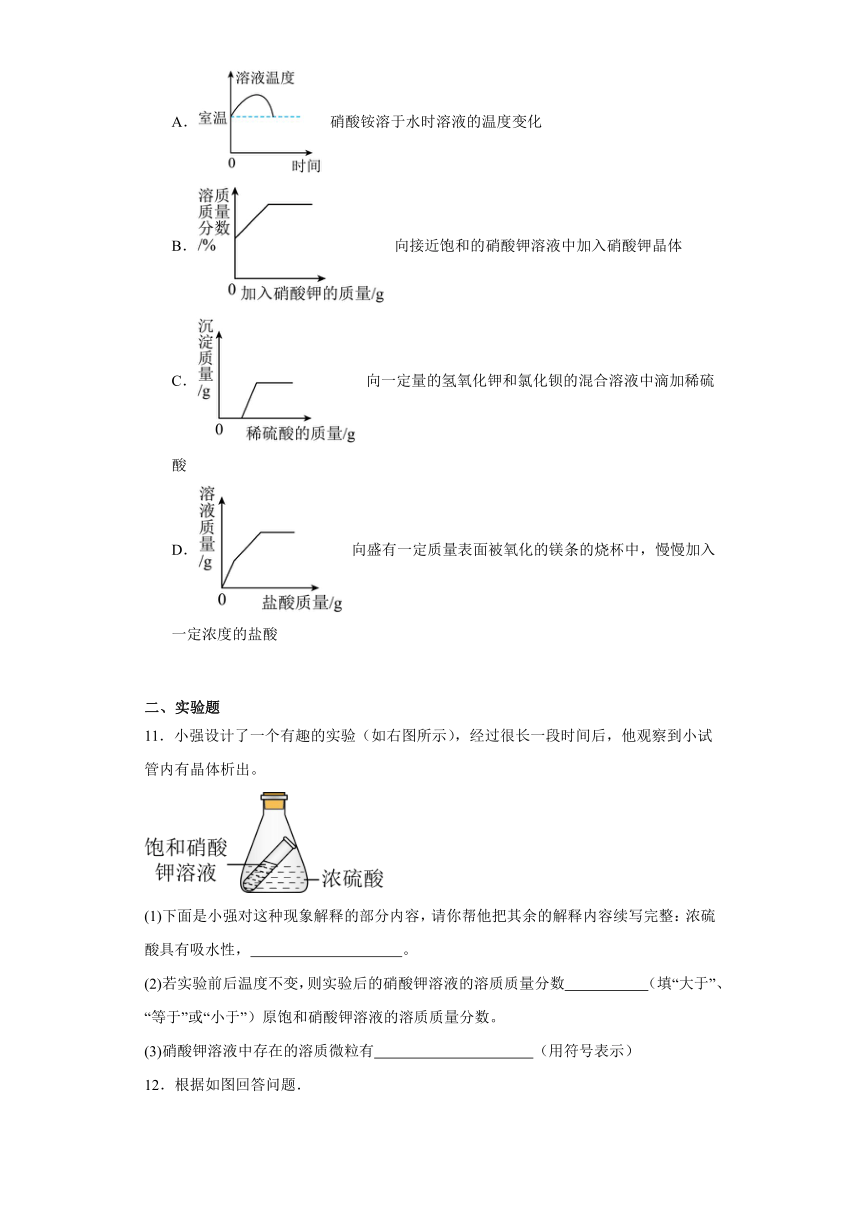
10.如图所示,坐标标示的量之间的变化关系与反应过程对应正确的是
A. 硝酸铵溶于水时溶液的温度变化
B. 向接近饱和的硝酸钾溶液中加入硝酸钾晶体
C. 向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸
D. 向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸
二、实验题
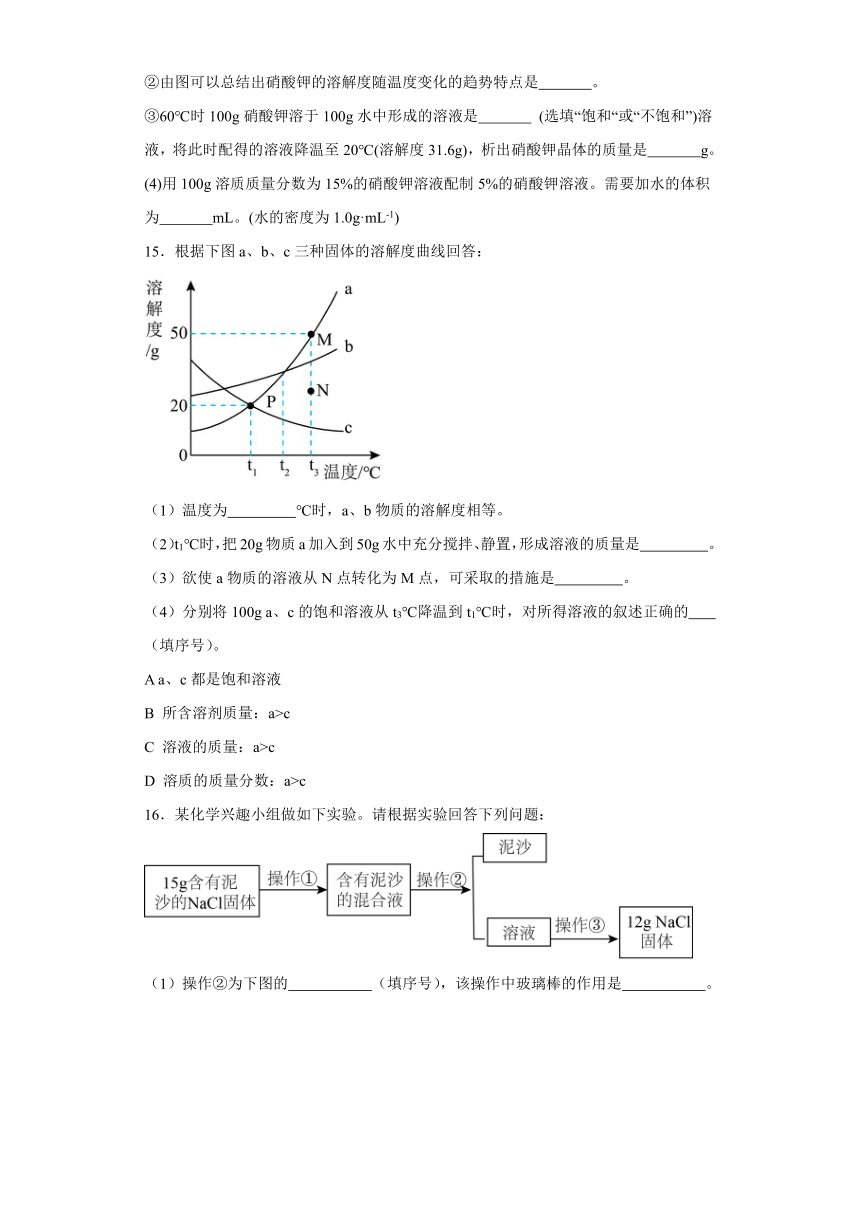
11.小强设计了一个有趣的实验(如右图所示),经过很长一段时间后,他观察到小试管内有晶体析出。
(1)下面是小强对这种现象解释的部分内容,请你帮他把其余的解释内容续写完整:浓硫酸具有吸水性, 。
(2)若实验前后温度不变,则实验后的硝酸钾溶液的溶质质量分数 (填“大于”、“等于”或“小于”)原饱和硝酸钾溶液的溶质质量分数。
(3)硝酸钾溶液中存在的溶质微粒有 (用符号表示)
12.根据如图回答问题.
(1)图1锥形瓶中充满二氧化碳,将分液漏斗中的氢氧化钠溶液加入到瓶中,观察到的现象是 .
(2)配制一定质量10%的稀硫酸,若量取浓硫酸时仰视读数,得到溶液中溶质的质量分数会 (填“大于”、“小于”或“等于”)10%;图2操作中用玻璃棒搅拌的目的是 .
(3)图3实验中铜片上的白磷燃烧而红磷不燃烧,说明了可燃物燃烧满足的条件是 ;烧杯中热水的作用是 和提供热量.
三、计算题
13.将100g5%的氯化钠溶液进行下列操作,请根据要求进行计算:
(1)若将其溶液的质量分数增大一倍,应该加入 克氯化钠(保留小数点后一位)。
(2)100g20%的氯化钠溶液,若使其溶液的质量分数变为原来的一半,应该加入 克水。
(3)50g10%的食盐溶液与 g20%的食盐溶液混合,可得到质量分数为15%的食盐溶液。
四、填空与简答
14.氯化钠和硝酸钾是实验室常见的试剂。
(1)硝酸钾是由 微粒构成的(填写微粒符号)。
(2)写出中和反应生成氯化钠的化学方程式 。
(3)如图是硝酸钾和氯化钠的溶解度曲线。
①20℃时氯化钠的溶解度是36g,其含义是: 。
②由图可以总结出硝酸钾的溶解度随温度变化的趋势特点是 。
③60℃时100g硝酸钾溶于100g水中形成的溶液是 (选填“饱和“或“不饱和”)溶液,将此时配得的溶液降温至20℃(溶解度31.6g),析出硝酸钾晶体的质量是 g。
(4)用100g溶质质量分数为15%的硝酸钾溶液配制5%的硝酸钾溶液。需要加水的体积为 mL。(水的密度为1.0g·mL-1)
15.根据下图a、b、c三种固体的溶解度曲线回答:
(1)温度为 ℃时,a、b物质的溶解度相等。
(2)t1℃时,把20g物质a加入到50g水中充分搅拌、静置,形成溶液的质量是 。
(3)欲使a物质的溶液从N点转化为M点,可采取的措施是 。
(4)分别将100g a、c的饱和溶液从t3℃降温到t1℃时,对所得溶液的叙述正确的 (填序号)。
A a、c都是饱和溶液
B 所含溶剂质量:a>c
C 溶液的质量:a>c
D 溶质的质量分数:a>c
16.某化学兴趣小组做如下实验。请根据实验回答下列问题:
(1)操作②为下图的 (填序号),该操作中玻璃棒的作用是 。
(2)上题A中应该用酒精灯的 部分加热。
(3)经过上述实验,计算出该粗盐的纯度为 。
(4)若得到NaCl的产量比实际值偏低,则可能的原因是 (填序号)。
A 过滤时滤纸破损
B 蒸发时受热不均,晶体溅出
C 溶解含泥沙的NaCl样品时,加入水量不足
试卷第1页,共3页
参考答案:
1.C
【详解】20℃时,氯化钠的溶解度为36g,即该温度下,100g水中最多能溶解36g氯化钠,设20℃时,36g水能溶解氯化钠的质量为x,则,x=12.96g,故形成的是饱和溶液,所得溶液的溶质质量分数为:。
故选C。
2.C
【详解】A、碱是解离出的阴离子全部是氢氧根离子的化合物,碱溶液中都含OH-,因此碱具有相似的化学性质,故选项说法正确;
B、浓盐酸具有挥发性,敞口放置,溶质质量减少,浓硫酸具有吸水性,敞口放置,溶剂水的质量增加,所以溶质质量分数都变小,故选项说法正确;
C、用湿润的pH试纸测定某酸性溶液的酸碱度,稀释了待测溶液,使溶液的酸性减弱,pH值增大,故选项说法错误;
D、量取水时俯视量筒读数,读数偏大,量取液体体积偏小,溶剂偏少,则造成溶质质量分数偏大,故选项说法正确。
故选C。
3.A
【详解】A、单质是由同种元素组成的,但同种元素组成的物质不一定是单质,氧气和臭氧组成的物质属于混合物,故A正确;
B、用氯化钠固体配制50克10%的氯化钠溶液的主要步骤:计算、称量、量取、溶解、装瓶,故B错误;
C、合金的硬度高于组成它们的纯金属,熔点低于组成它们的纯金属,故C错误;
D、人体若缺钙,青少年容易患佝偻病,老年人容易患骨质疏松症等疾病,不能引起贫血,故D错误。
故选A。
4.C
【详解】A、氢氧化钠固体应放在广口瓶中进行保存,不符合题意;
B、用托盘天平称量物品时,应遵循“左物右码”的原则,氢氧化钠腐蚀性较强,应放在玻璃器皿中进行称量,图中操作错误,不符合题意;
C、应将氢氧化钠固体放在烧杯中溶解,且应用玻璃棒不断搅拌,加速溶解,符合题意;
D、氢氧化钠溶液属于液体,应放在细口瓶中进行保存,不符合题意。
故选C。
5.B
【详解】A、设需要再加入氯化钠的质量为x,(200g+x)×20%=200g×10%+x,x=25g,故选项采用的方法错误,不符合题意;
B、由A选项的分析,应再加入25g溶质,故选项采用的方法正确,符合题意;
C、设需要蒸发水的质量为y,(200g-y)×20%=200g×10%,y=100g,应将溶剂蒸发掉100g水,不是倒掉100克溶液,故选项采用的方法错误,不符合题意;
D、根据C选项的分析,需要蒸发溶剂的质量为100g,故选项采用的方法错误,不符合题意。
故选B。
【点睛】本题考查溶液的浓缩问题,掌握溶液浓缩的方法、原理是正确解答此类题的关键所在。
6.D
【详解】溶质质量=溶液质量×溶质质量分数,溶剂质量=溶液质量-溶质质量,故某溶液的溶质质量分数为15%,是指在100份质量的溶液中,溶质质量为15份质量,溶剂质量为85份质量,故表示在100份质量的溶液中含有15份质量的溶质;在85份质量的溶剂中溶入15份质量的溶质。
故选D。
7.C
【详解】A、食盐不够干燥,溶质质量减少,会导致溶质质量分数偏小,故A项错误;
B、根据托盘天平称量固体时,左盘放物品,右盘放砝码,称量时指针偏向天平右侧,说明物品质量减少,会导致溶质质量分数减小,故B项错误;
C、俯视读数时实际数值偏小,溶剂质量减少,会导致溶质质量分数偏大,故C项正确;
D、根据溶液的均一性,所以配制后转移时溶液溅出,溶质质量分数不变,故D项错误;
故选C。
8.C
【详解】A、在使用量筒时,仰视读数测出的液体体积小于液体的实际体积,所以量取的液体体积大于10mL,故A错误;
B、用水湿润pH试纸,稀释了待测溶液,使溶液的酸碱性减弱,若测定的是酸性溶液,则会使测定结果变大;若测定的是碱性溶液,则会使测定结果变小;若测定的是中性溶液,则会使测定结果不变;由于不知溶液的酸碱性,故无法确定测定结果,故B错误;
C、测定空气中氧气含量的实验中,红磷质量的多少影响实验结果,红磷的量必须足量,否则会造成实验结果偏小,故C正确;
D、配制6%的氯化钠溶液时,若氯化钠中含有杂质,会导致溶质的质量偏小,则所配溶液溶质的质量分数偏小,故D错误。
故选C。
9.A
【详解】①高炉炼铁得到的不是纯铁,是生铁,错误;
②配制溶液的过程中,用量筒量取液体时仰视读数,读取数值小于实际数值,会使量取水的体积偏大,溶液质量偏大,会造成所配溶液溶质质量分数偏小,正确;
③1.6克某物质完全燃烧后,生成4.4克二氧化碳和3.6克水,根据质量守恒定律,化学反应前后,元素的种类和质量不变,生成物中含C、H、O,故该物质中一定含C、H元素,可能含氧元素,碳元素的质量为:,氢元素的质量为:,1.2g+0.4g=1.6g,故该物质中不含氧元素,不可能是一氧化碳和氢气的混合物,错误;
④向装有CO2的软塑料瓶中加入适量KOH溶液,由于二氧化碳能溶于水,且能与水反应,也能使软塑料瓶内气体减少,压强减小,充分振荡后软塑料瓶变瘪,不能证明KOH和CO2发生了反应,错误;
⑤金刚石和石墨均是由碳原子构成,但是由于碳原子的排列方式不同,导致了它们物理性质有很大差异,错误。
故正确的个数是1个。
故选A。
10.B
【详解】A、硝酸铵溶于水吸热,使温度降低,一段时间后温度恢复至室温,故选项图像错误;
B、向一接近饱和的硝酸钾溶液中,加入硝酸钾之前,溶液中含有硝酸钾,溶质质量分数不为零,逐渐加硝酸钾晶体,硝酸钾能继续溶解,溶质的质量增加,当硝酸钾溶液达到饱和状态时,溶质的质量不再发生改变,溶质质量分数也不在改变,图像应该是先上升后成一条水平直线,故选项图像正确;
C、向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸,钡离子能与硫酸根离子结合生成不溶于酸的硫酸钡沉淀,一开始就产生沉淀,故选项图像错误;
D、一定质量表面被氧化的镁条表面有一层氧化镁,慢慢加入一定浓度的盐酸,氧化镁先与稀盐酸反应生成氯化镁和水,氧化镁消失后里面的镁再与稀盐酸反应生成氯化镁和氢气,第二个过程溶液中由于生成气体故溶液增加的质量比第一个过程少,增加的幅度要小,完全反应后继续滴加稀盐酸,溶液的质量仍在增加,故选项图像错误;
答案为:B
【点睛】本题是一道图象坐标与化学知识相结合的综合题,解题的关键是结合所涉及的化学知识,正确分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图象
11.(1)可以吸收硝酸钾溶液中挥发出来的水分,使饱和硝酸钾溶液中的溶剂减少,溶质析出
(2)等于
(3)K+、
【详解】(1)浓硫酸具有吸水性,可以吸收硝酸钾溶液中挥发出来的水分,使饱和硝酸钾溶液中的溶剂减少,溶质析出;
(2)析出晶体后的溶液仍然是饱和溶液,若实验前后温度不变,则说明溶解度不变,故实验后的硝酸钾溶液的溶质质量分数等于原饱和硝酸钾溶液的溶质质量分数;
(3)硝酸钾溶液中存在的溶质微粒有钾离子和硝酸钾离子,符号分别为:K+、。
12. 气球变大 大于 散热 温度达到可燃物着火点 隔绝空气
【详解】(1)若关闭弹簧夹,把注射器中的氢氧化钠溶液加入到锥形瓶中,观察到的现象有:气球变大;产生此现象的原因是:二氧化碳与氢氧化钠溶液反应,使瓶内气体减少,压强变小,小于外界大气压,在大气压的作用下,气球变大;故答案:气球变大。
(2)用量筒量取浓硫酸时,仰视液面,读数比实际液体体积小,会造成实际量取的浓硫酸的体积偏大,其他操作无误,则所配置的稀硫酸中溶质的质量分数偏大;稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中。答案:大于;散热;
(3)实验过程中,铜片上的白磷与氧气接触,温度达到了着火点,燃烧起来;红磷虽然与氧气接触,但是温度没有达到着火点,不能燃烧。该实验说明,可燃物温度达到了着火点,可燃物才能燃烧;烧杯中的热水起到隔绝空气和提供热量的作用。故填: 温度达到可燃物的着火点;隔绝空气。
13.(1)5.6
(2)100
(3)50
【详解】(1)若将其溶液的质量分数增大一倍,设需要增加溶质氯化钠的质量为,则,解得,故填:5.6;
(2)若使其溶液的质量分数变为原来的一半,设需要增加溶剂水的质量为,则,解得,故填:100;
(3)设50g10%的食盐溶液与质量为的20%的食盐溶液混合,可得到质量分数为15%的食盐溶液,则,解得,故填:50。
14. K+、NO 20℃时,100g水中最多溶解36g硝酸钾 硝酸钾的溶解度随温度的升高而变大 不饱和 68.4 200
【详解】(1)硝酸钾属于盐,是由钾离子(K+)和硝酸根离子(NO3-)构成的。
(2)中和反应是酸和碱生成盐和水的反应,氢氧化钠和盐酸反应生成氯化钠和水,。
(3)①20℃时,氯化钠的溶解度是36g,其含义是20℃时,100g水中最多溶解36g硝酸钾,形成饱和溶液。
②由图可知,硝酸钾的溶解度随温度的升高而变大。
③60℃时,硝酸钾溶解度为110g,故100g硝酸钾可以全部溶于100g水中,形成硝酸钾的不饱和溶液;将此时配得的溶液降温至20℃(溶解度31.6g),析出硝酸钾晶体的质量是100g-31.6g=68.4g。
(4)溶液加水稀释前后溶质质量不变;100g溶质质量分数为15%的硝酸钾溶液可以配制5%的硝酸钾溶液的质量为100g×15%÷5%=300g,需要加水的质量为300g-100g=200g,故水的体积为200g÷1.0g·mL-1=200mL。
15. t2 60g 加溶质(或蒸发溶剂) D
【详解】(1)由图可知,t2℃时,a、b的溶解度曲线相交于一点,温度为t2℃时,a、b物质的溶解度相等;
(2)t1℃时,a的溶解度为20g,该温度下,将20g a物质加入到50g水中,充分搅拌,只能溶解10g,形成溶液的质量是:50g+10g=60g;
(3)欲使a物质的溶液从N点转化为M点,可采取的措施是增加溶质或恒温蒸发溶剂;
(4)A、分别将100g a、c的饱和溶液从t3℃降温到t1℃时,降温后,a的溶解度减小,有溶质析出,还是饱和溶液,c的溶解度增加,变为不饱和溶液,不符合题意;
B、t3℃时,溶解度:a>c,饱和溶液的溶质质量分数:a>c,等质量的饱和溶液中溶质质量:a>c,溶剂质量:a<c,降温后,溶剂质量不变,故溶剂质量:a<c,不符合题意;
C、降温后,a中有溶质析出,c中无溶质析出,故溶液质量:a<c,不符合题意;
D、分别将100g a、c的饱和溶液从t3℃降温到t1℃时,降温后,a的溶解度减小,有溶质析出,还是饱和溶液,c的溶解度增加,变为不饱和溶液,降温后,c的溶质质量分数不变,t1℃时,a的溶解度大于t3℃时,c的溶解度,故t1℃时,a的饱和溶液的溶质质量分数大于t3℃时,c的饱和溶液的溶质质量分数,故降温后,溶质的质量分数:a>c,符合题意。
故选D。
16. B 引流 外焰 80% BC
【详解】(1)操作①、②、③依次为图中的溶解C、过滤B和蒸发A;操作②中玻璃棒的作用是引流,防止液体洒出,故填:B;引流;
(2)酒精灯的外焰温度最高,应用酒精灯的外焰加热,故填:外焰;
(3)该粗盐的纯度为×100%=80%,故填:80%;
(4)A、过滤时滤纸有破损,会造成含泥沙的食盐有一部分进入滤液,被蒸发结晶析出导致产量偏高,故A不是可能的原因;
B、蒸发时有固体溅出,导致原混合物中的食盐没有全部转到产品中,故B是可能的原因;
C、溶解15g含有泥沙的NaCl时,加入的水量不足,导致食盐有一部分没被溶解,从而使食盐没有全部转化为产品,C也是可能的原因。
故选BC。
答案第1页,共2页
一、选择题
1.20℃NaCl的溶解度为36g,20℃时把18gNaCl加入到36g水中,充分溶解后,所得溶液的溶质质量分数为
A.50% B.33.3% C.26.5% D.36%
2.下列说法不正确的是
A.碱溶液中都含 OH,因此碱具有相似的化学性质
B.浓盐酸和浓硫酸在空气中敞口放置,溶质质量分数都变小
C.用湿润的 pH 试纸测定某酸性溶液的酸碱度
D.配制 16%的氯化钠溶液,量取水时俯视量筒读数,会造成溶质质量分数偏大
3.下列说法正确的是
A.单质是由同种元素组成的纯净物,则由同种元素组成的物质不一定是单质
B.用氯化钠固体配制50克10%的氯化钠溶液的主要步骤:计算、量取、溶解
C.合金的熔点和硬度均高于组成它们的纯金属
D.缺钙引起贫血
4.用NaOH固体配制200g10%的NaOH溶液,下列装置或操作正确的是
A.用细口瓶保存NaOH固体
B.用托盘天平称取NaOH固体
C.用烧杯溶解NaOH固体
D.用广口瓶存放NaOH溶液
5.若要使溶质质量分数为10%的200克氯化钠溶液的溶质质量分数增大一倍,以下操作可以实现该目的的是
A.加入20克氯化钠固体 B.加入25克氯化钠固体
C.倒掉100克溶液 D.蒸发掉90克溶剂
6.某溶液的溶质质量分数为15%,下列有关说法正确的是
①在100份质量的溶液中含有15份质量的溶质
②在115份质量的溶液中含有15份质量的溶质
③在100份质量的溶剂中溶入15份质量的溶质
④在85份质量的溶剂中溶入15份质量的溶质
A.①② B.③④ C.②③ D.①④
7.某化学小组配制了100克16%的食盐溶液,结果老师实验后发现浓度偏大,原因可能是
A.食盐不够干燥 B.称量时指针偏向天平右侧
C.俯视取水 D.配制后转移时溶液溅出
8.误差分析是定量实验的一个重要内容,下列分析正确的是
A.用量筒量取10mL水,仰视读数会导致水的实际体积偏小
B.测定溶液的pH,先用水将pH试纸润湿,会导致测出的pH偏大
C.用红磷燃烧测定空气中氧气的体积分数,红磷的量不足会导致结果偏小
D.配制溶质量分数为6%的氯化钠溶液,氯化钠中含有杂物,导致氯化钠的质量分数偏大
9.下列说法合理的有
①高炉炼铁得的是纯铁
②配制溶液的过程中,用量筒量取液体时仰视读数,会造成所配溶液溶质质量分数偏小
③1.6克某物质完全燃烧后,生成4.4克二氧化碳和3.6克水,则该物质可能是H2和CO的混合物
④向装有CO2的软塑料瓶中加入适量KOH溶液,充分振荡后软塑料瓶变瘪,证明KOH和CO2发生了反应
⑤金刚石和石墨由于碳原子的排列方式不同导致了它们化学性质有很大差异
A.1个 B.2个 C.3个 D.4个
10.如图所示,坐标标示的量之间的变化关系与反应过程对应正确的是
A. 硝酸铵溶于水时溶液的温度变化
B. 向接近饱和的硝酸钾溶液中加入硝酸钾晶体
C. 向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸
D. 向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸
二、实验题
11.小强设计了一个有趣的实验(如右图所示),经过很长一段时间后,他观察到小试管内有晶体析出。
(1)下面是小强对这种现象解释的部分内容,请你帮他把其余的解释内容续写完整:浓硫酸具有吸水性, 。
(2)若实验前后温度不变,则实验后的硝酸钾溶液的溶质质量分数 (填“大于”、“等于”或“小于”)原饱和硝酸钾溶液的溶质质量分数。
(3)硝酸钾溶液中存在的溶质微粒有 (用符号表示)
12.根据如图回答问题.
(1)图1锥形瓶中充满二氧化碳,将分液漏斗中的氢氧化钠溶液加入到瓶中,观察到的现象是 .
(2)配制一定质量10%的稀硫酸,若量取浓硫酸时仰视读数,得到溶液中溶质的质量分数会 (填“大于”、“小于”或“等于”)10%;图2操作中用玻璃棒搅拌的目的是 .
(3)图3实验中铜片上的白磷燃烧而红磷不燃烧,说明了可燃物燃烧满足的条件是 ;烧杯中热水的作用是 和提供热量.
三、计算题
13.将100g5%的氯化钠溶液进行下列操作,请根据要求进行计算:
(1)若将其溶液的质量分数增大一倍,应该加入 克氯化钠(保留小数点后一位)。
(2)100g20%的氯化钠溶液,若使其溶液的质量分数变为原来的一半,应该加入 克水。
(3)50g10%的食盐溶液与 g20%的食盐溶液混合,可得到质量分数为15%的食盐溶液。
四、填空与简答
14.氯化钠和硝酸钾是实验室常见的试剂。
(1)硝酸钾是由 微粒构成的(填写微粒符号)。
(2)写出中和反应生成氯化钠的化学方程式 。
(3)如图是硝酸钾和氯化钠的溶解度曲线。
①20℃时氯化钠的溶解度是36g,其含义是: 。
②由图可以总结出硝酸钾的溶解度随温度变化的趋势特点是 。
③60℃时100g硝酸钾溶于100g水中形成的溶液是 (选填“饱和“或“不饱和”)溶液,将此时配得的溶液降温至20℃(溶解度31.6g),析出硝酸钾晶体的质量是 g。
(4)用100g溶质质量分数为15%的硝酸钾溶液配制5%的硝酸钾溶液。需要加水的体积为 mL。(水的密度为1.0g·mL-1)
15.根据下图a、b、c三种固体的溶解度曲线回答:
(1)温度为 ℃时,a、b物质的溶解度相等。
(2)t1℃时,把20g物质a加入到50g水中充分搅拌、静置,形成溶液的质量是 。
(3)欲使a物质的溶液从N点转化为M点,可采取的措施是 。
(4)分别将100g a、c的饱和溶液从t3℃降温到t1℃时,对所得溶液的叙述正确的 (填序号)。
A a、c都是饱和溶液
B 所含溶剂质量:a>c
C 溶液的质量:a>c
D 溶质的质量分数:a>c
16.某化学兴趣小组做如下实验。请根据实验回答下列问题:
(1)操作②为下图的 (填序号),该操作中玻璃棒的作用是 。
(2)上题A中应该用酒精灯的 部分加热。
(3)经过上述实验,计算出该粗盐的纯度为 。
(4)若得到NaCl的产量比实际值偏低,则可能的原因是 (填序号)。
A 过滤时滤纸破损
B 蒸发时受热不均,晶体溅出
C 溶解含泥沙的NaCl样品时,加入水量不足
试卷第1页,共3页
参考答案:
1.C
【详解】20℃时,氯化钠的溶解度为36g,即该温度下,100g水中最多能溶解36g氯化钠,设20℃时,36g水能溶解氯化钠的质量为x,则,x=12.96g,故形成的是饱和溶液,所得溶液的溶质质量分数为:。
故选C。
2.C
【详解】A、碱是解离出的阴离子全部是氢氧根离子的化合物,碱溶液中都含OH-,因此碱具有相似的化学性质,故选项说法正确;
B、浓盐酸具有挥发性,敞口放置,溶质质量减少,浓硫酸具有吸水性,敞口放置,溶剂水的质量增加,所以溶质质量分数都变小,故选项说法正确;
C、用湿润的pH试纸测定某酸性溶液的酸碱度,稀释了待测溶液,使溶液的酸性减弱,pH值增大,故选项说法错误;
D、量取水时俯视量筒读数,读数偏大,量取液体体积偏小,溶剂偏少,则造成溶质质量分数偏大,故选项说法正确。
故选C。
3.A
【详解】A、单质是由同种元素组成的,但同种元素组成的物质不一定是单质,氧气和臭氧组成的物质属于混合物,故A正确;
B、用氯化钠固体配制50克10%的氯化钠溶液的主要步骤:计算、称量、量取、溶解、装瓶,故B错误;
C、合金的硬度高于组成它们的纯金属,熔点低于组成它们的纯金属,故C错误;
D、人体若缺钙,青少年容易患佝偻病,老年人容易患骨质疏松症等疾病,不能引起贫血,故D错误。
故选A。
4.C
【详解】A、氢氧化钠固体应放在广口瓶中进行保存,不符合题意;
B、用托盘天平称量物品时,应遵循“左物右码”的原则,氢氧化钠腐蚀性较强,应放在玻璃器皿中进行称量,图中操作错误,不符合题意;
C、应将氢氧化钠固体放在烧杯中溶解,且应用玻璃棒不断搅拌,加速溶解,符合题意;
D、氢氧化钠溶液属于液体,应放在细口瓶中进行保存,不符合题意。
故选C。
5.B
【详解】A、设需要再加入氯化钠的质量为x,(200g+x)×20%=200g×10%+x,x=25g,故选项采用的方法错误,不符合题意;
B、由A选项的分析,应再加入25g溶质,故选项采用的方法正确,符合题意;
C、设需要蒸发水的质量为y,(200g-y)×20%=200g×10%,y=100g,应将溶剂蒸发掉100g水,不是倒掉100克溶液,故选项采用的方法错误,不符合题意;
D、根据C选项的分析,需要蒸发溶剂的质量为100g,故选项采用的方法错误,不符合题意。
故选B。
【点睛】本题考查溶液的浓缩问题,掌握溶液浓缩的方法、原理是正确解答此类题的关键所在。
6.D
【详解】溶质质量=溶液质量×溶质质量分数,溶剂质量=溶液质量-溶质质量,故某溶液的溶质质量分数为15%,是指在100份质量的溶液中,溶质质量为15份质量,溶剂质量为85份质量,故表示在100份质量的溶液中含有15份质量的溶质;在85份质量的溶剂中溶入15份质量的溶质。
故选D。
7.C
【详解】A、食盐不够干燥,溶质质量减少,会导致溶质质量分数偏小,故A项错误;
B、根据托盘天平称量固体时,左盘放物品,右盘放砝码,称量时指针偏向天平右侧,说明物品质量减少,会导致溶质质量分数减小,故B项错误;
C、俯视读数时实际数值偏小,溶剂质量减少,会导致溶质质量分数偏大,故C项正确;
D、根据溶液的均一性,所以配制后转移时溶液溅出,溶质质量分数不变,故D项错误;
故选C。
8.C
【详解】A、在使用量筒时,仰视读数测出的液体体积小于液体的实际体积,所以量取的液体体积大于10mL,故A错误;
B、用水湿润pH试纸,稀释了待测溶液,使溶液的酸碱性减弱,若测定的是酸性溶液,则会使测定结果变大;若测定的是碱性溶液,则会使测定结果变小;若测定的是中性溶液,则会使测定结果不变;由于不知溶液的酸碱性,故无法确定测定结果,故B错误;
C、测定空气中氧气含量的实验中,红磷质量的多少影响实验结果,红磷的量必须足量,否则会造成实验结果偏小,故C正确;
D、配制6%的氯化钠溶液时,若氯化钠中含有杂质,会导致溶质的质量偏小,则所配溶液溶质的质量分数偏小,故D错误。
故选C。
9.A
【详解】①高炉炼铁得到的不是纯铁,是生铁,错误;
②配制溶液的过程中,用量筒量取液体时仰视读数,读取数值小于实际数值,会使量取水的体积偏大,溶液质量偏大,会造成所配溶液溶质质量分数偏小,正确;
③1.6克某物质完全燃烧后,生成4.4克二氧化碳和3.6克水,根据质量守恒定律,化学反应前后,元素的种类和质量不变,生成物中含C、H、O,故该物质中一定含C、H元素,可能含氧元素,碳元素的质量为:,氢元素的质量为:,1.2g+0.4g=1.6g,故该物质中不含氧元素,不可能是一氧化碳和氢气的混合物,错误;
④向装有CO2的软塑料瓶中加入适量KOH溶液,由于二氧化碳能溶于水,且能与水反应,也能使软塑料瓶内气体减少,压强减小,充分振荡后软塑料瓶变瘪,不能证明KOH和CO2发生了反应,错误;
⑤金刚石和石墨均是由碳原子构成,但是由于碳原子的排列方式不同,导致了它们物理性质有很大差异,错误。
故正确的个数是1个。
故选A。
10.B
【详解】A、硝酸铵溶于水吸热,使温度降低,一段时间后温度恢复至室温,故选项图像错误;
B、向一接近饱和的硝酸钾溶液中,加入硝酸钾之前,溶液中含有硝酸钾,溶质质量分数不为零,逐渐加硝酸钾晶体,硝酸钾能继续溶解,溶质的质量增加,当硝酸钾溶液达到饱和状态时,溶质的质量不再发生改变,溶质质量分数也不在改变,图像应该是先上升后成一条水平直线,故选项图像正确;
C、向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸,钡离子能与硫酸根离子结合生成不溶于酸的硫酸钡沉淀,一开始就产生沉淀,故选项图像错误;
D、一定质量表面被氧化的镁条表面有一层氧化镁,慢慢加入一定浓度的盐酸,氧化镁先与稀盐酸反应生成氯化镁和水,氧化镁消失后里面的镁再与稀盐酸反应生成氯化镁和氢气,第二个过程溶液中由于生成气体故溶液增加的质量比第一个过程少,增加的幅度要小,完全反应后继续滴加稀盐酸,溶液的质量仍在增加,故选项图像错误;
答案为:B
【点睛】本题是一道图象坐标与化学知识相结合的综合题,解题的关键是结合所涉及的化学知识,正确分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图象
11.(1)可以吸收硝酸钾溶液中挥发出来的水分,使饱和硝酸钾溶液中的溶剂减少,溶质析出
(2)等于
(3)K+、
【详解】(1)浓硫酸具有吸水性,可以吸收硝酸钾溶液中挥发出来的水分,使饱和硝酸钾溶液中的溶剂减少,溶质析出;
(2)析出晶体后的溶液仍然是饱和溶液,若实验前后温度不变,则说明溶解度不变,故实验后的硝酸钾溶液的溶质质量分数等于原饱和硝酸钾溶液的溶质质量分数;
(3)硝酸钾溶液中存在的溶质微粒有钾离子和硝酸钾离子,符号分别为:K+、。
12. 气球变大 大于 散热 温度达到可燃物着火点 隔绝空气
【详解】(1)若关闭弹簧夹,把注射器中的氢氧化钠溶液加入到锥形瓶中,观察到的现象有:气球变大;产生此现象的原因是:二氧化碳与氢氧化钠溶液反应,使瓶内气体减少,压强变小,小于外界大气压,在大气压的作用下,气球变大;故答案:气球变大。
(2)用量筒量取浓硫酸时,仰视液面,读数比实际液体体积小,会造成实际量取的浓硫酸的体积偏大,其他操作无误,则所配置的稀硫酸中溶质的质量分数偏大;稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中。答案:大于;散热;
(3)实验过程中,铜片上的白磷与氧气接触,温度达到了着火点,燃烧起来;红磷虽然与氧气接触,但是温度没有达到着火点,不能燃烧。该实验说明,可燃物温度达到了着火点,可燃物才能燃烧;烧杯中的热水起到隔绝空气和提供热量的作用。故填: 温度达到可燃物的着火点;隔绝空气。
13.(1)5.6
(2)100
(3)50
【详解】(1)若将其溶液的质量分数增大一倍,设需要增加溶质氯化钠的质量为,则,解得,故填:5.6;
(2)若使其溶液的质量分数变为原来的一半,设需要增加溶剂水的质量为,则,解得,故填:100;
(3)设50g10%的食盐溶液与质量为的20%的食盐溶液混合,可得到质量分数为15%的食盐溶液,则,解得,故填:50。
14. K+、NO 20℃时,100g水中最多溶解36g硝酸钾 硝酸钾的溶解度随温度的升高而变大 不饱和 68.4 200
【详解】(1)硝酸钾属于盐,是由钾离子(K+)和硝酸根离子(NO3-)构成的。
(2)中和反应是酸和碱生成盐和水的反应,氢氧化钠和盐酸反应生成氯化钠和水,。
(3)①20℃时,氯化钠的溶解度是36g,其含义是20℃时,100g水中最多溶解36g硝酸钾,形成饱和溶液。
②由图可知,硝酸钾的溶解度随温度的升高而变大。
③60℃时,硝酸钾溶解度为110g,故100g硝酸钾可以全部溶于100g水中,形成硝酸钾的不饱和溶液;将此时配得的溶液降温至20℃(溶解度31.6g),析出硝酸钾晶体的质量是100g-31.6g=68.4g。
(4)溶液加水稀释前后溶质质量不变;100g溶质质量分数为15%的硝酸钾溶液可以配制5%的硝酸钾溶液的质量为100g×15%÷5%=300g,需要加水的质量为300g-100g=200g,故水的体积为200g÷1.0g·mL-1=200mL。
15. t2 60g 加溶质(或蒸发溶剂) D
【详解】(1)由图可知,t2℃时,a、b的溶解度曲线相交于一点,温度为t2℃时,a、b物质的溶解度相等;
(2)t1℃时,a的溶解度为20g,该温度下,将20g a物质加入到50g水中,充分搅拌,只能溶解10g,形成溶液的质量是:50g+10g=60g;
(3)欲使a物质的溶液从N点转化为M点,可采取的措施是增加溶质或恒温蒸发溶剂;
(4)A、分别将100g a、c的饱和溶液从t3℃降温到t1℃时,降温后,a的溶解度减小,有溶质析出,还是饱和溶液,c的溶解度增加,变为不饱和溶液,不符合题意;
B、t3℃时,溶解度:a>c,饱和溶液的溶质质量分数:a>c,等质量的饱和溶液中溶质质量:a>c,溶剂质量:a<c,降温后,溶剂质量不变,故溶剂质量:a<c,不符合题意;
C、降温后,a中有溶质析出,c中无溶质析出,故溶液质量:a<c,不符合题意;
D、分别将100g a、c的饱和溶液从t3℃降温到t1℃时,降温后,a的溶解度减小,有溶质析出,还是饱和溶液,c的溶解度增加,变为不饱和溶液,降温后,c的溶质质量分数不变,t1℃时,a的溶解度大于t3℃时,c的溶解度,故t1℃时,a的饱和溶液的溶质质量分数大于t3℃时,c的饱和溶液的溶质质量分数,故降温后,溶质的质量分数:a>c,符合题意。
故选D。
16. B 引流 外焰 80% BC
【详解】(1)操作①、②、③依次为图中的溶解C、过滤B和蒸发A;操作②中玻璃棒的作用是引流,防止液体洒出,故填:B;引流;
(2)酒精灯的外焰温度最高,应用酒精灯的外焰加热,故填:外焰;
(3)该粗盐的纯度为×100%=80%,故填:80%;
(4)A、过滤时滤纸有破损,会造成含泥沙的食盐有一部分进入滤液,被蒸发结晶析出导致产量偏高,故A不是可能的原因;
B、蒸发时有固体溅出,导致原混合物中的食盐没有全部转到产品中,故B是可能的原因;
C、溶解15g含有泥沙的NaCl时,加入的水量不足,导致食盐有一部分没被溶解,从而使食盐没有全部转化为产品,C也是可能的原因。
故选BC。
答案第1页,共2页
同课章节目录
