6.1.3电极反应式的书写课件(共21张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.3电极反应式的书写课件(共21张ppt)化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 642.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-22 07:40:56 | ||
图片预览







文档简介
(共21张PPT)
第一节 化学反应与能量变化
电极反应式的书写
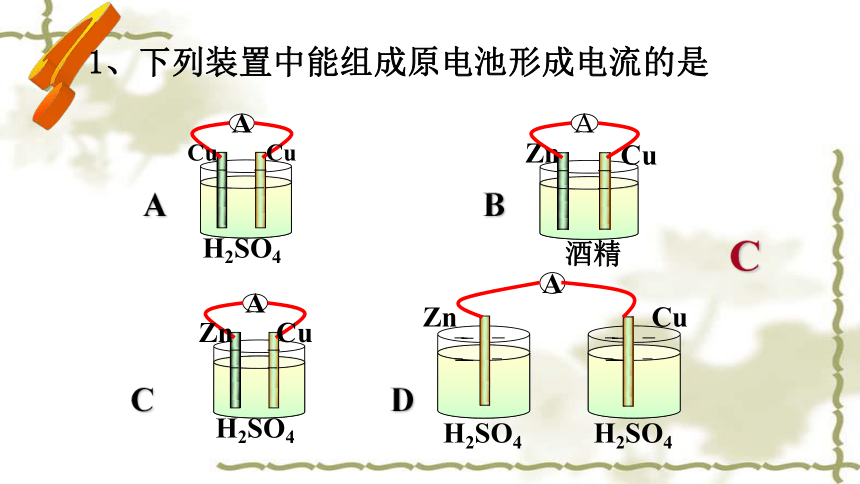
C
A
Zn
Cu
H2SO4
Cu
Zn
A
酒精
A B
Zn
H2SO4
A
Cu
H2SO4
C D
A
Cu
Cu
H2SO4
?
1、下列装置中能组成原电池形成电流的是
B
?
3、如图所示的装置中,a金属的活动性比氢强,b为碳棒。下列关于次装置的叙述中不正确的是( )
A.碳棒上有气体放出,溶液的PH变大。
B. a是 正极,b是 负极。
C.导线中有电子流动,电子从a极到 b极。
D. a极上发生了氧化反应。
a
b
B
?
4.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
5.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B.先变大后变小
C.逐渐变大 D.逐渐变小
C
?
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
(A)X>Y>Z (B)X>Z>Y
(C)Y>X>Z (D)Y>Z>X
C
习题六
?
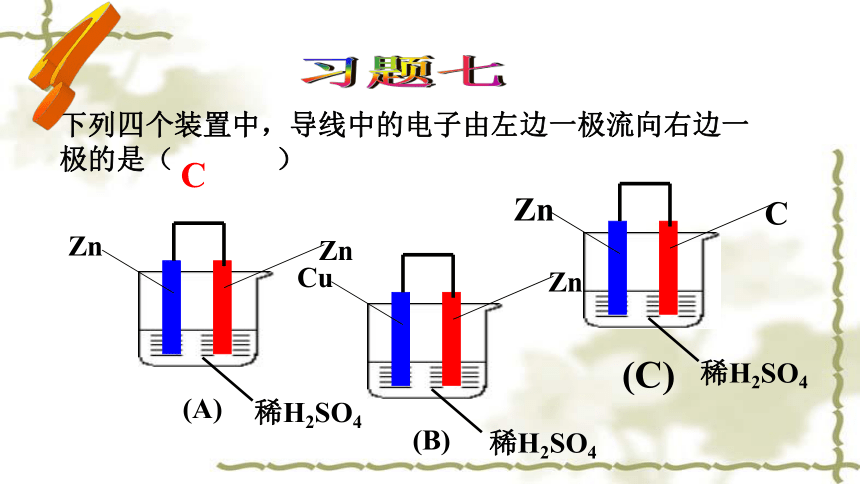
习题七
下列四个装置中,导线中的电子由左边一极流向右边一极的是( )
稀H2SO4
Zn
Zn
(A)
稀H2SO4
Cu
Zn
(B)
稀H2SO4
Zn
C
(C)
C
?
习题八
在理论上不可用于设计原电池的化学反应是
A.Fe+CuSO4=Cu+FeSO4
B.2FeCl3+Cu=2FeCl2+CuCl2
C.ICl+H2O=HCl+HIO
D.2Al+2H2O+2NaOH=2NaAlO2 + 3H2↑
C
?
电极反应式的书写
1、先判定正负极
1、步骤:
2、写出“正”、 “负”的字样
正:
负:
(+):
(-):
或
3、写出总反应式与电极式
或
总:
2、注意:①原子守恒
②电子守恒
(两极得失电子总数相等;
只写某一极时需约分。)
练习
⒈、
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e- =Zn2+
2H++2e- =H2↑
Zn+2H+=Zn2++H2↑
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
Fe+CuSO4=Cu+FeSO4
6、Ag – Fe– Ag2SO4溶液
7、Al – C– HCl溶液
正极:
负极:
总反应:
Fe-2e - =Fe2+
2 Ag + + 2e- = 2 Ag
Fe+2 Ag +=Fe2+ + 2 Ag
正极:
负极:
总反应:
2 Al - 6e - = 2 Al3+
6H + + 6e- = 3 H2
2 Al + 6H += 2 Al3+ + 3H2 ↑
8、Cu – C – AgNO3溶液
正极:
负极:
总反应:
Cu -2e - = Cu 2+
2 Ag + + 2e- = 2 Ag
Cu + 2 Ag += Cu2+ + 2 Ag
9、 Fe – Cu – FeCl3溶液
正极:
负极:
总反应:
2 Fe 3 + + 2e- = 2Fe 2+
Fe + 2 Fe 3 += 3 Fe 2+
Fe-2e - =Fe2+
板书
10、Al – Mg – NaOH溶液
正极:
负极:
总反应:
2 Al +2H2O + 2OH -= 2 AlO2 - + 3H2 ↑
2 Al3+ + 8OH - = 2 AlO2 - + 4H2O
2 Al + 8OH - - 6e- = 2 AlO2 - + 4H2O
6H2O + 6e- = 3H2 ↑ + 6OH -
2 Al - 6e - = 2 Al3+
小结:在原电池中,负极除了受材料影响外,还受电解
质溶液种类的影响。
板书
11、Fe – Cu – 浓HNO3
负极:
Cu-2e- = Cu2+
正极:
2NO3-+4H+ +2e- = 2NO 2↑ + 2H2O
总反应:
Cu+2NO3-+4H+ =Cu2++ 2NO2↑+2H2O
请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。
1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: .
拓 展:
Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu
1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不活泼的其他金属
思 考 题
请根据反应
Zn + 2AgNO3=Zn(NO3)2+2Ag
设计原电池,你有哪些可行方案
Zn - Cu AgNO3溶液
Zn - C AgNO3溶液
Zn - Ag AgNO3溶液
思 考 题
请根据反应
2Fe3+ + Fe = 3 Fe 2+
设计原电池,你有哪些可行方案
Fe-Cu FeCl3溶液
Fe-C Fe(NO3)3溶液
Fe-Ag Fe(SO4)3溶液
1、X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( )
(A)X>Y>Z (B)X>Z>Y
(C)Y>X>Z (D)Y>Z>X
C
2、关于如图所示装置的叙述,正确的是( )
A、铜是阳极,铜片上有气泡产生
B、铜片质量逐渐减少
C、电流从锌片经导线流向铜片
D、氢离子在铜片表面被还原
D
3、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
D
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
第一节 化学反应与能量变化
电极反应式的书写
C
A
Zn
Cu
H2SO4
Cu
Zn
A
酒精
A B
Zn
H2SO4
A
Cu
H2SO4
C D
A
Cu
Cu
H2SO4
?
1、下列装置中能组成原电池形成电流的是
B
?
3、如图所示的装置中,a金属的活动性比氢强,b为碳棒。下列关于次装置的叙述中不正确的是( )
A.碳棒上有气体放出,溶液的PH变大。
B. a是 正极,b是 负极。
C.导线中有电子流动,电子从a极到 b极。
D. a极上发生了氧化反应。
a
b
B
?
4.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
5.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B.先变大后变小
C.逐渐变大 D.逐渐变小
C
?
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
(A)X>Y>Z (B)X>Z>Y
(C)Y>X>Z (D)Y>Z>X
C
习题六
?
习题七
下列四个装置中,导线中的电子由左边一极流向右边一极的是( )
稀H2SO4
Zn
Zn
(A)
稀H2SO4
Cu
Zn
(B)
稀H2SO4
Zn
C
(C)
C
?
习题八
在理论上不可用于设计原电池的化学反应是
A.Fe+CuSO4=Cu+FeSO4
B.2FeCl3+Cu=2FeCl2+CuCl2
C.ICl+H2O=HCl+HIO
D.2Al+2H2O+2NaOH=2NaAlO2 + 3H2↑
C
?
电极反应式的书写
1、先判定正负极
1、步骤:
2、写出“正”、 “负”的字样
正:
负:
(+):
(-):
或
3、写出总反应式与电极式
或
总:
2、注意:①原子守恒
②电子守恒
(两极得失电子总数相等;
只写某一极时需约分。)
练习
⒈、
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑤
④
(∨)
(∨)
负极:
正极:
总反应:
正极:
负极:
总反应:
Zn-2e- =Zn2+
2H++2e- =H2↑
Zn+2H+=Zn2++H2↑
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
Fe+CuSO4=Cu+FeSO4
6、Ag – Fe– Ag2SO4溶液
7、Al – C– HCl溶液
正极:
负极:
总反应:
Fe-2e - =Fe2+
2 Ag + + 2e- = 2 Ag
Fe+2 Ag +=Fe2+ + 2 Ag
正极:
负极:
总反应:
2 Al - 6e - = 2 Al3+
6H + + 6e- = 3 H2
2 Al + 6H += 2 Al3+ + 3H2 ↑
8、Cu – C – AgNO3溶液
正极:
负极:
总反应:
Cu -2e - = Cu 2+
2 Ag + + 2e- = 2 Ag
Cu + 2 Ag += Cu2+ + 2 Ag
9、 Fe – Cu – FeCl3溶液
正极:
负极:
总反应:
2 Fe 3 + + 2e- = 2Fe 2+
Fe + 2 Fe 3 += 3 Fe 2+
Fe-2e - =Fe2+
板书
10、Al – Mg – NaOH溶液
正极:
负极:
总反应:
2 Al +2H2O + 2OH -= 2 AlO2 - + 3H2 ↑
2 Al3+ + 8OH - = 2 AlO2 - + 4H2O
2 Al + 8OH - - 6e- = 2 AlO2 - + 4H2O
6H2O + 6e- = 3H2 ↑ + 6OH -
2 Al - 6e - = 2 Al3+
小结:在原电池中,负极除了受材料影响外,还受电解
质溶液种类的影响。
板书
11、Fe – Cu – 浓HNO3
负极:
Cu-2e- = Cu2+
正极:
2NO3-+4H+ +2e- = 2NO 2↑ + 2H2O
总反应:
Cu+2NO3-+4H+ =Cu2++ 2NO2↑+2H2O
请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。
1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: .
拓 展:
Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu
1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不活泼的其他金属
思 考 题
请根据反应
Zn + 2AgNO3=Zn(NO3)2+2Ag
设计原电池,你有哪些可行方案
Zn - Cu AgNO3溶液
Zn - C AgNO3溶液
Zn - Ag AgNO3溶液
思 考 题
请根据反应
2Fe3+ + Fe = 3 Fe 2+
设计原电池,你有哪些可行方案
Fe-Cu FeCl3溶液
Fe-C Fe(NO3)3溶液
Fe-Ag Fe(SO4)3溶液
1、X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( )
(A)X>Y>Z (B)X>Z>Y
(C)Y>X>Z (D)Y>Z>X
C
2、关于如图所示装置的叙述,正确的是( )
A、铜是阳极,铜片上有气泡产生
B、铜片质量逐渐减少
C、电流从锌片经导线流向铜片
D、氢离子在铜片表面被还原
D
3、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
D
A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
