7.1.4烷烃的性质课件(共41张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 7.1.4烷烃的性质课件(共41张ppt)化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 39.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-22 07:43:44 | ||
图片预览








文档简介
(共41张PPT)
第4课时 烷烃的性质
第一节 认识有机化合物
煤层气
含碳原子
个数较多的烷烃
凡士林
天然气
沼气
蜡烛
蜡笔
主要成分甲烷
在生活中我们接触过哪些烷烃?
【思考】请结合生活和初中化学的有关知识,想一想烷烃可能具有哪些性质?
烷烃的性质
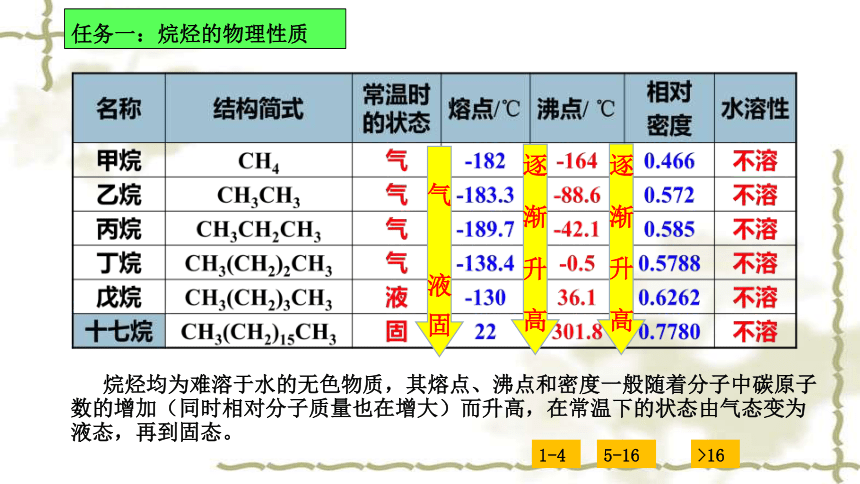
任务一:烷烃的物理性质
甲烷的物理性质:
通常情况下,甲烷是一种没有颜色、没有气味的气体,甲烷极难溶于水、密度是0.717g/L(标准状况)
气
液
固
逐
渐
升
高
逐
渐
升
高
烷烃均为难溶于水的无色物质,其熔点、沸点和密度一般随着分子中碳原子数的增加(同时相对分子质量也在增大)而升高,在常温下的状态由气态变为液态,再到固态。
1-4
5-16
>16
任务一:烷烃的物理性质
烷烃同系物熔沸点规律——碳原子数目越多→相对分子质量越大 →分子间作用力越大→熔沸点越高
通常4个碳以内的正烷烃都是气态;含5~16个碳的为液态;17个碳以上的为固态。
当含碳数目相同时,支链越多,沸点越低。
如新戊烷常温为气态
烷烃
板书
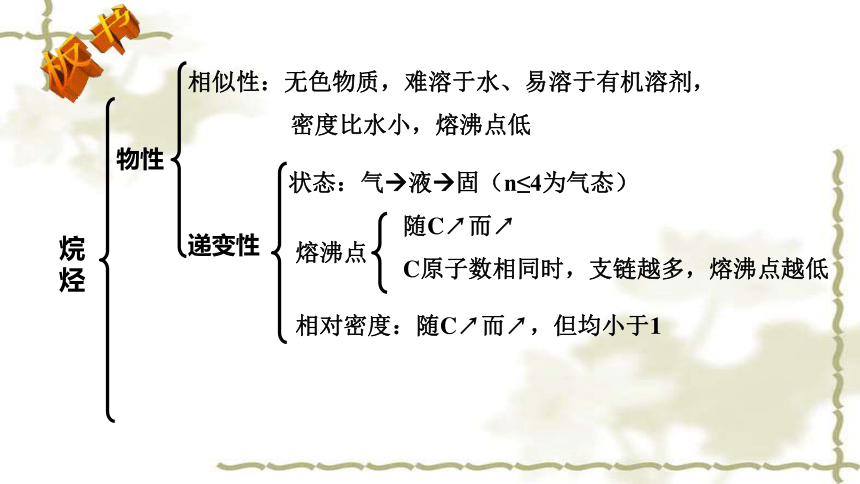
相似性:无色物质,难溶于水、易溶于有机溶剂,
密度比水小,熔沸点低
物性
递变性
状态:气 液 固(n≤4为气态)
熔沸点
相对密度:随C↗而↗,但均小于1
C原子数相同时,支链越多,熔沸点越低
随C↗而↗
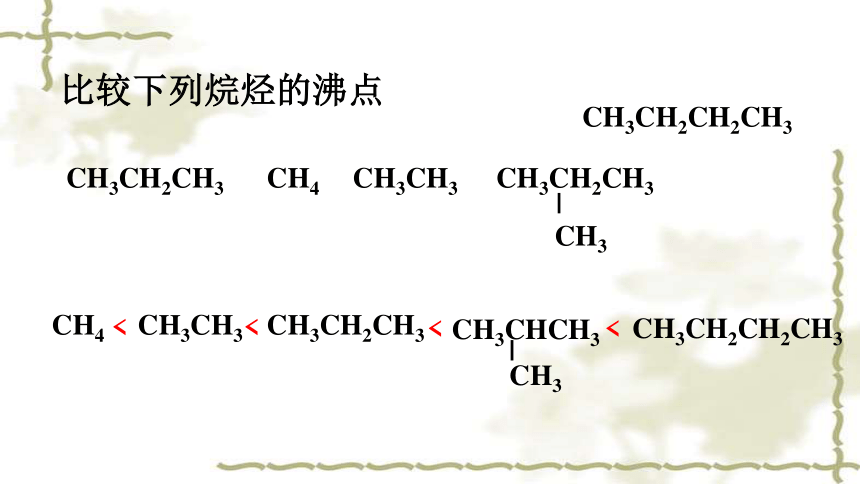
比较下列烷烃的沸点
CH4 CH3CH3 CH3CH2CH3
CH3CHCH3
CH3
<
<
<
<
CH3CH2CH3 CH4 CH3CH3 CH3CH2CH3
CH3
CH3CH2CH2CH3
CH3CH2CH2CH3
任务二:烷烃的化学性质
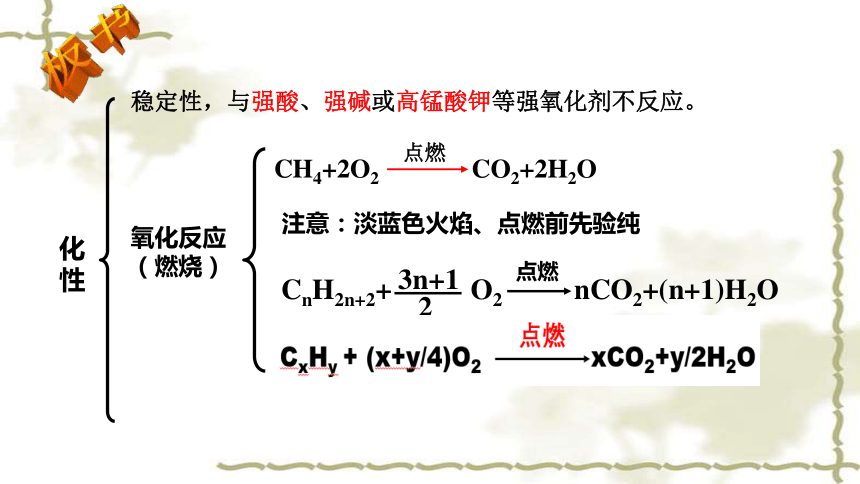
通常条件下,烷烃比较稳定,与强酸、强碱或高锰酸钾等强氧化剂不反应。
稳定性
* 可燃性:烷烃都能燃烧
CH4+2O2 CO2+2H2O
点燃
点燃甲烷前必须验纯
否则会爆炸。
煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。点燃之前要验纯。
化性
板书
稳定性,与强酸、强碱或高锰酸钾等强氧化剂不反应。
氧化反应(燃烧)
点燃
CnH2n+2+ O2 nCO2+(n+1)H2O
3n+1
2
CH4+2O2 CO2+2H2O
点燃
注意:淡蓝色火焰、点燃前先验纯
各1molC2H4、C2H6、C3H8、CH4
谁消耗O2最多?
谁生成H2O最多?
谁生成CO2最少?
?
C3H8
C3H8
CH4
规律:等n的烃完全燃,耗氧量取决于(x+y/4)的值;
生成水的量取决于y/2的值。
A.CH4 B.C2H6 C.C2H2、D、C5H12
?
等m的下列有机物完全燃烧,消耗O2最多的是( )
A
规律:等m的烃完全燃烧,耗氧量取决于y/x的值, 比值越大,耗氧量越大,生成水的量也取 决于y/x的值。
1、等物质的量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4 B、C2H6 C、C3H6 D、C6H6
2、等质量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4 B、C2H6 C、C3H6 D、C6H6
D
A
?
任务二:烷烃的化学性质
烷烃的分解
橡胶中加入炭黑做成轮胎,可增强耐磨性,延长其使用寿命。炭黑也可以用于生产油墨、油漆和黑色涂料等。炭黑可由烷烃在隔绝空气的条件下受热分解制备。写出甲烷分解生成炭黑的化学反应方程式。
烷烃的分解
CH4 C + 2H2
隔绝空气
1000~1200℃
炭黑:橡胶工业的原料
可以用于制造颜料、油墨、油漆等
合成氨
烷烃在较高温度下会发生分解。这个性质常被应用于石油化工和天然气化工生产中,从烷烃可得到一系列重要的化工基本原料和燃料。
化性
板书
性质稳定,与强酸、强碱或高锰酸钾等强氧化剂不反应。
氧化反应(燃烧)
点燃
CnH2n+2+ O2 nCO2+(n+1)H2O
3n+1
2
CH4+2O2 CO2+2H2O
点燃
注意:淡蓝色火焰、点燃前先验纯
分解反应
CH4 C + 2H2
高温
* 取代反应——烷烃的特征反应
【实验7-1】
取两支试管,均通过排饱和NaCl溶液的方法收集半试管CH4和半试管Cl2,分别用铁架台固定好(如图7-8)。将其中一支试管用铝箔套上,另一支试管放在光亮处(不要放在日光直射的地方)。静置,比较两支试管内的现象。
实验现象 原因分析
无光照
光照
无明显变化
无光照该反应不能发生
试管内气体颜色变浅
氯气逐渐消耗
试管壁上有油状液滴
生成不溶于水的液体
试管中液面上升
生成的气体溶于水中使试管内压强减小
水槽中有固体析出
Cl-饱和
可能观察到白雾
生成了易溶于水的HCl气体
实验结论
光照条件下,甲烷与氯气发生了反应
注意:暗处不反应 强光会爆炸
取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
H
C
H
H
Cl
H Cl
光
H
C
H
H
H
Cl Cl
+
+
一氯甲烷(g)
CH4与Cl2的反应原理
特征:一上一下、取而代之
* 取代反应
生成的一氯甲烷在常温下是气体,可与氯气进一步反应,依次又生成了二氯甲烷、三氯甲烷(氯仿)和四氯甲烷(四氯化碳)。
取代反应
板书
甲烷
CH4 + Cl2 CH3Cl + HCl
光
CH3Cl + Cl2 CH2Cl2 + HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4 + HCl
光
逐步取代
同时发生
现象:色变浅,出油滴,水上升,有白雾,晶体析。
注意:产物是混合物(5种),四种氯代产物都不溶于水,
HCl最多;常温下CH3Cl是气体,其余三种都是油状液体
反应中量的关系:
即:被取代n(H)=消耗n(Cl2)=生成n(HCl)
1mol H被取代→消耗 mol Cl2→生成 mol HCl。
不论如何控制反应物的用量,都是五种产物:CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,HCl的量最多
CH3Cl CH2Cl2 CHCl3 CCl4
空间构型
状态
四面体
正四面体
四面体
四面体
有机溶剂
气体
油状液体
油状液体
油状液体
有机溶剂
1
1
Cl
H
Cl
H
C
两种写法表示同一物质
H
Cl
Cl
H
C
同一物质不同投影方式
思考:由图可知甲烷是正四面体结构,那如何证明甲烷分子是正四面体结构呢?
方法1:应用物理方法测得CH4分子4个共价键的键角均为109°28′,
4个C-H键长均相等。则说明CH4为正四面体结构的分子
方法2:CH2Cl2只有一种结构,则说明CH4为正四面体结构的分子
取代反应
板书
甲烷
条件:纯卤素单质、光照
特点:有下有上,在哪下,在哪上。
定义:有机物分子中的某些原子或原子团被其它原子或原子
团所替代的反应;
CnH2n+1X + HX
光
CnH2n+2 + X2
会产生 种取代产物
9
?
1、向下列物质的溶液中加入AgNO3溶液,有白色沉淀产生的是( )
B
A、CH3Cl
B、NaCl
C、KClO3
D、CCl4
?
2、下列物质常温下呈气态的是 ( )
A、CH3Cl B、CH2Cl2
C、CHCl3 D、CCl4
A
3、下列物质中,不能与氯气发生取代反应
的是( )
A、CH3Cl B、CH2Cl2
C、CHCl3 D、CCl4
D
?
B
4、下列事实能证明CH4分子中是正四面体结构而非平面正四边形结构的是( )
A.CH3Cl只代表一种物质 B.CH2Cl2只代表一种物质
C.CHCl3只代表一种物质 D.CCl4只代表一种物质
?
5、下列有关甲烷的取代反应的叙述正确的是( )
A. CH4与Cl2的物质的量之比为1:1,混合反应只生成CH3Cl
B.CH4与Cl2的取代反应,生成的产物中CH3Cl最多
C. CH4与Cl2的取代反应生成的产物为混合物
D. 1 molCH4生成CCl4最多消耗2 molCl2
C
?
①同一个碳原子上的氢是等效氢
②同一碳原子上所连的甲基上的氢是等效氢
③处于分子中对称位置的碳上的氢原子是等效氢
判断烃的一元取代产物同分异构体数目
H C H
H
H
CH3 C CH3
CH3
CH3
H C C H
H
H
H
H
等效氢法
板书
4
CH3CH2CH2CH2CH3
CH3
CH3CCH2CH3
CH3
下面烷烃的等效H有多少种?
3
3
CH3 — C — C — CH3
CH3
CH3
CH3
CH3
1
1
CH3CCH3
CH3
CH3
CH3
CH3CHCHCHCH3
CH3 CH3
练2、进行一氯取代后,只能生成3种沸点不同的产
物的烷烃是( )
A、(CH3)2CHCH2CH2CH3 B、(CH3CH2)2CHCH3
C、(CH3)2CHCH(CH3)2 D、(CH3)3CCH2CH3
D
?
思考:
丁基(-C4H9)、戊基(-C5H11)各自有多少种结构?
-C5H11共8种结构
-C4H9共4种结构
H
C
H
H
H
C
C
H
3
C
H
3
C
H
3
H
3
C
H
C
C
H
H
H
H
H
C
C
H
3
C
H
3
H
3
C
C
C
H
3
C
H
3
C
H
3
[延伸拓展]一卤代物只有一种的烷烃必须符合什么规律?写出碳原子数小于10的这些烷烃的结构简式.
必须具有对称结构
练3、某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可以是( )
A.C3H8 B.C4H10 C.C5H12 D.C6H14
C
若某烃有n个可被取代的氢原子,则其a氯取代产物的数目与n-a取代产物的数目相同。
换元法
知识拓展
烷烃是一类最基本的有机物,从结构上可
以看作其他各类有机物的母体。烷烃的性质在
一定程度上体现了有机物的通性。与无机物相
比,大多数有机物的熔点比较低,且难溶于水
,易溶于汽油、乙醇、苯等有机溶剂;大多数
有机物容易燃烧,受热会发生分解;有机物的化学反应比较复杂,常伴有副反应发生,很多反应需要在加热、光照或使用催化剂的条件下进行。有机物除了有以上通性,依据其组成和结构的不同,还具有很多特性,我们在以后的学习中会逐步接触。
1.1mol丙烷在光照情况下,最多可以与 mol氯气发生取代反应。
8
2.根据CH4的化学性质,推测烷烃有什么化学性质?
请以乙烷、丙烷为例,写出其与氯气反应生成一氯代物的方程式
CH3CH3 + Cl2 CH3CH2Cl + HCl
光
CH3CH2CH3 + Cl2 CH3CH2CH2Cl + HCl
光
CH3CHCH3
Cl
或
3.预测CH3CH2CH3和 分别与氯气在光照下发生取代反应时,生成一氯代物的种类
2,4
CH3CHCH2CH3
CH3
4.下列反应属于取代反应的是 ( )
③CH3CH3 + 2Br2 CH2BrCH2Br + 2HBr
光照
①Fe + CuSO4=FeSO4 + Cu
②NaOH + HCl=NaCl + H2O
④CH2Cl2 + Br2 CHBrCl2 + HBr
光照
A. ①② B. ③④ C. ①③ D. ③④
B
下列物质互为同分异构体的是( )
A. CH3CH2CH3与CH3CH2CH2CH3
B. CH3CH(CH3)CH2CH3与CH3CH2CH(CH3)CH3
C. CH3(CH2)3CH3与CH3C(CH3)2CH3
D. CH3CH2CH2Cl与CH3CH2CH2Br
C
?
第4课时 烷烃的性质
第一节 认识有机化合物
煤层气
含碳原子
个数较多的烷烃
凡士林
天然气
沼气
蜡烛
蜡笔
主要成分甲烷
在生活中我们接触过哪些烷烃?
【思考】请结合生活和初中化学的有关知识,想一想烷烃可能具有哪些性质?
烷烃的性质
任务一:烷烃的物理性质
甲烷的物理性质:
通常情况下,甲烷是一种没有颜色、没有气味的气体,甲烷极难溶于水、密度是0.717g/L(标准状况)
气
液
固
逐
渐
升
高
逐
渐
升
高
烷烃均为难溶于水的无色物质,其熔点、沸点和密度一般随着分子中碳原子数的增加(同时相对分子质量也在增大)而升高,在常温下的状态由气态变为液态,再到固态。
1-4
5-16
>16
任务一:烷烃的物理性质
烷烃同系物熔沸点规律——碳原子数目越多→相对分子质量越大 →分子间作用力越大→熔沸点越高
通常4个碳以内的正烷烃都是气态;含5~16个碳的为液态;17个碳以上的为固态。
当含碳数目相同时,支链越多,沸点越低。
如新戊烷常温为气态
烷烃
板书
相似性:无色物质,难溶于水、易溶于有机溶剂,
密度比水小,熔沸点低
物性
递变性
状态:气 液 固(n≤4为气态)
熔沸点
相对密度:随C↗而↗,但均小于1
C原子数相同时,支链越多,熔沸点越低
随C↗而↗
比较下列烷烃的沸点
CH4 CH3CH3 CH3CH2CH3
CH3CHCH3
CH3
<
<
<
<
CH3CH2CH3 CH4 CH3CH3 CH3CH2CH3
CH3
CH3CH2CH2CH3
CH3CH2CH2CH3
任务二:烷烃的化学性质
通常条件下,烷烃比较稳定,与强酸、强碱或高锰酸钾等强氧化剂不反应。
稳定性
* 可燃性:烷烃都能燃烧
CH4+2O2 CO2+2H2O
点燃
点燃甲烷前必须验纯
否则会爆炸。
煤矿中的爆炸事故多与甲烷气体爆炸有关。为了保证安全生产,必须采取通风、严禁烟火等措施。点燃之前要验纯。
化性
板书
稳定性,与强酸、强碱或高锰酸钾等强氧化剂不反应。
氧化反应(燃烧)
点燃
CnH2n+2+ O2 nCO2+(n+1)H2O
3n+1
2
CH4+2O2 CO2+2H2O
点燃
注意:淡蓝色火焰、点燃前先验纯
各1molC2H4、C2H6、C3H8、CH4
谁消耗O2最多?
谁生成H2O最多?
谁生成CO2最少?
?
C3H8
C3H8
CH4
规律:等n的烃完全燃,耗氧量取决于(x+y/4)的值;
生成水的量取决于y/2的值。
A.CH4 B.C2H6 C.C2H2、D、C5H12
?
等m的下列有机物完全燃烧,消耗O2最多的是( )
A
规律:等m的烃完全燃烧,耗氧量取决于y/x的值, 比值越大,耗氧量越大,生成水的量也取 决于y/x的值。
1、等物质的量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4 B、C2H6 C、C3H6 D、C6H6
2、等质量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4 B、C2H6 C、C3H6 D、C6H6
D
A
?
任务二:烷烃的化学性质
烷烃的分解
橡胶中加入炭黑做成轮胎,可增强耐磨性,延长其使用寿命。炭黑也可以用于生产油墨、油漆和黑色涂料等。炭黑可由烷烃在隔绝空气的条件下受热分解制备。写出甲烷分解生成炭黑的化学反应方程式。
烷烃的分解
CH4 C + 2H2
隔绝空气
1000~1200℃
炭黑:橡胶工业的原料
可以用于制造颜料、油墨、油漆等
合成氨
烷烃在较高温度下会发生分解。这个性质常被应用于石油化工和天然气化工生产中,从烷烃可得到一系列重要的化工基本原料和燃料。
化性
板书
性质稳定,与强酸、强碱或高锰酸钾等强氧化剂不反应。
氧化反应(燃烧)
点燃
CnH2n+2+ O2 nCO2+(n+1)H2O
3n+1
2
CH4+2O2 CO2+2H2O
点燃
注意:淡蓝色火焰、点燃前先验纯
分解反应
CH4 C + 2H2
高温
* 取代反应——烷烃的特征反应
【实验7-1】
取两支试管,均通过排饱和NaCl溶液的方法收集半试管CH4和半试管Cl2,分别用铁架台固定好(如图7-8)。将其中一支试管用铝箔套上,另一支试管放在光亮处(不要放在日光直射的地方)。静置,比较两支试管内的现象。
实验现象 原因分析
无光照
光照
无明显变化
无光照该反应不能发生
试管内气体颜色变浅
氯气逐渐消耗
试管壁上有油状液滴
生成不溶于水的液体
试管中液面上升
生成的气体溶于水中使试管内压强减小
水槽中有固体析出
Cl-饱和
可能观察到白雾
生成了易溶于水的HCl气体
实验结论
光照条件下,甲烷与氯气发生了反应
注意:暗处不反应 强光会爆炸
取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
H
C
H
H
Cl
H Cl
光
H
C
H
H
H
Cl Cl
+
+
一氯甲烷(g)
CH4与Cl2的反应原理
特征:一上一下、取而代之
* 取代反应
生成的一氯甲烷在常温下是气体,可与氯气进一步反应,依次又生成了二氯甲烷、三氯甲烷(氯仿)和四氯甲烷(四氯化碳)。
取代反应
板书
甲烷
CH4 + Cl2 CH3Cl + HCl
光
CH3Cl + Cl2 CH2Cl2 + HCl
光
CH2Cl2 + Cl2 CHCl3 + HCl
光
CHCl3 + Cl2 CCl4 + HCl
光
逐步取代
同时发生
现象:色变浅,出油滴,水上升,有白雾,晶体析。
注意:产物是混合物(5种),四种氯代产物都不溶于水,
HCl最多;常温下CH3Cl是气体,其余三种都是油状液体
反应中量的关系:
即:被取代n(H)=消耗n(Cl2)=生成n(HCl)
1mol H被取代→消耗 mol Cl2→生成 mol HCl。
不论如何控制反应物的用量,都是五种产物:CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,HCl的量最多
CH3Cl CH2Cl2 CHCl3 CCl4
空间构型
状态
四面体
正四面体
四面体
四面体
有机溶剂
气体
油状液体
油状液体
油状液体
有机溶剂
1
1
Cl
H
Cl
H
C
两种写法表示同一物质
H
Cl
Cl
H
C
同一物质不同投影方式
思考:由图可知甲烷是正四面体结构,那如何证明甲烷分子是正四面体结构呢?
方法1:应用物理方法测得CH4分子4个共价键的键角均为109°28′,
4个C-H键长均相等。则说明CH4为正四面体结构的分子
方法2:CH2Cl2只有一种结构,则说明CH4为正四面体结构的分子
取代反应
板书
甲烷
条件:纯卤素单质、光照
特点:有下有上,在哪下,在哪上。
定义:有机物分子中的某些原子或原子团被其它原子或原子
团所替代的反应;
CnH2n+1X + HX
光
CnH2n+2 + X2
会产生 种取代产物
9
?
1、向下列物质的溶液中加入AgNO3溶液,有白色沉淀产生的是( )
B
A、CH3Cl
B、NaCl
C、KClO3
D、CCl4
?
2、下列物质常温下呈气态的是 ( )
A、CH3Cl B、CH2Cl2
C、CHCl3 D、CCl4
A
3、下列物质中,不能与氯气发生取代反应
的是( )
A、CH3Cl B、CH2Cl2
C、CHCl3 D、CCl4
D
?
B
4、下列事实能证明CH4分子中是正四面体结构而非平面正四边形结构的是( )
A.CH3Cl只代表一种物质 B.CH2Cl2只代表一种物质
C.CHCl3只代表一种物质 D.CCl4只代表一种物质
?
5、下列有关甲烷的取代反应的叙述正确的是( )
A. CH4与Cl2的物质的量之比为1:1,混合反应只生成CH3Cl
B.CH4与Cl2的取代反应,生成的产物中CH3Cl最多
C. CH4与Cl2的取代反应生成的产物为混合物
D. 1 molCH4生成CCl4最多消耗2 molCl2
C
?
①同一个碳原子上的氢是等效氢
②同一碳原子上所连的甲基上的氢是等效氢
③处于分子中对称位置的碳上的氢原子是等效氢
判断烃的一元取代产物同分异构体数目
H C H
H
H
CH3 C CH3
CH3
CH3
H C C H
H
H
H
H
等效氢法
板书
4
CH3CH2CH2CH2CH3
CH3
CH3CCH2CH3
CH3
下面烷烃的等效H有多少种?
3
3
CH3 — C — C — CH3
CH3
CH3
CH3
CH3
1
1
CH3CCH3
CH3
CH3
CH3
CH3CHCHCHCH3
CH3 CH3
练2、进行一氯取代后,只能生成3种沸点不同的产
物的烷烃是( )
A、(CH3)2CHCH2CH2CH3 B、(CH3CH2)2CHCH3
C、(CH3)2CHCH(CH3)2 D、(CH3)3CCH2CH3
D
?
思考:
丁基(-C4H9)、戊基(-C5H11)各自有多少种结构?
-C5H11共8种结构
-C4H9共4种结构
H
C
H
H
H
C
C
H
3
C
H
3
C
H
3
H
3
C
H
C
C
H
H
H
H
H
C
C
H
3
C
H
3
H
3
C
C
C
H
3
C
H
3
C
H
3
[延伸拓展]一卤代物只有一种的烷烃必须符合什么规律?写出碳原子数小于10的这些烷烃的结构简式.
必须具有对称结构
练3、某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可以是( )
A.C3H8 B.C4H10 C.C5H12 D.C6H14
C
若某烃有n个可被取代的氢原子,则其a氯取代产物的数目与n-a取代产物的数目相同。
换元法
知识拓展
烷烃是一类最基本的有机物,从结构上可
以看作其他各类有机物的母体。烷烃的性质在
一定程度上体现了有机物的通性。与无机物相
比,大多数有机物的熔点比较低,且难溶于水
,易溶于汽油、乙醇、苯等有机溶剂;大多数
有机物容易燃烧,受热会发生分解;有机物的化学反应比较复杂,常伴有副反应发生,很多反应需要在加热、光照或使用催化剂的条件下进行。有机物除了有以上通性,依据其组成和结构的不同,还具有很多特性,我们在以后的学习中会逐步接触。
1.1mol丙烷在光照情况下,最多可以与 mol氯气发生取代反应。
8
2.根据CH4的化学性质,推测烷烃有什么化学性质?
请以乙烷、丙烷为例,写出其与氯气反应生成一氯代物的方程式
CH3CH3 + Cl2 CH3CH2Cl + HCl
光
CH3CH2CH3 + Cl2 CH3CH2CH2Cl + HCl
光
CH3CHCH3
Cl
或
3.预测CH3CH2CH3和 分别与氯气在光照下发生取代反应时,生成一氯代物的种类
2,4
CH3CHCH2CH3
CH3
4.下列反应属于取代反应的是 ( )
③CH3CH3 + 2Br2 CH2BrCH2Br + 2HBr
光照
①Fe + CuSO4=FeSO4 + Cu
②NaOH + HCl=NaCl + H2O
④CH2Cl2 + Br2 CHBrCl2 + HBr
光照
A. ①② B. ③④ C. ①③ D. ③④
B
下列物质互为同分异构体的是( )
A. CH3CH2CH3与CH3CH2CH2CH3
B. CH3CH(CH3)CH2CH3与CH3CH2CH(CH3)CH3
C. CH3(CH2)3CH3与CH3C(CH3)2CH3
D. CH3CH2CH2Cl与CH3CH2CH2Br
C
?
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
