选择题综合练(三) (含解析)—2024高考化学 考前冲刺综合练
文档属性
| 名称 | 选择题综合练(三) (含解析)—2024高考化学 考前冲刺综合练 |  | |
| 格式 | doc | ||
| 文件大小 | 726.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-22 21:18:58 | ||
图片预览




文档简介
选择题综合练(三)
1.劳动教育是五育并举的重要一环,下列劳动涉及的化学知识不正确的是( )
选项 劳动项目 化学知识
A 垃圾分类 “可回收物”中废纸、塑料、玻璃均属于无机非金属材料
B 秋收体验 收获的秸秆可用于生产酒精、饲料
C 污水处理 利用明矾可使废水中的细小颗粒絮凝聚沉
D 抽纱实践 潮汕抽纱所用材料棉、麻面料的主要成分均为纤维素
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.25 ℃,pH=13的1.0 L Ba(OH)2溶液中含有OH-的数目为0.2NA
B.60 g SiO2晶体中Si—O键数目为2NA
C.在K37ClO3+6H35Cl(浓)===KCl+3Cl2↑+3H2O反应中,若有212 g氯气生成,则反应中转移电子的数目为5NA
D.加热条件下,20 mL 10 mol·L-1浓硝酸与足量铜反应转移电子数为0.1NA
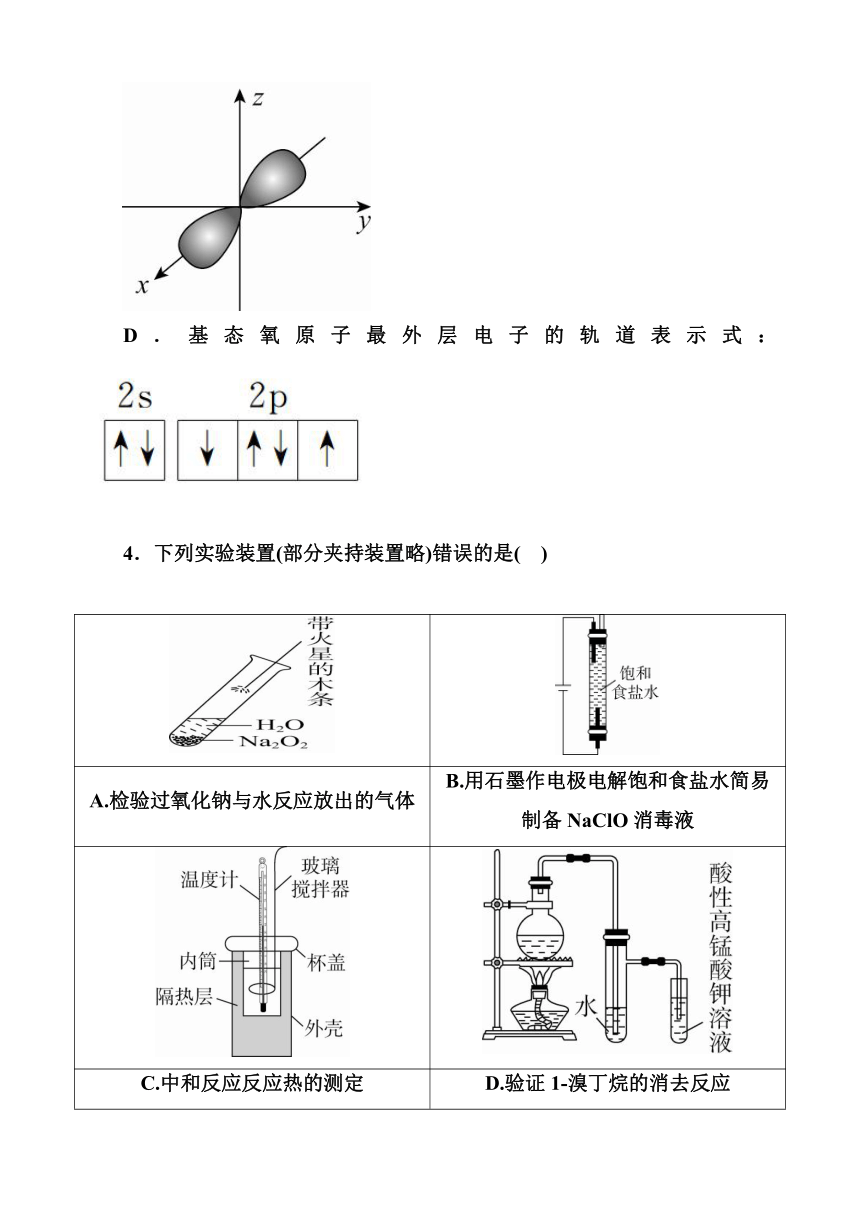
3.已知在一定条件下,SO2也能体现其氧化性,例如:2H2S+SO2===3S+2H2O,下列化学用语使用正确的是( )
A.SO2的VSEPR模型:
B.HS-的电离方程式:HS-+H2O??H2S+OH-
C.基态硫原子px轨道的电子云轮廓图:
D.基态氧原子最外层电子的轨道表示式:
4.下列实验装置(部分夹持装置略)错误的是( )
A.检验过氧化钠与水反应放出的气体 B.用石墨作电极电解饱和食盐水简易制备NaClO消毒液
C.中和反应反应热的测定 D.验证1 溴丁烷的消去反应
5.三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生如下反应:3BrF3+5H2O===HBrO3+Br2+9HF+O2↑。下列有关该反应的说法不正确的是( )
A.当0.5 mol H2O被氧化时,生成0.1 mol氧气
B.氧化剂与还原剂的物质的量之比为2∶3
C.当转移电子6 mol时,生成的还原产物为1 mol
D.当生成2.7 mol HF时,被还原的BrF3为0.6 mol
6.用废铁屑制备磁性氧化铁(Fe3O4),制取过程如图:
下列说法不正确的是( )
A.浸泡过程中适当加热并搅拌效果更好
B.取少量溶液A于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色,说明A中有Fe3+
C.制备Fe3O4的反应Fe2++2Fe3++8OH-Fe3O4+4H2O为非氧化还原反应
D.磁性氧化铁是一种黑色的难溶物
7.有机物X是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
A.有机物X的分子式为C16H16NO3
B.有机物X不存在顺反异构现象
C.1 mol X最多能与7 mol H2发生加成反应
D.有机物X能与NaHCO3溶液反应生成CO2
8.化合物A(结构式如下图)是重要的药物中间体和分析试剂,化合物A由原子序数依次增大的短周期元素X、Y、Z、W组成,W是地壳中分布最广的元素,下列说法正确的是( D )
A.Y的氢化物的沸点一定低于W的氢化物的沸点
B.原子半径大小顺序:W>Z>Y>X
C.非金属性强弱顺序:X>W>Y>Z
D.X、Y、Z、W四种元素可形成离子化合物
9.均含有短周期元素W的X、Y、Z三种物质间的转化关系如图所示。下列说法不正确的是( )
A.W可能是非金属元素
B.X可能是氧化物
C.Y、Z之间的转化可能是氧化还原反应
D.Y和Z在溶液中反应可能生成X
10.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 物质 杂质 除杂质应选用的试剂或操作方法
① MgCl2溶液 AlCl3 在MgCl2溶液中加过量NaOH溶液搅拌、过滤
② FeSO4溶液 CuSO4 加入过量铁粉并过滤
③ CO2 SO2 依次通过盛有NaOH溶液和浓硫酸的洗气瓶
④ NaNO3 CaCO3 加稀盐酸溶解、过滤、蒸发、结晶
A. ② B.①②
C.②③ D.①②③④
11.Al Mn Cu合金的晶胞如图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置。下列说法正确的是( )
A.Al原子周围等距且最近的Al原子有6个
B.若A原子的分数坐标为(0,0,0),则B原子的分数坐标为
C.Al Mn Cu合金化学式可表示为AlMnCu4
D.沿晶胞对角面的切面图为
12.已知N2O4(g)2NO2(g) ΔH>0,平衡体系中气体的平均摩尔质量()在不同温度下随压强p的变化曲线如图所示。下列说法正确的是( )
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:va<vb
D.当=69 g·mol-1时,n(NO2)∶n(N2O4)=2∶1
13.一定温度、压强下,CH3—CH===CH2(g)与HCl(g)反应可以生成CH3CHClCH3(g)和CH3CH2CH2Cl(g),反应中的能量变化如图所示。下列说法不正确的是( )
A.生成CH3CH2CH2Cl(g)的反应中,第一步为反应的决速步
B.短时间内,CH3CHClCH3(g)是主产物
C.升高温度达平衡时,可以提高产物中CH3CH2CH2Cl(g)的比例
D.CH3—CH===CH2(g)+HCl(g)CH3CH2CH2Cl(g)的焓变等于第一步与第二步正反应活化能的差值
14.双极膜电解法制巯基乙酸(HSCH2COOH)和高纯NaOH溶液原理如图所示,其中a、b为离子交换膜,双极膜在直流电压下可解离出H+和OH-。下列说法正确的是( )
A.膜a和膜b均为阳离子交换膜
B.双极膜解离出的H+在双极膜的右侧
C.碱室1和碱室2的NaOH溶液可以循环使用,电解过程不产生其他副产物
D.若将盐室的原料换成Na2SO4溶液,当外电路通过2 mol e-时,可生成2 mol H2SO4
15.亚砷酸(H3AsO3)作为一种化疗药物,常用于白血病的治疗,其在水溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。下列说法不正确的是( )
A.②代表H2AsO,0.1 mol·L-1亚砷酸溶液中c(H+)约为10-5.15 mol·L-1
B.等浓度的H3AsO3与NaOH等体积混合,所得溶液中水的电离受到促进
C.以酚酞为指示剂,将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为H3AsO3+2OH-===HAsO+2H2O
D.b点溶液中c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)+c(Na+)
选择题综合练(三)
1.劳动教育是五育并举的重要一环,下列劳动涉及的化学知识不正确的是( A )
选项 劳动项目 化学知识
A 垃圾分类 “可回收物”中废纸、塑料、玻璃均属于无机非金属材料
B 秋收体验 收获的秸秆可用于生产酒精、饲料
C 污水处理 利用明矾可使废水中的细小颗粒絮凝聚沉
D 抽纱实践 潮汕抽纱所用材料棉、麻面料的主要成分均为纤维素
解析 废纸、塑料属于有机物,故A错误;秸秆主要成分是纤维素,纤维素经过水解得到葡萄糖,葡萄糖可转变为乙醇,因此秸秆可用于生产酒精、饲料,故B正确;明矾中铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中杂质,可使废水中的细小颗粒絮凝聚沉,故C正确;棉、麻面料的主要成分均为纤维素,故D正确。
2.设NA为阿伏加德罗常数的值,下列说法正确的是( C )
A.25 ℃,pH=13的1.0 L Ba(OH)2溶液中含有OH-的数目为0.2NA
B.60 g SiO2晶体中Si—O键数目为2NA
C.在K37ClO3+6H35Cl(浓)===KCl+3Cl2↑+3H2O反应中,若有212 g氯气生成,则反应中转移电子的数目为5NA
D.加热条件下,20 mL 10 mol·L-1浓硝酸与足量铜反应转移电子数为0.1NA
解析 25 ℃,pH=13的1.0 L Ba(OH)2溶液中,c(OH-)= mol/L=0.1 mol/L,OH-的数目为0.1 mol/L×1.0 L×NA mol-1=0.1NA,故A错误;SiO2晶体中1个Si原子形成4个Si—O键,所以60 g即1 mol SiO2晶体中Si—O键数目为4NA,故B错误;在K37ClO3+6H35Cl(浓)===KCl+3Cl2↑+3H2O反应中,Cl2的平均相对分子质量为= ,且反应中每生成3 mol Cl2转移电子数为5 mol,若有212 g(即3 mol)氯气生成,则反应中电子转移的数目为5NA,故C正确;足量铜与浓硝酸发生反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,随着反应进行,HNO3不断被消耗,铜与稀硝酸发生反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,参加反应的HNO3的物质的量为20×10-3 L×10 mol·L-1=0.2 mol,消耗的铜的物质的量在0.05 mol~0.075 mol之间,则转移的电子数在0.1NA~0.15NA之间,故D错误。
3.已知在一定条件下,SO2也能体现其氧化性,例如:2H2S+SO2===3S+2H2O,下列化学用语使用正确的是( C )
A.SO2的VSEPR模型:
B.HS-的电离方程式:HS-+H2O??H2S+OH-
C.基态硫原子px轨道的电子云轮廓图:
D.基态氧原子最外层电子的轨道表示式:
解析 二氧化硫中心原子S的价层电子对数为3,有1对孤电子对,S的杂化类型为sp2,VSEPR模型为平面三角形,A错误;HS-的电离方程式为HS-??H++S2-,B错误;基态硫原子px轨道的电子云轮廓为哑铃形,C正确;基态氧原子最外层电子的轨道表示式: ,D错误。
4.下列实验装置(部分夹持装置略)错误的是( B )
A.检验过氧化钠与水反应放出的气体 B.用石墨作电极电解饱和食盐水简易制备NaClO消毒液
C.中和反应反应热的测定 D.验证1 溴丁烷的消去反应
解析 氧气具有助燃性,带火星的木条复燃,说明过氧化钠与水反应产生氧气,故A正确;电解饱和氯化钠溶液反应为2NaCl+2H2OCl2↑+H2↑+2NaOH,生成的氯气和氢氧化钠反应生成次氯酸钠,为了使生成的氯气与氢氧化钠溶液充分接触,氯气应该在下面生成,所以下端是阳极,与电源的正极相连,上端为阴极,与电源的负极相连,故B错误;中和热测定要保证热量不会过多散失,故C正确;1 溴丁烷的消去反应需要在氢氧化钠醇溶液、加热的条件下进行,加热时挥发出的乙醇能使酸性高锰酸钾溶液褪色,为避免干扰实验结果,应将气体先通入水中以除去其中的乙醇蒸气,故D正确。
5.三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生如下反应:3BrF3+5H2O===HBrO3+Br2+9HF+O2↑。下列有关该反应的说法不正确的是( A )
A.当0.5 mol H2O被氧化时,生成0.1 mol氧气
B.氧化剂与还原剂的物质的量之比为2∶3
C.当转移电子6 mol时,生成的还原产物为1 mol
D.当生成2.7 mol HF时,被还原的BrF3为0.6 mol
解析 由方程式可知,该反应中5 mol H2O中有2 mol H2O发生了氧化反应,生成1 mol O2,则0.5 mol H2O被氧化时,生成了0.25 mol O2,A错误;该反应3 mol BrF3中作为氧化剂的BrF3有2 mol,作为还原剂的BrF3有1 mol,5 mol H2O中有2 mol为还原剂,则氧化剂与还原剂的物质的量之比为2∶3,B正确;2 mol BrF3为氧化剂,得到6 mol电子生成还原产物Br2,Br2的物质的量为1 mol,C正确;由反应方程式可知,生成9 mol HF时,有2 mol BrF3被还原,则生成2.7 mol HF时,被还原的BrF3为0.6 mol,D正确。
6.用废铁屑制备磁性氧化铁(Fe3O4),制取过程如图:
下列说法不正确的是( B )
A.浸泡过程中适当加热并搅拌效果更好
B.取少量溶液A于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色,说明A中有Fe3+
C.制备Fe3O4的反应Fe2++2Fe3++8OH-Fe3O4+4H2O为非氧化还原反应
D.磁性氧化铁是一种黑色的难溶物
解析 废铁屑加入碳酸钠溶液浸泡,除去表面的油污,加入稀硫酸溶解废铁屑,得到硫酸亚铁溶液,调节pH为1~2,加入适量的过氧化氢,将部分亚铁离子氧化成铁离子,加入氢氧化钠溶液,通入氮气并加热得到磁性氧化铁。浸泡过程中适当加热并搅拌,可增大接触面积,加快反应速率,效果更好,故A正确;Fe3+可与 KSCN溶液反应,溶液变红色,如果滴加氯水,会把亚铁离子氧化成铁离子,再滴加KSCN溶液,溶液变红色,不能说明A中有Fe3+,故B错误;制备Fe3O4的反应Fe2++2Fe3++8OH-Fe3O4+4H2O中,各元素的化合价没有发生变化,为非氧化还原反应,故C正确;磁性氧化铁(Fe3O4)是一种黑色的难溶物,故D正确。
7.有机物X是一种医药中间体,其结构简式如图所示。下列说法正确的是( B )
A.有机物X的分子式为C16H16NO3
B.有机物X不存在顺反异构现象
C.1 mol X最多能与7 mol H2发生加成反应
D.有机物X能与NaHCO3溶液反应生成CO2
解析 根据题图可知,该有机物的分子式为C16H15NO3,A项错误;有机物X中碳碳双键的其中一个C原子上连有两个相同的基团:,故不存在顺反异构现象,B项正确;1 mol苯环能与3 mol氢气发生加成反应,1 mol碳碳双键和碳氧双键均能与1 mol氢气发生加成反应,所以1 mol X最多能与8 mol H2发生加成反应,C项错误;羧基能与碳酸氢钠发生反应,该有机物中无羧基,故不能与碳酸氢钠溶液发生反应,D项错误。
8.化合物A(结构式如下图)是重要的药物中间体和分析试剂,化合物A由原子序数依次增大的短周期元素X、Y、Z、W组成,W是地壳中分布最广的元素,下列说法正确的是( D )
A.Y的氢化物的沸点一定低于W的氢化物的沸点
B.原子半径大小顺序:W>Z>Y>X
C.非金属性强弱顺序:X>W>Y>Z
D.X、Y、Z、W四种元素可形成离子化合物
解析 化合物A由原子序数依次增大的短周期元素X、Y、Z、W组成,W是地壳中分布最广的元素,则W为O元素,由化合物A的结构式可知,X只形成一个共价键,原子序数小于O,且在这几种元素中原子序数最小,则X为H元素,Y形成四个共价键,且原子序数小于O,则Y为C元素,Z形成三个共价键,且原子序数小于O,则Z为N元素。A项,Y为C元素,W为O元素,C的氢化物有可能是分子量很大的烃,沸点有可能比H2O或H2O2高,错误;B项,根据一般电子层数越多,原子半径越大,同周期主族元素随着原子序数的递增,原子半径减小,则H只有一个电子层,原子半径最小,C、N、O均有两个电子层,属于同周期元素,原子序数:C<N<O,原子半径大小:C>N>O>H,即Y>Z>W>X,错误;C项,根据同周期主族元素从左至右,非金属性依次增强,原子序数:C<N<O,则非金属性:O>N>C,在CH4中H呈现正价,非金属性:C>H,所以非金属性:O>N>C>H,即W>Z>Y>X,错误;D项,X、Y、Z、W这四种元素可形成离子化合物(NH4)2CO3或NH4HCO3,正确。
9.均含有短周期元素W的X、Y、Z三种物质间的转化关系如图所示。下列说法不正确的是( C )
A.W可能是非金属元素
B.X可能是氧化物
C.Y、Z之间的转化可能是氧化还原反应
D.Y和Z在溶液中反应可能生成X
解析 W可能是非金属元素,如X为NaHCO3,Y为CO2,Z为Na2CO3时,W为碳元素,A项正确;X可能是氧化物,如X为Al2O3,Y为Al2(SO4)3,Z为NaAlO2,B项正确;Y、Z之间的相互转化方式为加酸或加碱,不可能是氧化还原反应,C项错误;当X为Al(OH)3时,Y为Al2(SO4)3,Z为NaAlO2,Y和Z在溶液中反应可生成X,D项正确。
10.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( A )
序号 物质 杂质 除杂质应选用的试剂或操作方法
① MgCl2溶液 AlCl3 在MgCl2溶液中加过量NaOH溶液搅拌、过滤
② FeSO4溶液 CuSO4 加入过量铁粉并过滤
③ CO2 SO2 依次通过盛有NaOH溶液和浓硫酸的洗气瓶
④ NaNO3 CaCO3 加稀盐酸溶解、过滤、蒸发、结晶
A. ② B.①②
C.②③ D.①②③④
解析 MgCl2和AlCl3均与氢氧化钠溶液反应,过量NaOH溶液不能用于除去MgCl2溶液中的AlCl3杂质,故①错误;FeSO4与铁粉不反应,CuSO4与铁粉反应生成单质铜和FeSO4,则过量铁粉可以除去FeSO4溶液中的CuSO4杂质,故②正确;CO2和SO2均为酸性气体,都能与氢氧化钠溶液反应,不能达到除杂的目的,故③错误;NaNO3易溶于水,CaCO3难溶于水,直接加水溶解过滤,再蒸发结晶即可除杂,加入稀盐酸与碳酸钙反应生成可溶于水的氯化钙,引入新杂质,不能达到除杂目的,故④错误。故选A。
11.Al Mn Cu合金的晶胞如图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置。下列说法正确的是( D )
A.Al原子周围等距且最近的Al原子有6个
B.若A原子的分数坐标为(0,0,0),则B原子的分数坐标为
C.Al Mn Cu合金化学式可表示为AlMnCu4
D.沿晶胞对角面的切面图为
解析 题图中与B所表示的Al原子等距离的Al原子有3个,由于还需要考虑前后和左右两个垂直面的情况,因此等距离且最近的Al原子有12个,A错误;B原子位于Cu形成的小立方体体心,+×=,B原子的分数坐标为,B错误;由于4个Mn原子和4个Al原子均在晶胞内,所以整个晶胞共包括4个Mn原子和4个Al原子,由于8个Cu原子在顶点,12个在棱上,6个在面上,1个在晶胞内部,所以晶胞共分摊Cu:8×+12×+6×+1×1=8个,Cu∶Al∶Mn=8∶4∶4=2∶1∶1,化学式为AlMnCu2,C错误。
12.已知N2O4(g)2NO2(g) ΔH>0,平衡体系中气体的平均摩尔质量()在不同温度下随压强p的变化曲线如图所示。下列说法正确的是( C )
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:va<vb
D.当=69 g·mol-1时,n(NO2)∶n(N2O4)=2∶1
解析 反应物和生成物均为气体,总质量不变,平衡正向移动时气体的物质的量增大,则减小,逆向移动时增大,该反应为气体物质的量增大的吸热反应,所以升高温度、减小压强可以使平衡正向移动,减小;降低温度、增大压强可以使平衡逆向移动,增大。A项,由分析可知T2<T1,错误;B项,a点和c点是在同一温度下的平衡常数,所以K(a)=K(c),错误;C项,温度越高,反应速率越快,压强越大,反应速率越快,根据前面分析可知T2<T1,图中b点压强大于a点,所以va<vb,正确;D项,设n(NO2)∶n(N2O4)=x∶y,则有=69,所以x∶y=1∶1,错误。
13.一定温度、压强下,CH3—CH===CH2(g)与HCl(g)反应可以生成CH3CHClCH3(g)和CH3CH2CH2Cl(g),反应中的能量变化如图所示。下列说法不正确的是( D )
A.生成CH3CH2CH2Cl(g)的反应中,第一步为反应的决速步
B.短时间内,CH3CHClCH3(g)是主产物
C.升高温度达平衡时,可以提高产物中CH3CH2CH2Cl(g)的比例
D.CH3—CH===CH2(g)+HCl(g)CH3CH2CH2Cl(g)的焓变等于第一步与第二步正反应活化能的差值
解析 生成CH3CH2CH2Cl(g)的反应中,第一步反应活化能高,是决速步,故A正确;短时间内,生成CH3CHClCH3(g)的反应活化能低,反应速率快,因此CH3CHClCH3(g)是主产物,故B正确;CH3CHClCH3(g)CH3CH2CH2Cl(g) ΔH>0,升高温度有利于平衡正向移动,可以提高产物中CH3CH2CH2Cl(g)的比例,故C正确;CH3—CH===CH2(g)+HCl(g)CH3CH2CH2Cl(g)的焓变等于第一步与第二步反应的ΔH的代数和,故D错误。
14.双极膜电解法制巯基乙酸(HSCH2COOH)和高纯NaOH溶液原理如图所示,其中a、b为离子交换膜,双极膜在直流电压下可解离出H+和OH-。下列说法正确的是( A )
A.膜a和膜b均为阳离子交换膜
B.双极膜解离出的H+在双极膜的右侧
C.碱室1和碱室2的NaOH溶液可以循环使用,电解过程不产生其他副产物
D.若将盐室的原料换成Na2SO4溶液,当外电路通过2 mol e-时,可生成2 mol H2SO4
解析 根据装置图可知,该装置为电解池装置,根据电解原理,左边电极为阴极,电极反应式为2H2O+2e-===H2↑+2OH-,HSCH2COONa中Na+向阴极移动,膜a为阳离子交换膜,右边电极为阳极,电极反应式为4OH--4e-===O2↑+2H2O,碱室2中Na+向左移,膜b为阳离子交换膜。由以上分析可知,膜a、b均为阳离子交换膜,故A正确;双极膜解离出的H+在双极膜的左侧,故B错误;碱室1和碱室2的NaOH溶液可循环使用,副产物还有氢气和氧气,故C错误;外电路有2 mol电子通过,盐室中有2 mol Na+移向碱室1,双极膜中有2 mol H+移向盐室,即得到1 mol H2SO4,故D错误。
15.亚砷酸(H3AsO3)作为一种化疗药物,常用于白血病的治疗,其在水溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。下列说法不正确的是( C )
A.②代表H2AsO,0.1 mol·L-1亚砷酸溶液中c(H+)约为10-5.15 mol·L-1
B.等浓度的H3AsO3与NaOH等体积混合,所得溶液中水的电离受到促进
C.以酚酞为指示剂,将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为H3AsO3+2OH-===HAsO+2H2O
D.b点溶液中c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)+c(Na+)
解析 用NaOH溶液滴定H3AsO3时,随pH不断增大,H3AsO3H2AsO+H+、H2AsOHAsO+H+、HAsOAsO+H+的平衡正向移动,因此物质的量分数:H3AsO3减小、H2AsO先增后减、HAsO先增后减、AsO增大,H2AsO先于HAsO出现,结合图像可得曲线①为H3AsO3,曲线②为H2AsO,曲线③为HAsO,曲线④为AsO。由以上分析可知,②代表H2AsO,根据a(9.3,0.5)可得c(H3AsO3)=c(H2AsO),c(H+)=10-9.3 mol·L-1,可计算亚砷酸的Ka1==1×10-9.3,0.1 mol·L-1亚砷酸溶液中c(H2AsO)≈c(H+)、c(H3AsO3)≈0.1 mol·L-1,代入Ka1==1×10-9.3=,解得c(H+)=1×10-5.15 mol·L-1,故A正确;等浓度的H3AsO3与NaOH等体积混合,溶质为NaH2AsO3,则Kh(H2AsO)===1×10-4.7,根据b点得到Ka2==1×10-12.1,因此H2AsO水解程度大于电离程度,促进了水的电离,故B正确;以酚酞为指示剂,将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加,根据图中信息得到溶液为NaH2AsO3,因此该过程中主要反应的离子方程式为H3AsO3+OH-===H2AsO+H2O,故C错误;根据电荷守恒,b点得到c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)+c(Na+),故D正确。
1.劳动教育是五育并举的重要一环,下列劳动涉及的化学知识不正确的是( )
选项 劳动项目 化学知识
A 垃圾分类 “可回收物”中废纸、塑料、玻璃均属于无机非金属材料
B 秋收体验 收获的秸秆可用于生产酒精、饲料
C 污水处理 利用明矾可使废水中的细小颗粒絮凝聚沉
D 抽纱实践 潮汕抽纱所用材料棉、麻面料的主要成分均为纤维素
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.25 ℃,pH=13的1.0 L Ba(OH)2溶液中含有OH-的数目为0.2NA
B.60 g SiO2晶体中Si—O键数目为2NA
C.在K37ClO3+6H35Cl(浓)===KCl+3Cl2↑+3H2O反应中,若有212 g氯气生成,则反应中转移电子的数目为5NA
D.加热条件下,20 mL 10 mol·L-1浓硝酸与足量铜反应转移电子数为0.1NA
3.已知在一定条件下,SO2也能体现其氧化性,例如:2H2S+SO2===3S+2H2O,下列化学用语使用正确的是( )
A.SO2的VSEPR模型:
B.HS-的电离方程式:HS-+H2O??H2S+OH-
C.基态硫原子px轨道的电子云轮廓图:
D.基态氧原子最外层电子的轨道表示式:
4.下列实验装置(部分夹持装置略)错误的是( )
A.检验过氧化钠与水反应放出的气体 B.用石墨作电极电解饱和食盐水简易制备NaClO消毒液
C.中和反应反应热的测定 D.验证1 溴丁烷的消去反应
5.三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生如下反应:3BrF3+5H2O===HBrO3+Br2+9HF+O2↑。下列有关该反应的说法不正确的是( )
A.当0.5 mol H2O被氧化时,生成0.1 mol氧气
B.氧化剂与还原剂的物质的量之比为2∶3
C.当转移电子6 mol时,生成的还原产物为1 mol
D.当生成2.7 mol HF时,被还原的BrF3为0.6 mol
6.用废铁屑制备磁性氧化铁(Fe3O4),制取过程如图:
下列说法不正确的是( )
A.浸泡过程中适当加热并搅拌效果更好
B.取少量溶液A于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色,说明A中有Fe3+
C.制备Fe3O4的反应Fe2++2Fe3++8OH-Fe3O4+4H2O为非氧化还原反应
D.磁性氧化铁是一种黑色的难溶物
7.有机物X是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
A.有机物X的分子式为C16H16NO3
B.有机物X不存在顺反异构现象
C.1 mol X最多能与7 mol H2发生加成反应
D.有机物X能与NaHCO3溶液反应生成CO2
8.化合物A(结构式如下图)是重要的药物中间体和分析试剂,化合物A由原子序数依次增大的短周期元素X、Y、Z、W组成,W是地壳中分布最广的元素,下列说法正确的是( D )
A.Y的氢化物的沸点一定低于W的氢化物的沸点
B.原子半径大小顺序:W>Z>Y>X
C.非金属性强弱顺序:X>W>Y>Z
D.X、Y、Z、W四种元素可形成离子化合物
9.均含有短周期元素W的X、Y、Z三种物质间的转化关系如图所示。下列说法不正确的是( )
A.W可能是非金属元素
B.X可能是氧化物
C.Y、Z之间的转化可能是氧化还原反应
D.Y和Z在溶液中反应可能生成X
10.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 物质 杂质 除杂质应选用的试剂或操作方法
① MgCl2溶液 AlCl3 在MgCl2溶液中加过量NaOH溶液搅拌、过滤
② FeSO4溶液 CuSO4 加入过量铁粉并过滤
③ CO2 SO2 依次通过盛有NaOH溶液和浓硫酸的洗气瓶
④ NaNO3 CaCO3 加稀盐酸溶解、过滤、蒸发、结晶
A. ② B.①②
C.②③ D.①②③④
11.Al Mn Cu合金的晶胞如图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置。下列说法正确的是( )
A.Al原子周围等距且最近的Al原子有6个
B.若A原子的分数坐标为(0,0,0),则B原子的分数坐标为
C.Al Mn Cu合金化学式可表示为AlMnCu4
D.沿晶胞对角面的切面图为
12.已知N2O4(g)2NO2(g) ΔH>0,平衡体系中气体的平均摩尔质量()在不同温度下随压强p的变化曲线如图所示。下列说法正确的是( )
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:va<vb
D.当=69 g·mol-1时,n(NO2)∶n(N2O4)=2∶1
13.一定温度、压强下,CH3—CH===CH2(g)与HCl(g)反应可以生成CH3CHClCH3(g)和CH3CH2CH2Cl(g),反应中的能量变化如图所示。下列说法不正确的是( )
A.生成CH3CH2CH2Cl(g)的反应中,第一步为反应的决速步
B.短时间内,CH3CHClCH3(g)是主产物
C.升高温度达平衡时,可以提高产物中CH3CH2CH2Cl(g)的比例
D.CH3—CH===CH2(g)+HCl(g)CH3CH2CH2Cl(g)的焓变等于第一步与第二步正反应活化能的差值
14.双极膜电解法制巯基乙酸(HSCH2COOH)和高纯NaOH溶液原理如图所示,其中a、b为离子交换膜,双极膜在直流电压下可解离出H+和OH-。下列说法正确的是( )
A.膜a和膜b均为阳离子交换膜
B.双极膜解离出的H+在双极膜的右侧
C.碱室1和碱室2的NaOH溶液可以循环使用,电解过程不产生其他副产物
D.若将盐室的原料换成Na2SO4溶液,当外电路通过2 mol e-时,可生成2 mol H2SO4
15.亚砷酸(H3AsO3)作为一种化疗药物,常用于白血病的治疗,其在水溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。下列说法不正确的是( )
A.②代表H2AsO,0.1 mol·L-1亚砷酸溶液中c(H+)约为10-5.15 mol·L-1
B.等浓度的H3AsO3与NaOH等体积混合,所得溶液中水的电离受到促进
C.以酚酞为指示剂,将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为H3AsO3+2OH-===HAsO+2H2O
D.b点溶液中c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)+c(Na+)
选择题综合练(三)
1.劳动教育是五育并举的重要一环,下列劳动涉及的化学知识不正确的是( A )
选项 劳动项目 化学知识
A 垃圾分类 “可回收物”中废纸、塑料、玻璃均属于无机非金属材料
B 秋收体验 收获的秸秆可用于生产酒精、饲料
C 污水处理 利用明矾可使废水中的细小颗粒絮凝聚沉
D 抽纱实践 潮汕抽纱所用材料棉、麻面料的主要成分均为纤维素
解析 废纸、塑料属于有机物,故A错误;秸秆主要成分是纤维素,纤维素经过水解得到葡萄糖,葡萄糖可转变为乙醇,因此秸秆可用于生产酒精、饲料,故B正确;明矾中铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中杂质,可使废水中的细小颗粒絮凝聚沉,故C正确;棉、麻面料的主要成分均为纤维素,故D正确。
2.设NA为阿伏加德罗常数的值,下列说法正确的是( C )
A.25 ℃,pH=13的1.0 L Ba(OH)2溶液中含有OH-的数目为0.2NA
B.60 g SiO2晶体中Si—O键数目为2NA
C.在K37ClO3+6H35Cl(浓)===KCl+3Cl2↑+3H2O反应中,若有212 g氯气生成,则反应中转移电子的数目为5NA
D.加热条件下,20 mL 10 mol·L-1浓硝酸与足量铜反应转移电子数为0.1NA
解析 25 ℃,pH=13的1.0 L Ba(OH)2溶液中,c(OH-)= mol/L=0.1 mol/L,OH-的数目为0.1 mol/L×1.0 L×NA mol-1=0.1NA,故A错误;SiO2晶体中1个Si原子形成4个Si—O键,所以60 g即1 mol SiO2晶体中Si—O键数目为4NA,故B错误;在K37ClO3+6H35Cl(浓)===KCl+3Cl2↑+3H2O反应中,Cl2的平均相对分子质量为= ,且反应中每生成3 mol Cl2转移电子数为5 mol,若有212 g(即3 mol)氯气生成,则反应中电子转移的数目为5NA,故C正确;足量铜与浓硝酸发生反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,随着反应进行,HNO3不断被消耗,铜与稀硝酸发生反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,参加反应的HNO3的物质的量为20×10-3 L×10 mol·L-1=0.2 mol,消耗的铜的物质的量在0.05 mol~0.075 mol之间,则转移的电子数在0.1NA~0.15NA之间,故D错误。
3.已知在一定条件下,SO2也能体现其氧化性,例如:2H2S+SO2===3S+2H2O,下列化学用语使用正确的是( C )
A.SO2的VSEPR模型:
B.HS-的电离方程式:HS-+H2O??H2S+OH-
C.基态硫原子px轨道的电子云轮廓图:
D.基态氧原子最外层电子的轨道表示式:
解析 二氧化硫中心原子S的价层电子对数为3,有1对孤电子对,S的杂化类型为sp2,VSEPR模型为平面三角形,A错误;HS-的电离方程式为HS-??H++S2-,B错误;基态硫原子px轨道的电子云轮廓为哑铃形,C正确;基态氧原子最外层电子的轨道表示式: ,D错误。
4.下列实验装置(部分夹持装置略)错误的是( B )
A.检验过氧化钠与水反应放出的气体 B.用石墨作电极电解饱和食盐水简易制备NaClO消毒液
C.中和反应反应热的测定 D.验证1 溴丁烷的消去反应
解析 氧气具有助燃性,带火星的木条复燃,说明过氧化钠与水反应产生氧气,故A正确;电解饱和氯化钠溶液反应为2NaCl+2H2OCl2↑+H2↑+2NaOH,生成的氯气和氢氧化钠反应生成次氯酸钠,为了使生成的氯气与氢氧化钠溶液充分接触,氯气应该在下面生成,所以下端是阳极,与电源的正极相连,上端为阴极,与电源的负极相连,故B错误;中和热测定要保证热量不会过多散失,故C正确;1 溴丁烷的消去反应需要在氢氧化钠醇溶液、加热的条件下进行,加热时挥发出的乙醇能使酸性高锰酸钾溶液褪色,为避免干扰实验结果,应将气体先通入水中以除去其中的乙醇蒸气,故D正确。
5.三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生如下反应:3BrF3+5H2O===HBrO3+Br2+9HF+O2↑。下列有关该反应的说法不正确的是( A )
A.当0.5 mol H2O被氧化时,生成0.1 mol氧气
B.氧化剂与还原剂的物质的量之比为2∶3
C.当转移电子6 mol时,生成的还原产物为1 mol
D.当生成2.7 mol HF时,被还原的BrF3为0.6 mol
解析 由方程式可知,该反应中5 mol H2O中有2 mol H2O发生了氧化反应,生成1 mol O2,则0.5 mol H2O被氧化时,生成了0.25 mol O2,A错误;该反应3 mol BrF3中作为氧化剂的BrF3有2 mol,作为还原剂的BrF3有1 mol,5 mol H2O中有2 mol为还原剂,则氧化剂与还原剂的物质的量之比为2∶3,B正确;2 mol BrF3为氧化剂,得到6 mol电子生成还原产物Br2,Br2的物质的量为1 mol,C正确;由反应方程式可知,生成9 mol HF时,有2 mol BrF3被还原,则生成2.7 mol HF时,被还原的BrF3为0.6 mol,D正确。
6.用废铁屑制备磁性氧化铁(Fe3O4),制取过程如图:
下列说法不正确的是( B )
A.浸泡过程中适当加热并搅拌效果更好
B.取少量溶液A于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色,说明A中有Fe3+
C.制备Fe3O4的反应Fe2++2Fe3++8OH-Fe3O4+4H2O为非氧化还原反应
D.磁性氧化铁是一种黑色的难溶物
解析 废铁屑加入碳酸钠溶液浸泡,除去表面的油污,加入稀硫酸溶解废铁屑,得到硫酸亚铁溶液,调节pH为1~2,加入适量的过氧化氢,将部分亚铁离子氧化成铁离子,加入氢氧化钠溶液,通入氮气并加热得到磁性氧化铁。浸泡过程中适当加热并搅拌,可增大接触面积,加快反应速率,效果更好,故A正确;Fe3+可与 KSCN溶液反应,溶液变红色,如果滴加氯水,会把亚铁离子氧化成铁离子,再滴加KSCN溶液,溶液变红色,不能说明A中有Fe3+,故B错误;制备Fe3O4的反应Fe2++2Fe3++8OH-Fe3O4+4H2O中,各元素的化合价没有发生变化,为非氧化还原反应,故C正确;磁性氧化铁(Fe3O4)是一种黑色的难溶物,故D正确。
7.有机物X是一种医药中间体,其结构简式如图所示。下列说法正确的是( B )
A.有机物X的分子式为C16H16NO3
B.有机物X不存在顺反异构现象
C.1 mol X最多能与7 mol H2发生加成反应
D.有机物X能与NaHCO3溶液反应生成CO2
解析 根据题图可知,该有机物的分子式为C16H15NO3,A项错误;有机物X中碳碳双键的其中一个C原子上连有两个相同的基团:,故不存在顺反异构现象,B项正确;1 mol苯环能与3 mol氢气发生加成反应,1 mol碳碳双键和碳氧双键均能与1 mol氢气发生加成反应,所以1 mol X最多能与8 mol H2发生加成反应,C项错误;羧基能与碳酸氢钠发生反应,该有机物中无羧基,故不能与碳酸氢钠溶液发生反应,D项错误。
8.化合物A(结构式如下图)是重要的药物中间体和分析试剂,化合物A由原子序数依次增大的短周期元素X、Y、Z、W组成,W是地壳中分布最广的元素,下列说法正确的是( D )
A.Y的氢化物的沸点一定低于W的氢化物的沸点
B.原子半径大小顺序:W>Z>Y>X
C.非金属性强弱顺序:X>W>Y>Z
D.X、Y、Z、W四种元素可形成离子化合物
解析 化合物A由原子序数依次增大的短周期元素X、Y、Z、W组成,W是地壳中分布最广的元素,则W为O元素,由化合物A的结构式可知,X只形成一个共价键,原子序数小于O,且在这几种元素中原子序数最小,则X为H元素,Y形成四个共价键,且原子序数小于O,则Y为C元素,Z形成三个共价键,且原子序数小于O,则Z为N元素。A项,Y为C元素,W为O元素,C的氢化物有可能是分子量很大的烃,沸点有可能比H2O或H2O2高,错误;B项,根据一般电子层数越多,原子半径越大,同周期主族元素随着原子序数的递增,原子半径减小,则H只有一个电子层,原子半径最小,C、N、O均有两个电子层,属于同周期元素,原子序数:C<N<O,原子半径大小:C>N>O>H,即Y>Z>W>X,错误;C项,根据同周期主族元素从左至右,非金属性依次增强,原子序数:C<N<O,则非金属性:O>N>C,在CH4中H呈现正价,非金属性:C>H,所以非金属性:O>N>C>H,即W>Z>Y>X,错误;D项,X、Y、Z、W这四种元素可形成离子化合物(NH4)2CO3或NH4HCO3,正确。
9.均含有短周期元素W的X、Y、Z三种物质间的转化关系如图所示。下列说法不正确的是( C )
A.W可能是非金属元素
B.X可能是氧化物
C.Y、Z之间的转化可能是氧化还原反应
D.Y和Z在溶液中反应可能生成X
解析 W可能是非金属元素,如X为NaHCO3,Y为CO2,Z为Na2CO3时,W为碳元素,A项正确;X可能是氧化物,如X为Al2O3,Y为Al2(SO4)3,Z为NaAlO2,B项正确;Y、Z之间的相互转化方式为加酸或加碱,不可能是氧化还原反应,C项错误;当X为Al(OH)3时,Y为Al2(SO4)3,Z为NaAlO2,Y和Z在溶液中反应可生成X,D项正确。
10.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( A )
序号 物质 杂质 除杂质应选用的试剂或操作方法
① MgCl2溶液 AlCl3 在MgCl2溶液中加过量NaOH溶液搅拌、过滤
② FeSO4溶液 CuSO4 加入过量铁粉并过滤
③ CO2 SO2 依次通过盛有NaOH溶液和浓硫酸的洗气瓶
④ NaNO3 CaCO3 加稀盐酸溶解、过滤、蒸发、结晶
A. ② B.①②
C.②③ D.①②③④
解析 MgCl2和AlCl3均与氢氧化钠溶液反应,过量NaOH溶液不能用于除去MgCl2溶液中的AlCl3杂质,故①错误;FeSO4与铁粉不反应,CuSO4与铁粉反应生成单质铜和FeSO4,则过量铁粉可以除去FeSO4溶液中的CuSO4杂质,故②正确;CO2和SO2均为酸性气体,都能与氢氧化钠溶液反应,不能达到除杂的目的,故③错误;NaNO3易溶于水,CaCO3难溶于水,直接加水溶解过滤,再蒸发结晶即可除杂,加入稀盐酸与碳酸钙反应生成可溶于水的氯化钙,引入新杂质,不能达到除杂目的,故④错误。故选A。
11.Al Mn Cu合金的晶胞如图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置。下列说法正确的是( D )
A.Al原子周围等距且最近的Al原子有6个
B.若A原子的分数坐标为(0,0,0),则B原子的分数坐标为
C.Al Mn Cu合金化学式可表示为AlMnCu4
D.沿晶胞对角面的切面图为
解析 题图中与B所表示的Al原子等距离的Al原子有3个,由于还需要考虑前后和左右两个垂直面的情况,因此等距离且最近的Al原子有12个,A错误;B原子位于Cu形成的小立方体体心,+×=,B原子的分数坐标为,B错误;由于4个Mn原子和4个Al原子均在晶胞内,所以整个晶胞共包括4个Mn原子和4个Al原子,由于8个Cu原子在顶点,12个在棱上,6个在面上,1个在晶胞内部,所以晶胞共分摊Cu:8×+12×+6×+1×1=8个,Cu∶Al∶Mn=8∶4∶4=2∶1∶1,化学式为AlMnCu2,C错误。
12.已知N2O4(g)2NO2(g) ΔH>0,平衡体系中气体的平均摩尔质量()在不同温度下随压强p的变化曲线如图所示。下列说法正确的是( C )
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:va<vb
D.当=69 g·mol-1时,n(NO2)∶n(N2O4)=2∶1
解析 反应物和生成物均为气体,总质量不变,平衡正向移动时气体的物质的量增大,则减小,逆向移动时增大,该反应为气体物质的量增大的吸热反应,所以升高温度、减小压强可以使平衡正向移动,减小;降低温度、增大压强可以使平衡逆向移动,增大。A项,由分析可知T2<T1,错误;B项,a点和c点是在同一温度下的平衡常数,所以K(a)=K(c),错误;C项,温度越高,反应速率越快,压强越大,反应速率越快,根据前面分析可知T2<T1,图中b点压强大于a点,所以va<vb,正确;D项,设n(NO2)∶n(N2O4)=x∶y,则有=69,所以x∶y=1∶1,错误。
13.一定温度、压强下,CH3—CH===CH2(g)与HCl(g)反应可以生成CH3CHClCH3(g)和CH3CH2CH2Cl(g),反应中的能量变化如图所示。下列说法不正确的是( D )
A.生成CH3CH2CH2Cl(g)的反应中,第一步为反应的决速步
B.短时间内,CH3CHClCH3(g)是主产物
C.升高温度达平衡时,可以提高产物中CH3CH2CH2Cl(g)的比例
D.CH3—CH===CH2(g)+HCl(g)CH3CH2CH2Cl(g)的焓变等于第一步与第二步正反应活化能的差值
解析 生成CH3CH2CH2Cl(g)的反应中,第一步反应活化能高,是决速步,故A正确;短时间内,生成CH3CHClCH3(g)的反应活化能低,反应速率快,因此CH3CHClCH3(g)是主产物,故B正确;CH3CHClCH3(g)CH3CH2CH2Cl(g) ΔH>0,升高温度有利于平衡正向移动,可以提高产物中CH3CH2CH2Cl(g)的比例,故C正确;CH3—CH===CH2(g)+HCl(g)CH3CH2CH2Cl(g)的焓变等于第一步与第二步反应的ΔH的代数和,故D错误。
14.双极膜电解法制巯基乙酸(HSCH2COOH)和高纯NaOH溶液原理如图所示,其中a、b为离子交换膜,双极膜在直流电压下可解离出H+和OH-。下列说法正确的是( A )
A.膜a和膜b均为阳离子交换膜
B.双极膜解离出的H+在双极膜的右侧
C.碱室1和碱室2的NaOH溶液可以循环使用,电解过程不产生其他副产物
D.若将盐室的原料换成Na2SO4溶液,当外电路通过2 mol e-时,可生成2 mol H2SO4
解析 根据装置图可知,该装置为电解池装置,根据电解原理,左边电极为阴极,电极反应式为2H2O+2e-===H2↑+2OH-,HSCH2COONa中Na+向阴极移动,膜a为阳离子交换膜,右边电极为阳极,电极反应式为4OH--4e-===O2↑+2H2O,碱室2中Na+向左移,膜b为阳离子交换膜。由以上分析可知,膜a、b均为阳离子交换膜,故A正确;双极膜解离出的H+在双极膜的左侧,故B错误;碱室1和碱室2的NaOH溶液可循环使用,副产物还有氢气和氧气,故C错误;外电路有2 mol电子通过,盐室中有2 mol Na+移向碱室1,双极膜中有2 mol H+移向盐室,即得到1 mol H2SO4,故D错误。
15.亚砷酸(H3AsO3)作为一种化疗药物,常用于白血病的治疗,其在水溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。下列说法不正确的是( C )
A.②代表H2AsO,0.1 mol·L-1亚砷酸溶液中c(H+)约为10-5.15 mol·L-1
B.等浓度的H3AsO3与NaOH等体积混合,所得溶液中水的电离受到促进
C.以酚酞为指示剂,将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为H3AsO3+2OH-===HAsO+2H2O
D.b点溶液中c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)+c(Na+)
解析 用NaOH溶液滴定H3AsO3时,随pH不断增大,H3AsO3H2AsO+H+、H2AsOHAsO+H+、HAsOAsO+H+的平衡正向移动,因此物质的量分数:H3AsO3减小、H2AsO先增后减、HAsO先增后减、AsO增大,H2AsO先于HAsO出现,结合图像可得曲线①为H3AsO3,曲线②为H2AsO,曲线③为HAsO,曲线④为AsO。由以上分析可知,②代表H2AsO,根据a(9.3,0.5)可得c(H3AsO3)=c(H2AsO),c(H+)=10-9.3 mol·L-1,可计算亚砷酸的Ka1==1×10-9.3,0.1 mol·L-1亚砷酸溶液中c(H2AsO)≈c(H+)、c(H3AsO3)≈0.1 mol·L-1,代入Ka1==1×10-9.3=,解得c(H+)=1×10-5.15 mol·L-1,故A正确;等浓度的H3AsO3与NaOH等体积混合,溶质为NaH2AsO3,则Kh(H2AsO)===1×10-4.7,根据b点得到Ka2==1×10-12.1,因此H2AsO水解程度大于电离程度,促进了水的电离,故B正确;以酚酞为指示剂,将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加,根据图中信息得到溶液为NaH2AsO3,因此该过程中主要反应的离子方程式为H3AsO3+OH-===H2AsO+H2O,故C错误;根据电荷守恒,b点得到c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)+c(Na+),故D正确。
同课章节目录
