选择题综合练(四) (含解析)—2024高考化学 考前冲刺综合练
文档属性
| 名称 | 选择题综合练(四) (含解析)—2024高考化学 考前冲刺综合练 |  | |
| 格式 | doc | ||
| 文件大小 | 572.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-22 21:19:50 | ||
图片预览



文档简介
选择题综合练(四)
1.中国传统文化对人类文明贡献巨大,很早就把化学技术应用到生产、生活中。下列与化学有关的说法不正确的是( )
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.《神农本草经》中提到:“白青[Cu2(OH)2CO3]得铁化为铜”,其中白青属于碱
C.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳机诸药者”,这是利用了KNO3的氧化性
D.《本草经集注》中记载了区分硝石(KNO3)和朴硝(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色试验
2.已知K2Cr2O7+4H2SO4+3H2C2O4===Cr2(SO4)3+6CO2↑+7H2O+K2SO4,设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA
B.0.1 mol·L-1的K2SO4溶液中所含的离子总数为0.3NA
C.1 mol羟基(—OH)和1 mol OH-中所含的质子数和电子数均为9NA
D.若该反应生成标准状况下气体2.24 L,则反应中转移的电子数为0.1NA
3.下列化学用语或图示表达不正确的是( A )
A.AsO的空间结构模型:
B.顺 2 丁烯的分子结构模型:
C.基态铬原子的价层电子排布式:3d54s1
D.过氧化钠的电子式:
4.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
选项 已知 类推
A 将Na加入Fe2(SO4)3溶液中:6H2O+6Na+2Fe3+===2Fe(OH)3↓+6Na++3H2↑ 将Na加入CuSO4溶液中:2H2O+2Na+Cu2+===Cu(OH)2↓+2Na++H2↑
B 向Ca(ClO)2溶液中通入少量CO2:CO2+Ca2++2ClO-+H2O===CaCO3↓+2HClO 向Ca(ClO)2溶液中通入少量SO2:SO2+Ca2++2ClO-+H2O===CaSO3↓+2HClO
C HCl溶液与Fe(OH)3反应:Fe(OH)3+3H+===Fe3++3H2O HI溶液与Fe(OH)3反应:Fe(OH)3+3H+===Fe3++3H2O
D 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O 稀H2SO4与Ba(OH)2溶液反应至中性:H++OH-===H2O
5.高铁酸钾是一种新型、高效、多功能水处理剂,工业上采用向KOH溶液中通入氯气,然后再加入Fe(NO3)3溶液的方法制备K2FeO4,发生反应:
①Cl2+KOH―→KCl+KClO+KClO3+H2O(未配平);
②2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O。
下列说法正确的是( )
A.反应①中每消耗4 mol KOH,会吸收44.8 L Cl2
B.氧化性:K2FeO4>KClO
C.若反应①中n(ClO-)∶n(ClO)=5∶1,则氧化剂与还原剂的物质的量之比为5∶3
D.若反应①的氧化产物只有KClO,则得到0.2 mol K2FeO4时消耗0.6 mol Cl2
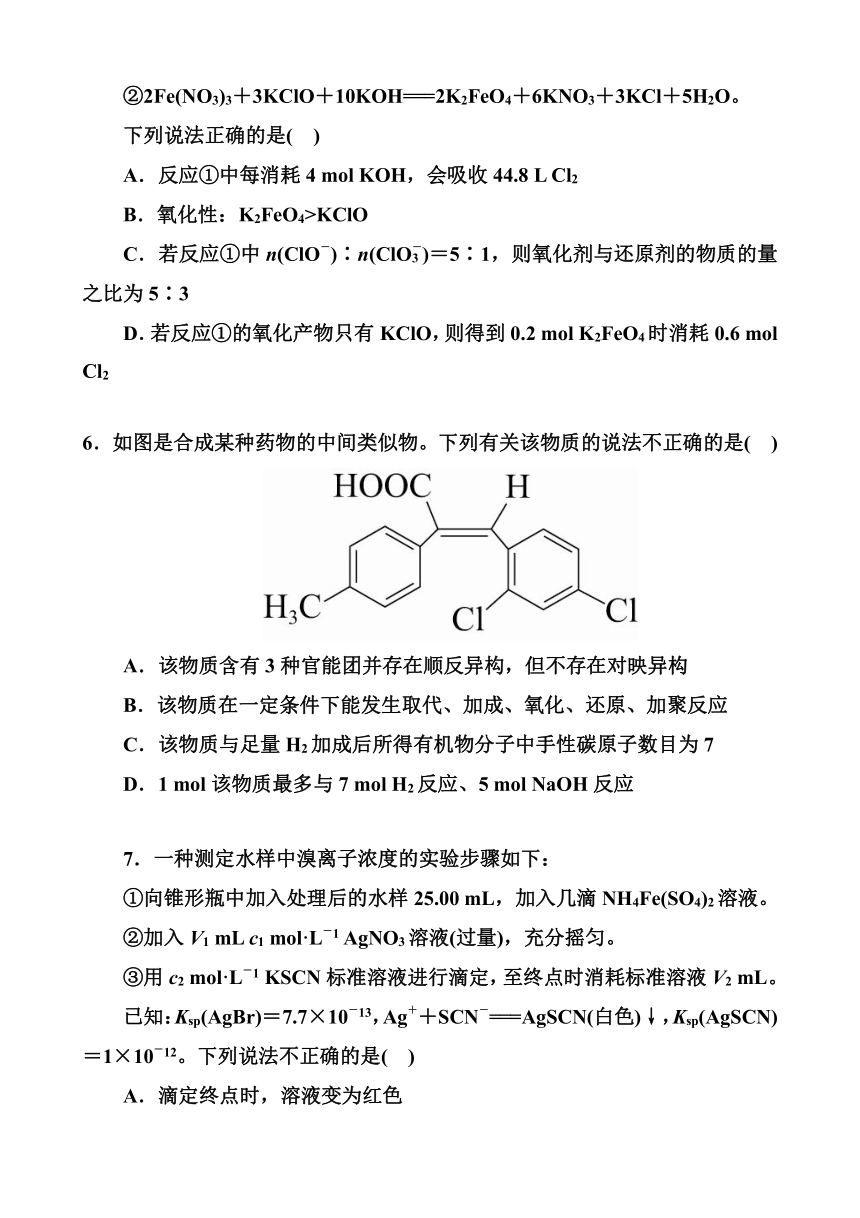
6.如图是合成某种药物的中间类似物。下列有关该物质的说法不正确的是( )
A.该物质含有3种官能团并存在顺反异构,但不存在对映异构
B.该物质在一定条件下能发生取代、加成、氧化、还原、加聚反应
C.该物质与足量H2加成后所得有机物分子中手性碳原子数目为7
D.1 mol该物质最多与7 mol H2反应、5 mol NaOH反应
7.一种测定水样中溴离子浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00 mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1 mL c1 mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2 mol·L-1 KSCN标准溶液进行滴定,至终点时消耗标准溶液V2 mL。
已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-===AgSCN(白色)↓,Ksp(AgSCN)=1×10-12。下列说法不正确的是( )
A.滴定终点时,溶液变为红色
B.该水样中溴离子浓度为c(Br-)= mol·L-1
C.AgBr(s)+SCN-(aq)AgSCN(s)+Br-(aq)的平衡常数K=0.77
D.该实验需要严格控制水样的pH,若pH过高,则测定结果将偏高
8.铜金合金可作为CO2转化为碳氢化合物的催化剂,如图是一种铜金合金的晶胞结构图。下列说法正确的是( )
A.该晶胞的体积为a3×10-36 cm3
B.Au和Cu原子数之比为3∶1
C.与Au最邻近的Cu原子数为12
D.Au和Cu之间的最短距离为a pm
9.短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同主族,X原子的最外层电子数是Y原子最外层电子数的6倍。甲、乙、丙分别为W、X、Z的单质,A、B、C是由W、X、Z形成的二元化合物,上述物质的转化关系如图所示(反应条件略去)。下列说法错误的是( )
A.原子半径:Y>Z>W>X
B.工业上可利用反应①制备丙
C.A、B、C均能与Y的最高价氧化物对应的水化物反应
D.X、Y、Z三种元素形成的一种化合物的水溶液可作防火剂
10.氮及其化合物的“价类”二维图如下所示。
下列说法正确的是( )
A.X可通过加热氯化铵固体制取
B.从物质类别角度分析,P和Z都属于酸性氧化物
C.将X转化为Q的过程,属于氮的固定
D.浓的Y溶液保存在棕色试剂瓶中,并置于冷暗处
11.由下列实验操作及现象能得出相应结论的是( )
选项 实验操作 实验现象 实验结论
A 向盛有浓HNO3的两支试管中分别加入除去氧化膜的镁带和铝片 加入镁带的试管中迅速产生红棕色气体;加入铝片的试管中无明显现象 金属活泼性:Mg>Al
B 向BaCl2溶液中通入SO2和气体X 产生白色沉淀 气体X一定为氧化剂
C 将苯、液溴、铁粉混合物反应产生的气体通入AgNO3溶液中 生成淡黄色沉淀 证明苯与液溴在Fe催化下发生取代反应
D 一块除去铁锈的铁片上滴一滴铁氰化钾溶液,静置2~3 min 生成蓝色沉淀 铁片上可能发生了电化学腐蚀
12.甲酸(HCOOH)具有液氢储存材料和清洁制氢的巨大潜力,产生氢气的反应为HCOOH(g)CO2(g)+H2(g),在T ℃时,向体积不等的恒容密闭容器中分别加入一定量的HCOOH(g),反应相同时间,测得各容器中甲酸的转化率与容器体积的关系如图所示,其中m、n点反应达平衡。下列说法正确的是( )
A.m、p两点中,甲酸的浓度:m>p
B.V1∶V2=1∶10
C.n点时再充入一定量HCOOH(g),达平衡时甲酸的转化率升高
D.p点时H2的体积分数为
13.已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,I表示中间体。下列说法正确的是( A )
A.化合物A与H2O之间的碰撞不均为有效碰撞
B.该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1
C.使用更高效的催化剂可降低反应所需的活化能和反应热
D.升高温度,有利于该反应正向进行
14.点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入金属内部的腐蚀形态。某铁合金钝化膜破损后的孔蚀如图,下列说法正确的是( )
A.为防止孔蚀发生可以将外接电源正极与金属相连
B.蚀孔外每吸收2.24 L O2,可氧化0.2 mol Fe
C.由于孔隙中Fe3+水解导致电解质酸性增强
D.孔隙中可以发生析氢腐蚀
15.常温下,难溶物Ag2CrO4与BaCrO4在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示:p(CrO)=-lg c(CrO),p(Mn+)=-lg c(Mn+),Mn+表示Ag+或Ba2+。下列说法错误的是( B )
A.K表示Ag2CrO4的溶解平衡曲线
B.常温下,Ag2CrO4的分散系在a点时为悬浊液
C.向c点溶液中加入Na2CrO4饱和溶液,析出BaCrO4固体
D.BaCrO4(s)+2Ag+(aq)Ag2CrO4(s)+Ba2+(aq)的平衡常数K=101.3
选择题综合练(四)
1.中国传统文化对人类文明贡献巨大,很早就把化学技术应用到生产、生活中。下列与化学有关的说法不正确的是( B )
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.《神农本草经》中提到:“白青[Cu2(OH)2CO3]得铁化为铜”,其中白青属于碱
C.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳机诸药者”,这是利用了KNO3的氧化性
D.《本草经集注》中记载了区分硝石(KNO3)和朴硝(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色试验
解析 侯氏制碱法是向饱和的NaCl溶液中通入NH3和CO2,反应生成了溶解度较小的NaHCO3,A正确;白青的化学式为Cu2(OH)2CO3,含有金属阳离子Cu2+,酸根离子CO,同时又含有OH-,故属于碱式盐,B错误;火药发生化学反应时,KNO3中氮元素的化合价降低,被还原,作氧化剂,体现氧化性,C正确;鉴别硝石(KNO3)和朴硝(Na2SO4),利用钾元素和钠元素的焰色不同,钠元素焰色为黄色,钾元素焰色为紫色(透过蓝色钴玻璃),D正确。
2.已知K2Cr2O7+4H2SO4+3H2C2O4===Cr2(SO4)3+6CO2↑+7H2O+K2SO4,设NA为阿伏加德罗常数的值。下列说法正确的是( D )
A.常温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA
B.0.1 mol·L-1的K2SO4溶液中所含的离子总数为0.3NA
C.1 mol羟基(—OH)和1 mol OH-中所含的质子数和电子数均为9NA
D.若该反应生成标准状况下气体2.24 L,则反应中转移的电子数为0.1NA
解析 pH=1的硫酸溶液中c(H+)=0.1 mol·L-1,因此1 L pH=1的硫酸溶液中含有H+物质的量为0.1 mol,则该溶液中H+数目为0.1NA,故A错误;没有指明溶液的体积,无法计算离子的物质的量,故B错误;1 mol —OH、1 mol OH-所含的质子的物质的量均为9 mol,所含电子的物质的量分别为9 mol、10 mol,故C错误;根据反应方程式,CO2为氧化产物,生成标准状况下CO2的体积为2.24 L,转移电子物质的量为×1=0.1 mol,故D正确。
3.下列化学用语或图示表达不正确的是( A )
A.AsO的空间结构模型:
B.顺 2 丁烯的分子结构模型:
C.基态铬原子的价层电子排布式:3d54s1
D.过氧化钠的电子式:
解析 AsO中As原子的价层电子对数是4,空间结构为正四面体,故A错误。
4.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( A )
选项 已知 类推
A 将Na加入Fe2(SO4)3溶液中:6H2O+6Na+2Fe3+===2Fe(OH)3↓+6Na++3H2↑ 将Na加入CuSO4溶液中:2H2O+2Na+Cu2+===Cu(OH)2↓+2Na++H2↑
B 向Ca(ClO)2溶液中通入少量CO2:CO2+Ca2++2ClO-+H2O===CaCO3↓+2HClO 向Ca(ClO)2溶液中通入少量SO2:SO2+Ca2++2ClO-+H2O===CaSO3↓+2HClO
C HCl溶液与Fe(OH)3反应:Fe(OH)3+3H+===Fe3++3H2O HI溶液与Fe(OH)3反应:Fe(OH)3+3H+===Fe3++3H2O
D 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O 稀H2SO4与Ba(OH)2溶液反应至中性:H++OH-===H2O
解析 将Na加入Fe2(SO4)3溶液中,钠先与水反应生成氢氧化钠,氢氧化钠再与Fe2(SO4)3发生复分解反应,Na加入CuSO4溶液中,也发生类似反应,A正确;向Ca(ClO)2溶液中通入少量SO2,二氧化硫具有还原性,会被次氯酸根离子氧化为硫酸根离子,不能生成CaSO3,B错误;HI既有酸性,又有强还原性,I-会与Fe3+反应生成Fe2+与碘单质,C错误;稀H2SO4与Ba(OH)2溶液反应除氢离子与氢氧根离子反应生成水外,硫酸根离子与钡离子也发生了反应,D错误。
5.高铁酸钾是一种新型、高效、多功能水处理剂,工业上采用向KOH溶液中通入氯气,然后再加入Fe(NO3)3溶液的方法制备K2FeO4,发生反应:
①Cl2+KOH―→KCl+KClO+KClO3+H2O(未配平);
②2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O。
下列说法正确的是( C )
A.反应①中每消耗4 mol KOH,会吸收44.8 L Cl2
B.氧化性:K2FeO4>KClO
C.若反应①中n(ClO-)∶n(ClO)=5∶1,则氧化剂与还原剂的物质的量之比为5∶3
D.若反应①的氧化产物只有KClO,则得到0.2 mol K2FeO4时消耗0.6 mol Cl2
解析 反应①的生成物有KCl、KClO、KClO3,其中K、Cl元素的物质的量之比为1∶1,所以每消耗4 mol KOH吸收2 mol氯气,题干未告知气体所处的状态,故无法计算2 mol氯气的体积,A错误;根据同一氧化还原反应,氧化剂的氧化性强于氧化产物,而反应②K2FeO4为氧化产物,KClO为氧化剂,则氧化性:K2FeO4<KClO,B错误;设ClO-为5 mol,ClO为1 mol,氯气转化成ClO-、ClO被氧化,转化成KCl被还原,根据得失电子守恒可知,生成KCl的物质的量为5 mol×(1-0)+1 mol×(5-0)=10 mol,则氧化剂与还原剂的物质的量之比为10 mol∶(5 mol+1 mol)=5∶3,C正确;根据得失电子守恒可得关系式:2K2FeO4~3KClO~3Cl2,则得到0.2 mol K2FeO4时消耗0.3 mol Cl2,D错误。
6.如图是合成某种药物的中间类似物。下列有关该物质的说法不正确的是( C )
A.该物质含有3种官能团并存在顺反异构,但不存在对映异构
B.该物质在一定条件下能发生取代、加成、氧化、还原、加聚反应
C.该物质与足量H2加成后所得有机物分子中手性碳原子数目为7
D.1 mol该物质最多与7 mol H2反应、5 mol NaOH反应
解析 该物质含有3种官能团,分别是羧基、碳碳双键和氯原子;碳碳双键连接了四个不同的原子或基团,则该物质存在顺反异构;该物质不存在手性碳原子,故该物质不存在对映异构,A正确。该物质含有羧基和甲基,可以发生取代反应;含有碳碳双键,可以发生加成、氧化、还原、加聚反应,B正确。该物质与足量H2加成所得有机物分子为,其手性碳原子(标有“”)如图所示,共有4个,C错误。1 mol该物质含有1 mol碳碳双键和2 mol苯环,1 mol该物质最多可以和7 mol H2发生反应;1 mol该物质含有1 mol羧基和2 mol苯环上的氯原子,苯环上的氯原子和NaOH反应后生成的酚羟基会继续消耗NaOH,故1 mol该物质最多与5 mol NaOH反应,D正确。
7.一种测定水样中溴离子浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00 mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1 mL c1 mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2 mol·L-1 KSCN标准溶液进行滴定,至终点时消耗标准溶液V2 mL。
已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-===AgSCN(白色)↓,Ksp(AgSCN)=1×10-12。下列说法不正确的是( D )
A.滴定终点时,溶液变为红色
B.该水样中溴离子浓度为c(Br-)= mol·L-1
C.AgBr(s)+SCN-(aq)AgSCN(s)+Br-(aq)的平衡常数K=0.77
D.该实验需要严格控制水样的pH,若pH过高,则测定结果将偏高
解析 加入几滴NH4Fe(SO4)2指示剂,滴定终点时,KSCN过量,会与铁离子反应,因此溶液变为红色,故A正确;25.00 mL水样中Br-物质的量n(Br-)=V1×10-3 L×c1 mol·L-1-V2 ×10-3 L×c2 mol·L-1=(V1c1-V2c2)×10-3 mol,因此该水样中溴离子浓度为c(Br-)= mol·L-1,故B正确;AgBr(s)+SCN-(aq)AgSCN(s)+Br-(aq)的平衡常数K====0.77,故C正确;该实验需要严格控制水样的pH,若pH过高,银离子会与氢氧根离子反应,则得到的溴离子物质的量减少,则测定结果将偏低,故D错误。
8.铜金合金可作为CO2转化为碳氢化合物的催化剂,如图是一种铜金合金的晶胞结构图。下列说法正确的是( C )
A.该晶胞的体积为a3×10-36 cm3
B.Au和Cu原子数之比为3∶1
C.与Au最邻近的Cu原子数为12
D.Au和Cu之间的最短距离为a pm
解析 晶胞参数为a pm,即a×10-10 cm,则晶胞体积为a3×10-30 cm3,A错误;晶胞中,Au的个数为8×=1,Cu的个数为6×=3,则Au和Cu原子数之比为1∶3,B错误;由题图可知,与Au最邻近的Cu原子数为12,C正确;由题图可知,Au和Cu之间的最短距离是面对角线的一半,即a pm,D错误。
9.短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同主族,X原子的最外层电子数是Y原子最外层电子数的6倍。甲、乙、丙分别为W、X、Z的单质,A、B、C是由W、X、Z形成的二元化合物,上述物质的转化关系如图所示(反应条件略去)。下列说法错误的是( C )
A.原子半径:Y>Z>W>X
B.工业上可利用反应①制备丙
C.A、B、C均能与Y的最高价氧化物对应的水化物反应
D.X、Y、Z三种元素形成的一种化合物的水溶液可作防火剂
解析 短周期主族元素W、X、Y、Z的原子序数依次增大,X原子的最外层电子数为Y原子最外层电子数的6倍,即X最外层电子数只能为6,Y最外层电子数只能为1,则X为O,Y为Na,乙为O2,W可能为Be、B、C、N,对应同族的Z可能为Mg、Al、Si、P。由题知甲、丙分别为W、Z的单质,A、B、C是由W、X、Z形成的二元化合物,且由题图知B能与O2反应,反应①中A与甲反应生成丙和B,联想W、Z的可能情况,推测B为CO,则C为CO2,即W为C,Z为Si,则甲为C单质,丙为Si单质,由反应2C+ SiO2Si+2CO↑可知,A为SiO2,且满足甲和C反应生成B,即C+CO22CO,推测合理。综上所述W为C、X为O、Y为Na、Z为Si。A项,同周期元素从左向右,原子半径逐渐减小,同主族元素从上向下,原子半径逐渐增大,故原子半径:Na>Si>C>O,正确;B项,工业上可利用反应①制备Si,正确;C项,Y的最高价氧化物对应的水化物为NaOH,SiO2与CO2均能与其反应,但CO与NaOH不反应,错误;D项,Na2SiO3溶液可作防火剂,正确。
10.氮及其化合物的“价类”二维图如下所示。
下列说法正确的是( D )
A.X可通过加热氯化铵固体制取
B.从物质类别角度分析,P和Z都属于酸性氧化物
C.将X转化为Q的过程,属于氮的固定
D.浓的Y溶液保存在棕色试剂瓶中,并置于冷暗处
解析 根据化合价以及所属物质类别可知,X为NH3,Q为NO,Z为NO2,P为N2O5,Y为HNO3,W为NH3·H2O。直接加热氯化铵固体分解生成的HCl和氨气又会反应生成氯化铵,可通过加热氯化铵和氢氧化钙的混合物来制取氨气,A错误;Z为NO2,NO2与碱发生氧化还原反应,生成两种盐,不是酸性氧化物,B错误;氮的固定是指将游离态的氮转化为化合态,X转化为Q的过程是一种化合态转化为另一种化合态,不属于氮的固定,C错误;浓硝酸见光易分解,需保存在棕色试剂瓶中,并置于冷暗处,D正确。
11.由下列实验操作及现象能得出相应结论的是( D )
选项 实验操作 实验现象 实验结论
A 向盛有浓HNO3的两支试管中分别加入除去氧化膜的镁带和铝片 加入镁带的试管中迅速产生红棕色气体;加入铝片的试管中无明显现象 金属活泼性:Mg>Al
B 向BaCl2溶液中通入SO2和气体X 产生白色沉淀 气体X一定为氧化剂
C 将苯、液溴、铁粉混合物反应产生的气体通入AgNO3溶液中 生成淡黄色沉淀 证明苯与液溴在Fe催化下发生取代反应
D 一块除去铁锈的铁片上滴一滴铁氰化钾溶液,静置2~3 min 生成蓝色沉淀 铁片上可能发生了电化学腐蚀
解析 常温下,浓硝酸和铝发生钝化,不能说明实验结论,故A错误;向BaCl2溶液中通入SO2和气体X,气体X可以是氧化性气体Cl2、NO2等,此时白色沉淀是硫酸钡,气体X也可以是碱性气体氨气,此时白色沉淀是亚硫酸钡,故B错误;溴单质易挥发,遇水反应生成溴化氢和次溴酸,溴离子可与硝酸银反应生成淡黄色沉淀,不能证明取代反应的发生,故C错误;滴加铁氰化钾溶液生成蓝色沉淀,说明有亚铁离子生成,铁片上可能发生了电化学腐蚀,故D正确。
12.甲酸(HCOOH)具有液氢储存材料和清洁制氢的巨大潜力,产生氢气的反应为HCOOH(g)CO2(g)+H2(g),在T ℃时,向体积不等的恒容密闭容器中分别加入一定量的HCOOH(g),反应相同时间,测得各容器中甲酸的转化率与容器体积的关系如图所示,其中m、n点反应达平衡。下列说法正确的是( A )
A.m、p两点中,甲酸的浓度:m>p
B.V1∶V2=1∶10
C.n点时再充入一定量HCOOH(g),达平衡时甲酸的转化率升高
D.p点时H2的体积分数为
解析 m、p两点甲酸的转化率相等,p点容器体积更大,所以甲酸浓度:m>p,故A正确;在T ℃时,假设充入HCOOH(g)的物质的量为1 mol,m点甲酸的转化率为40%,n点甲酸的转化率为80%,由于温度一样,所以平衡常数K相等,则存在K==,V1∶V2=1∶12,故B错误;n点反应达平衡,再充入一定量HCOOH(g),平衡正向移动,但是甲酸的转化率降低,故C错误;在T ℃时,假设充入HCOOH(g)的物质的量为1 mol,p点甲酸的转化率为40%,则p点时H2的体积分数为=,故D错误。
13.已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,I表示中间体。下列说法正确的是( A )
A.化合物A与H2O之间的碰撞不均为有效碰撞
B.该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1
C.使用更高效的催化剂可降低反应所需的活化能和反应热
D.升高温度,有利于该反应正向进行
解析 根据有效碰撞理论可知,化合物A与H2O之间的碰撞不均为有效碰撞,A项正确;该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1-(-1.99 kJ·mol-1)=18.86 kJ·mol-1,B项错误;使用更高效的催化剂可降低反应所需的活化能,但催化剂不能改变反应热,C项错误;由题图知,化合物A与H2O在一定条件下反应生成化合物B与HCOO-为放热反应,升高温度,不利于该反应正向进行,D项错误。
14.点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入金属内部的腐蚀形态。某铁合金钝化膜破损后的孔蚀如图,下列说法正确的是( D )
A.为防止孔蚀发生可以将外接电源正极与金属相连
B.蚀孔外每吸收2.24 L O2,可氧化0.2 mol Fe
C.由于孔隙中Fe3+水解导致电解质酸性增强
D.孔隙中可以发生析氢腐蚀
解析 为防止孔蚀发生可以将外接电源负极与金属相连,A错误;2.24 L O2没有指明是否为标准状况,不一定为0.1 mol O2,B错误;封闭环境中由于Fe2+水解导致酸性增强,C错误;由于孔隙中介质的酸性增强,有HCl存在,可发生析氢腐蚀,D正确。
15.常温下,难溶物Ag2CrO4与BaCrO4在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示:p(CrO)=-lg c(CrO),p(Mn+)=-lg c(Mn+),Mn+表示Ag+或Ba2+。下列说法错误的是( B )
A.K表示Ag2CrO4的溶解平衡曲线
B.常温下,Ag2CrO4的分散系在a点时为悬浊液
C.向c点溶液中加入Na2CrO4饱和溶液,析出BaCrO4固体
D.BaCrO4(s)+2Ag+(aq)Ag2CrO4(s)+Ba2+(aq)的平衡常数K=101.3
解析 假设K表示Ag2CrO4的溶解平衡曲线,根据b点数据可知,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(10-3.5)2×10-4.1=10-11.1,符合图中曲线K起始的数据,因此K为Ag2CrO4的溶解平衡曲线,则L表示BaCrO4的溶解平衡曲线,A正确;a点在K斜线上方,在金属阳离子浓度不变时,纵坐标越大,表示相应的阴离子浓度越小,因此a点Q=c2(Ag+)·c(CrO)<Ksp(Ag2CrO4),因此a点形成的是Ag2CrO4的不饱和溶液,B错误;L表示BaCrO4的溶解平衡曲线,c点为BaCrO4的饱和溶液,若加入Na2CrO4饱和溶液,则c(CrO)增大,由于Ksp不变,BaCrO4固体会析出,最终导致溶液中c(Ba2+)减小,C正确;L表示BaCrO4的溶解平衡曲线,由c(5,4.8)可知,BaCrO4的溶度积常数Ksp=10-(5+4.8)=10-9.8,K为Ag2CrO4的溶解平衡曲线,由b点坐标可知Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(10-3.5)2×10-4.1=10-11.1,BaCrO4(s)+2Ag+(aq)Ag2CrO4(s)+Ba2+(aq)的平衡常数K==== =101.3,D正确。
1.中国传统文化对人类文明贡献巨大,很早就把化学技术应用到生产、生活中。下列与化学有关的说法不正确的是( )
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.《神农本草经》中提到:“白青[Cu2(OH)2CO3]得铁化为铜”,其中白青属于碱
C.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳机诸药者”,这是利用了KNO3的氧化性
D.《本草经集注》中记载了区分硝石(KNO3)和朴硝(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色试验
2.已知K2Cr2O7+4H2SO4+3H2C2O4===Cr2(SO4)3+6CO2↑+7H2O+K2SO4,设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA
B.0.1 mol·L-1的K2SO4溶液中所含的离子总数为0.3NA
C.1 mol羟基(—OH)和1 mol OH-中所含的质子数和电子数均为9NA
D.若该反应生成标准状况下气体2.24 L,则反应中转移的电子数为0.1NA
3.下列化学用语或图示表达不正确的是( A )
A.AsO的空间结构模型:
B.顺 2 丁烯的分子结构模型:
C.基态铬原子的价层电子排布式:3d54s1
D.过氧化钠的电子式:
4.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
选项 已知 类推
A 将Na加入Fe2(SO4)3溶液中:6H2O+6Na+2Fe3+===2Fe(OH)3↓+6Na++3H2↑ 将Na加入CuSO4溶液中:2H2O+2Na+Cu2+===Cu(OH)2↓+2Na++H2↑
B 向Ca(ClO)2溶液中通入少量CO2:CO2+Ca2++2ClO-+H2O===CaCO3↓+2HClO 向Ca(ClO)2溶液中通入少量SO2:SO2+Ca2++2ClO-+H2O===CaSO3↓+2HClO
C HCl溶液与Fe(OH)3反应:Fe(OH)3+3H+===Fe3++3H2O HI溶液与Fe(OH)3反应:Fe(OH)3+3H+===Fe3++3H2O
D 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O 稀H2SO4与Ba(OH)2溶液反应至中性:H++OH-===H2O
5.高铁酸钾是一种新型、高效、多功能水处理剂,工业上采用向KOH溶液中通入氯气,然后再加入Fe(NO3)3溶液的方法制备K2FeO4,发生反应:
①Cl2+KOH―→KCl+KClO+KClO3+H2O(未配平);
②2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O。
下列说法正确的是( )
A.反应①中每消耗4 mol KOH,会吸收44.8 L Cl2
B.氧化性:K2FeO4>KClO
C.若反应①中n(ClO-)∶n(ClO)=5∶1,则氧化剂与还原剂的物质的量之比为5∶3
D.若反应①的氧化产物只有KClO,则得到0.2 mol K2FeO4时消耗0.6 mol Cl2
6.如图是合成某种药物的中间类似物。下列有关该物质的说法不正确的是( )
A.该物质含有3种官能团并存在顺反异构,但不存在对映异构
B.该物质在一定条件下能发生取代、加成、氧化、还原、加聚反应
C.该物质与足量H2加成后所得有机物分子中手性碳原子数目为7
D.1 mol该物质最多与7 mol H2反应、5 mol NaOH反应
7.一种测定水样中溴离子浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00 mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1 mL c1 mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2 mol·L-1 KSCN标准溶液进行滴定,至终点时消耗标准溶液V2 mL。
已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-===AgSCN(白色)↓,Ksp(AgSCN)=1×10-12。下列说法不正确的是( )
A.滴定终点时,溶液变为红色
B.该水样中溴离子浓度为c(Br-)= mol·L-1
C.AgBr(s)+SCN-(aq)AgSCN(s)+Br-(aq)的平衡常数K=0.77
D.该实验需要严格控制水样的pH,若pH过高,则测定结果将偏高
8.铜金合金可作为CO2转化为碳氢化合物的催化剂,如图是一种铜金合金的晶胞结构图。下列说法正确的是( )
A.该晶胞的体积为a3×10-36 cm3
B.Au和Cu原子数之比为3∶1
C.与Au最邻近的Cu原子数为12
D.Au和Cu之间的最短距离为a pm
9.短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同主族,X原子的最外层电子数是Y原子最外层电子数的6倍。甲、乙、丙分别为W、X、Z的单质,A、B、C是由W、X、Z形成的二元化合物,上述物质的转化关系如图所示(反应条件略去)。下列说法错误的是( )
A.原子半径:Y>Z>W>X
B.工业上可利用反应①制备丙
C.A、B、C均能与Y的最高价氧化物对应的水化物反应
D.X、Y、Z三种元素形成的一种化合物的水溶液可作防火剂
10.氮及其化合物的“价类”二维图如下所示。
下列说法正确的是( )
A.X可通过加热氯化铵固体制取
B.从物质类别角度分析,P和Z都属于酸性氧化物
C.将X转化为Q的过程,属于氮的固定
D.浓的Y溶液保存在棕色试剂瓶中,并置于冷暗处
11.由下列实验操作及现象能得出相应结论的是( )
选项 实验操作 实验现象 实验结论
A 向盛有浓HNO3的两支试管中分别加入除去氧化膜的镁带和铝片 加入镁带的试管中迅速产生红棕色气体;加入铝片的试管中无明显现象 金属活泼性:Mg>Al
B 向BaCl2溶液中通入SO2和气体X 产生白色沉淀 气体X一定为氧化剂
C 将苯、液溴、铁粉混合物反应产生的气体通入AgNO3溶液中 生成淡黄色沉淀 证明苯与液溴在Fe催化下发生取代反应
D 一块除去铁锈的铁片上滴一滴铁氰化钾溶液,静置2~3 min 生成蓝色沉淀 铁片上可能发生了电化学腐蚀
12.甲酸(HCOOH)具有液氢储存材料和清洁制氢的巨大潜力,产生氢气的反应为HCOOH(g)CO2(g)+H2(g),在T ℃时,向体积不等的恒容密闭容器中分别加入一定量的HCOOH(g),反应相同时间,测得各容器中甲酸的转化率与容器体积的关系如图所示,其中m、n点反应达平衡。下列说法正确的是( )
A.m、p两点中,甲酸的浓度:m>p
B.V1∶V2=1∶10
C.n点时再充入一定量HCOOH(g),达平衡时甲酸的转化率升高
D.p点时H2的体积分数为
13.已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,I表示中间体。下列说法正确的是( A )
A.化合物A与H2O之间的碰撞不均为有效碰撞
B.该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1
C.使用更高效的催化剂可降低反应所需的活化能和反应热
D.升高温度,有利于该反应正向进行
14.点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入金属内部的腐蚀形态。某铁合金钝化膜破损后的孔蚀如图,下列说法正确的是( )
A.为防止孔蚀发生可以将外接电源正极与金属相连
B.蚀孔外每吸收2.24 L O2,可氧化0.2 mol Fe
C.由于孔隙中Fe3+水解导致电解质酸性增强
D.孔隙中可以发生析氢腐蚀
15.常温下,难溶物Ag2CrO4与BaCrO4在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示:p(CrO)=-lg c(CrO),p(Mn+)=-lg c(Mn+),Mn+表示Ag+或Ba2+。下列说法错误的是( B )
A.K表示Ag2CrO4的溶解平衡曲线
B.常温下,Ag2CrO4的分散系在a点时为悬浊液
C.向c点溶液中加入Na2CrO4饱和溶液,析出BaCrO4固体
D.BaCrO4(s)+2Ag+(aq)Ag2CrO4(s)+Ba2+(aq)的平衡常数K=101.3
选择题综合练(四)
1.中国传统文化对人类文明贡献巨大,很早就把化学技术应用到生产、生活中。下列与化学有关的说法不正确的是( B )
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.《神农本草经》中提到:“白青[Cu2(OH)2CO3]得铁化为铜”,其中白青属于碱
C.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳机诸药者”,这是利用了KNO3的氧化性
D.《本草经集注》中记载了区分硝石(KNO3)和朴硝(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色试验
解析 侯氏制碱法是向饱和的NaCl溶液中通入NH3和CO2,反应生成了溶解度较小的NaHCO3,A正确;白青的化学式为Cu2(OH)2CO3,含有金属阳离子Cu2+,酸根离子CO,同时又含有OH-,故属于碱式盐,B错误;火药发生化学反应时,KNO3中氮元素的化合价降低,被还原,作氧化剂,体现氧化性,C正确;鉴别硝石(KNO3)和朴硝(Na2SO4),利用钾元素和钠元素的焰色不同,钠元素焰色为黄色,钾元素焰色为紫色(透过蓝色钴玻璃),D正确。
2.已知K2Cr2O7+4H2SO4+3H2C2O4===Cr2(SO4)3+6CO2↑+7H2O+K2SO4,设NA为阿伏加德罗常数的值。下列说法正确的是( D )
A.常温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA
B.0.1 mol·L-1的K2SO4溶液中所含的离子总数为0.3NA
C.1 mol羟基(—OH)和1 mol OH-中所含的质子数和电子数均为9NA
D.若该反应生成标准状况下气体2.24 L,则反应中转移的电子数为0.1NA
解析 pH=1的硫酸溶液中c(H+)=0.1 mol·L-1,因此1 L pH=1的硫酸溶液中含有H+物质的量为0.1 mol,则该溶液中H+数目为0.1NA,故A错误;没有指明溶液的体积,无法计算离子的物质的量,故B错误;1 mol —OH、1 mol OH-所含的质子的物质的量均为9 mol,所含电子的物质的量分别为9 mol、10 mol,故C错误;根据反应方程式,CO2为氧化产物,生成标准状况下CO2的体积为2.24 L,转移电子物质的量为×1=0.1 mol,故D正确。
3.下列化学用语或图示表达不正确的是( A )
A.AsO的空间结构模型:
B.顺 2 丁烯的分子结构模型:
C.基态铬原子的价层电子排布式:3d54s1
D.过氧化钠的电子式:
解析 AsO中As原子的价层电子对数是4,空间结构为正四面体,故A错误。
4.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( A )
选项 已知 类推
A 将Na加入Fe2(SO4)3溶液中:6H2O+6Na+2Fe3+===2Fe(OH)3↓+6Na++3H2↑ 将Na加入CuSO4溶液中:2H2O+2Na+Cu2+===Cu(OH)2↓+2Na++H2↑
B 向Ca(ClO)2溶液中通入少量CO2:CO2+Ca2++2ClO-+H2O===CaCO3↓+2HClO 向Ca(ClO)2溶液中通入少量SO2:SO2+Ca2++2ClO-+H2O===CaSO3↓+2HClO
C HCl溶液与Fe(OH)3反应:Fe(OH)3+3H+===Fe3++3H2O HI溶液与Fe(OH)3反应:Fe(OH)3+3H+===Fe3++3H2O
D 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O 稀H2SO4与Ba(OH)2溶液反应至中性:H++OH-===H2O
解析 将Na加入Fe2(SO4)3溶液中,钠先与水反应生成氢氧化钠,氢氧化钠再与Fe2(SO4)3发生复分解反应,Na加入CuSO4溶液中,也发生类似反应,A正确;向Ca(ClO)2溶液中通入少量SO2,二氧化硫具有还原性,会被次氯酸根离子氧化为硫酸根离子,不能生成CaSO3,B错误;HI既有酸性,又有强还原性,I-会与Fe3+反应生成Fe2+与碘单质,C错误;稀H2SO4与Ba(OH)2溶液反应除氢离子与氢氧根离子反应生成水外,硫酸根离子与钡离子也发生了反应,D错误。
5.高铁酸钾是一种新型、高效、多功能水处理剂,工业上采用向KOH溶液中通入氯气,然后再加入Fe(NO3)3溶液的方法制备K2FeO4,发生反应:
①Cl2+KOH―→KCl+KClO+KClO3+H2O(未配平);
②2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O。
下列说法正确的是( C )
A.反应①中每消耗4 mol KOH,会吸收44.8 L Cl2
B.氧化性:K2FeO4>KClO
C.若反应①中n(ClO-)∶n(ClO)=5∶1,则氧化剂与还原剂的物质的量之比为5∶3
D.若反应①的氧化产物只有KClO,则得到0.2 mol K2FeO4时消耗0.6 mol Cl2
解析 反应①的生成物有KCl、KClO、KClO3,其中K、Cl元素的物质的量之比为1∶1,所以每消耗4 mol KOH吸收2 mol氯气,题干未告知气体所处的状态,故无法计算2 mol氯气的体积,A错误;根据同一氧化还原反应,氧化剂的氧化性强于氧化产物,而反应②K2FeO4为氧化产物,KClO为氧化剂,则氧化性:K2FeO4<KClO,B错误;设ClO-为5 mol,ClO为1 mol,氯气转化成ClO-、ClO被氧化,转化成KCl被还原,根据得失电子守恒可知,生成KCl的物质的量为5 mol×(1-0)+1 mol×(5-0)=10 mol,则氧化剂与还原剂的物质的量之比为10 mol∶(5 mol+1 mol)=5∶3,C正确;根据得失电子守恒可得关系式:2K2FeO4~3KClO~3Cl2,则得到0.2 mol K2FeO4时消耗0.3 mol Cl2,D错误。
6.如图是合成某种药物的中间类似物。下列有关该物质的说法不正确的是( C )
A.该物质含有3种官能团并存在顺反异构,但不存在对映异构
B.该物质在一定条件下能发生取代、加成、氧化、还原、加聚反应
C.该物质与足量H2加成后所得有机物分子中手性碳原子数目为7
D.1 mol该物质最多与7 mol H2反应、5 mol NaOH反应
解析 该物质含有3种官能团,分别是羧基、碳碳双键和氯原子;碳碳双键连接了四个不同的原子或基团,则该物质存在顺反异构;该物质不存在手性碳原子,故该物质不存在对映异构,A正确。该物质含有羧基和甲基,可以发生取代反应;含有碳碳双键,可以发生加成、氧化、还原、加聚反应,B正确。该物质与足量H2加成所得有机物分子为,其手性碳原子(标有“”)如图所示,共有4个,C错误。1 mol该物质含有1 mol碳碳双键和2 mol苯环,1 mol该物质最多可以和7 mol H2发生反应;1 mol该物质含有1 mol羧基和2 mol苯环上的氯原子,苯环上的氯原子和NaOH反应后生成的酚羟基会继续消耗NaOH,故1 mol该物质最多与5 mol NaOH反应,D正确。
7.一种测定水样中溴离子浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00 mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1 mL c1 mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2 mol·L-1 KSCN标准溶液进行滴定,至终点时消耗标准溶液V2 mL。
已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-===AgSCN(白色)↓,Ksp(AgSCN)=1×10-12。下列说法不正确的是( D )
A.滴定终点时,溶液变为红色
B.该水样中溴离子浓度为c(Br-)= mol·L-1
C.AgBr(s)+SCN-(aq)AgSCN(s)+Br-(aq)的平衡常数K=0.77
D.该实验需要严格控制水样的pH,若pH过高,则测定结果将偏高
解析 加入几滴NH4Fe(SO4)2指示剂,滴定终点时,KSCN过量,会与铁离子反应,因此溶液变为红色,故A正确;25.00 mL水样中Br-物质的量n(Br-)=V1×10-3 L×c1 mol·L-1-V2 ×10-3 L×c2 mol·L-1=(V1c1-V2c2)×10-3 mol,因此该水样中溴离子浓度为c(Br-)= mol·L-1,故B正确;AgBr(s)+SCN-(aq)AgSCN(s)+Br-(aq)的平衡常数K====0.77,故C正确;该实验需要严格控制水样的pH,若pH过高,银离子会与氢氧根离子反应,则得到的溴离子物质的量减少,则测定结果将偏低,故D错误。
8.铜金合金可作为CO2转化为碳氢化合物的催化剂,如图是一种铜金合金的晶胞结构图。下列说法正确的是( C )
A.该晶胞的体积为a3×10-36 cm3
B.Au和Cu原子数之比为3∶1
C.与Au最邻近的Cu原子数为12
D.Au和Cu之间的最短距离为a pm
解析 晶胞参数为a pm,即a×10-10 cm,则晶胞体积为a3×10-30 cm3,A错误;晶胞中,Au的个数为8×=1,Cu的个数为6×=3,则Au和Cu原子数之比为1∶3,B错误;由题图可知,与Au最邻近的Cu原子数为12,C正确;由题图可知,Au和Cu之间的最短距离是面对角线的一半,即a pm,D错误。
9.短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同主族,X原子的最外层电子数是Y原子最外层电子数的6倍。甲、乙、丙分别为W、X、Z的单质,A、B、C是由W、X、Z形成的二元化合物,上述物质的转化关系如图所示(反应条件略去)。下列说法错误的是( C )
A.原子半径:Y>Z>W>X
B.工业上可利用反应①制备丙
C.A、B、C均能与Y的最高价氧化物对应的水化物反应
D.X、Y、Z三种元素形成的一种化合物的水溶液可作防火剂
解析 短周期主族元素W、X、Y、Z的原子序数依次增大,X原子的最外层电子数为Y原子最外层电子数的6倍,即X最外层电子数只能为6,Y最外层电子数只能为1,则X为O,Y为Na,乙为O2,W可能为Be、B、C、N,对应同族的Z可能为Mg、Al、Si、P。由题知甲、丙分别为W、Z的单质,A、B、C是由W、X、Z形成的二元化合物,且由题图知B能与O2反应,反应①中A与甲反应生成丙和B,联想W、Z的可能情况,推测B为CO,则C为CO2,即W为C,Z为Si,则甲为C单质,丙为Si单质,由反应2C+ SiO2Si+2CO↑可知,A为SiO2,且满足甲和C反应生成B,即C+CO22CO,推测合理。综上所述W为C、X为O、Y为Na、Z为Si。A项,同周期元素从左向右,原子半径逐渐减小,同主族元素从上向下,原子半径逐渐增大,故原子半径:Na>Si>C>O,正确;B项,工业上可利用反应①制备Si,正确;C项,Y的最高价氧化物对应的水化物为NaOH,SiO2与CO2均能与其反应,但CO与NaOH不反应,错误;D项,Na2SiO3溶液可作防火剂,正确。
10.氮及其化合物的“价类”二维图如下所示。
下列说法正确的是( D )
A.X可通过加热氯化铵固体制取
B.从物质类别角度分析,P和Z都属于酸性氧化物
C.将X转化为Q的过程,属于氮的固定
D.浓的Y溶液保存在棕色试剂瓶中,并置于冷暗处
解析 根据化合价以及所属物质类别可知,X为NH3,Q为NO,Z为NO2,P为N2O5,Y为HNO3,W为NH3·H2O。直接加热氯化铵固体分解生成的HCl和氨气又会反应生成氯化铵,可通过加热氯化铵和氢氧化钙的混合物来制取氨气,A错误;Z为NO2,NO2与碱发生氧化还原反应,生成两种盐,不是酸性氧化物,B错误;氮的固定是指将游离态的氮转化为化合态,X转化为Q的过程是一种化合态转化为另一种化合态,不属于氮的固定,C错误;浓硝酸见光易分解,需保存在棕色试剂瓶中,并置于冷暗处,D正确。
11.由下列实验操作及现象能得出相应结论的是( D )
选项 实验操作 实验现象 实验结论
A 向盛有浓HNO3的两支试管中分别加入除去氧化膜的镁带和铝片 加入镁带的试管中迅速产生红棕色气体;加入铝片的试管中无明显现象 金属活泼性:Mg>Al
B 向BaCl2溶液中通入SO2和气体X 产生白色沉淀 气体X一定为氧化剂
C 将苯、液溴、铁粉混合物反应产生的气体通入AgNO3溶液中 生成淡黄色沉淀 证明苯与液溴在Fe催化下发生取代反应
D 一块除去铁锈的铁片上滴一滴铁氰化钾溶液,静置2~3 min 生成蓝色沉淀 铁片上可能发生了电化学腐蚀
解析 常温下,浓硝酸和铝发生钝化,不能说明实验结论,故A错误;向BaCl2溶液中通入SO2和气体X,气体X可以是氧化性气体Cl2、NO2等,此时白色沉淀是硫酸钡,气体X也可以是碱性气体氨气,此时白色沉淀是亚硫酸钡,故B错误;溴单质易挥发,遇水反应生成溴化氢和次溴酸,溴离子可与硝酸银反应生成淡黄色沉淀,不能证明取代反应的发生,故C错误;滴加铁氰化钾溶液生成蓝色沉淀,说明有亚铁离子生成,铁片上可能发生了电化学腐蚀,故D正确。
12.甲酸(HCOOH)具有液氢储存材料和清洁制氢的巨大潜力,产生氢气的反应为HCOOH(g)CO2(g)+H2(g),在T ℃时,向体积不等的恒容密闭容器中分别加入一定量的HCOOH(g),反应相同时间,测得各容器中甲酸的转化率与容器体积的关系如图所示,其中m、n点反应达平衡。下列说法正确的是( A )
A.m、p两点中,甲酸的浓度:m>p
B.V1∶V2=1∶10
C.n点时再充入一定量HCOOH(g),达平衡时甲酸的转化率升高
D.p点时H2的体积分数为
解析 m、p两点甲酸的转化率相等,p点容器体积更大,所以甲酸浓度:m>p,故A正确;在T ℃时,假设充入HCOOH(g)的物质的量为1 mol,m点甲酸的转化率为40%,n点甲酸的转化率为80%,由于温度一样,所以平衡常数K相等,则存在K==,V1∶V2=1∶12,故B错误;n点反应达平衡,再充入一定量HCOOH(g),平衡正向移动,但是甲酸的转化率降低,故C错误;在T ℃时,假设充入HCOOH(g)的物质的量为1 mol,p点甲酸的转化率为40%,则p点时H2的体积分数为=,故D错误。
13.已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,I表示中间体。下列说法正确的是( A )
A.化合物A与H2O之间的碰撞不均为有效碰撞
B.该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1
C.使用更高效的催化剂可降低反应所需的活化能和反应热
D.升高温度,有利于该反应正向进行
解析 根据有效碰撞理论可知,化合物A与H2O之间的碰撞不均为有效碰撞,A项正确;该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1-(-1.99 kJ·mol-1)=18.86 kJ·mol-1,B项错误;使用更高效的催化剂可降低反应所需的活化能,但催化剂不能改变反应热,C项错误;由题图知,化合物A与H2O在一定条件下反应生成化合物B与HCOO-为放热反应,升高温度,不利于该反应正向进行,D项错误。
14.点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入金属内部的腐蚀形态。某铁合金钝化膜破损后的孔蚀如图,下列说法正确的是( D )
A.为防止孔蚀发生可以将外接电源正极与金属相连
B.蚀孔外每吸收2.24 L O2,可氧化0.2 mol Fe
C.由于孔隙中Fe3+水解导致电解质酸性增强
D.孔隙中可以发生析氢腐蚀
解析 为防止孔蚀发生可以将外接电源负极与金属相连,A错误;2.24 L O2没有指明是否为标准状况,不一定为0.1 mol O2,B错误;封闭环境中由于Fe2+水解导致酸性增强,C错误;由于孔隙中介质的酸性增强,有HCl存在,可发生析氢腐蚀,D正确。
15.常温下,难溶物Ag2CrO4与BaCrO4在水中的沉淀溶解平衡曲线如图所示,若定义其坐标图示:p(CrO)=-lg c(CrO),p(Mn+)=-lg c(Mn+),Mn+表示Ag+或Ba2+。下列说法错误的是( B )
A.K表示Ag2CrO4的溶解平衡曲线
B.常温下,Ag2CrO4的分散系在a点时为悬浊液
C.向c点溶液中加入Na2CrO4饱和溶液,析出BaCrO4固体
D.BaCrO4(s)+2Ag+(aq)Ag2CrO4(s)+Ba2+(aq)的平衡常数K=101.3
解析 假设K表示Ag2CrO4的溶解平衡曲线,根据b点数据可知,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(10-3.5)2×10-4.1=10-11.1,符合图中曲线K起始的数据,因此K为Ag2CrO4的溶解平衡曲线,则L表示BaCrO4的溶解平衡曲线,A正确;a点在K斜线上方,在金属阳离子浓度不变时,纵坐标越大,表示相应的阴离子浓度越小,因此a点Q=c2(Ag+)·c(CrO)<Ksp(Ag2CrO4),因此a点形成的是Ag2CrO4的不饱和溶液,B错误;L表示BaCrO4的溶解平衡曲线,c点为BaCrO4的饱和溶液,若加入Na2CrO4饱和溶液,则c(CrO)增大,由于Ksp不变,BaCrO4固体会析出,最终导致溶液中c(Ba2+)减小,C正确;L表示BaCrO4的溶解平衡曲线,由c(5,4.8)可知,BaCrO4的溶度积常数Ksp=10-(5+4.8)=10-9.8,K为Ag2CrO4的溶解平衡曲线,由b点坐标可知Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(10-3.5)2×10-4.1=10-11.1,BaCrO4(s)+2Ag+(aq)Ag2CrO4(s)+Ba2+(aq)的平衡常数K==== =101.3,D正确。
同课章节目录
