重庆市璧山来凤中学校2023-2024学年高一下学期3月月考化学试卷(含答案)
文档属性
| 名称 | 重庆市璧山来凤中学校2023-2024学年高一下学期3月月考化学试卷(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-22 23:51:24 | ||
图片预览


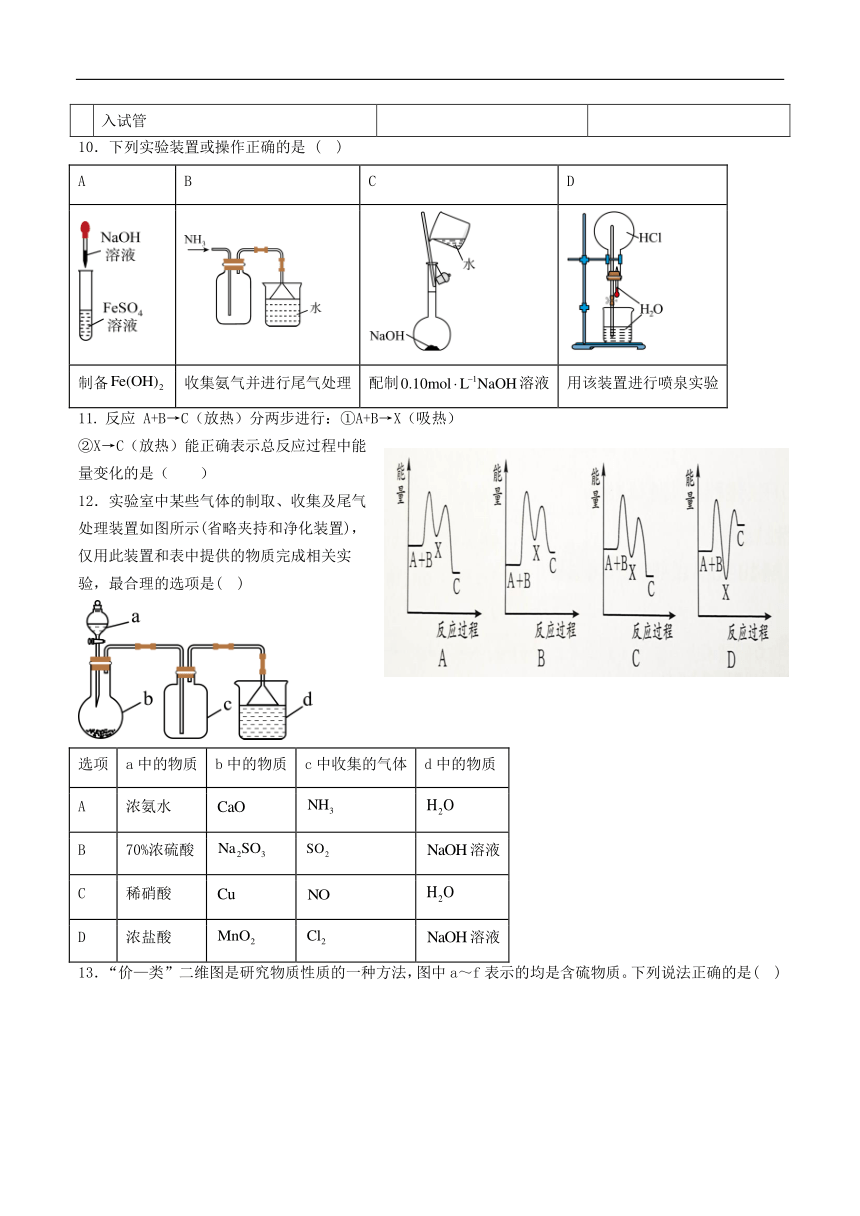
文档简介
高2026届3月考试化学试题
考试时间:75分钟 满分:100分 难度:0.47 区分度:0.29
可能用到的相对原子质量:H- 1 C- 12 N -14 O- 16 Na -23 S -32 Fe- 56 Cu -64 Al-27
第Ⅰ卷(选择题 共42分)
一、选择题(共14题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求。)
1.我国在科技上不断取得重大成果。下列各项中使用的材料不属于无机非金属材料的是( )
A.“神舟十四号”上搭载的石英加速度计 B.“嫦娥五号”探测器使用的砷化镓太阳能电池板 C、双龙头实心铜印章 D.应用于5G手机中的石墨烯导热膜
2.下列污染现象主要与SO2有关的是( )
A.水华 B.臭氧层空洞
C.酸雨 D.白色污染
3.实验室中下列做法正确的是( )
A.氢氟酸保存在棕色玻璃试剂瓶中 B.用剩的白磷放回盛有水的广口瓶中
C.烧碱溶液保存在玻璃塞试剂瓶中 D.浓硝酸保存在带橡胶塞的棕色细口瓶中
4.使用下列装置给液体升温时,将化学能转化为热能的是( )
A.太阳能热水器 B.热水壶
C.天然气燃烧 D.冷水与热水传递热量
5.下列事实可以用同一原理解释的是()
A.SO2、Cl2均能使品红溶液褪色 B.S与铁、铜反应均生成低价态硫化物
C.NH4HCO3晶体、碘固体受热均能变成气体 D.ClO-与S2-、H+在溶液中均不能大量共存
6.蔗糖与浓硫酸发生作用的过程如下图所示:
下列关于该过程的分析错误的是 ( )
A.过程中蔗糖分子发生了化学键的断裂
B.过程②固体体积膨胀,体现了浓硫酸的酸性
C.过程①白色固体变黑,主要体现了浓硫酸的脱水性
D.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的强氧化性
7.为阿伏加德罗常数的值。下列说法正确的是( )
A.、浓硫酸与足量铜加热反应,生成分子的数目为
B.和充分反应转移电子数为
C.常温下,将铝片投入足量的浓硝酸中,铝失去的电子数为
D.标准状况下,与足量的反应,生成的分子数为
8.下列离子方程式书写不正确的是 ( )
A.向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+
B.Cu和浓HNO3反应生成NO2气体:Cu+4H++2=Cu2++2NO2↑+2H2O
C.Ba(OH)2溶液中通入过量CO2:OH-+CO2=
D.少量碳酸氢钠溶液与足量澄清石灰水混合: HCO3- +Ca2++OH-=CaCO3↓+H2O
9.下列实验操作、现象和结论均正确的是( )
实验操作 现象 结论
A 浓硫酸滴入蔗糖中,产生的气体通入澄清石灰水 蔗糖变黑、体积膨胀,澄清石灰水变浑浊 浓硫酸具有脱水性和强氧化性
B 取适量固体于试管中,滴入少量水并用温度计检测 试管内温度上升,结块变为晶体 溶于水放热
C 向溶液中逐滴加入稀氨水至过量 产生白色沉淀,并逐渐增多,后慢慢溶解 碱性:
D 取适量浓硝酸于试管中,将灼热的木炭插入试管 产生红棕色气体 浓硝酸与炭反应产生
10.下列实验装置或操作正确的是 ( )
A B C D
制备 收集氨气并进行尾气处理 配制溶液 用该装置进行喷泉实验
反应 A+B→C(放热)分两步进行:①A+B→X(吸热)
②X→C(放热)能正确表示总反应过程中能量变化的是( )
12.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 a中的物质 b中的物质 c中收集的气体 d中的物质
A 浓氨水
B 70%浓硫酸 溶液
C 稀硝酸
D 浓盐酸 溶液
13.“价—类”二维图是研究物质性质的一种方法,图中a~f表示的均是含硫物质。下列说法正确的是( )
A.a可用硫化亚铁与稀硝酸反应制取
B.可发生反应:(未配平)
C.c能使溴水褪色,证明c有漂白性
D.f既有氧化性又有还原性
14.将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,如图所示,下列说法正确的是 ( )
A.在图示的转化中,化合价不变的元素只有铜
B.由图示的转化可得出的氧化性的强弱顺序是:Fe3+>O2>S
C.回收S的总反应为2H2S+O2=2S+2H2O
D.①②③三步均为氧化还原反应
第II卷(非选择题 共58分)
二、非选择题:本题共4个小题,共58分。
15、(12分)化学反应中会伴随放热和吸热的现象,请回答下列问题:
在人体内,O2与葡萄糖反应生成H2O和CO2的能量变化如右图所示
该反应属于______(填“放热”或“吸热”)反应,
断开氧气分子中的化学键会______(填“放出”或“吸收”)能量,
形成H-O键会______(填“放出”或“吸收”)能量
反应物的总能量______(填“大于”、“小于”或“等于”)生成物的总能量。
(2)某同学进行如下实验,研究化学反应中的热量变化。
反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________(填“放热”或“吸热”)反应,Ba(OH)2·8H2O与NH4Cl的反应是________(填“放热”或“吸热”)反应。
(3)①中反应的离子方程式为________________________,该反应的还原剂是______________(填化学式)。
16.(12分)已知:A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
(1)若A为常见的金属单质,焰色反应呈黄色,X是能使品红溶液褪色的气体,写出D→E的离子方程式为 ________________________。
(2)若A为淡黄色粉末,X为非金属单质,通常为黑色粉末,则与足量的充分反应时,转移电子总数为 ;若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种稀溶液,可选择的试剂为 。(填字母)
a.溶液 b.氨水 c.澄清石灰水 d.溶液
(3)若A、B均为氮的常见氧化物,X是Fe,溶液D加入溶液变红。
①写出加热条件下C的浓溶液与X反应生成D的化学方程式为 。
②检验溶液D中还可能存在的方法是 。
17.(14分)某实验小组利用以下装置制取氨气并探究氨气的性质:
(1)装置A中发生反应的化学方程式为 。
(2)装置B中的干燥剂是 (填名称)。
(3)装置C中的现象是 。
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是 ,发生反应的化学方程式为 。
(5)为防止过量氨气外逸,需在上述装置末端增加尾气吸收装置,应选用的装置是 (填“E”或“F”)。
18.(20分)是硫元素中一种重要物质,在生产生活中有重要用途。
(1)某研究小组用如图装置进行与溶液反应的相关实验(夹持装置已略去)
①通入足量时C中观察到的现象为 。
②根据以上现象,该小组同学认为与溶液发生氧化还原反应。
a.写出与溶液反应的离子方程式: 。
b.该小组同学向C试管反应后的溶液中加入硝酸酸化的溶液,若出现白色沉淀,即可证明反应生成了。该做法 (填“合理”或“不合理”),理由是 。
③为了验证具有还原性,实验中可以代替溶液的试剂有 (填字母)。
A.浓硫酸 B.酸性溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究的性质:(熔点:为,为16.8℃,沸点:为,为45℃)
①装置I模拟工业生产中催化氧化的反应,其化学方程式为 。
②甲同学按I、Ⅱ、Ⅲ、IV的顺序连接装置,装置Ⅲ中溶液逐渐褪色,生成,同时酸性增强,则该反应的离子方程式为(忽略的影响) 。
③乙同学按I、Ⅱ、IV顺序连接装置,若装置IV中有溶液,反应后增重4.8g,则装置IV中发生反应的化学方程式为 。
化学答案
选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
C C B C B B B A D D A B D C
二、非选择题:本题共4个小题,共58分。
15.(12分)
(1)放热 (1分) 吸收(1分) 放出(1分) 大于(1分)
( 2 )放热 (1分) 吸热 (1分)
(3) 2Al+6H+ =2Al3+ +H2 ↑(3分) Al(3分)
16.(12分)
(1)(3分)
(2)(或) (2分) a(2分)
(3) (3分) 取D中适量溶液置于洁净试管中,滴加几滴酸性高锰酸钾溶液,充分反应后褪色,证明溶液中含有,否则无(或用铁氰化钾溶液)(2分)
17.(14分)
(1)(3分)
(2)碱石灰(或生石灰、固体) (2分)
(3)湿润的红色石蕊试纸变蓝(2分)
(4) 有白烟生成 (2分) (3分)
(5)E(2分)
18.(20分)
(1)溶液由棕黄色变成浅绿色 (2分) (3分)
不合理(2分) 可以将氧化成,干扰实验 (2分) BC(2分)
(2) (3分) (3分)(3分)
考试时间:75分钟 满分:100分 难度:0.47 区分度:0.29
可能用到的相对原子质量:H- 1 C- 12 N -14 O- 16 Na -23 S -32 Fe- 56 Cu -64 Al-27
第Ⅰ卷(选择题 共42分)
一、选择题(共14题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求。)
1.我国在科技上不断取得重大成果。下列各项中使用的材料不属于无机非金属材料的是( )
A.“神舟十四号”上搭载的石英加速度计 B.“嫦娥五号”探测器使用的砷化镓太阳能电池板 C、双龙头实心铜印章 D.应用于5G手机中的石墨烯导热膜
2.下列污染现象主要与SO2有关的是( )
A.水华 B.臭氧层空洞
C.酸雨 D.白色污染
3.实验室中下列做法正确的是( )
A.氢氟酸保存在棕色玻璃试剂瓶中 B.用剩的白磷放回盛有水的广口瓶中
C.烧碱溶液保存在玻璃塞试剂瓶中 D.浓硝酸保存在带橡胶塞的棕色细口瓶中
4.使用下列装置给液体升温时,将化学能转化为热能的是( )
A.太阳能热水器 B.热水壶
C.天然气燃烧 D.冷水与热水传递热量
5.下列事实可以用同一原理解释的是()
A.SO2、Cl2均能使品红溶液褪色 B.S与铁、铜反应均生成低价态硫化物
C.NH4HCO3晶体、碘固体受热均能变成气体 D.ClO-与S2-、H+在溶液中均不能大量共存
6.蔗糖与浓硫酸发生作用的过程如下图所示:
下列关于该过程的分析错误的是 ( )
A.过程中蔗糖分子发生了化学键的断裂
B.过程②固体体积膨胀,体现了浓硫酸的酸性
C.过程①白色固体变黑,主要体现了浓硫酸的脱水性
D.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的强氧化性
7.为阿伏加德罗常数的值。下列说法正确的是( )
A.、浓硫酸与足量铜加热反应,生成分子的数目为
B.和充分反应转移电子数为
C.常温下,将铝片投入足量的浓硝酸中,铝失去的电子数为
D.标准状况下,与足量的反应,生成的分子数为
8.下列离子方程式书写不正确的是 ( )
A.向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+
B.Cu和浓HNO3反应生成NO2气体:Cu+4H++2=Cu2++2NO2↑+2H2O
C.Ba(OH)2溶液中通入过量CO2:OH-+CO2=
D.少量碳酸氢钠溶液与足量澄清石灰水混合: HCO3- +Ca2++OH-=CaCO3↓+H2O
9.下列实验操作、现象和结论均正确的是( )
实验操作 现象 结论
A 浓硫酸滴入蔗糖中,产生的气体通入澄清石灰水 蔗糖变黑、体积膨胀,澄清石灰水变浑浊 浓硫酸具有脱水性和强氧化性
B 取适量固体于试管中,滴入少量水并用温度计检测 试管内温度上升,结块变为晶体 溶于水放热
C 向溶液中逐滴加入稀氨水至过量 产生白色沉淀,并逐渐增多,后慢慢溶解 碱性:
D 取适量浓硝酸于试管中,将灼热的木炭插入试管 产生红棕色气体 浓硝酸与炭反应产生
10.下列实验装置或操作正确的是 ( )
A B C D
制备 收集氨气并进行尾气处理 配制溶液 用该装置进行喷泉实验
反应 A+B→C(放热)分两步进行:①A+B→X(吸热)
②X→C(放热)能正确表示总反应过程中能量变化的是( )
12.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 a中的物质 b中的物质 c中收集的气体 d中的物质
A 浓氨水
B 70%浓硫酸 溶液
C 稀硝酸
D 浓盐酸 溶液
13.“价—类”二维图是研究物质性质的一种方法,图中a~f表示的均是含硫物质。下列说法正确的是( )
A.a可用硫化亚铁与稀硝酸反应制取
B.可发生反应:(未配平)
C.c能使溴水褪色,证明c有漂白性
D.f既有氧化性又有还原性
14.将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,如图所示,下列说法正确的是 ( )
A.在图示的转化中,化合价不变的元素只有铜
B.由图示的转化可得出的氧化性的强弱顺序是:Fe3+>O2>S
C.回收S的总反应为2H2S+O2=2S+2H2O
D.①②③三步均为氧化还原反应
第II卷(非选择题 共58分)
二、非选择题:本题共4个小题,共58分。
15、(12分)化学反应中会伴随放热和吸热的现象,请回答下列问题:
在人体内,O2与葡萄糖反应生成H2O和CO2的能量变化如右图所示
该反应属于______(填“放热”或“吸热”)反应,
断开氧气分子中的化学键会______(填“放出”或“吸收”)能量,
形成H-O键会______(填“放出”或“吸收”)能量
反应物的总能量______(填“大于”、“小于”或“等于”)生成物的总能量。
(2)某同学进行如下实验,研究化学反应中的热量变化。
反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________(填“放热”或“吸热”)反应,Ba(OH)2·8H2O与NH4Cl的反应是________(填“放热”或“吸热”)反应。
(3)①中反应的离子方程式为________________________,该反应的还原剂是______________(填化学式)。
16.(12分)已知:A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
(1)若A为常见的金属单质,焰色反应呈黄色,X是能使品红溶液褪色的气体,写出D→E的离子方程式为 ________________________。
(2)若A为淡黄色粉末,X为非金属单质,通常为黑色粉末,则与足量的充分反应时,转移电子总数为 ;若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种稀溶液,可选择的试剂为 。(填字母)
a.溶液 b.氨水 c.澄清石灰水 d.溶液
(3)若A、B均为氮的常见氧化物,X是Fe,溶液D加入溶液变红。
①写出加热条件下C的浓溶液与X反应生成D的化学方程式为 。
②检验溶液D中还可能存在的方法是 。
17.(14分)某实验小组利用以下装置制取氨气并探究氨气的性质:
(1)装置A中发生反应的化学方程式为 。
(2)装置B中的干燥剂是 (填名称)。
(3)装置C中的现象是 。
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是 ,发生反应的化学方程式为 。
(5)为防止过量氨气外逸,需在上述装置末端增加尾气吸收装置,应选用的装置是 (填“E”或“F”)。
18.(20分)是硫元素中一种重要物质,在生产生活中有重要用途。
(1)某研究小组用如图装置进行与溶液反应的相关实验(夹持装置已略去)
①通入足量时C中观察到的现象为 。
②根据以上现象,该小组同学认为与溶液发生氧化还原反应。
a.写出与溶液反应的离子方程式: 。
b.该小组同学向C试管反应后的溶液中加入硝酸酸化的溶液,若出现白色沉淀,即可证明反应生成了。该做法 (填“合理”或“不合理”),理由是 。
③为了验证具有还原性,实验中可以代替溶液的试剂有 (填字母)。
A.浓硫酸 B.酸性溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究的性质:(熔点:为,为16.8℃,沸点:为,为45℃)
①装置I模拟工业生产中催化氧化的反应,其化学方程式为 。
②甲同学按I、Ⅱ、Ⅲ、IV的顺序连接装置,装置Ⅲ中溶液逐渐褪色,生成,同时酸性增强,则该反应的离子方程式为(忽略的影响) 。
③乙同学按I、Ⅱ、IV顺序连接装置,若装置IV中有溶液,反应后增重4.8g,则装置IV中发生反应的化学方程式为 。
化学答案
选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
C C B C B B B A D D A B D C
二、非选择题:本题共4个小题,共58分。
15.(12分)
(1)放热 (1分) 吸收(1分) 放出(1分) 大于(1分)
( 2 )放热 (1分) 吸热 (1分)
(3) 2Al+6H+ =2Al3+ +H2 ↑(3分) Al(3分)
16.(12分)
(1)(3分)
(2)(或) (2分) a(2分)
(3) (3分) 取D中适量溶液置于洁净试管中,滴加几滴酸性高锰酸钾溶液,充分反应后褪色,证明溶液中含有,否则无(或用铁氰化钾溶液)(2分)
17.(14分)
(1)(3分)
(2)碱石灰(或生石灰、固体) (2分)
(3)湿润的红色石蕊试纸变蓝(2分)
(4) 有白烟生成 (2分) (3分)
(5)E(2分)
18.(20分)
(1)溶液由棕黄色变成浅绿色 (2分) (3分)
不合理(2分) 可以将氧化成,干扰实验 (2分) BC(2分)
(2) (3分) (3分)(3分)
同课章节目录
