2024年中考化学专题训练——根据方程式推测化学式(含解析)
文档属性
| 名称 | 2024年中考化学专题训练——根据方程式推测化学式(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 868.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-23 08:35:02 | ||
图片预览


文档简介
2024年中考化学专题训练——根据方程式推测化学式
一、选择题
1.我国古代有卓越的冶金技术。古人会将炉甘石(ZnCO3)和木炭粉混合,加热到高温后可得到金属锌,实验过程中有如下反应发生:①;②。下列有关说法中不正确的是
A.X的化学式为CO2 B.反应前后锌元素质量不变
C.反应①前后各元素化合价均不改变 D.反应②中ZnO发生了氧化反应
2.高铁列车车体材料使用的不锈钢中加入了金属镍增强性能,工业高温上采用火法炼镍的原理是:,下列说法错误的是
A.反应中X的化学式为CO2 B.NiO中Ni的化合价为+2价
C.碳过量时,气体产物中可能有CO D.此反应说明碳具有氧化性
3.2023年10月26日,神舟十七号发射成功,中国再一次实现航天员太空会师。载人航天器中处理CO2的一种方法的原理是,其中X的化学式为
A.O2 B.O3 C.CO D.H2O
4.ClO2是一种高效水处理剂,可由下列反应制备:2NaClO3+SO2+H2SO4=2ClO2+2X,下列说法不正确的是
A.X的化学式为NaHSO4 B.该反应前后元素化合价有变化
C.反应中共涉及到2中氧化物 D.ClO2中氯、氧元素质量比为71∶32
5.锂电池“刀片电池”中的正极材料之一为LiFePO4。生成LiFePO4的反应化学方程式为:2FePO4+6H2C2O4+2LiOH2LiFePO4+7CO2↑+5CO↑+7X。则X的化学式是
A.H2O B.H2O2 C.H3PO4 D.H2CO3
6.超氧化钾KO2常备于急救器和消防员背包中,能迅速与水反应放出氧气,反应的化学方程式为:2KO2+2H2O2=2KOH+X+O2↑,则X的化学式为
A.H2O2 B.H2O C.2H2 D.H2
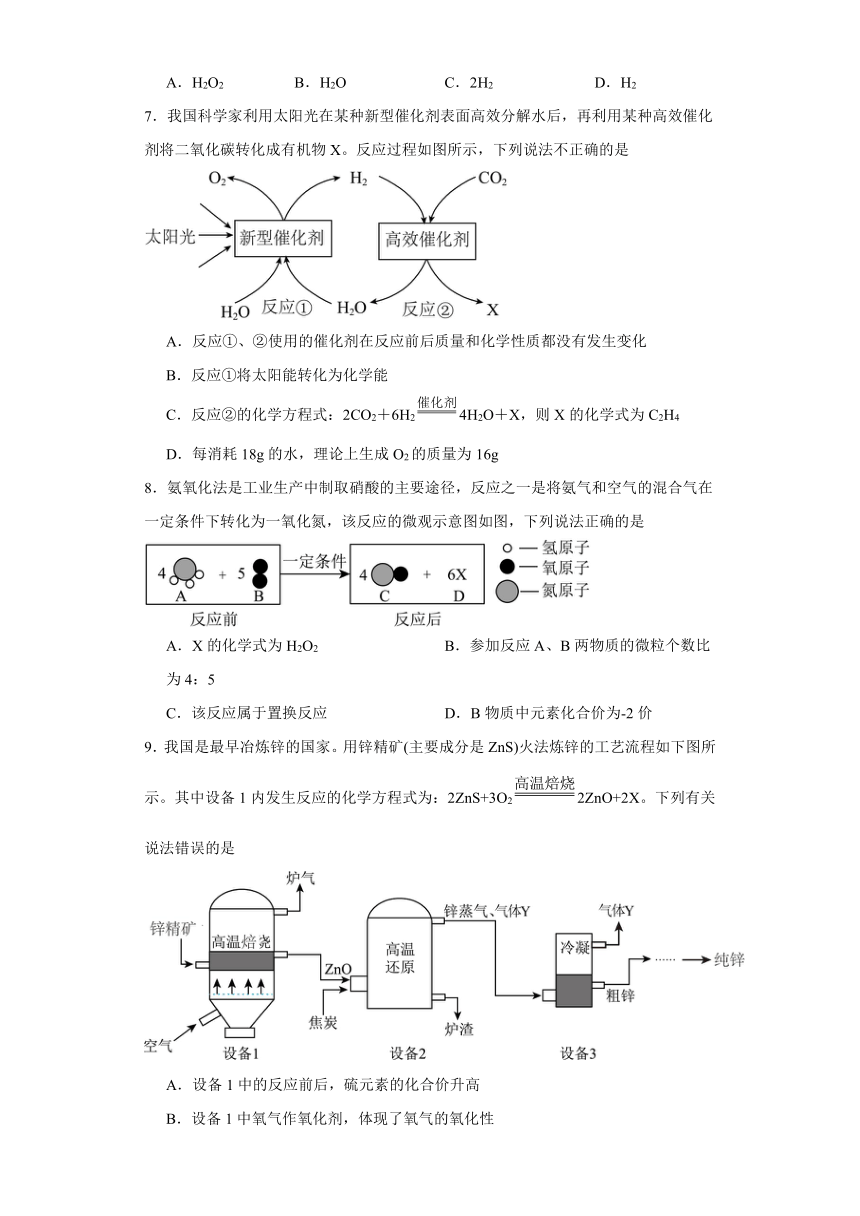
7.我国科学家利用太阳光在某种新型催化剂表面高效分解水后,再利用某种高效催化剂将二氧化碳转化成有机物X。反应过程如图所示,下列说法不正确的是
A.反应①、②使用的催化剂在反应前后质量和化学性质都没有发生变化
B.反应①将太阳能转化为化学能
C.反应②的化学方程式:2CO2+6H24H2O+X,则X的化学式为C2H4
D.每消耗18g的水,理论上生成O2的质量为16g
8.氨氧化法是工业生产中制取硝酸的主要途径,反应之一是将氨气和空气的混合气在一定条件下转化为一氧化氮,该反应的微观示意图如图,下列说法正确的是
A.X的化学式为H2O2 B.参加反应A、B两物质的微粒个数比为4:5
C.该反应属于置换反应 D.B物质中元素化合价为-2价
9.我国是最早冶炼锌的国家。用锌精矿(主要成分是ZnS)火法炼锌的工艺流程如下图所示。其中设备1内发生反应的化学方程式为:2ZnS+3O22ZnO+2X。下列有关说法错误的是
A.设备1中的反应前后,硫元素的化合价升高
B.设备1中氧气作氧化剂,体现了氧气的氧化性
C.设备2中的反应,体现了焦炭和气体Y的还原性
D.设备3中的原理是利用沸点不同将粗锌和气体Y分离
10.将泡腾片[含维生素C、柠檬酸(C6H8O7)和碳酸氢钠]放入水中可看到大量气泡产生;某同学查阅资料后得知,其中一个反应为:。为测定生成物NaxC6H8-xO7化学式中x的数值,用4套相同装置(图1)加等量的水后,分别装入不同质量的柠檬酸和碳酸氢钠固体进行实验,测得该条件下产生的气体体积如表所示。
实验组别 柠檬酸/g 碳酸氢钠/g 气体体积/L
1 1.92 0.84 224
2 1.92 1.68 y
3 1.92 2.52 672
4 1.92 3.36 672
下列有关说法中错误的是
A.反应方程式中的M物质的化学式为:H2O
B.读取量气管数据前若未调节水准管使左右液面相平,测得气体体积将偏大
C.表格中y=448
D.应选用第3组实验的数据进行计算,经计算x=3
二、实验题
11.回答下列问题:
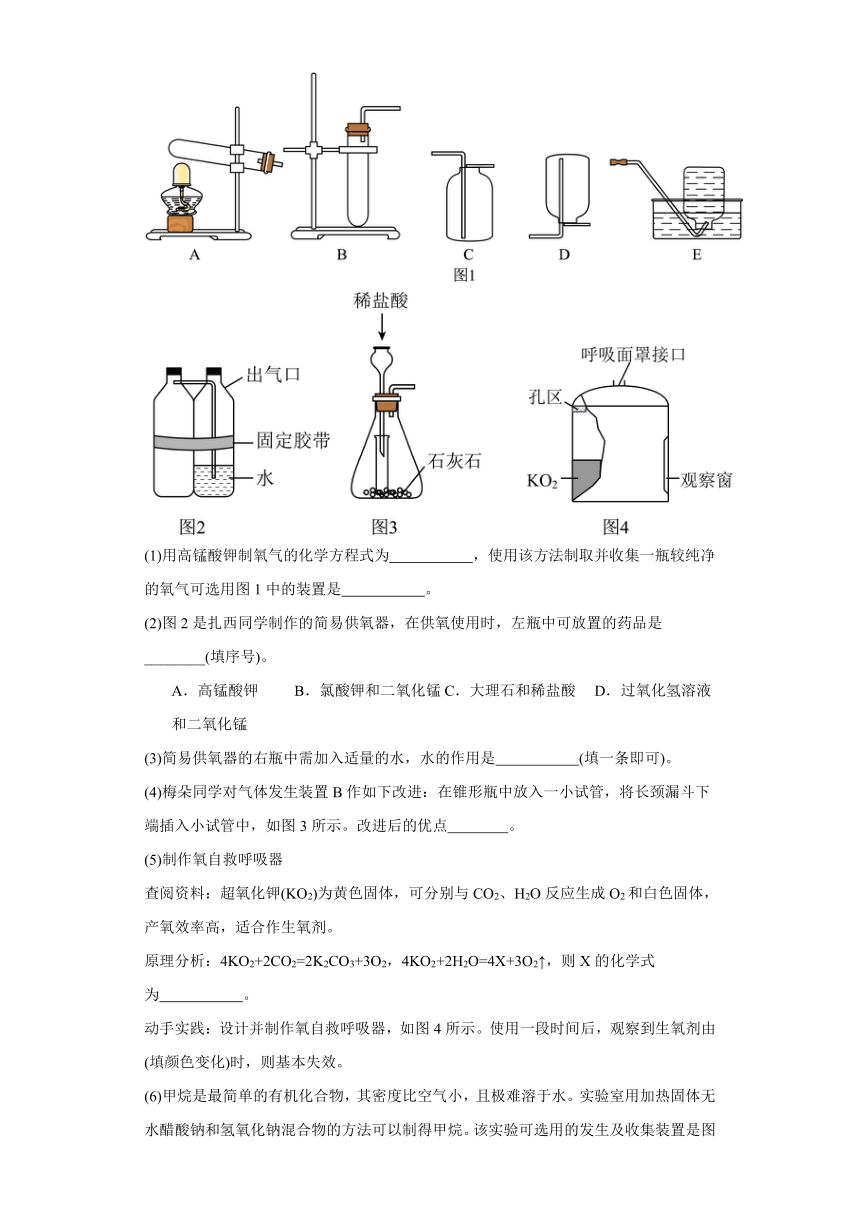
(1)实验室制取O2及性质检验
①图1中仪器a的名称是 。
②用分解H2O2溶液制取O2,应选择图1中的发生装置 (填字母),化学方程式为 。
③收集一瓶O2并进行性质检验。
操作 现象 结论
硫燃烧时, (填字母),生成刺激性气味的气体 a.产生大量白烟 b.生成黑色固体 c.发出蓝紫色火焰 O2具有氧化性
集气瓶中水的作用是 。
(2)制作氧自救呼吸器
查阅资料:超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成O2和白色固体,产氧效率高,适合作生氧剂。
原理分析:4KO2+2CO2=2K2CO3+3O2,4KO2+2H2O=4X+3O2↑,则X的化学式为 。
动手实践:设计并制作氧自救呼吸器、如图2所示。使用一段时间后,观察到生氧剂由 (填颜色变化)时,则基本失效。
12.实验室制取氧气的方法有三种:加热高锰酸钾、在二氧化锰作催化剂的条件下分解过氧化氢、在加热和二氧化锰作催化剂的条件下分解氯酸钾。
(1)用高锰酸钾制氧气的化学方程式为 ,使用该方法制取并收集一瓶较纯净的氧气可选用图1中的装置是 。
(2)图2是扎西同学制作的简易供氧器,在供氧使用时,左瓶中可放置的药品是________(填序号)。
A.高锰酸钾 B.氯酸钾和二氧化锰 C.大理石和稀盐酸 D.过氧化氢溶液和二氧化锰
(3)简易供氧器的右瓶中需加入适量的水,水的作用是 (填一条即可)。
(4)梅朵同学对气体发生装置B作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中,如图3所示。改进后的优点 。
(5)制作氧自救呼吸器
查阅资料:超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成O2和白色固体,产氧效率高,适合作生氧剂。
原理分析:4KO2+2CO2=2K2CO3+3O2,4KO2+2H2O=4X+3O2↑,则X的化学式为 。
动手实践:设计并制作氧自救呼吸器,如图4所示。使用一段时间后,观察到生氧剂由 (填颜色变化)时,则基本失效。
(6)甲烷是最简单的有机化合物,其密度比空气小,且极难溶于水。实验室用加热固体无水醋酸钠和氢氧化钠混合物的方法可以制得甲烷。该实验可选用的发生及收集装置是图1中的 。
三、计算题
13.我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为:2B+6X2B(OH)3+3H2↑,请计算:
(1)X的化学式为 。
(2)若制取12 kg 氢气,理论上需要单质硼的质量。
四、填空与简答
14.化学与生活、生产、科技息息相关,请运用化学知识回答下列问题。
(1)我们身边有很多物质,写出一种你熟悉的物质的化学式 。
(2)“贵州茅台,中国酒界的瑰宝”,打开茅台酒能闻到浓郁的香气,请从微观角度解释其原因 。
(3)厨房常用的加碘盐、补铁酱油。它们中的“碘”、“铁”指的 (填“元素”或“原子”),食盐中加入一定量的 酸钾,碘酸钾在物质类别上属于 (填“单质”或“化合物”),其中碘元素的化合价是 。
(4)2023年杭州亚运会主火炬数字化点燃的全过程惊艳到了所有人,而主火炬燃料首创使用了零碳甲醇,甲醇燃烧的化学方程式:,X的化学式 。
15.化学与生活、科技、能源息息相关。
(1)我国“神舟十七号”载人飞船由长征二号F遥十七运载火箭发射升空。火箭选用偏二甲肼(C2H8N2)和四氧化二氮组成双元动力推进剂,二者发生反应的化学方程式为C2H8N2+2N2O42CO2↑+3N2↑+4X,则X的化学式为 。
(2)第24届冬奥会在北京和张家口成功举办。冰上运动场馆的外墙铺设一种新型的塑料——聚氟乙烯膜[C2H2F2]n,它美观耐用,该材料属于 (选填“金属材料”或“有机合成材料”)。
(3)我国可燃冰开采技术世界领先,将可燃冰进行二次能源开发意义重大。甲烷和水在一定条件下可制备合成气(主要成分是一氧化碳和氢气),该反应的化学方程式为 。
16.阅读下列短文,回答相关问题。
目前我国的能源结构中以煤(高碳)、石油(中碳)、天然气(低碳)为代表的化石燃料仍占主导地位,化石燃料的燃烧在释放热量的同时产生CO2,CO2是最主要的温室气体。低碳、零碳、负碳技术的开发是我国科学家正致力研发的项目。
CO2也是巨大的碳资源。目前,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。根据CO2与其他能源的耦合方式不同,CO2的转化利用技术可分为以下三条途径。
途径1:CO2耦合化石能源的转化利用技术。如CH4与CO2催化重整为H2与CO。
途径2:CO2耦合零碳能源的转化利用技术。如图所示是我国科研团队利用催化剂MoS2实现低温、高效、长寿命催化CO2加氢制甲醇(CH3OH)的工艺。
途径3:CO2直接转化利用技术。如以太阳能或其他可再生能源发电为驱动力,在温和条件下将CO2直接转化为化学原料或燃料。
(1)写出自然界中吸收CO2的一条途径: 。
(2)氢氧燃料电池的能量转化形式是将化学能转化为 。
(3)我国科学家将CO2直接转化成葡萄糖的过程中,第一阶段的反应可表示为:,则R的化学式是 。
(4)写出CO2和H2在MoS2催化剂和加热条件下转化为甲醇(CH3OH)的化学方程式: 。
(5)下列叙述正确的是 (填序号)。
a.H2、CO2与CH3OH在一定条件下可相互转化
b.途径2解决了氢气低成本制取和有效储存的难题
c.能源的开发与利用向“减碳趋氢”的方向发展
试卷第1页,共3页
参考答案:
1.D
【详解】A、根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应②中反应物含C、Zn、O的个数分别是1、2、2,生成物中含C、Zn、O的个数分别是0、2、0,故生成物中还应含1个C、2个O,故X的化学式为:CO2,不符合题意;
B、根据质量守恒定律,化学反应前后,元素质量不变,因此反应前后锌元素质量不变,不符合题意;
C、反应①中,锌元素反应前后的化合价都为+2,氧元素反应前后的化合价都为-2,碳元素反应前后的化合价都为+4,不符合题意;
D、氧化还原反应中,得到氧的物质发生氧化反应,失去氧的物质发生还原反应,氧化锌在反应②中失去氧,发生了还原反应,符合题意。
故选:D。
2.D
【详解】A、依据质量守恒定律可知:化学变化前后原子的个数和种类不变,反应前1个碳原子,2个镍原子,2个氧原子,反应后2个镍原子,则X中含有2个氧原子,1个碳原子,则反应中X化学式为CO2,说法正确;
B、NiO中氧元素化合价为-2,根据化合物化合价代数和为零,故NiO中Ni的化合价为+2价,说法正确;
C、由化学方程式可知,该反应有二氧化碳生成,二氧化碳与碳在高温条件下反应生成一氧化碳,碳过量时,气体产物中可能有CO,说法正确;
D、由化学方程式可知,碳夺走氧化镍中的氧元素,属于还原剂,此反应说明碳具有还原性,说法错误。
故选D。
3.A
【详解】反应前后原子种类不变,等号左边Li、C、O的原子个数比分别为4、2、8,反应后除X外,Li、C、O的原子个数比分别为4、2、6,则X中含有2个氧原子,则化学式为O2,故选A。
4.D
【详解】A、根据质量守恒定律,化学反应前后原子种类和数目不变,反应前有2个Na、2个Cl、12个O、2个S、2个H,反应后有2个Cl、4个O,则2X中有2个Na、8个O、2个S、2个H,X的化学式为NaHSO4,该选项说法正确;
B、根据化合物中各元素正负化合价代数和为零,反应物NaClO3中钠元素化合价是+1,氧元素化合价是-2,则氯元素的化合价为+5,反应物SO2中氧元素显-2价,则硫元素显+4价,生成物ClO2中氧元素显-2价,则氯元素显+4价,生成物NaHSO4中钠元素显+1价,氢元素显+1价,氧元素显-2价,则硫元素显+6价,该反应前后元素化合价有变化,该选项说法正确;
C、氧化物是指由两种元素组成,其中一种是氧元素的化合物,反应中共涉及到SO2、ClO2两种氧化物,该选项说法正确;
D、ClO2中氯、氧元素质量比为35.5:32,该选项说法不正确;
故选:D。
5.A
【详解】反应前后原子的种类和个数不变,等号左边Fe、P、C、Li、H、O的个数分别为2、2、12、2、14、34,等号右边除7X外,Fe、P、C、Li、H、O的个数分别为2、2、12、2、0、27,则7X中含有14个氢原子和7个氧原子,则X的化学式为H2O,故选A。
6.A
【详解】根据质量守恒定律,化学反应前后原子种类和数目不变,反应前有2个K、6个O、4个H,反应后由有2个K、4个O、2个H,故X中含有2个O和2个H,化学式为H2O2;
故选:A。
7.D
【详解】A、催化剂能改变化学反应的速率,而本身的质量和化学性质不变,说法正确;
B、根据反应过程图可知,反应①将太阳能转化为化学能,说法正确;
C、由化学方程式2CO2+6H24H2O+X,可知,反应前碳、氢、氧原子个数分别为2、12、4,反应后的生成物中碳、氢、氧原子个数分别为0、8、4,根据反应前后原子种类、数目不变,则X分子中含有2个碳原子、4个氢原子,物质X的化学式为C2H4,说法正确;
D、根据反应过程图可知,反应①水在太阳光和催化剂作用下生成氢气和氧气,反应②中水又是生成物,在化学过程中能循环使用,,当只有反应①时,水中氧元素全部转化为氧气,生成氧气的质量=,由于反应过程存在反应②每消耗18g的水,理论上生成O2的质量不等于16g,说法错误。
故选D。
8.B
【详解】A、根据质量守恒定律,反应前后原子种类和数目不变,反应前有4个N、12个H、10个O,反应后有4个N、4个O,则6X中含有12个H、6个O,X中含有2个H、1个O,化学式为H2O,故A说法错误;
B、由图可知,参加反应A、B两物质的微粒个数比为4:5,故B说法正确;
C、由A分析可知,该反应为氨气和氢气在一定条件下反应生成一氧化氮和水,该反应的反应物是两种化合物,不属于置换反应,故C说法错误;
D、由图可知,B为H2,属于单质,则B物质中氢元素的化合价为0,故D说法错误;
故选:B。
9.C
【详解】A、设备1中,根据反应前后原子种类和个数不变,则X的化学式为SO2,ZnS中硫元素化合价为-2价,而SO2中硫元素化合价为+4价,则硫元素化合价升高,该选项说法正确;
B、设备1中,氧气提供了氧元素,作氧化剂,同时也体现了氧气的氧化性,该选项说法正确;
C、设备2中,Y为生成物,没有体现其还原性,该选项说法错误;
D、设备3通过冷凝分离锌和气体Y,则原理是利用沸点不同将粗锌和气体Y分离,该选项说法正确。
故选C。
10.B
【详解】A、根据质量守恒定律,化学反应前后原子的种类和个数不变,反应前C:6+x、H:8+x、
O:7+3x、Na:x,反应后:Na:x、C:6+x、H:8-x、O:7+2x,故xM共有O:x、H:2x,M中有O:1、H:2,故M为H2O,正确;
B、反应前后都应调整量气管和水准管液面相平,保持装置内外压强相同,若读数时,量气管中的液面低于水准管的液面,说明内部气压大于大气压,则量气管中气体的体积将偏小,若读数时,量气管中的液面高于水准管的液面,说明内部气压小于大气压,则量气管中气体的体积将偏大,错误;
C、实验1和实验3 对比,说明0.84g碳酸氢钠完全反应生成气体224L,在实验2中,碳酸氢钠为1.68g,故产生气体448L,故y=448,正确;
D、实验3和实验4对比,说明1.92g柠檬酸完全反应生成气体672L
x=3,正确。
故选:B。
11.(1) 锥形瓶 B c 吸收生成的二氧化硫,防止污染空气
(2) KOH 黄色变为白色
【详解】(1)①图1中仪器a的名称是锥形瓶;
②用分解H2O2溶液制取O2,反应条件不需要加热,故发生装置选:B;过氧化氢在二氧化锰的条件下分解生成水和氧气,化学方程式为:;
③硫在氧气中燃烧时,发出蓝紫色火焰,生成刺激性气味的气体,故选:c;集气瓶中水的作用是:吸收生成的二氧化硫,防止污染空气;
(2)①反应前有4K、10O、4H,反应后(X除外)有6O,根据质量守恒定律,则X的化学式为KOH;
②超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成氧气和白色固体KOH,使用一段时间后,观察到生氧剂由黄色变为白色时,则基本失效。
12.(1) 2KMnO4K2MnO4+MnO2+O2↑ AE
(2)D
(3)判断是否有氧气产生(合理即可)
(4)节约药品
(5) KOH 黄色变成白色
(6)AD/AE
【详解】(1)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4K2MnO4+MnO2+O2↑,该反应属于固-固加热型,选择的发生装置为A,氧气的密度比空气大,不易溶于水,可采用向上排空气法或排水法收集,采用排水法收集气体较纯净,选择的收集装置为E,故填:2KMnO4K2MnO4+MnO2+O2↑;AE;
(2)①图2是制作的简易供氧器,该装置不需加热,高锰酸钾、氯酸钾和二氧化锰制取氧气时需要加热,而常用大理石和稀盐酸反应来制取二氧化碳气体,过氧化氢在二氧化锰催化作用下分解生成水和氧气,在供氧使用时,左瓶中可放置的药品是过氧化氢溶液和二氧化锰,故选D;
(3)简易供氧器的右瓶中需加入适量的水,水的作用是可使氧气润湿,且可判断是否有氧气产生,故填:判断是否有氧气产生(合理即可);
(4)在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中,改进后的优点是:能形成液封,防止气体从长颈漏斗中逸出、节约药品等,故填:节约药品;
(5)原理分析:根据质量守恒定律,反应前后原子的种类、数目不变,反应前K、O、H的原子个数分别为4、10、4,反应后K、O、H的原子个数分别为0、6、0,则4X中含有4个钾原子、4个氧原子和4个氢原子,X的化学式为KOH,故填:KOH;
动手实践:超氧化钾为黄色固体,碳酸钾、氢氧化钾均为白色固体,当观察到生氧剂由黄色变为白色,则基本失效,故填:黄色变成白色;
(6)实验室用加热固体无水醋酸钠和氢氧化钠混合物的方法可以制得甲烷,属于固-固加热型,选择的发生装置为A,甲烷密度比空气小,且极难溶于水,可采用向下排空气法或排水法收集,选择的收集装置为D或E,故填:AD或AE。
13.(1)H2O
(2)解:设若制取12kg氢气,理论上需要单质硼的质量为x。
x=44kg
答:若制取12kg氢气,理论上需要单质硼的质量为44kg。
【详解】(1)根据化学方程式可知,反应后有2个硼原子,12个氢原子,6个氧原子,反应前有2个硼原子,故6X中含有12个氢原子,6个氧原子,根据质量守恒定律,化学反应前后原子的种类和个数不变,则一个X分子中含有2个氢原子和一个氧原子,故X的化学式为H2O;
(2)见答案。
14.(1)NaCl、NaOH(合理即可)
(2)分子在不断的运动
(3) 元素 化合物 +5价
(4)CO2
【详解】(1)我们身边有很多物质,如氯化钠,化学式为:NaCl;如烧碱,化学式为:NaOH;
(2)打开茅台酒能闻到浓郁的香气,是因为酒中的香味分子在不断地运动,向四周扩散,使人们闻到酒的香味;
(3)厨房常用的加碘盐、补铁酱油。它们中的“碘”、“铁”指的元素;食盐中加入一定量的 酸钾(KIO3),碘酸钾是由碘钾、氧元素组成的,在物质类别上属于化合物;碘酸钾中钾元素为+1价,氧元素为-2价,根据化合物中各元素化合价代数和为0,设碘元素化合价为x,可列:(+1)+x+(-2)×3=0,x=+5,故碘元素的化合价是+5价;
(4)根据只花了守恒定律可知,化学反应前后原子的种类和数目不变,由化学方程式知,反应前碳、氢、氧的原子分别为:2、8、8,反应后碳、氢、氧的原子分别为:0、8、4,缺少2个碳原子和4个氧原子,X的系数为2,X的化学式为:CO2。
15.(1)H2O
(2)有机合成材料
(3)
【详解】(1)化学方程式左边:碳原子个数2个;氢原子个数8个;氮原子个数6个;氧原子个数8个。化学方程式右边:碳原子个数2个;氧原子个数4个;氮原子个数6个。所以4X中含有氢原子个数8个,含有氧原子个数4个。即X中含有氢原子个数2个,含有氧原子个数1个。所以X的化学式为H2O。故填:H2O。
(2)由于聚氟乙烯膜是一种新型的塑料,塑料属于有机合成材料。故填:有机合成材料。
(3)甲烷和水在一定条件下反应生成一氧化碳和氢气,所以化学方程式为。故填:。
16.(1)植物光合作用
(2)电能
(3)C2H4O2
(4)
(5)abc
【详解】(1)自然界中,绿色植物可以通过光合作用吸收二氧化碳;
(2)氢氧燃料电池的能量转化主要形式是把化学能转化为电能;
(3)根据质量守恒定律,化学反应前后原子种类和个数不变,反应前有2个碳原子、6个氧原子和4个氢原子,反应后有4个氧原子,故R为2个碳原子、4个氢原子和2个氧原子,R的化学式为:C2H4O2;
(4)由流程图可知,CO2和H2在MoS2催化剂和加热条件下转化为甲醇和水,化学方程式为:;
(5)a、由流程图可知,CO2和H2在一定条件下可以转化为甲醇和水,甲醇和水在一定条件下可以反应生成二氧化碳和氢气,所以H2 、CO2与CH3OH在一定条件下可相互转化,说法正确;
b、途径2是催化二氧化碳加氢生成甲醇,使用时,再利用甲醇释放出氢气和二氧化碳,二氧化碳循环利用继续加氢生成甲醇,储存甲醇的成本相比储存氢气要低很多,说法正确;
c、由流程图可知,二氧化碳是作为反应中的循环气体,氢气则是作为产物,所以是尽量减小二氧化碳的排放同时达到生成氢气,可以看出能源的开发与利用是向“减碳趋氢”的方向发展,说法正确;
故选:abc。
答案第1页,共2页
一、选择题
1.我国古代有卓越的冶金技术。古人会将炉甘石(ZnCO3)和木炭粉混合,加热到高温后可得到金属锌,实验过程中有如下反应发生:①;②。下列有关说法中不正确的是
A.X的化学式为CO2 B.反应前后锌元素质量不变
C.反应①前后各元素化合价均不改变 D.反应②中ZnO发生了氧化反应
2.高铁列车车体材料使用的不锈钢中加入了金属镍增强性能,工业高温上采用火法炼镍的原理是:,下列说法错误的是
A.反应中X的化学式为CO2 B.NiO中Ni的化合价为+2价
C.碳过量时,气体产物中可能有CO D.此反应说明碳具有氧化性
3.2023年10月26日,神舟十七号发射成功,中国再一次实现航天员太空会师。载人航天器中处理CO2的一种方法的原理是,其中X的化学式为
A.O2 B.O3 C.CO D.H2O
4.ClO2是一种高效水处理剂,可由下列反应制备:2NaClO3+SO2+H2SO4=2ClO2+2X,下列说法不正确的是
A.X的化学式为NaHSO4 B.该反应前后元素化合价有变化
C.反应中共涉及到2中氧化物 D.ClO2中氯、氧元素质量比为71∶32
5.锂电池“刀片电池”中的正极材料之一为LiFePO4。生成LiFePO4的反应化学方程式为:2FePO4+6H2C2O4+2LiOH2LiFePO4+7CO2↑+5CO↑+7X。则X的化学式是
A.H2O B.H2O2 C.H3PO4 D.H2CO3
6.超氧化钾KO2常备于急救器和消防员背包中,能迅速与水反应放出氧气,反应的化学方程式为:2KO2+2H2O2=2KOH+X+O2↑,则X的化学式为
A.H2O2 B.H2O C.2H2 D.H2
7.我国科学家利用太阳光在某种新型催化剂表面高效分解水后,再利用某种高效催化剂将二氧化碳转化成有机物X。反应过程如图所示,下列说法不正确的是
A.反应①、②使用的催化剂在反应前后质量和化学性质都没有发生变化
B.反应①将太阳能转化为化学能
C.反应②的化学方程式:2CO2+6H24H2O+X,则X的化学式为C2H4
D.每消耗18g的水,理论上生成O2的质量为16g
8.氨氧化法是工业生产中制取硝酸的主要途径,反应之一是将氨气和空气的混合气在一定条件下转化为一氧化氮,该反应的微观示意图如图,下列说法正确的是
A.X的化学式为H2O2 B.参加反应A、B两物质的微粒个数比为4:5
C.该反应属于置换反应 D.B物质中元素化合价为-2价
9.我国是最早冶炼锌的国家。用锌精矿(主要成分是ZnS)火法炼锌的工艺流程如下图所示。其中设备1内发生反应的化学方程式为:2ZnS+3O22ZnO+2X。下列有关说法错误的是
A.设备1中的反应前后,硫元素的化合价升高
B.设备1中氧气作氧化剂,体现了氧气的氧化性
C.设备2中的反应,体现了焦炭和气体Y的还原性
D.设备3中的原理是利用沸点不同将粗锌和气体Y分离
10.将泡腾片[含维生素C、柠檬酸(C6H8O7)和碳酸氢钠]放入水中可看到大量气泡产生;某同学查阅资料后得知,其中一个反应为:。为测定生成物NaxC6H8-xO7化学式中x的数值,用4套相同装置(图1)加等量的水后,分别装入不同质量的柠檬酸和碳酸氢钠固体进行实验,测得该条件下产生的气体体积如表所示。
实验组别 柠檬酸/g 碳酸氢钠/g 气体体积/L
1 1.92 0.84 224
2 1.92 1.68 y
3 1.92 2.52 672
4 1.92 3.36 672
下列有关说法中错误的是
A.反应方程式中的M物质的化学式为:H2O
B.读取量气管数据前若未调节水准管使左右液面相平,测得气体体积将偏大
C.表格中y=448
D.应选用第3组实验的数据进行计算,经计算x=3
二、实验题
11.回答下列问题:
(1)实验室制取O2及性质检验
①图1中仪器a的名称是 。
②用分解H2O2溶液制取O2,应选择图1中的发生装置 (填字母),化学方程式为 。
③收集一瓶O2并进行性质检验。
操作 现象 结论
硫燃烧时, (填字母),生成刺激性气味的气体 a.产生大量白烟 b.生成黑色固体 c.发出蓝紫色火焰 O2具有氧化性
集气瓶中水的作用是 。
(2)制作氧自救呼吸器
查阅资料:超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成O2和白色固体,产氧效率高,适合作生氧剂。
原理分析:4KO2+2CO2=2K2CO3+3O2,4KO2+2H2O=4X+3O2↑,则X的化学式为 。
动手实践:设计并制作氧自救呼吸器、如图2所示。使用一段时间后,观察到生氧剂由 (填颜色变化)时,则基本失效。
12.实验室制取氧气的方法有三种:加热高锰酸钾、在二氧化锰作催化剂的条件下分解过氧化氢、在加热和二氧化锰作催化剂的条件下分解氯酸钾。
(1)用高锰酸钾制氧气的化学方程式为 ,使用该方法制取并收集一瓶较纯净的氧气可选用图1中的装置是 。
(2)图2是扎西同学制作的简易供氧器,在供氧使用时,左瓶中可放置的药品是________(填序号)。
A.高锰酸钾 B.氯酸钾和二氧化锰 C.大理石和稀盐酸 D.过氧化氢溶液和二氧化锰
(3)简易供氧器的右瓶中需加入适量的水,水的作用是 (填一条即可)。
(4)梅朵同学对气体发生装置B作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中,如图3所示。改进后的优点 。
(5)制作氧自救呼吸器
查阅资料:超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成O2和白色固体,产氧效率高,适合作生氧剂。
原理分析:4KO2+2CO2=2K2CO3+3O2,4KO2+2H2O=4X+3O2↑,则X的化学式为 。
动手实践:设计并制作氧自救呼吸器,如图4所示。使用一段时间后,观察到生氧剂由 (填颜色变化)时,则基本失效。
(6)甲烷是最简单的有机化合物,其密度比空气小,且极难溶于水。实验室用加热固体无水醋酸钠和氢氧化钠混合物的方法可以制得甲烷。该实验可选用的发生及收集装置是图1中的 。
三、计算题
13.我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为:2B+6X2B(OH)3+3H2↑,请计算:
(1)X的化学式为 。
(2)若制取12 kg 氢气,理论上需要单质硼的质量。
四、填空与简答
14.化学与生活、生产、科技息息相关,请运用化学知识回答下列问题。
(1)我们身边有很多物质,写出一种你熟悉的物质的化学式 。
(2)“贵州茅台,中国酒界的瑰宝”,打开茅台酒能闻到浓郁的香气,请从微观角度解释其原因 。
(3)厨房常用的加碘盐、补铁酱油。它们中的“碘”、“铁”指的 (填“元素”或“原子”),食盐中加入一定量的 酸钾,碘酸钾在物质类别上属于 (填“单质”或“化合物”),其中碘元素的化合价是 。
(4)2023年杭州亚运会主火炬数字化点燃的全过程惊艳到了所有人,而主火炬燃料首创使用了零碳甲醇,甲醇燃烧的化学方程式:,X的化学式 。
15.化学与生活、科技、能源息息相关。
(1)我国“神舟十七号”载人飞船由长征二号F遥十七运载火箭发射升空。火箭选用偏二甲肼(C2H8N2)和四氧化二氮组成双元动力推进剂,二者发生反应的化学方程式为C2H8N2+2N2O42CO2↑+3N2↑+4X,则X的化学式为 。
(2)第24届冬奥会在北京和张家口成功举办。冰上运动场馆的外墙铺设一种新型的塑料——聚氟乙烯膜[C2H2F2]n,它美观耐用,该材料属于 (选填“金属材料”或“有机合成材料”)。
(3)我国可燃冰开采技术世界领先,将可燃冰进行二次能源开发意义重大。甲烷和水在一定条件下可制备合成气(主要成分是一氧化碳和氢气),该反应的化学方程式为 。
16.阅读下列短文,回答相关问题。
目前我国的能源结构中以煤(高碳)、石油(中碳)、天然气(低碳)为代表的化石燃料仍占主导地位,化石燃料的燃烧在释放热量的同时产生CO2,CO2是最主要的温室气体。低碳、零碳、负碳技术的开发是我国科学家正致力研发的项目。
CO2也是巨大的碳资源。目前,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。根据CO2与其他能源的耦合方式不同,CO2的转化利用技术可分为以下三条途径。
途径1:CO2耦合化石能源的转化利用技术。如CH4与CO2催化重整为H2与CO。
途径2:CO2耦合零碳能源的转化利用技术。如图所示是我国科研团队利用催化剂MoS2实现低温、高效、长寿命催化CO2加氢制甲醇(CH3OH)的工艺。
途径3:CO2直接转化利用技术。如以太阳能或其他可再生能源发电为驱动力,在温和条件下将CO2直接转化为化学原料或燃料。
(1)写出自然界中吸收CO2的一条途径: 。
(2)氢氧燃料电池的能量转化形式是将化学能转化为 。
(3)我国科学家将CO2直接转化成葡萄糖的过程中,第一阶段的反应可表示为:,则R的化学式是 。
(4)写出CO2和H2在MoS2催化剂和加热条件下转化为甲醇(CH3OH)的化学方程式: 。
(5)下列叙述正确的是 (填序号)。
a.H2、CO2与CH3OH在一定条件下可相互转化
b.途径2解决了氢气低成本制取和有效储存的难题
c.能源的开发与利用向“减碳趋氢”的方向发展
试卷第1页,共3页
参考答案:
1.D
【详解】A、根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应②中反应物含C、Zn、O的个数分别是1、2、2,生成物中含C、Zn、O的个数分别是0、2、0,故生成物中还应含1个C、2个O,故X的化学式为:CO2,不符合题意;
B、根据质量守恒定律,化学反应前后,元素质量不变,因此反应前后锌元素质量不变,不符合题意;
C、反应①中,锌元素反应前后的化合价都为+2,氧元素反应前后的化合价都为-2,碳元素反应前后的化合价都为+4,不符合题意;
D、氧化还原反应中,得到氧的物质发生氧化反应,失去氧的物质发生还原反应,氧化锌在反应②中失去氧,发生了还原反应,符合题意。
故选:D。
2.D
【详解】A、依据质量守恒定律可知:化学变化前后原子的个数和种类不变,反应前1个碳原子,2个镍原子,2个氧原子,反应后2个镍原子,则X中含有2个氧原子,1个碳原子,则反应中X化学式为CO2,说法正确;
B、NiO中氧元素化合价为-2,根据化合物化合价代数和为零,故NiO中Ni的化合价为+2价,说法正确;
C、由化学方程式可知,该反应有二氧化碳生成,二氧化碳与碳在高温条件下反应生成一氧化碳,碳过量时,气体产物中可能有CO,说法正确;
D、由化学方程式可知,碳夺走氧化镍中的氧元素,属于还原剂,此反应说明碳具有还原性,说法错误。
故选D。
3.A
【详解】反应前后原子种类不变,等号左边Li、C、O的原子个数比分别为4、2、8,反应后除X外,Li、C、O的原子个数比分别为4、2、6,则X中含有2个氧原子,则化学式为O2,故选A。
4.D
【详解】A、根据质量守恒定律,化学反应前后原子种类和数目不变,反应前有2个Na、2个Cl、12个O、2个S、2个H,反应后有2个Cl、4个O,则2X中有2个Na、8个O、2个S、2个H,X的化学式为NaHSO4,该选项说法正确;
B、根据化合物中各元素正负化合价代数和为零,反应物NaClO3中钠元素化合价是+1,氧元素化合价是-2,则氯元素的化合价为+5,反应物SO2中氧元素显-2价,则硫元素显+4价,生成物ClO2中氧元素显-2价,则氯元素显+4价,生成物NaHSO4中钠元素显+1价,氢元素显+1价,氧元素显-2价,则硫元素显+6价,该反应前后元素化合价有变化,该选项说法正确;
C、氧化物是指由两种元素组成,其中一种是氧元素的化合物,反应中共涉及到SO2、ClO2两种氧化物,该选项说法正确;
D、ClO2中氯、氧元素质量比为35.5:32,该选项说法不正确;
故选:D。
5.A
【详解】反应前后原子的种类和个数不变,等号左边Fe、P、C、Li、H、O的个数分别为2、2、12、2、14、34,等号右边除7X外,Fe、P、C、Li、H、O的个数分别为2、2、12、2、0、27,则7X中含有14个氢原子和7个氧原子,则X的化学式为H2O,故选A。
6.A
【详解】根据质量守恒定律,化学反应前后原子种类和数目不变,反应前有2个K、6个O、4个H,反应后由有2个K、4个O、2个H,故X中含有2个O和2个H,化学式为H2O2;
故选:A。
7.D
【详解】A、催化剂能改变化学反应的速率,而本身的质量和化学性质不变,说法正确;
B、根据反应过程图可知,反应①将太阳能转化为化学能,说法正确;
C、由化学方程式2CO2+6H24H2O+X,可知,反应前碳、氢、氧原子个数分别为2、12、4,反应后的生成物中碳、氢、氧原子个数分别为0、8、4,根据反应前后原子种类、数目不变,则X分子中含有2个碳原子、4个氢原子,物质X的化学式为C2H4,说法正确;
D、根据反应过程图可知,反应①水在太阳光和催化剂作用下生成氢气和氧气,反应②中水又是生成物,在化学过程中能循环使用,,当只有反应①时,水中氧元素全部转化为氧气,生成氧气的质量=,由于反应过程存在反应②每消耗18g的水,理论上生成O2的质量不等于16g,说法错误。
故选D。
8.B
【详解】A、根据质量守恒定律,反应前后原子种类和数目不变,反应前有4个N、12个H、10个O,反应后有4个N、4个O,则6X中含有12个H、6个O,X中含有2个H、1个O,化学式为H2O,故A说法错误;
B、由图可知,参加反应A、B两物质的微粒个数比为4:5,故B说法正确;
C、由A分析可知,该反应为氨气和氢气在一定条件下反应生成一氧化氮和水,该反应的反应物是两种化合物,不属于置换反应,故C说法错误;
D、由图可知,B为H2,属于单质,则B物质中氢元素的化合价为0,故D说法错误;
故选:B。
9.C
【详解】A、设备1中,根据反应前后原子种类和个数不变,则X的化学式为SO2,ZnS中硫元素化合价为-2价,而SO2中硫元素化合价为+4价,则硫元素化合价升高,该选项说法正确;
B、设备1中,氧气提供了氧元素,作氧化剂,同时也体现了氧气的氧化性,该选项说法正确;
C、设备2中,Y为生成物,没有体现其还原性,该选项说法错误;
D、设备3通过冷凝分离锌和气体Y,则原理是利用沸点不同将粗锌和气体Y分离,该选项说法正确。
故选C。
10.B
【详解】A、根据质量守恒定律,化学反应前后原子的种类和个数不变,反应前C:6+x、H:8+x、
O:7+3x、Na:x,反应后:Na:x、C:6+x、H:8-x、O:7+2x,故xM共有O:x、H:2x,M中有O:1、H:2,故M为H2O,正确;
B、反应前后都应调整量气管和水准管液面相平,保持装置内外压强相同,若读数时,量气管中的液面低于水准管的液面,说明内部气压大于大气压,则量气管中气体的体积将偏小,若读数时,量气管中的液面高于水准管的液面,说明内部气压小于大气压,则量气管中气体的体积将偏大,错误;
C、实验1和实验3 对比,说明0.84g碳酸氢钠完全反应生成气体224L,在实验2中,碳酸氢钠为1.68g,故产生气体448L,故y=448,正确;
D、实验3和实验4对比,说明1.92g柠檬酸完全反应生成气体672L
x=3,正确。
故选:B。
11.(1) 锥形瓶 B c 吸收生成的二氧化硫,防止污染空气
(2) KOH 黄色变为白色
【详解】(1)①图1中仪器a的名称是锥形瓶;
②用分解H2O2溶液制取O2,反应条件不需要加热,故发生装置选:B;过氧化氢在二氧化锰的条件下分解生成水和氧气,化学方程式为:;
③硫在氧气中燃烧时,发出蓝紫色火焰,生成刺激性气味的气体,故选:c;集气瓶中水的作用是:吸收生成的二氧化硫,防止污染空气;
(2)①反应前有4K、10O、4H,反应后(X除外)有6O,根据质量守恒定律,则X的化学式为KOH;
②超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成氧气和白色固体KOH,使用一段时间后,观察到生氧剂由黄色变为白色时,则基本失效。
12.(1) 2KMnO4K2MnO4+MnO2+O2↑ AE
(2)D
(3)判断是否有氧气产生(合理即可)
(4)节约药品
(5) KOH 黄色变成白色
(6)AD/AE
【详解】(1)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为2KMnO4K2MnO4+MnO2+O2↑,该反应属于固-固加热型,选择的发生装置为A,氧气的密度比空气大,不易溶于水,可采用向上排空气法或排水法收集,采用排水法收集气体较纯净,选择的收集装置为E,故填:2KMnO4K2MnO4+MnO2+O2↑;AE;
(2)①图2是制作的简易供氧器,该装置不需加热,高锰酸钾、氯酸钾和二氧化锰制取氧气时需要加热,而常用大理石和稀盐酸反应来制取二氧化碳气体,过氧化氢在二氧化锰催化作用下分解生成水和氧气,在供氧使用时,左瓶中可放置的药品是过氧化氢溶液和二氧化锰,故选D;
(3)简易供氧器的右瓶中需加入适量的水,水的作用是可使氧气润湿,且可判断是否有氧气产生,故填:判断是否有氧气产生(合理即可);
(4)在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中,改进后的优点是:能形成液封,防止气体从长颈漏斗中逸出、节约药品等,故填:节约药品;
(5)原理分析:根据质量守恒定律,反应前后原子的种类、数目不变,反应前K、O、H的原子个数分别为4、10、4,反应后K、O、H的原子个数分别为0、6、0,则4X中含有4个钾原子、4个氧原子和4个氢原子,X的化学式为KOH,故填:KOH;
动手实践:超氧化钾为黄色固体,碳酸钾、氢氧化钾均为白色固体,当观察到生氧剂由黄色变为白色,则基本失效,故填:黄色变成白色;
(6)实验室用加热固体无水醋酸钠和氢氧化钠混合物的方法可以制得甲烷,属于固-固加热型,选择的发生装置为A,甲烷密度比空气小,且极难溶于水,可采用向下排空气法或排水法收集,选择的收集装置为D或E,故填:AD或AE。
13.(1)H2O
(2)解:设若制取12kg氢气,理论上需要单质硼的质量为x。
x=44kg
答:若制取12kg氢气,理论上需要单质硼的质量为44kg。
【详解】(1)根据化学方程式可知,反应后有2个硼原子,12个氢原子,6个氧原子,反应前有2个硼原子,故6X中含有12个氢原子,6个氧原子,根据质量守恒定律,化学反应前后原子的种类和个数不变,则一个X分子中含有2个氢原子和一个氧原子,故X的化学式为H2O;
(2)见答案。
14.(1)NaCl、NaOH(合理即可)
(2)分子在不断的运动
(3) 元素 化合物 +5价
(4)CO2
【详解】(1)我们身边有很多物质,如氯化钠,化学式为:NaCl;如烧碱,化学式为:NaOH;
(2)打开茅台酒能闻到浓郁的香气,是因为酒中的香味分子在不断地运动,向四周扩散,使人们闻到酒的香味;
(3)厨房常用的加碘盐、补铁酱油。它们中的“碘”、“铁”指的元素;食盐中加入一定量的 酸钾(KIO3),碘酸钾是由碘钾、氧元素组成的,在物质类别上属于化合物;碘酸钾中钾元素为+1价,氧元素为-2价,根据化合物中各元素化合价代数和为0,设碘元素化合价为x,可列:(+1)+x+(-2)×3=0,x=+5,故碘元素的化合价是+5价;
(4)根据只花了守恒定律可知,化学反应前后原子的种类和数目不变,由化学方程式知,反应前碳、氢、氧的原子分别为:2、8、8,反应后碳、氢、氧的原子分别为:0、8、4,缺少2个碳原子和4个氧原子,X的系数为2,X的化学式为:CO2。
15.(1)H2O
(2)有机合成材料
(3)
【详解】(1)化学方程式左边:碳原子个数2个;氢原子个数8个;氮原子个数6个;氧原子个数8个。化学方程式右边:碳原子个数2个;氧原子个数4个;氮原子个数6个。所以4X中含有氢原子个数8个,含有氧原子个数4个。即X中含有氢原子个数2个,含有氧原子个数1个。所以X的化学式为H2O。故填:H2O。
(2)由于聚氟乙烯膜是一种新型的塑料,塑料属于有机合成材料。故填:有机合成材料。
(3)甲烷和水在一定条件下反应生成一氧化碳和氢气,所以化学方程式为。故填:。
16.(1)植物光合作用
(2)电能
(3)C2H4O2
(4)
(5)abc
【详解】(1)自然界中,绿色植物可以通过光合作用吸收二氧化碳;
(2)氢氧燃料电池的能量转化主要形式是把化学能转化为电能;
(3)根据质量守恒定律,化学反应前后原子种类和个数不变,反应前有2个碳原子、6个氧原子和4个氢原子,反应后有4个氧原子,故R为2个碳原子、4个氢原子和2个氧原子,R的化学式为:C2H4O2;
(4)由流程图可知,CO2和H2在MoS2催化剂和加热条件下转化为甲醇和水,化学方程式为:;
(5)a、由流程图可知,CO2和H2在一定条件下可以转化为甲醇和水,甲醇和水在一定条件下可以反应生成二氧化碳和氢气,所以H2 、CO2与CH3OH在一定条件下可相互转化,说法正确;
b、途径2是催化二氧化碳加氢生成甲醇,使用时,再利用甲醇释放出氢气和二氧化碳,二氧化碳循环利用继续加氢生成甲醇,储存甲醇的成本相比储存氢气要低很多,说法正确;
c、由流程图可知,二氧化碳是作为反应中的循环气体,氢气则是作为产物,所以是尽量减小二氧化碳的排放同时达到生成氢气,可以看出能源的开发与利用是向“减碳趋氢”的方向发展,说法正确;
故选:abc。
答案第1页,共2页
同课章节目录
