江西省上饶县清水中学粤教版九年级化学上册:3.4 物质构成的表示式 课件
文档属性
| 名称 | 江西省上饶县清水中学粤教版九年级化学上册:3.4 物质构成的表示式 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 132.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-01 00:00:00 | ||
图片预览










文档简介
课件46张PPT。1
物质构成的
表示式 用元素符号和右下角数字组合来表示物质组成的式子叫化学式。
例:O2、H2O 一、化学式的定义:32.化学式的意义⑴表示一种物质——
由整个化学式表示;⑵表示该物质由哪些元素组成
——从化学式中的各元素符号进行判断;4
⑶表示物质的一个分子
——多个分子在化学式
前加系数;(注意:分子前加系数只有微观意义,
表示几个分子)5 化学式是通过实验方法测定物质的组成和结构后确定的,不得随意猜测和臆造。6 1.以水的化学式为例,说明化学式的含义。
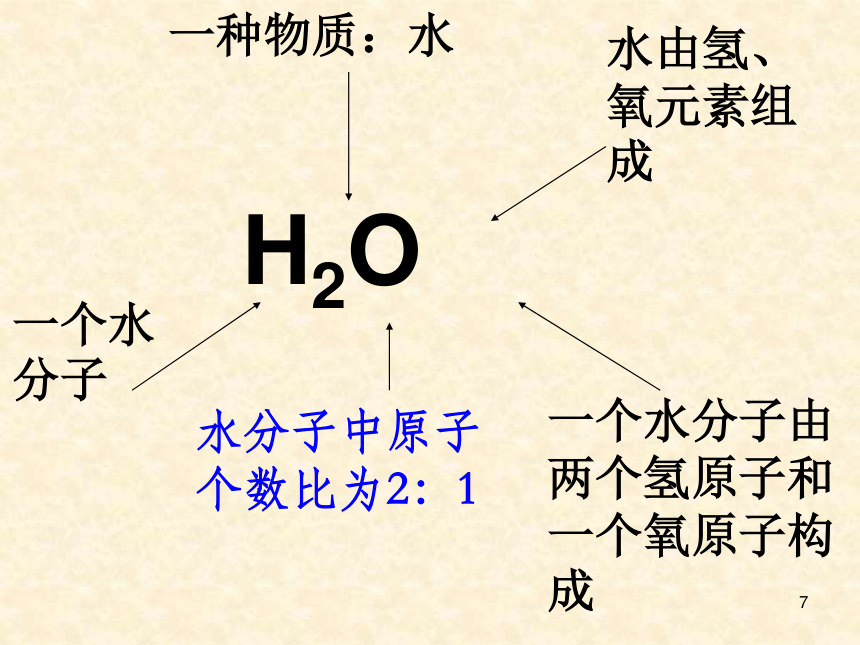
7H2O一种物质:水一个水分子水由氢、氧元素组成一个水分子由两个氢原子和一个氧原子构成水分子中原子个数比为2:18 2.以H2SO4为例,总结化学式的含义。
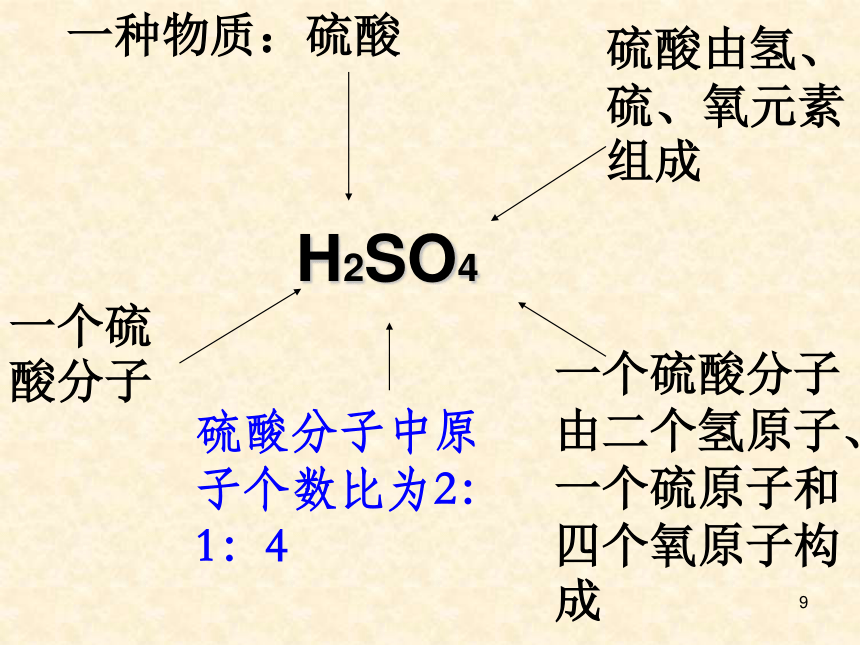
9一种物质:硫酸一个硫酸分子硫酸由氢、硫、氧元素组成一个硫酸分子由二个氢原子、一个硫原子和四个氧原子构成硫酸分子中原子个数比为2:1:4H2SO410讨论:H H2 2H 2H2的意义2H2 两个氢分子2H 两个氢原子 H2 氢气 一个氢气分子
每个氢气分子由两个氢原子构成H 氢元素 一个氢原子11随堂练习课本P118 4121、单质化学式的书写:化学式的写法:(用元素符号表示它们的化学式:
例:Fe Cu C Si He )(化学式在元素符号右下角写上每个
分子中的原子个数,例:H2 O2 Cl2 O3 )13化合价1.化合价的含义: 一种元素一定数目的原子和其
它元素一定数目的原子化合的性
质叫做元素的化合价。化合价有正负之分142.化合价的表示方法和读法 化合价通常标在元素符号
或原子团符号的正上方,
用+1 +2 +3 -1 -2 0表示。例: +2 -3 +1
Mg PO4 Na15化合价与离子的数值相等正负号相同,但表示的们位置不同。
化合价:正上方
(+、-号在前、数字在后,是1也要写)
举例:化合价+2 -3 +1
离子电荷:右上角,读某离子或某根
(数字在前、+、-号在后,是1可略写)
离子: Mg2+ CO32- Na+
16熟记元素常见的化合价 一价钾钠银氢,氯-1价
二价钙镁钡锌,氧-2价
一二铜二三铁三铝四硅
氢氧根、硝酸根-1价
碳酸根、硫酸根-2价
铵根+1价17元素化合价的基本规律: 化合价有正价、负价
①氧元素的化合价通常显-2价;
②氢元素的化合价通常显+1价;
③一般地,金属元素显正价,非金属元素显负价。18在化合物中元素的正、负化合价的代数和等于零 单质中元素的化合价为零。公式:
各原子(或原子团)的化合价×本身的原子(或原子团)右下角个数之和=019例:课本P117练:KMnO4 、K2MnO4 、MnO2中的锰元素化合价20学生练习:
求HCl HClO KClO3
HClO4 Cl2 中Cl元素的
化合价-1 +1 +5 +7 0213.根据化合价书写化合物化学式(以氧化铝为例)
(1)元素化合价绝对值
交叉法。
(2)最小公倍数法
22元素化合价的绝对值交叉法
1.写出组成化合物的各元素:
正价在左负价在右 Al O +3 -2
2.标出各元素的化合价: Al O
3.元素化合价绝对值对交叉
4.检查:化合物中正、负元素化合价的代数
和是否等于零。Al2O323
①写出组成化合物的各元素:正价在左
负价在右 Al O +3 -2
②标出各元素的化合价:Al O
③求化合价绝对值的最小公倍数: 3 2 = 6
④求组成化合物各原子个数比:
Al原子个数6/3=2 O原子个数6/2=3
⑤用小数字在元素符号的右下角标明构成物
质的一个分子各原子个数 Al2O3
⑥检查:化合物中正、负元素化合价的代数
和是否等于零。最小公倍数法24 在化合物中元素原子个数比不是
最简比的要约简。
例:+4-2 +2-2 +2-2
CO2 CuO CaO
因为2 ∶ 4 等于1∶2,所以化学式为
CO2而不是C2O4
因为2 ∶2等于1∶1,所以化学式为
CuO CaO而不是Cu2O2 Ca2O2 )
252元素或单原子原子团26化合价:元素的正上方Mg Na Al O+2+1+3-2离子电荷:元素的右上角离子阳离子阴离子最外层电子小于4,易失电子
带正电荷(+)最外层电子大于4,易得电子
带负电荷(-)读法:某离子单原子化合价与离子的表示27例:Ag Cu Fe Fe+2+3+2+银离子铜离子铁离子亚铁离子一个铜离子带2单位的正电荷。28化合价:原子团的正上方OH NH4 NO3 SO4 CO3
氢氧 铵 硝酸 硫酸 碳酸-1+1-1-2-2原子团离子的表示:原子团的右上角带电的原子团又叫做根根根根根根原子团的表示原子团不能随便拆分,原子个数比是个定值读法29化合价记忆原则“记不变留可变”
“可变的化合价可通过计算准确得出”
(根据化合物中各元素的化合价之和为零算出)30随堂练习写出化学符号中“2”的意义:
2H2O 2H 2Na+
Mg2+ Mg+231总结:化学符号中数字的意义1.在元素符号的前面:表示微粒个数
2.在元素符号的右下角:
表示每个微粒中某原子的个数;
3.在元素符号的右上角:
表示每个离子所带电荷数;
4.在元素符号的正上方:
表示元素或原子团的化合价;32根据元素化合价可判断化学式的正误。 方法:求化合物中各元素化合价
的代数和是否等于零。例:MgCl33化学式的读法:书写从左到右、读法从右到左
单 质:
金属.固态非金属 读“元素名称”
气态非金属 读“某气”34化合物:
化学式中无数字 读“某化某”例:NaCl KCl MgS MgO 氯化钠 氯化钾 硫化镁 氧化镁35化学式中有数字读“几某化几某”
个别也读“某化某”CO2 Fe3O4 P2O5 MnO2
Al2O3 Fe2O3 Na2O MgCl2二氧化碳 四氧化三铁 五氧化二磷 二氧化锰氧化铝 氧化铁 氧化钠 氯化镁36
含OH- 离子的读“氢氧化某”
例:NaOH读氢氧化钠
KOH读氢氧化钾含NO3- 读“硝酸某”例:NaNO3硝酸钠含SO42-读“硫酸某”例:CuSO4硫酸铜含CO32-读“碳酸某”例:CaCO3碳酸钙37课堂训练写出下列物质的化学式:
氧化镁 氧化钾 氧化铜
氯化铜 氯化镁 氯化铝
碳酸钠 碳酸镁 氢氧化钙
硫酸铝 氯化铵 硝酸钠返回38二、据化学式的计算(1)计算相对分子质量:
(各元素原子的相对原子质量与原子个数的乘积之和)
32+16×3=801×2+32+16×4 =98例: SO3H2SO439训练:
1:H2O的相对分子质量
2:CO2的相对分子质量
3:KClO3的相对分子质量
= 1 × 2 + 16 = 18= 12 + 16 × 2 = 44= 39 + 35.5 + 16 × 3 = 122.540小结:
相对分子质量等于各元素原子
的相对原子质量与原子个数的乘
积之和;
(同种元素相对原子质量乘以
原子个数、不种元素的相对原子
质量之和相加)41计算化合物中各元素之间的质量比如:NH4NO3 中
N H O 元素的质量比=14×2:1×4:16×3=7:1:12=1×2:32:16×4=1:16:32H2SO4 中H S O元素的质量比42
例:计算NH4NO3中的氮元素
的质量分数=2N / NH4NO3×100%
=14×2/80×100%=35%(3)计算化合物中
某一元素的质量分数43 (2)多少克尿素 CO(NH2)2 含氮量与160克NH4NO3含氮量相等解:设:尿素的质量为Y
160g×2N/ NH4NO3 =Y×2N/CO(NH2)2
160g×(2×14 / 80) = Y ×(2×14 / 60)
56g ≈ 0.47Y
Y≈ 120 g44基础练习: 1.下列说法中,正确的是 ( )
A.任何物质都可用化学式表示其组成;
B.只有分子构成的物质,可用化学式表
示其组成;
C.化学式是科学家猜想得出的;
D.硫化钠的化学式为Na2S.D45 2 .元素R为+4价,与氧元素形成的化合物中,氧元素的质量分数为
50%,则R的相对原子质量为 。32 3. 味精的主要成分是谷氨酸钠,谷氨酸钠的化学式为C2H7NO4Na2,则谷氨酸钠由 种元素组成,其中碳元素与氮元素的质量比是 。512:746 4.根据表格数据,
1.计算RX2里,R与X 的质量比 。
2.若R的相对原子质量为32,则RX3的相
对分子质量为 。1:180
物质构成的
表示式 用元素符号和右下角数字组合来表示物质组成的式子叫化学式。
例:O2、H2O 一、化学式的定义:32.化学式的意义⑴表示一种物质——
由整个化学式表示;⑵表示该物质由哪些元素组成
——从化学式中的各元素符号进行判断;4
⑶表示物质的一个分子
——多个分子在化学式
前加系数;(注意:分子前加系数只有微观意义,
表示几个分子)5 化学式是通过实验方法测定物质的组成和结构后确定的,不得随意猜测和臆造。6 1.以水的化学式为例,说明化学式的含义。
7H2O一种物质:水一个水分子水由氢、氧元素组成一个水分子由两个氢原子和一个氧原子构成水分子中原子个数比为2:18 2.以H2SO4为例,总结化学式的含义。
9一种物质:硫酸一个硫酸分子硫酸由氢、硫、氧元素组成一个硫酸分子由二个氢原子、一个硫原子和四个氧原子构成硫酸分子中原子个数比为2:1:4H2SO410讨论:H H2 2H 2H2的意义2H2 两个氢分子2H 两个氢原子 H2 氢气 一个氢气分子
每个氢气分子由两个氢原子构成H 氢元素 一个氢原子11随堂练习课本P118 4121、单质化学式的书写:化学式的写法:(用元素符号表示它们的化学式:
例:Fe Cu C Si He )(化学式在元素符号右下角写上每个
分子中的原子个数,例:H2 O2 Cl2 O3 )13化合价1.化合价的含义: 一种元素一定数目的原子和其
它元素一定数目的原子化合的性
质叫做元素的化合价。化合价有正负之分142.化合价的表示方法和读法 化合价通常标在元素符号
或原子团符号的正上方,
用+1 +2 +3 -1 -2 0表示。例: +2 -3 +1
Mg PO4 Na15化合价与离子的数值相等正负号相同,但表示的们位置不同。
化合价:正上方
(+、-号在前、数字在后,是1也要写)
举例:化合价+2 -3 +1
离子电荷:右上角,读某离子或某根
(数字在前、+、-号在后,是1可略写)
离子: Mg2+ CO32- Na+
16熟记元素常见的化合价 一价钾钠银氢,氯-1价
二价钙镁钡锌,氧-2价
一二铜二三铁三铝四硅
氢氧根、硝酸根-1价
碳酸根、硫酸根-2价
铵根+1价17元素化合价的基本规律: 化合价有正价、负价
①氧元素的化合价通常显-2价;
②氢元素的化合价通常显+1价;
③一般地,金属元素显正价,非金属元素显负价。18在化合物中元素的正、负化合价的代数和等于零 单质中元素的化合价为零。公式:
各原子(或原子团)的化合价×本身的原子(或原子团)右下角个数之和=019例:课本P117练:KMnO4 、K2MnO4 、MnO2中的锰元素化合价20学生练习:
求HCl HClO KClO3
HClO4 Cl2 中Cl元素的
化合价-1 +1 +5 +7 0213.根据化合价书写化合物化学式(以氧化铝为例)
(1)元素化合价绝对值
交叉法。
(2)最小公倍数法
22元素化合价的绝对值交叉法
1.写出组成化合物的各元素:
正价在左负价在右 Al O +3 -2
2.标出各元素的化合价: Al O
3.元素化合价绝对值对交叉
4.检查:化合物中正、负元素化合价的代数
和是否等于零。Al2O323
①写出组成化合物的各元素:正价在左
负价在右 Al O +3 -2
②标出各元素的化合价:Al O
③求化合价绝对值的最小公倍数: 3 2 = 6
④求组成化合物各原子个数比:
Al原子个数6/3=2 O原子个数6/2=3
⑤用小数字在元素符号的右下角标明构成物
质的一个分子各原子个数 Al2O3
⑥检查:化合物中正、负元素化合价的代数
和是否等于零。最小公倍数法24 在化合物中元素原子个数比不是
最简比的要约简。
例:+4-2 +2-2 +2-2
CO2 CuO CaO
因为2 ∶ 4 等于1∶2,所以化学式为
CO2而不是C2O4
因为2 ∶2等于1∶1,所以化学式为
CuO CaO而不是Cu2O2 Ca2O2 )
252元素或单原子原子团26化合价:元素的正上方Mg Na Al O+2+1+3-2离子电荷:元素的右上角离子阳离子阴离子最外层电子小于4,易失电子
带正电荷(+)最外层电子大于4,易得电子
带负电荷(-)读法:某离子单原子化合价与离子的表示27例:Ag Cu Fe Fe+2+3+2+银离子铜离子铁离子亚铁离子一个铜离子带2单位的正电荷。28化合价:原子团的正上方OH NH4 NO3 SO4 CO3
氢氧 铵 硝酸 硫酸 碳酸-1+1-1-2-2原子团离子的表示:原子团的右上角带电的原子团又叫做根根根根根根原子团的表示原子团不能随便拆分,原子个数比是个定值读法29化合价记忆原则“记不变留可变”
“可变的化合价可通过计算准确得出”
(根据化合物中各元素的化合价之和为零算出)30随堂练习写出化学符号中“2”的意义:
2H2O 2H 2Na+
Mg2+ Mg+231总结:化学符号中数字的意义1.在元素符号的前面:表示微粒个数
2.在元素符号的右下角:
表示每个微粒中某原子的个数;
3.在元素符号的右上角:
表示每个离子所带电荷数;
4.在元素符号的正上方:
表示元素或原子团的化合价;32根据元素化合价可判断化学式的正误。 方法:求化合物中各元素化合价
的代数和是否等于零。例:MgCl33化学式的读法:书写从左到右、读法从右到左
单 质:
金属.固态非金属 读“元素名称”
气态非金属 读“某气”34化合物:
化学式中无数字 读“某化某”例:NaCl KCl MgS MgO 氯化钠 氯化钾 硫化镁 氧化镁35化学式中有数字读“几某化几某”
个别也读“某化某”CO2 Fe3O4 P2O5 MnO2
Al2O3 Fe2O3 Na2O MgCl2二氧化碳 四氧化三铁 五氧化二磷 二氧化锰氧化铝 氧化铁 氧化钠 氯化镁36
含OH- 离子的读“氢氧化某”
例:NaOH读氢氧化钠
KOH读氢氧化钾含NO3- 读“硝酸某”例:NaNO3硝酸钠含SO42-读“硫酸某”例:CuSO4硫酸铜含CO32-读“碳酸某”例:CaCO3碳酸钙37课堂训练写出下列物质的化学式:
氧化镁 氧化钾 氧化铜
氯化铜 氯化镁 氯化铝
碳酸钠 碳酸镁 氢氧化钙
硫酸铝 氯化铵 硝酸钠返回38二、据化学式的计算(1)计算相对分子质量:
(各元素原子的相对原子质量与原子个数的乘积之和)
32+16×3=801×2+32+16×4 =98例: SO3H2SO439训练:
1:H2O的相对分子质量
2:CO2的相对分子质量
3:KClO3的相对分子质量
= 1 × 2 + 16 = 18= 12 + 16 × 2 = 44= 39 + 35.5 + 16 × 3 = 122.540小结:
相对分子质量等于各元素原子
的相对原子质量与原子个数的乘
积之和;
(同种元素相对原子质量乘以
原子个数、不种元素的相对原子
质量之和相加)41计算化合物中各元素之间的质量比如:NH4NO3 中
N H O 元素的质量比=14×2:1×4:16×3=7:1:12=1×2:32:16×4=1:16:32H2SO4 中H S O元素的质量比42
例:计算NH4NO3中的氮元素
的质量分数=2N / NH4NO3×100%
=14×2/80×100%=35%(3)计算化合物中
某一元素的质量分数43 (2)多少克尿素 CO(NH2)2 含氮量与160克NH4NO3含氮量相等解:设:尿素的质量为Y
160g×2N/ NH4NO3 =Y×2N/CO(NH2)2
160g×(2×14 / 80) = Y ×(2×14 / 60)
56g ≈ 0.47Y
Y≈ 120 g44基础练习: 1.下列说法中,正确的是 ( )
A.任何物质都可用化学式表示其组成;
B.只有分子构成的物质,可用化学式表
示其组成;
C.化学式是科学家猜想得出的;
D.硫化钠的化学式为Na2S.D45 2 .元素R为+4价,与氧元素形成的化合物中,氧元素的质量分数为
50%,则R的相对原子质量为 。32 3. 味精的主要成分是谷氨酸钠,谷氨酸钠的化学式为C2H7NO4Na2,则谷氨酸钠由 种元素组成,其中碳元素与氮元素的质量比是 。512:746 4.根据表格数据,
1.计算RX2里,R与X 的质量比 。
2.若R的相对原子质量为32,则RX3的相
对分子质量为 。1:180
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
