2015年獐沟中学高二化学学业水平测试模拟试题(一)
文档属性
| 名称 | 2015年獐沟中学高二化学学业水平测试模拟试题(一) |

|
|
| 格式 | zip | ||
| 文件大小 | 99.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-01 00:00:00 | ||
图片预览

文档简介
2015年獐沟中学高二化学学业水平测试模拟试卷(一)本试卷分为第I卷和第II卷两部分。试卷1至6页。共100分。考试时间75分钟。
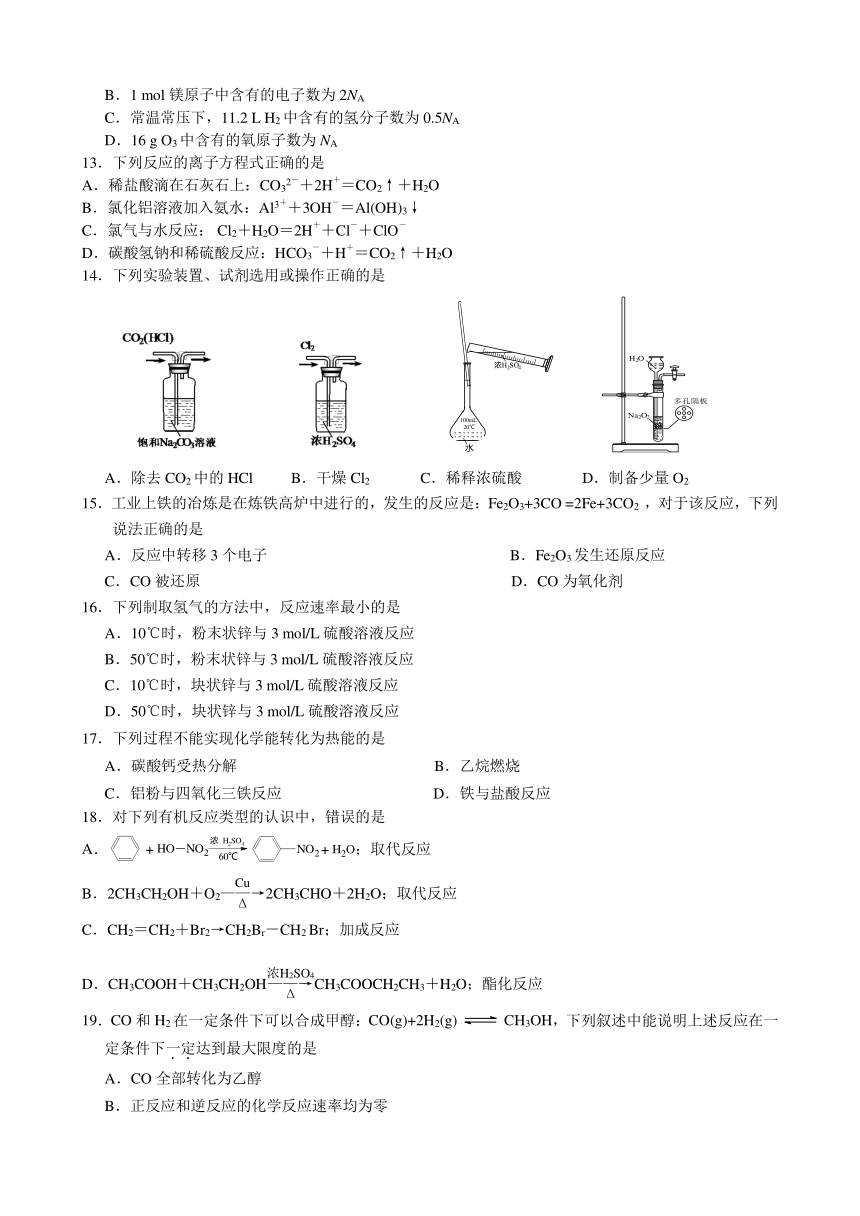
可能用到的相对原子质量: H-1 O -16 S-32 Fe-56 Ba-137
第Ⅰ卷(选择题 共69分)
单项选择题:在每题的4个选项中,只有1个选项符合要求(本部分23题,每题3分,共69分)
一、单项选择题(本部分23小题,每题3分,共计69分。在每题的四个选项中,只有一个选项
是符合要求的。
1.减缓温室气体排放是2011年南非德班联合国气候变化大会的主要议题,下列过程不产生温室气体的是
A.使用天然气作燃料 B.使用风力发电
C.用火力发电 D.用已脱硫的煤作燃料
2. 用生石灰中和法阻止海水酸化是人们的一种设想。生石灰(CaO)属于
A.碱 B.酸性氧化物 C.碱性氧化物 D.两性氧化物
3. 在下列物质分类中,前者包括后者的是
A.氧化物 化合物 B.分散系 溶液 C.溶液 胶体 D.电解质 化合物
4.下列化学用语正确的是
A.乙烯的结构简式是C2H4 B.氯离子的结构示意图:
C.NaCl的电子式是Na:Cl D. 硫酸的电离方程式:H2SO4=H2+ + SO42-
5.下物质间的转化通过一步化学反应不能实现的是
A.Fe→Fe3O4 B.Na Cl→Cl2 C.CuO→Cu(OH)2 D.Na→Na2O
6.某溶液中可能含有SO42-、CO32-等。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是
A.H2SO4溶液 B.HCl溶液 C.NaOH溶液 D.NaNO3溶液
7.下列关于物质性质的说法正确的是
A.通常状况下,NO2是无色的气体
B.SO2能漂白品红等物质,说明SO2有氧化性
C.加热时,铁单质与浓硝酸不发生反应
D.二氧化氯具有强氧化性,可用于自来水的杀菌消毒
8.下列实验方法或实验叙述正确的是
A.将pH试纸直接放入某溶液中,测定该溶液的pH B.用澄清石灰水鉴别NaHCO3 和Na2CO3
C.过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁 D.从碘水提取碘可用乙醇作萃取剂
9.下列各组离子在溶液中可以大量共存的是
A.Ba2+、NO3-、CO32- B.H+、K+、SO32-
C.Cu2+、OH-、Cl- D.Ba2+、OH一、C1—
10.下列说法正确的是
A.1H、2H、3H、H+、H2是氢元素形成的五种不同粒子
B.O2、O3互为同位素
C.正丁烷和异丁烷互为同系物
D.乙烷、乙烯互为同分异构体
11.实验室制取气体时,必须用排水法收集的是
A.NH3 B.NO C.NO2 D.SO2
12.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 mol/L BaCl2溶液中含有的钡离子数为NA
B.1 mol镁原子中含有的电子数为2NA
C.常温常压下,11.2 L H2中含有的氢分子数为0.5NA
D.16 g O3中含有的氧原子数为NA
13.下列反应的离子方程式正确的是
A.稀盐酸滴在石灰石上:CO32-+2H+=CO2↑+H2O
B.氯化铝溶液加入氨水:Al3++3OH-=Al(OH)3↓
C.氯气与水反应: Cl2+H2O=2H++Cl-+ClO-
D.碳酸氢钠和稀硫酸反应:HCO3-+H+=CO2↑+H2O
14.下列实验装置、试剂选用或操作正确的是
A.除去CO2中的HCl B.干燥Cl2 C.稀释浓硫酸 D.制备少量O2[
15.工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是:Fe2O3+3CO =2Fe+3CO2 ,对于该反应,下列说法正确的是
A.反应中转移3个电子 B.Fe2O3发生还原反应
C.CO被还原 D.CO为氧化剂
16.下列制取氢气的方法中,反应速率最小的是
A.10℃时,粉末状锌与3 mol/L硫酸溶液反应
B.50℃时,粉末状锌与3 mol/L硫酸溶液反应
C.10℃时,块状锌与3 mol/L硫酸溶液反应
D.50℃时,块状锌与3 mol/L硫酸溶液反应
17.下列过程不能实现化学能转化为热能的是
A.碳酸钙受热分解 B.乙烷燃烧
C.铝粉与四氧化三铁反应 D.铁与盐酸反应
18.对下列有机反应类型的认识中,错误的是
A.;取代反应
B.2CH3CH2OH+O22CH3CHO+2H2O;取代反应
C.CH2=CH2+Br2→CH2Br-CH2 Br;加成反应
D.CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O;酯化反应
19.CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)CH3OH,下列叙述中能说明上述反应在一定条件下一定达到最大限度的是
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为零
C.CO和H2以1∶2的物质的量之比反应生成甲醇
D.反应体系中甲醇的物质的量浓度不再变化
20.某原电池装置图如右图所示,有关该原电池的说法正确的是
A.在铁棒上产生气泡,碳棒上没有气泡
B.H+在溶液中定向流向铁
C.电子由铁电极流出
D.该装置能将电能转化为化学能
21.下列有关说法正确的是
A.漂白粉久置于空气中会增加漂白效果
B.以海水为原料能制取Na、HCl、Mg、Br2等物质
C.蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO·2CO2·2H2O
D.二氧化硅不与任何酸反应,可用石英制造耐酸容器
22.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是 A.原子半径:A<B<C<D<E
B.化合物AE与CE含有相同类型的化学键
C.金属性:D>C
D.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
23.今有一混合物的水溶液,只可能含有以 ( http: / / www.21cnjy.com )下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-。现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推测正确的是
A.一定不存在Ba2+,NH4+可能存在 B.CO32-一定不存在
C.Na+一定存在 D.一定不存在Cl-
第Ⅱ卷(非选择题 共31分)
二、非选择题(本部分3题,共31分)
24.(15分)A、《化学与生活》
(1)(6分)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。
① 抗酸药物具有抗酸作用的原因是_____________________________________________。某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。写出该抗酸药发挥功效时的离子方程式:
_______________________________________、_____________________________________。
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)__________________。
(2)(5分)材料是人类赖 ( http: / / www.21cnjy.com )以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子材料及复合材料。生活中的玻璃、陶瓷、水泥属于上述材料中的____________,其生产原料不需要使用石灰石的是________________。我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等。用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
纤维编号 ① ② ③
灼烧时的气味 特殊气味 烧纸气味 烧焦羽毛气味
则羊毛、棉花的编号分别为________________________。
(3)(4分)糖类、油脂、蛋白质和维生素都是人类的基本营养物质。下表为某品牌燕麦片标签中的一部分。
每100 g含有营养成分 糖类 油脂 蛋白质 维生素C 钙 镁 钠 锌
7.6 g 7.8 g 7.4 g 18 mg 201 mg 18.2 mg 30.8 mg 8.1 mg
燕麦片的营养成分中能与水反应生成氨基酸 ( http: / / www.21cnjy.com )的营养物质是___________________;每克营养物质氧化时放出能量最多的是__________;人体必需的微量元素是_______________。“服用维生素C,可使食物中的Fe3+变为Fe2+”这句话指出,维生素C在这一反应中作_______剂。
25.(6分)下列框图所示的物质转 ( http: / / www.21cnjy.com )化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟,D是日常生活中常见的盐(部分反应物和生成物及溶剂水已略去)。请回答下列问题:
(1)甲元素在周期表中的位置 ▲ .
(2)B的电子式为 ▲ .
(3)写出A溶液和甲反应的离子方程式 ▲ .
(4)写出A和E反应的化学方程式 ▲ .
26.(10分)粉煤灰是燃煤电厂排 ( http: / / www.21cnjy.com )出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为42.6%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13+3Na2CO3=2NaAlSiO4+4NaAlO2+3CO2↑ ①
Al6Si2O13+5Na2CO3=2Na2SiO3+6NaAlO2+5CO2↑ ②
SiO2+Na2CO3=Na2SiO3+CO2↑ ③
(1)粉煤灰中铝的质量分数为_________%,根据SiO2与纯碱反应的化学方程式,书写氧化铝与纯碱反应的化学方程式___________________________________________________。
(2)用1mol Al6S ( http: / / www.21cnjy.com )i2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3____________mol,共消耗Na2CO3_____________mol(得到的固体中无SiO2)。
(3)若粉煤灰中 Al6 ( http: / / www.21cnjy.com )Si2O13 与 SiO2的物质的量之比为1∶2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2_________________mol。
2015年獐沟中学高二化学学业水平测试模拟试卷(一) 参考答案
1 2 3 4 5 6 7 8 9 10 11
B C B B C B D C D A B
12 13 14 15 16 17 18 19 20 21 22 23
D D B B C A B D C B D C
24. A题(15分)
(1)①抗酸药物中的成份与胃酸会发生反应,消耗胃酸(1分)
MgCO3+2H+=Mg2++CO2↑+H2O Al(OH)3+3H+=Al3++3H2O (各2分)
②C6H12O6 (1分)
(2)无机非金属材料 陶瓷 ③②(1+2+2分)
(3)蛋白质 油脂 锌 还原(各1分)
25.(6分)(1)第三周期ⅢA族(2) (3) 2Al + 2OHˉ+ 2H2O = 2AlO2ˉ+ 3 H2
(4)NaOH+NH4Cl NaCl+NH3↑+H2O (方程式每空两分,其他每空一分,共6分)
26.(10分)(1)16.2% Al2O3+Na2CO3=2NaAlO2+CO2↑(各2分)
(2)5 8(各2分)
(3)5mol(2分)
Fe
C
稀硫酸
可能用到的相对原子质量: H-1 O -16 S-32 Fe-56 Ba-137
第Ⅰ卷(选择题 共69分)
单项选择题:在每题的4个选项中,只有1个选项符合要求(本部分23题,每题3分,共69分)
一、单项选择题(本部分23小题,每题3分,共计69分。在每题的四个选项中,只有一个选项
是符合要求的。
1.减缓温室气体排放是2011年南非德班联合国气候变化大会的主要议题,下列过程不产生温室气体的是
A.使用天然气作燃料 B.使用风力发电
C.用火力发电 D.用已脱硫的煤作燃料
2. 用生石灰中和法阻止海水酸化是人们的一种设想。生石灰(CaO)属于
A.碱 B.酸性氧化物 C.碱性氧化物 D.两性氧化物
3. 在下列物质分类中,前者包括后者的是
A.氧化物 化合物 B.分散系 溶液 C.溶液 胶体 D.电解质 化合物
4.下列化学用语正确的是
A.乙烯的结构简式是C2H4 B.氯离子的结构示意图:
C.NaCl的电子式是Na:Cl D. 硫酸的电离方程式:H2SO4=H2+ + SO42-
5.下物质间的转化通过一步化学反应不能实现的是
A.Fe→Fe3O4 B.Na Cl→Cl2 C.CuO→Cu(OH)2 D.Na→Na2O
6.某溶液中可能含有SO42-、CO32-等。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是
A.H2SO4溶液 B.HCl溶液 C.NaOH溶液 D.NaNO3溶液
7.下列关于物质性质的说法正确的是
A.通常状况下,NO2是无色的气体
B.SO2能漂白品红等物质,说明SO2有氧化性
C.加热时,铁单质与浓硝酸不发生反应
D.二氧化氯具有强氧化性,可用于自来水的杀菌消毒
8.下列实验方法或实验叙述正确的是
A.将pH试纸直接放入某溶液中,测定该溶液的pH B.用澄清石灰水鉴别NaHCO3 和Na2CO3
C.过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁 D.从碘水提取碘可用乙醇作萃取剂
9.下列各组离子在溶液中可以大量共存的是
A.Ba2+、NO3-、CO32- B.H+、K+、SO32-
C.Cu2+、OH-、Cl- D.Ba2+、OH一、C1—
10.下列说法正确的是
A.1H、2H、3H、H+、H2是氢元素形成的五种不同粒子
B.O2、O3互为同位素
C.正丁烷和异丁烷互为同系物
D.乙烷、乙烯互为同分异构体
11.实验室制取气体时,必须用排水法收集的是
A.NH3 B.NO C.NO2 D.SO2
12.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 mol/L BaCl2溶液中含有的钡离子数为NA
B.1 mol镁原子中含有的电子数为2NA
C.常温常压下,11.2 L H2中含有的氢分子数为0.5NA
D.16 g O3中含有的氧原子数为NA
13.下列反应的离子方程式正确的是
A.稀盐酸滴在石灰石上:CO32-+2H+=CO2↑+H2O
B.氯化铝溶液加入氨水:Al3++3OH-=Al(OH)3↓
C.氯气与水反应: Cl2+H2O=2H++Cl-+ClO-
D.碳酸氢钠和稀硫酸反应:HCO3-+H+=CO2↑+H2O
14.下列实验装置、试剂选用或操作正确的是
A.除去CO2中的HCl B.干燥Cl2 C.稀释浓硫酸 D.制备少量O2[
15.工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是:Fe2O3+3CO =2Fe+3CO2 ,对于该反应,下列说法正确的是
A.反应中转移3个电子 B.Fe2O3发生还原反应
C.CO被还原 D.CO为氧化剂
16.下列制取氢气的方法中,反应速率最小的是
A.10℃时,粉末状锌与3 mol/L硫酸溶液反应
B.50℃时,粉末状锌与3 mol/L硫酸溶液反应
C.10℃时,块状锌与3 mol/L硫酸溶液反应
D.50℃时,块状锌与3 mol/L硫酸溶液反应
17.下列过程不能实现化学能转化为热能的是
A.碳酸钙受热分解 B.乙烷燃烧
C.铝粉与四氧化三铁反应 D.铁与盐酸反应
18.对下列有机反应类型的认识中,错误的是
A.;取代反应
B.2CH3CH2OH+O22CH3CHO+2H2O;取代反应
C.CH2=CH2+Br2→CH2Br-CH2 Br;加成反应
D.CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O;酯化反应
19.CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)CH3OH,下列叙述中能说明上述反应在一定条件下一定达到最大限度的是
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为零
C.CO和H2以1∶2的物质的量之比反应生成甲醇
D.反应体系中甲醇的物质的量浓度不再变化
20.某原电池装置图如右图所示,有关该原电池的说法正确的是
A.在铁棒上产生气泡,碳棒上没有气泡
B.H+在溶液中定向流向铁
C.电子由铁电极流出
D.该装置能将电能转化为化学能
21.下列有关说法正确的是
A.漂白粉久置于空气中会增加漂白效果
B.以海水为原料能制取Na、HCl、Mg、Br2等物质
C.蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO·2CO2·2H2O
D.二氧化硅不与任何酸反应,可用石英制造耐酸容器
22.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是 A.原子半径:A<B<C<D<E
B.化合物AE与CE含有相同类型的化学键
C.金属性:D>C
D.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
23.今有一混合物的水溶液,只可能含有以 ( http: / / www.21cnjy.com )下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-。现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推测正确的是
A.一定不存在Ba2+,NH4+可能存在 B.CO32-一定不存在
C.Na+一定存在 D.一定不存在Cl-
第Ⅱ卷(非选择题 共31分)
二、非选择题(本部分3题,共31分)
24.(15分)A、《化学与生活》
(1)(6分)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。
① 抗酸药物具有抗酸作用的原因是_____________________________________________。某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。写出该抗酸药发挥功效时的离子方程式:
_______________________________________、_____________________________________。
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)__________________。
(2)(5分)材料是人类赖 ( http: / / www.21cnjy.com )以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子材料及复合材料。生活中的玻璃、陶瓷、水泥属于上述材料中的____________,其生产原料不需要使用石灰石的是________________。我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等。用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
纤维编号 ① ② ③
灼烧时的气味 特殊气味 烧纸气味 烧焦羽毛气味
则羊毛、棉花的编号分别为________________________。
(3)(4分)糖类、油脂、蛋白质和维生素都是人类的基本营养物质。下表为某品牌燕麦片标签中的一部分。
每100 g含有营养成分 糖类 油脂 蛋白质 维生素C 钙 镁 钠 锌
7.6 g 7.8 g 7.4 g 18 mg 201 mg 18.2 mg 30.8 mg 8.1 mg
燕麦片的营养成分中能与水反应生成氨基酸 ( http: / / www.21cnjy.com )的营养物质是___________________;每克营养物质氧化时放出能量最多的是__________;人体必需的微量元素是_______________。“服用维生素C,可使食物中的Fe3+变为Fe2+”这句话指出,维生素C在这一反应中作_______剂。
25.(6分)下列框图所示的物质转 ( http: / / www.21cnjy.com )化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟,D是日常生活中常见的盐(部分反应物和生成物及溶剂水已略去)。请回答下列问题:
(1)甲元素在周期表中的位置 ▲ .
(2)B的电子式为 ▲ .
(3)写出A溶液和甲反应的离子方程式 ▲ .
(4)写出A和E反应的化学方程式 ▲ .
26.(10分)粉煤灰是燃煤电厂排 ( http: / / www.21cnjy.com )出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为42.6%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13+3Na2CO3=2NaAlSiO4+4NaAlO2+3CO2↑ ①
Al6Si2O13+5Na2CO3=2Na2SiO3+6NaAlO2+5CO2↑ ②
SiO2+Na2CO3=Na2SiO3+CO2↑ ③
(1)粉煤灰中铝的质量分数为_________%,根据SiO2与纯碱反应的化学方程式,书写氧化铝与纯碱反应的化学方程式___________________________________________________。
(2)用1mol Al6S ( http: / / www.21cnjy.com )i2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3____________mol,共消耗Na2CO3_____________mol(得到的固体中无SiO2)。
(3)若粉煤灰中 Al6 ( http: / / www.21cnjy.com )Si2O13 与 SiO2的物质的量之比为1∶2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2_________________mol。
2015年獐沟中学高二化学学业水平测试模拟试卷(一) 参考答案
1 2 3 4 5 6 7 8 9 10 11
B C B B C B D C D A B
12 13 14 15 16 17 18 19 20 21 22 23
D D B B C A B D C B D C
24. A题(15分)
(1)①抗酸药物中的成份与胃酸会发生反应,消耗胃酸(1分)
MgCO3+2H+=Mg2++CO2↑+H2O Al(OH)3+3H+=Al3++3H2O (各2分)
②C6H12O6 (1分)
(2)无机非金属材料 陶瓷 ③②(1+2+2分)
(3)蛋白质 油脂 锌 还原(各1分)
25.(6分)(1)第三周期ⅢA族(2) (3) 2Al + 2OHˉ+ 2H2O = 2AlO2ˉ+ 3 H2
(4)NaOH+NH4Cl NaCl+NH3↑+H2O (方程式每空两分,其他每空一分,共6分)
26.(10分)(1)16.2% Al2O3+Na2CO3=2NaAlO2+CO2↑(各2分)
(2)5 8(各2分)
(3)5mol(2分)
Fe
C
稀硫酸
同课章节目录
