2024年中考化学强化复习-----工艺流程题(含答案)
文档属性
| 名称 | 2024年中考化学强化复习-----工艺流程题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 912.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-23 10:16:31 | ||
图片预览


文档简介
2024年中考化学强化复习+工艺流程题
1.香兰素是一种广泛使用的可食用香料,从香兰草豆荚粉中提取香兰素()的流程如下。
(1)香兰素由 种元素组成。
(2)将香兰素的乙醇溶液蒸馏,得到香兰素。该过程发生的是 变化(填“物理”或“化学”)。
(3)该流程中,可循环使用的物质有和 。
2.高纯碳酸钙广泛应用于精密电子陶瓷、医药等生产。某兴趣小组按图所示实验步骤,模拟工业流程制备高纯碳酸钙。请回答下列问题:
(1)试剂X是 。
(2)“操作1”的名称 ,该操作需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)“转化2”过程中发生反应的化学方程式为 (转化中H2O参与反应);
(4)该流程中可循环利用的物质是 (填化学式)。
3.某工业废液中含有AgNO3、Zn(NO3)2和Fe(NO3)2。现要回收银,并得到副产品FeSO4·7H2O,基本流程如下:
(1)操作1和2的名称是 ,所用玻璃仪器有:烧杯、玻璃棒、 。
(2)确认操作2中稀硫酸已足量的操作是:向固体中加入 ,无现象。
(3)该流程有关说法正确的是 。
a.过量X是锌 b.操作2、操作3玻璃棒作用相同 c.溶液B中的溶质是2种
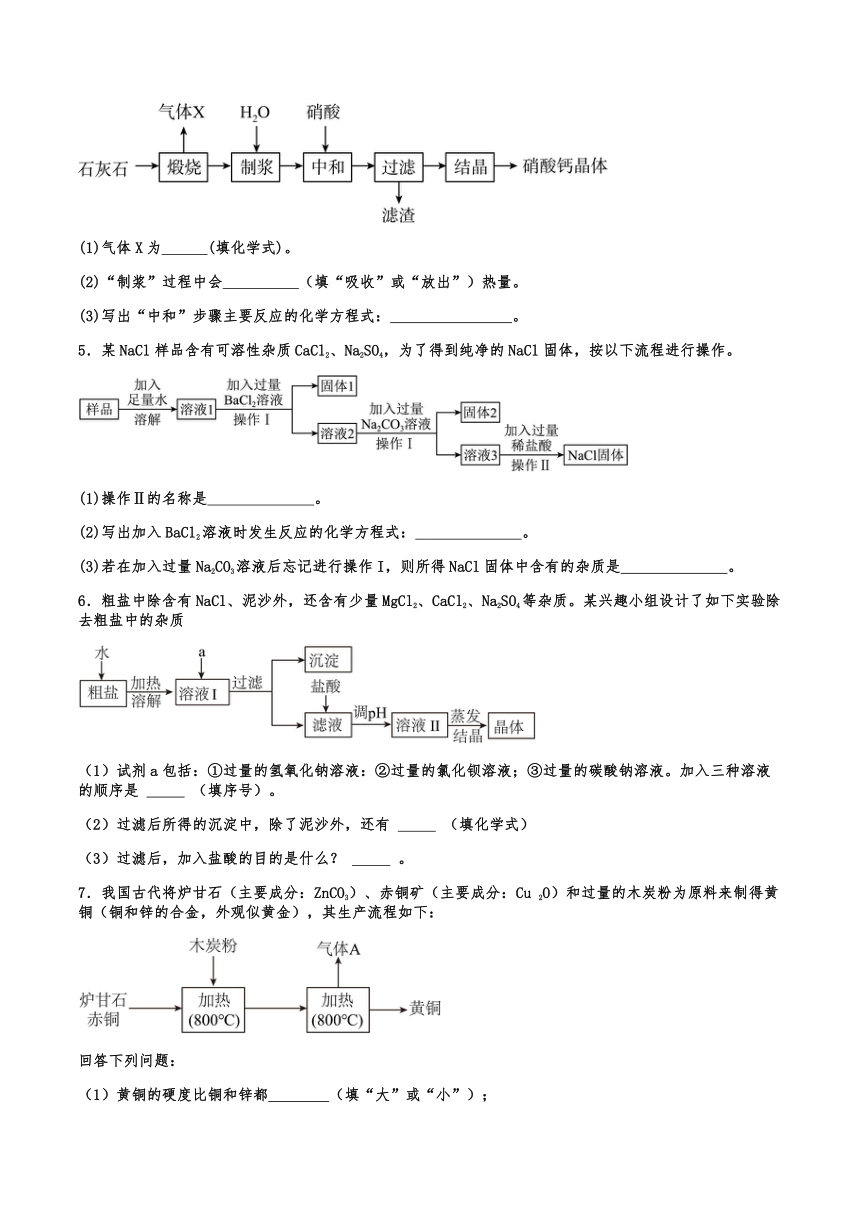
4.硝酸钙 [Ca(NO3)2] 可用于无土栽培。一种利用石灰石制备硝酸钙晶体的流程如下图。已知:硝酸会挥发、受热会分解。
(1)气体X为 (填化学式)。
(2)“制浆”过程中会 (填“吸收”或“放出”)热量。
(3)写出“中和”步骤主要反应的化学方程式: 。
5.某NaCl样品含有可溶性杂质CaCl2、Na2SO4,为了得到纯净的NaCl固体,按以下流程进行操作。
(1)操作Ⅱ的名称是 。
(2)写出加入BaCl2溶液时发生反应的化学方程式: 。
(3)若在加入过量Na2CO3溶液后忘记进行操作I,则所得NaCl固体中含有的杂质是 。
6.粗盐中除含有NaCl、泥沙外,还含有少量MgCl2、CaCl2、Na2SO4等杂质。某兴趣小组设计了如下实验除去粗盐中的杂质
(1)试剂a包括:①过量的氢氧化钠溶液:②过量的氯化钡溶液;③过量的碳酸钠溶液。加入三种溶液的顺序是 (填序号)。
(2)过滤后所得的沉淀中,除了泥沙外,还有 (填化学式)
(3)过滤后,加入盐酸的目的是什么? 。
7.我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu 2O)和过量的木炭粉为原料来制得黄铜(铜和锌的合金,外观似黄金),其生产流程如下:
回答下列问题:
(1)黄铜的硬度比铜和锌都 (填“大”或“小”);
(2)加热时,发生的主要反应化学方程式为:①;②;③ (赤铜矿和木炭粉反应),该反应的基本反应类型属于 ;
(3)气体A中,除二氧化碳外还可能生成另一种气体,它的化学式是 ,该气体的用途 (写一条)
(4)鉴别黄铜和黄金有多种方法,用灼烧法鉴别产生的现象及结论是 。
8.科学探测发现,月球贮存有一定数量的甲烷和钛铁矿(主要成分FeTiO3)。人类有望利用月球上的资源,并通过一系列反应获取氢气为火箭提供燃料,获取氧气逐渐形成可供呼吸的大气层。如图是科学家设想的有关人类利用月球资源的操作流程:
(1)FeTiO3中铁元素的化合价为+2,则钛元素的化合价为 。
(2)写出水电解的化学反应方程式 。
(3)该流程中可循环利用的两种物质是H2和 。
9.下列流程可用于制备硫酸铵。
步骤1.制硫酸:
(1)反应①的化学方程式为 。
(2)反应②为 ,其中X是 (填化学式)。
步骤2.合成氨:
(3)“原料气”中N2的制备:N2约占空气体积的五分之四,可通过分离液态空气的方法得到。
(4)“原料气”中H2的制备:高温时,CH4和水蒸气在催化剂作用下反应得到H2和CO2,该反应的化学方程式为 。
(5)反应③为,属于 反应(填基本反应类型)。
(6)NH3溶于水时形成氨水。
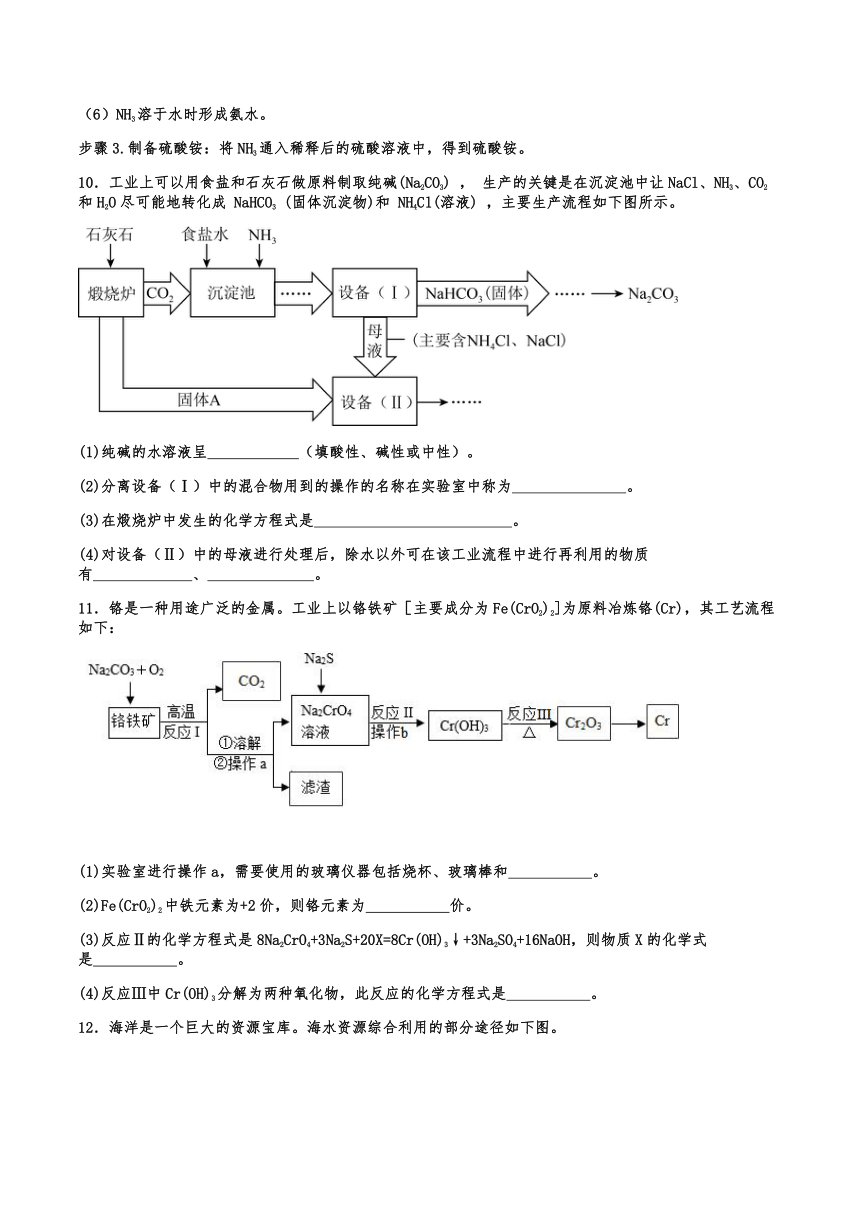
步骤3.制备硫酸铵:将NH3通入稀释后的硫酸溶液中,得到硫酸铵。
10.工业上可以用食盐和石灰石做原料制取纯碱(Na2CO3) , 生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能地转化成 NaHCO3 (固体沉淀物)和 NH4Cl(溶液) ,主要生产流程如下图所示。
(1)纯碱的水溶液呈 (填酸性、碱性或中性)。
(2)分离设备(Ⅰ)中的混合物用到的操作的名称在实验室中称为 。
(3)在煅烧炉中发生的化学方程式是 。
(4)对设备(Ⅱ)中的母液进行处理后,除水以外可在该工业流程中进行再利用的物质有 、 。
11.铬是一种用途广泛的金属。工业上以铬铁矿[主要成分为Fe(CrO2)2]为原料冶炼铬(Cr),其工艺流程如下:
(1)实验室进行操作a,需要使用的玻璃仪器包括烧杯、玻璃棒和 。
(2)Fe(CrO2)2中铁元素为+2价,则铬元素为 价。
(3)反应Ⅱ的化学方程式是8Na2CrO4+3Na2S+20X=8Cr(OH)3↓+3Na2SO4+16NaOH,则物质X的化学式是 。
(4)反应Ⅲ中Cr(OH)3分解为两种氧化物,此反应的化学方程式是 。
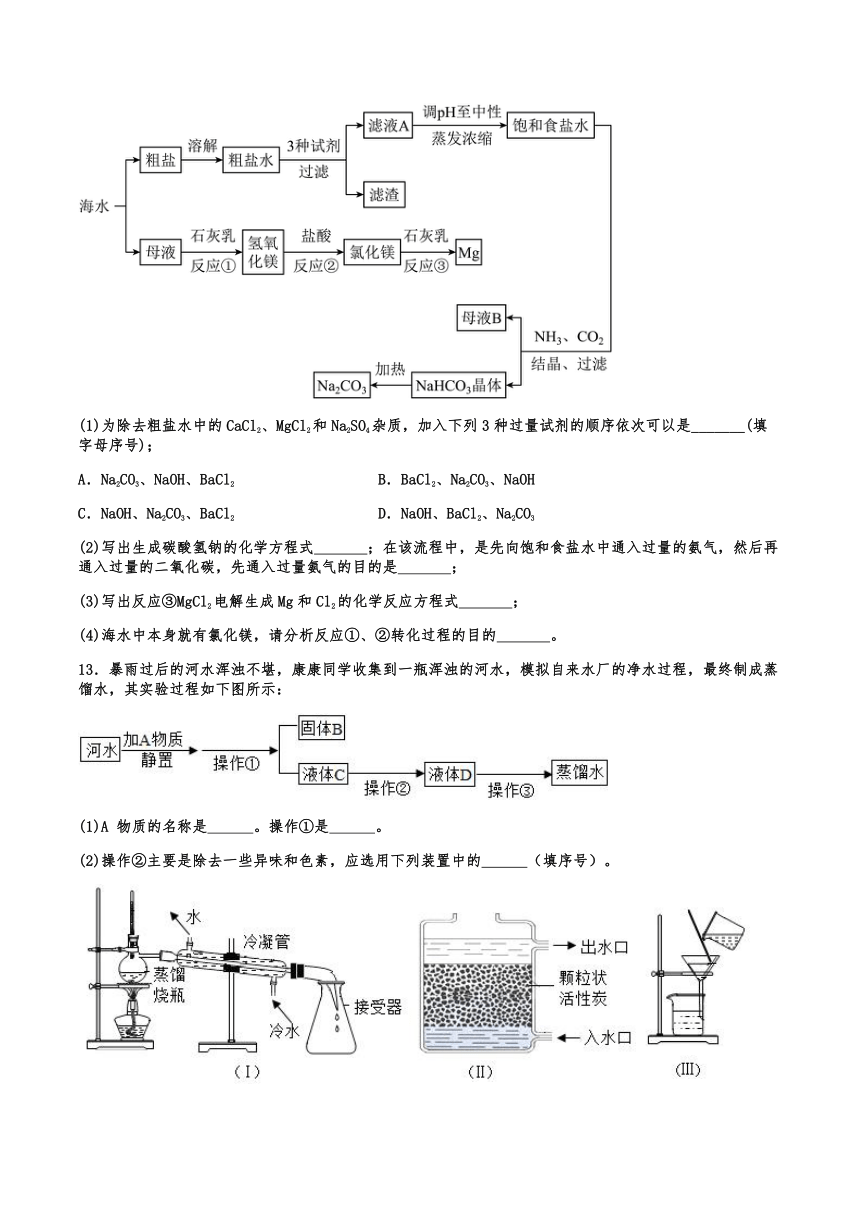
12.海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如下图。
(1)为除去粗盐水中的CaCl2、MgCl2和Na2SO4杂质,加入下列3种过量试剂的顺序依次可以是_______(填字母序号);
A.Na2CO3、NaOH、BaCl2 B.BaCl2、Na2CO3、NaOH
C.NaOH、Na2CO3、BaCl2 D.NaOH、BaCl2、Na2CO3
(2)写出生成碳酸氢钠的化学方程式 ;在该流程中,是先向饱和食盐水中通入过量的氨气,然后再通入过量的二氧化碳,先通入过量氨气的目的是 ;
(3)写出反应③MgCl2电解生成Mg和Cl2的化学反应方程式 ;
(4)海水中本身就有氯化镁,请分析反应①、②转化过程的目的 。
13.暴雨过后的河水浑浊不堪,康康同学收集到一瓶浑浊的河水,模拟自来水厂的净水过程,最终制成蒸馏水,其实验过程如下图所示:
(1)A 物质的名称是 。操作①是 。
(2)操作②主要是除去一些异味和色素,应选用下列装置中的 (填序号)。
(3)小刚取少量液体 D 于试管中,加入少量 区分硬水和软水,发现有较多浮渣产生,说明液体 D 是 水。所以康康同学在实验室进行了操作③,操作③应选用的装置是 (填序号)。
(4)康康同学的净化水过程和自来水厂净化水过程相比,缺少的操作名称是: ,多余的操作名称是: 。
14.Li2CO3是制备锂电池的重要原料。实验室以锂辉石精矿(含Li2O·Al2O3·4SiO2和其它杂质)为原料制取Li2CO3的硫酸法生产工艺流程如图所示:
已知:
① ,
②K2SO4在水中的溶解度受温度变化影响不大。
③Li2CO3在热水中的溶解度很小。
(1)“研磨”的目的是 。
(2)“水浸”后的滤液中含有的主要离子有 。
(3)“沉锂”发生的复分解反应是 (写化学方程式),为了进一步回收滤液中的成分,可进行的操作有蒸发结晶、 (填作名称)、洗涤、干燥。
(4)使用热水“洗涤”,原因是 。为了检验产品是否洗涤干净,取洗涤后的溶液于试管,并滴入 (填名称)溶液,若观察到 ,则说明洗涤干净。
15.海洋是巨大的资源宝库。学习小组模拟化工厂生产流程,利用海水制取纯减和金属镁,设计方案如图所示。请回答下列问题:
(1)流程I为海水“晒盐”:由海水获得粗盐的结晶方法是 。
(2)流程Ⅱ为粗盐精制:粗盐中通常含有泥沙等难溶性杂质和Ca2+、Mg2+、等可溶性杂质离子。为除去上述可溶性杂质离子,将粗盐溶解并依次加入下列试剂:过量NaOH溶液→过量BaCl2溶液→a→适量稀盐酸。
①上述除杂过程中,a是 。
③ 加入过量BaCl2溶液的目的是 。
③加入稀盐酸之前应进行的操作是 。
(3)流程Ⅲ为海水“制碱”:滤液A中碳酸氢钠是否饱和? (填“是”或“否”),流程Ⅲ中循环利用的物质X是 (填写化学式)。
(4)流程Ⅳ为海水提镁:氢氧化镁和盐酸反应的化学方程式为 ,母液中本来就有氯化镁,不直接进行电解来制取金属镁,而是经过了加石灰乳、盐酸等过程,这样做的目的是 。
16.海水中蕴藏着丰富的化学资源。
(1)海水含有的氯、钠、镁、硫、钙、钾元素中属于金属元素的有 种。
(2)从海水中可获取食盐。
①海水晒盐的过程如图1所示。 池中的NaCl溶液一定是饱和溶液。
②实验室里去除粗盐中难溶性杂质的一般步骤为溶解、过滤、蒸发,这三种操作都要使用的玻璃仪器是 。
(3)淡化海水可采用图2所示膜分离技术。装置左侧的海水浓度会 (选填 “变大”“变小”或“不变”)。从海水中获得淡水,还可以采用的操作有 。
(4)海洋是地球上最大的“氢矿”,开发海洋“氢矿”是未来氢能发展的重要方向。
①直接电解海水制氢气,发生主要反应,则X为 。
②科学家研究的新型技术,可以直接电解海水中的水获得氢气,写出反应的化学方程式: 。
17.绿矾(FeSO4·7H2O)的 种综合利用,其工艺流程如图(主要是生产还原铁粉):
已知: 隔绝空气进行“焙烧”时,FeCO3会分解生成氧化亚铁和 氧化碳,
(1)绿矾溶解后,溶液中大量存在的金属阳离子是 (填离子符号)。按照 般的物质分类方法,绿矾(FeSO4·7H2O)属于 (填“氧化物”、“酸”、“碱”或“盐”)。
(2)转化步骤中, 般控制温度不能超过 30℃,其原因是 。
(3)在焙烧过程中作为还原剂的是 氧化碳。产生还原剂 氧化碳的反应化学方程式是 ;该工艺得到的粗还原铁粉往往含有的杂质是 (填化学式)。
(4)在焙烧过程中需加入 CaCO3进行脱硫处理.如图 1 为加 CaCO3和未加 CaCO3对还原铁粉产率的影响,据图分析 CaCO3的另 作用为 。
(5)粗还原铁粉经加工处理后制得较为纯净的还原铁粉, 纯还原铁粉和水蒸气在高温条件下,可制得四氧化三铁( 种常用的磁性材料)同时 成 种气体,其装置如图 2 所示:SAP 材料吸水性强,湿润的 SAP 材料能为该反应持续提供水蒸气,实验开始 段时间后,观察到肥皂液中有大量的气泡产 ,此气泡用火柴即能点燃,同时有肥皂泡飘到空中, 试写出纯还原铁粉和水蒸气反应的化学方程式 ,干燥的 SAP 材料的作用是 。
18.一水合硫酸锰(·)是白色或浅粉红色的晶体,易溶于水,不溶于乙醇,是重要的微量元素肥料,也可用作饲料添加剂,合成脂肪酸的催化剂。工业上可用软锰矿(主要成分为MnO2,还含有少量MgO、Al2O3,及Fe2O3等杂质)与化工厂含SO2的废气制备一水合硫酸锰,生产工艺流程如下图所示。
【查阅资料】
Ⅰ.不溶于水,不与酸反应。
Ⅱ. 酸浸过程中MnO2发生的主要反应为:
Ⅲ. 部分金属阳离子生成氢氧化物沉淀的pH范围如下(开始沉淀~完全沉淀);
Fe3+:1.8~3.2 Al3+:4.1~5.0 Mn2+:8.3~9.8 Mg2+:9.4~12.4
(1)生产中将软锰矿粉碎的目的是 。
(2)酸浸时MgO与酸发生反应的化学方程式是 。
(3)酸浸时SO2的吸收效率与pH、温度的关系如下图所示。为提高SO2的吸收效率,酸浸时溶液pH和温度应控制在 最适宜。
(4)加入石灰浆调节pH,可将浸出液中杂质离子形成氢氧化物沉淀而除去。沉淀完全后,滤液中含有的金属离子是 (填离子符号)。
(5)从滤液中得到纯净的MnSO4·H2O,需要洗涤晶体。为减少晶体损失,可选用的洗涤液为 (填字母序号)
a. 乙醇 b. 水(常温) c.饱和MnSO4溶液
19.纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。然后再焙烧NaHCO3制得纯碱(Na2CO3)。生产纯碱的工艺流程示意图如下:
请回答下列问题:
①操作A的名称为 。
②可用 方法获得物质B固体
③向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,其原因是 。
④析出NaHCO3晶体中可能含有少量氯离子杂质,实验室确定NaHCO3晶体表面杂质洗净的方法
(2)常温下在10mL10.6g·L-1Na2CO3溶液中逐滴加入3.65g·L-1HCl溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如图所示。
根据图示回答下列问题:
①在同一溶液中,、、H2CO3 (填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为 (填化学式)。
(3)浓盐酸的溶质质量分数为36%,密度是1.18g/cm3,现要配制0.365%的稀盐酸(该稀盐酸密度近似为水的密度)200ml,需要该浓盐酸 毫升, 配制时还应加入 毫升水。(水的密度为1.00g/cm3)(保留2位小数)
2024年中考化学强化复习+工艺流程题参考答案
1.香兰素是一种广泛使用的可食用香料,从香兰草豆荚粉中提取香兰素()的流程如下。
(1)香兰素由 种元素组成。
(2)将香兰素的乙醇溶液蒸馏,得到香兰素。该过程发生的是 变化(填“物理”或“化学”)。
(3)该流程中,可循环使用的物质有和 。
【答案】(1)三/3
(2)物理
(3)无水乙醇
2.高纯碳酸钙广泛应用于精密电子陶瓷、医药等生产。某兴趣小组按图所示实验步骤,模拟工业流程制备高纯碳酸钙。请回答下列问题:
(1)试剂X是 。
(2)“操作1”的名称 ,该操作需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)“转化2”过程中发生反应的化学方程式为 (转化中H2O参与反应);
(4)该流程中可循环利用的物质是 (填化学式)。
【答案】 稀HC1 过滤 漏斗 CO2
3.某工业废液中含有AgNO3、Zn(NO3)2和Fe(NO3)2。现要回收银,并得到副产品FeSO4·7H2O,基本流程如下:
(1)操作1和2的名称是 ,所用玻璃仪器有:烧杯、玻璃棒、 。
(2)确认操作2中稀硫酸已足量的操作是:向固体中加入 ,无现象。
(3)该流程有关说法正确的是 。
a.过量X是锌 b.操作2、操作3玻璃棒作用相同 c.溶液B中的溶质是2种
【答案】 过滤 漏斗 稀硫酸,无气泡产生 c
4.硝酸钙 [Ca(NO3)2] 可用于无土栽培。一种利用石灰石制备硝酸钙晶体的流程如下图。已知:硝酸会挥发、受热会分解。
(1)气体X为 (填化学式)。
(2)“制浆”过程中会 (填“吸收”或“放出”)热量。
(3)写出“中和”步骤主要反应的化学方程式: 。
【答案】(1)CO2
(2)放出
(3)Ca(OH)2 + 2HNO3=Ca(NO3)2 + 2H2O
5.某NaCl样品含有可溶性杂质CaCl2、Na2SO4,为了得到纯净的NaCl固体,按以下流程进行操作。
(1)操作Ⅱ的名称是 。
(2)写出加入BaCl2溶液时发生反应的化学方程式: 。
(3)若在加入过量Na2CO3溶液后忘记进行操作I,则所得NaCl固体中含有的杂质是 。
【答案】(1)蒸发结晶
(2)
(3)CaCl2、BaCl2
6.粗盐中除含有NaCl、泥沙外,还含有少量MgCl2、CaCl2、Na2SO4等杂质。某兴趣小组设计了如下实验除去粗盐中的杂质
(1)试剂a包括:①过量的氢氧化钠溶液:②过量的氯化钡溶液;③过量的碳酸钠溶液。加入三种溶液的顺序是 (填序号)。
(2)过滤后所得的沉淀中,除了泥沙外,还有 (填化学式)
(3)过滤后,加入盐酸的目的是什么? 。
【答案】 ①②③ Mg(OH)2、BaSO4、BaCO3、CaCO3 除去过量的碳酸钠和氢氧化钠
7.我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu 2O)和过量的木炭粉为原料来制得黄铜(铜和锌的合金,外观似黄金),其生产流程如下:
回答下列问题:
(1)黄铜的硬度比铜和锌都 (填“大”或“小”);
(2)加热时,发生的主要反应化学方程式为:①;②;③ (赤铜矿和木炭粉反应),该反应的基本反应类型属于 ;
(3)气体A中,除二氧化碳外还可能生成另一种气体,它的化学式是 ,该气体的用途 (写一条)
(4)鉴别黄铜和黄金有多种方法,用灼烧法鉴别产生的现象及结论是 。
【答案】 大 置换反应 CO 做燃料或做还原剂冶炼金属 将样品灼烧,表面变黑色的是黄铜,不变色的是黄金
8.科学探测发现,月球贮存有一定数量的甲烷和钛铁矿(主要成分FeTiO3)。人类有望利用月球上的资源,并通过一系列反应获取氢气为火箭提供燃料,获取氧气逐渐形成可供呼吸的大气层。如图是科学家设想的有关人类利用月球资源的操作流程:
(1)FeTiO3中铁元素的化合价为+2,则钛元素的化合价为 。
(2)写出水电解的化学反应方程式 。
(3)该流程中可循环利用的两种物质是H2和 。
【答案】(1)+4价
(2)2H2O2H2↑+O2↑
(3)甲烷/CH4
9.下列流程可用于制备硫酸铵。
步骤1.制硫酸:
(1)反应①的化学方程式为 。
(2)反应②为 ,其中X是 (填化学式)。
步骤2.合成氨:
(3)“原料气”中N2的制备:N2约占空气体积的五分之四,可通过分离液态空气的方法得到。
(4)“原料气”中H2的制备:高温时,CH4和水蒸气在催化剂作用下反应得到H2和CO2,该反应的化学方程式为 。
(5)反应③为,属于 反应(填基本反应类型)。
(6)NH3溶于水时形成氨水。
步骤3.制备硫酸铵:将NH3通入稀释后的硫酸溶液中,得到硫酸铵。
【答案】 H2O 化合
10.工业上可以用食盐和石灰石做原料制取纯碱(Na2CO3) , 生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能地转化成 NaHCO3 (固体沉淀物)和 NH4Cl(溶液) ,主要生产流程如下图所示。
(1)纯碱的水溶液呈 (填酸性、碱性或中性)。
(2)分离设备(Ⅰ)中的混合物用到的操作的名称在实验室中称为 。
(3)在煅烧炉中发生的化学方程式是 。
(4)对设备(Ⅱ)中的母液进行处理后,除水以外可在该工业流程中进行再利用的物质有 、 。
【答案】(1)碱性
(2)过滤
(3)CaCO3CaO+CO2↑
(4) 氯化钠或NaCl 氨气或NH3
11.铬是一种用途广泛的金属。工业上以铬铁矿[主要成分为Fe(CrO2)2]为原料冶炼铬(Cr),其工艺流程如下:
(1)实验室进行操作a,需要使用的玻璃仪器包括烧杯、玻璃棒和 。
(2)Fe(CrO2)2中铁元素为+2价,则铬元素为 价。
(3)反应Ⅱ的化学方程式是8Na2CrO4+3Na2S+20X=8Cr(OH)3↓+3Na2SO4+16NaOH,则物质X的化学式是 。
(4)反应Ⅲ中Cr(OH)3分解为两种氧化物,此反应的化学方程式是 。
【答案】(1)漏斗
(2)+3
(3)H2O
(4)
12.海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如下图。
(1)为除去粗盐水中的CaCl2、MgCl2和Na2SO4杂质,加入下列3种过量试剂的顺序依次可以是_______(填字母序号);
A.Na2CO3、NaOH、BaCl2 B.BaCl2、Na2CO3、NaOH
C.NaOH、Na2CO3、BaCl2 D.NaOH、BaCl2、Na2CO3
(2)写出生成碳酸氢钠的化学方程式 ;在该流程中,是先向饱和食盐水中通入过量的氨气,然后再通入过量的二氧化碳,先通入过量氨气的目的是 ;
(3)写出反应③MgCl2电解生成Mg和Cl2的化学反应方程式 ;
(4)海水中本身就有氯化镁,请分析反应①、②转化过程的目的 。
【答案】(1)BD
(2) 使溶液显碱性,有利于吸收CO2
(3)
(4)富集并提纯氯化镁(MgCl2)
13.暴雨过后的河水浑浊不堪,康康同学收集到一瓶浑浊的河水,模拟自来水厂的净水过程,最终制成蒸馏水,其实验过程如下图所示:
(1)A 物质的名称是 。操作①是 。
(2)操作②主要是除去一些异味和色素,应选用下列装置中的 (填序号)。
(3)小刚取少量液体 D 于试管中,加入少量 区分硬水和软水,发现有较多浮渣产生,说明液体 D 是 水。所以康康同学在实验室进行了操作③,操作③应选用的装置是 (填序号)。
(4)康康同学的净化水过程和自来水厂净化水过程相比,缺少的操作名称是: ,多余的操作名称是: 。
【答案】(1) 明矾 过滤
(2)(Ⅱ)
(3) 肥皂水 硬水 (Ⅰ)
(4) 杀菌消毒 蒸馏
14.Li2CO3是制备锂电池的重要原料。实验室以锂辉石精矿(含Li2O·Al2O3·4SiO2和其它杂质)为原料制取Li2CO3的硫酸法生产工艺流程如图所示:
已知:
① ,
②K2SO4在水中的溶解度受温度变化影响不大。
③Li2CO3在热水中的溶解度很小。
(1)“研磨”的目的是 。
(2)“水浸”后的滤液中含有的主要离子有 。
(3)“沉锂”发生的复分解反应是 (写化学方程式),为了进一步回收滤液中的成分,可进行的操作有蒸发结晶、 (填作名称)、洗涤、干燥。
(4)使用热水“洗涤”,原因是 。为了检验产品是否洗涤干净,取洗涤后的溶液于试管,并滴入 (填名称)溶液,若观察到 ,则说明洗涤干净。
【答案】(1)增大反应物之间的接触面积,使反应更充分
(2)Li+、
(3) 过滤
(4) Li2CO3在热水中的溶解度很小,用“热水洗涤”可以减少碳酸锂的损失 氯化钡(合理即可) 无白色沉淀生成
15.海洋是巨大的资源宝库。学习小组模拟化工厂生产流程,利用海水制取纯减和金属镁,设计方案如图所示。请回答下列问题:
(1)流程I为海水“晒盐”:由海水获得粗盐的结晶方法是 。
(2)流程Ⅱ为粗盐精制:粗盐中通常含有泥沙等难溶性杂质和Ca2+、Mg2+、等可溶性杂质离子。为除去上述可溶性杂质离子,将粗盐溶解并依次加入下列试剂:过量NaOH溶液→过量BaCl2溶液→a→适量稀盐酸。
①上述除杂过程中,a是 。
③ 加入过量BaCl2溶液的目的是 。
③加入稀盐酸之前应进行的操作是 。
(3)流程Ⅲ为海水“制碱”:滤液A中碳酸氢钠是否饱和? (填“是”或“否”),流程Ⅲ中循环利用的物质X是 (填写化学式)。
(4)流程Ⅳ为海水提镁:氢氧化镁和盐酸反应的化学方程式为 ,母液中本来就有氯化镁,不直接进行电解来制取金属镁,而是经过了加石灰乳、盐酸等过程,这样做的目的是 。
【答案】(1)蒸发结晶
(2) 过量碳酸钠溶液 除去硫酸根离子 过滤
(3) 是 CO2
(4) Mg(OH)2+2HCl=MgCl2+2H2O 富集提纯镁盐
16.海水中蕴藏着丰富的化学资源。
(1)海水含有的氯、钠、镁、硫、钙、钾元素中属于金属元素的有 种。
(2)从海水中可获取食盐。
①海水晒盐的过程如图1所示。 池中的NaCl溶液一定是饱和溶液。
②实验室里去除粗盐中难溶性杂质的一般步骤为溶解、过滤、蒸发,这三种操作都要使用的玻璃仪器是 。
(3)淡化海水可采用图2所示膜分离技术。装置左侧的海水浓度会 (选填 “变大”“变小”或“不变”)。从海水中获得淡水,还可以采用的操作有 。
(4)海洋是地球上最大的“氢矿”,开发海洋“氢矿”是未来氢能发展的重要方向。
①直接电解海水制氢气,发生主要反应,则X为 。
②科学家研究的新型技术,可以直接电解海水中的水获得氢气,写出反应的化学方程式: 。
【答案】(1)4/四
(2) 结晶 玻璃棒
(3) 变大 蒸馏
(4) NaOH 略
17.绿矾(FeSO4·7H2O)的 种综合利用,其工艺流程如图(主要是生产还原铁粉):
已知: 隔绝空气进行“焙烧”时,FeCO3会分解生成氧化亚铁和 氧化碳,
(1)绿矾溶解后,溶液中大量存在的金属阳离子是 (填离子符号)。按照 般的物质分类方法,绿矾(FeSO4·7H2O)属于 (填“氧化物”、“酸”、“碱”或“盐”)。
(2)转化步骤中, 般控制温度不能超过 30℃,其原因是 。
(3)在焙烧过程中作为还原剂的是 氧化碳。产生还原剂 氧化碳的反应化学方程式是 ;该工艺得到的粗还原铁粉往往含有的杂质是 (填化学式)。
(4)在焙烧过程中需加入 CaCO3进行脱硫处理.如图 1 为加 CaCO3和未加 CaCO3对还原铁粉产率的影响,据图分析 CaCO3的另 作用为 。
(5)粗还原铁粉经加工处理后制得较为纯净的还原铁粉, 纯还原铁粉和水蒸气在高温条件下,可制得四氧化三铁( 种常用的磁性材料)同时 成 种气体,其装置如图 2 所示:SAP 材料吸水性强,湿润的 SAP 材料能为该反应持续提供水蒸气,实验开始 段时间后,观察到肥皂液中有大量的气泡产 ,此气泡用火柴即能点燃,同时有肥皂泡飘到空中, 试写出纯还原铁粉和水蒸气反应的化学方程式 ,干燥的 SAP 材料的作用是 。
【答案】(1) Fe2+ 盐
(2)碳酸氢铵受热易分解(或可防 碳酸氢铵分解)
(3) C
(4)增 还原铁粉的产率(或提 产率、或 温分解产 CO2、或可 成较多的 CO)
(5) 干燥剂或吸水作
18.一水合硫酸锰(·)是白色或浅粉红色的晶体,易溶于水,不溶于乙醇,是重要的微量元素肥料,也可用作饲料添加剂,合成脂肪酸的催化剂。工业上可用软锰矿(主要成分为MnO2,还含有少量MgO、Al2O3,及Fe2O3等杂质)与化工厂含SO2的废气制备一水合硫酸锰,生产工艺流程如下图所示。
【查阅资料】
Ⅰ.不溶于水,不与酸反应。
Ⅱ. 酸浸过程中MnO2发生的主要反应为:
Ⅲ. 部分金属阳离子生成氢氧化物沉淀的pH范围如下(开始沉淀~完全沉淀);
Fe3+:1.8~3.2 Al3+:4.1~5.0 Mn2+:8.3~9.8 Mg2+:9.4~12.4
(1)生产中将软锰矿粉碎的目的是 。
(2)酸浸时MgO与酸发生反应的化学方程式是 。
(3)酸浸时SO2的吸收效率与pH、温度的关系如下图所示。为提高SO2的吸收效率,酸浸时溶液pH和温度应控制在 最适宜。
(4)加入石灰浆调节pH,可将浸出液中杂质离子形成氢氧化物沉淀而除去。沉淀完全后,滤液中含有的金属离子是 (填离子符号)。
(5)从滤液中得到纯净的MnSO4·H2O,需要洗涤晶体。为减少晶体损失,可选用的洗涤液为 (填字母序号)
a. 乙醇 b. 水(常温) c.饱和MnSO4溶液
【答案】(1)增大反应物的接触面积,加快反应速率,提高浸取率
(2)
(3)溶液的pH为3,温度为40°C
(4)和
(5)ac/ca
19.纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。然后再焙烧NaHCO3制得纯碱(Na2CO3)。生产纯碱的工艺流程示意图如下:
请回答下列问题:
①操作A的名称为 。
②可用 方法获得物质B固体
③向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,其原因是 。
④析出NaHCO3晶体中可能含有少量氯离子杂质,实验室确定NaHCO3晶体表面杂质洗净的方法
(2)常温下在10mL10.6g·L-1Na2CO3溶液中逐滴加入3.65g·L-1HCl溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如图所示。
根据图示回答下列问题:
①在同一溶液中,、、H2CO3 (填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为 (填化学式)。
(3)浓盐酸的溶质质量分数为36%,密度是1.18g/cm3,现要配制0.365%的稀盐酸(该稀盐酸密度近似为水的密度)200ml,需要该浓盐酸 毫升, 配制时还应加入 毫升水。(水的密度为1.00g/cm3)(保留2位小数)
【答案】(1) 过滤 降温结晶 碳酸钠溶解度比碳酸氢钠大 取最后一次洗涤液,加稀硝酸酸化,再滴加AgNO3溶液,若不产生白色沉淀,该晶体洗净
(2) 不能 、H2CO3
(3) 1.72ml 198.28ml
1.香兰素是一种广泛使用的可食用香料,从香兰草豆荚粉中提取香兰素()的流程如下。
(1)香兰素由 种元素组成。
(2)将香兰素的乙醇溶液蒸馏,得到香兰素。该过程发生的是 变化(填“物理”或“化学”)。
(3)该流程中,可循环使用的物质有和 。
2.高纯碳酸钙广泛应用于精密电子陶瓷、医药等生产。某兴趣小组按图所示实验步骤,模拟工业流程制备高纯碳酸钙。请回答下列问题:
(1)试剂X是 。
(2)“操作1”的名称 ,该操作需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)“转化2”过程中发生反应的化学方程式为 (转化中H2O参与反应);
(4)该流程中可循环利用的物质是 (填化学式)。
3.某工业废液中含有AgNO3、Zn(NO3)2和Fe(NO3)2。现要回收银,并得到副产品FeSO4·7H2O,基本流程如下:
(1)操作1和2的名称是 ,所用玻璃仪器有:烧杯、玻璃棒、 。
(2)确认操作2中稀硫酸已足量的操作是:向固体中加入 ,无现象。
(3)该流程有关说法正确的是 。
a.过量X是锌 b.操作2、操作3玻璃棒作用相同 c.溶液B中的溶质是2种
4.硝酸钙 [Ca(NO3)2] 可用于无土栽培。一种利用石灰石制备硝酸钙晶体的流程如下图。已知:硝酸会挥发、受热会分解。
(1)气体X为 (填化学式)。
(2)“制浆”过程中会 (填“吸收”或“放出”)热量。
(3)写出“中和”步骤主要反应的化学方程式: 。
5.某NaCl样品含有可溶性杂质CaCl2、Na2SO4,为了得到纯净的NaCl固体,按以下流程进行操作。
(1)操作Ⅱ的名称是 。
(2)写出加入BaCl2溶液时发生反应的化学方程式: 。
(3)若在加入过量Na2CO3溶液后忘记进行操作I,则所得NaCl固体中含有的杂质是 。
6.粗盐中除含有NaCl、泥沙外,还含有少量MgCl2、CaCl2、Na2SO4等杂质。某兴趣小组设计了如下实验除去粗盐中的杂质
(1)试剂a包括:①过量的氢氧化钠溶液:②过量的氯化钡溶液;③过量的碳酸钠溶液。加入三种溶液的顺序是 (填序号)。
(2)过滤后所得的沉淀中,除了泥沙外,还有 (填化学式)
(3)过滤后,加入盐酸的目的是什么? 。
7.我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu 2O)和过量的木炭粉为原料来制得黄铜(铜和锌的合金,外观似黄金),其生产流程如下:
回答下列问题:
(1)黄铜的硬度比铜和锌都 (填“大”或“小”);
(2)加热时,发生的主要反应化学方程式为:①;②;③ (赤铜矿和木炭粉反应),该反应的基本反应类型属于 ;
(3)气体A中,除二氧化碳外还可能生成另一种气体,它的化学式是 ,该气体的用途 (写一条)
(4)鉴别黄铜和黄金有多种方法,用灼烧法鉴别产生的现象及结论是 。
8.科学探测发现,月球贮存有一定数量的甲烷和钛铁矿(主要成分FeTiO3)。人类有望利用月球上的资源,并通过一系列反应获取氢气为火箭提供燃料,获取氧气逐渐形成可供呼吸的大气层。如图是科学家设想的有关人类利用月球资源的操作流程:
(1)FeTiO3中铁元素的化合价为+2,则钛元素的化合价为 。
(2)写出水电解的化学反应方程式 。
(3)该流程中可循环利用的两种物质是H2和 。
9.下列流程可用于制备硫酸铵。
步骤1.制硫酸:
(1)反应①的化学方程式为 。
(2)反应②为 ,其中X是 (填化学式)。
步骤2.合成氨:
(3)“原料气”中N2的制备:N2约占空气体积的五分之四,可通过分离液态空气的方法得到。
(4)“原料气”中H2的制备:高温时,CH4和水蒸气在催化剂作用下反应得到H2和CO2,该反应的化学方程式为 。
(5)反应③为,属于 反应(填基本反应类型)。
(6)NH3溶于水时形成氨水。
步骤3.制备硫酸铵:将NH3通入稀释后的硫酸溶液中,得到硫酸铵。
10.工业上可以用食盐和石灰石做原料制取纯碱(Na2CO3) , 生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能地转化成 NaHCO3 (固体沉淀物)和 NH4Cl(溶液) ,主要生产流程如下图所示。
(1)纯碱的水溶液呈 (填酸性、碱性或中性)。
(2)分离设备(Ⅰ)中的混合物用到的操作的名称在实验室中称为 。
(3)在煅烧炉中发生的化学方程式是 。
(4)对设备(Ⅱ)中的母液进行处理后,除水以外可在该工业流程中进行再利用的物质有 、 。
11.铬是一种用途广泛的金属。工业上以铬铁矿[主要成分为Fe(CrO2)2]为原料冶炼铬(Cr),其工艺流程如下:
(1)实验室进行操作a,需要使用的玻璃仪器包括烧杯、玻璃棒和 。
(2)Fe(CrO2)2中铁元素为+2价,则铬元素为 价。
(3)反应Ⅱ的化学方程式是8Na2CrO4+3Na2S+20X=8Cr(OH)3↓+3Na2SO4+16NaOH,则物质X的化学式是 。
(4)反应Ⅲ中Cr(OH)3分解为两种氧化物,此反应的化学方程式是 。
12.海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如下图。
(1)为除去粗盐水中的CaCl2、MgCl2和Na2SO4杂质,加入下列3种过量试剂的顺序依次可以是_______(填字母序号);
A.Na2CO3、NaOH、BaCl2 B.BaCl2、Na2CO3、NaOH
C.NaOH、Na2CO3、BaCl2 D.NaOH、BaCl2、Na2CO3
(2)写出生成碳酸氢钠的化学方程式 ;在该流程中,是先向饱和食盐水中通入过量的氨气,然后再通入过量的二氧化碳,先通入过量氨气的目的是 ;
(3)写出反应③MgCl2电解生成Mg和Cl2的化学反应方程式 ;
(4)海水中本身就有氯化镁,请分析反应①、②转化过程的目的 。
13.暴雨过后的河水浑浊不堪,康康同学收集到一瓶浑浊的河水,模拟自来水厂的净水过程,最终制成蒸馏水,其实验过程如下图所示:
(1)A 物质的名称是 。操作①是 。
(2)操作②主要是除去一些异味和色素,应选用下列装置中的 (填序号)。
(3)小刚取少量液体 D 于试管中,加入少量 区分硬水和软水,发现有较多浮渣产生,说明液体 D 是 水。所以康康同学在实验室进行了操作③,操作③应选用的装置是 (填序号)。
(4)康康同学的净化水过程和自来水厂净化水过程相比,缺少的操作名称是: ,多余的操作名称是: 。
14.Li2CO3是制备锂电池的重要原料。实验室以锂辉石精矿(含Li2O·Al2O3·4SiO2和其它杂质)为原料制取Li2CO3的硫酸法生产工艺流程如图所示:
已知:
① ,
②K2SO4在水中的溶解度受温度变化影响不大。
③Li2CO3在热水中的溶解度很小。
(1)“研磨”的目的是 。
(2)“水浸”后的滤液中含有的主要离子有 。
(3)“沉锂”发生的复分解反应是 (写化学方程式),为了进一步回收滤液中的成分,可进行的操作有蒸发结晶、 (填作名称)、洗涤、干燥。
(4)使用热水“洗涤”,原因是 。为了检验产品是否洗涤干净,取洗涤后的溶液于试管,并滴入 (填名称)溶液,若观察到 ,则说明洗涤干净。
15.海洋是巨大的资源宝库。学习小组模拟化工厂生产流程,利用海水制取纯减和金属镁,设计方案如图所示。请回答下列问题:
(1)流程I为海水“晒盐”:由海水获得粗盐的结晶方法是 。
(2)流程Ⅱ为粗盐精制:粗盐中通常含有泥沙等难溶性杂质和Ca2+、Mg2+、等可溶性杂质离子。为除去上述可溶性杂质离子,将粗盐溶解并依次加入下列试剂:过量NaOH溶液→过量BaCl2溶液→a→适量稀盐酸。
①上述除杂过程中,a是 。
③ 加入过量BaCl2溶液的目的是 。
③加入稀盐酸之前应进行的操作是 。
(3)流程Ⅲ为海水“制碱”:滤液A中碳酸氢钠是否饱和? (填“是”或“否”),流程Ⅲ中循环利用的物质X是 (填写化学式)。
(4)流程Ⅳ为海水提镁:氢氧化镁和盐酸反应的化学方程式为 ,母液中本来就有氯化镁,不直接进行电解来制取金属镁,而是经过了加石灰乳、盐酸等过程,这样做的目的是 。
16.海水中蕴藏着丰富的化学资源。
(1)海水含有的氯、钠、镁、硫、钙、钾元素中属于金属元素的有 种。
(2)从海水中可获取食盐。
①海水晒盐的过程如图1所示。 池中的NaCl溶液一定是饱和溶液。
②实验室里去除粗盐中难溶性杂质的一般步骤为溶解、过滤、蒸发,这三种操作都要使用的玻璃仪器是 。
(3)淡化海水可采用图2所示膜分离技术。装置左侧的海水浓度会 (选填 “变大”“变小”或“不变”)。从海水中获得淡水,还可以采用的操作有 。
(4)海洋是地球上最大的“氢矿”,开发海洋“氢矿”是未来氢能发展的重要方向。
①直接电解海水制氢气,发生主要反应,则X为 。
②科学家研究的新型技术,可以直接电解海水中的水获得氢气,写出反应的化学方程式: 。
17.绿矾(FeSO4·7H2O)的 种综合利用,其工艺流程如图(主要是生产还原铁粉):
已知: 隔绝空气进行“焙烧”时,FeCO3会分解生成氧化亚铁和 氧化碳,
(1)绿矾溶解后,溶液中大量存在的金属阳离子是 (填离子符号)。按照 般的物质分类方法,绿矾(FeSO4·7H2O)属于 (填“氧化物”、“酸”、“碱”或“盐”)。
(2)转化步骤中, 般控制温度不能超过 30℃,其原因是 。
(3)在焙烧过程中作为还原剂的是 氧化碳。产生还原剂 氧化碳的反应化学方程式是 ;该工艺得到的粗还原铁粉往往含有的杂质是 (填化学式)。
(4)在焙烧过程中需加入 CaCO3进行脱硫处理.如图 1 为加 CaCO3和未加 CaCO3对还原铁粉产率的影响,据图分析 CaCO3的另 作用为 。
(5)粗还原铁粉经加工处理后制得较为纯净的还原铁粉, 纯还原铁粉和水蒸气在高温条件下,可制得四氧化三铁( 种常用的磁性材料)同时 成 种气体,其装置如图 2 所示:SAP 材料吸水性强,湿润的 SAP 材料能为该反应持续提供水蒸气,实验开始 段时间后,观察到肥皂液中有大量的气泡产 ,此气泡用火柴即能点燃,同时有肥皂泡飘到空中, 试写出纯还原铁粉和水蒸气反应的化学方程式 ,干燥的 SAP 材料的作用是 。
18.一水合硫酸锰(·)是白色或浅粉红色的晶体,易溶于水,不溶于乙醇,是重要的微量元素肥料,也可用作饲料添加剂,合成脂肪酸的催化剂。工业上可用软锰矿(主要成分为MnO2,还含有少量MgO、Al2O3,及Fe2O3等杂质)与化工厂含SO2的废气制备一水合硫酸锰,生产工艺流程如下图所示。
【查阅资料】
Ⅰ.不溶于水,不与酸反应。
Ⅱ. 酸浸过程中MnO2发生的主要反应为:
Ⅲ. 部分金属阳离子生成氢氧化物沉淀的pH范围如下(开始沉淀~完全沉淀);
Fe3+:1.8~3.2 Al3+:4.1~5.0 Mn2+:8.3~9.8 Mg2+:9.4~12.4
(1)生产中将软锰矿粉碎的目的是 。
(2)酸浸时MgO与酸发生反应的化学方程式是 。
(3)酸浸时SO2的吸收效率与pH、温度的关系如下图所示。为提高SO2的吸收效率,酸浸时溶液pH和温度应控制在 最适宜。
(4)加入石灰浆调节pH,可将浸出液中杂质离子形成氢氧化物沉淀而除去。沉淀完全后,滤液中含有的金属离子是 (填离子符号)。
(5)从滤液中得到纯净的MnSO4·H2O,需要洗涤晶体。为减少晶体损失,可选用的洗涤液为 (填字母序号)
a. 乙醇 b. 水(常温) c.饱和MnSO4溶液
19.纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。然后再焙烧NaHCO3制得纯碱(Na2CO3)。生产纯碱的工艺流程示意图如下:
请回答下列问题:
①操作A的名称为 。
②可用 方法获得物质B固体
③向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,其原因是 。
④析出NaHCO3晶体中可能含有少量氯离子杂质,实验室确定NaHCO3晶体表面杂质洗净的方法
(2)常温下在10mL10.6g·L-1Na2CO3溶液中逐滴加入3.65g·L-1HCl溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如图所示。
根据图示回答下列问题:
①在同一溶液中,、、H2CO3 (填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为 (填化学式)。
(3)浓盐酸的溶质质量分数为36%,密度是1.18g/cm3,现要配制0.365%的稀盐酸(该稀盐酸密度近似为水的密度)200ml,需要该浓盐酸 毫升, 配制时还应加入 毫升水。(水的密度为1.00g/cm3)(保留2位小数)
2024年中考化学强化复习+工艺流程题参考答案
1.香兰素是一种广泛使用的可食用香料,从香兰草豆荚粉中提取香兰素()的流程如下。
(1)香兰素由 种元素组成。
(2)将香兰素的乙醇溶液蒸馏,得到香兰素。该过程发生的是 变化(填“物理”或“化学”)。
(3)该流程中,可循环使用的物质有和 。
【答案】(1)三/3
(2)物理
(3)无水乙醇
2.高纯碳酸钙广泛应用于精密电子陶瓷、医药等生产。某兴趣小组按图所示实验步骤,模拟工业流程制备高纯碳酸钙。请回答下列问题:
(1)试剂X是 。
(2)“操作1”的名称 ,该操作需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)“转化2”过程中发生反应的化学方程式为 (转化中H2O参与反应);
(4)该流程中可循环利用的物质是 (填化学式)。
【答案】 稀HC1 过滤 漏斗 CO2
3.某工业废液中含有AgNO3、Zn(NO3)2和Fe(NO3)2。现要回收银,并得到副产品FeSO4·7H2O,基本流程如下:
(1)操作1和2的名称是 ,所用玻璃仪器有:烧杯、玻璃棒、 。
(2)确认操作2中稀硫酸已足量的操作是:向固体中加入 ,无现象。
(3)该流程有关说法正确的是 。
a.过量X是锌 b.操作2、操作3玻璃棒作用相同 c.溶液B中的溶质是2种
【答案】 过滤 漏斗 稀硫酸,无气泡产生 c
4.硝酸钙 [Ca(NO3)2] 可用于无土栽培。一种利用石灰石制备硝酸钙晶体的流程如下图。已知:硝酸会挥发、受热会分解。
(1)气体X为 (填化学式)。
(2)“制浆”过程中会 (填“吸收”或“放出”)热量。
(3)写出“中和”步骤主要反应的化学方程式: 。
【答案】(1)CO2
(2)放出
(3)Ca(OH)2 + 2HNO3=Ca(NO3)2 + 2H2O
5.某NaCl样品含有可溶性杂质CaCl2、Na2SO4,为了得到纯净的NaCl固体,按以下流程进行操作。
(1)操作Ⅱ的名称是 。
(2)写出加入BaCl2溶液时发生反应的化学方程式: 。
(3)若在加入过量Na2CO3溶液后忘记进行操作I,则所得NaCl固体中含有的杂质是 。
【答案】(1)蒸发结晶
(2)
(3)CaCl2、BaCl2
6.粗盐中除含有NaCl、泥沙外,还含有少量MgCl2、CaCl2、Na2SO4等杂质。某兴趣小组设计了如下实验除去粗盐中的杂质
(1)试剂a包括:①过量的氢氧化钠溶液:②过量的氯化钡溶液;③过量的碳酸钠溶液。加入三种溶液的顺序是 (填序号)。
(2)过滤后所得的沉淀中,除了泥沙外,还有 (填化学式)
(3)过滤后,加入盐酸的目的是什么? 。
【答案】 ①②③ Mg(OH)2、BaSO4、BaCO3、CaCO3 除去过量的碳酸钠和氢氧化钠
7.我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu 2O)和过量的木炭粉为原料来制得黄铜(铜和锌的合金,外观似黄金),其生产流程如下:
回答下列问题:
(1)黄铜的硬度比铜和锌都 (填“大”或“小”);
(2)加热时,发生的主要反应化学方程式为:①;②;③ (赤铜矿和木炭粉反应),该反应的基本反应类型属于 ;
(3)气体A中,除二氧化碳外还可能生成另一种气体,它的化学式是 ,该气体的用途 (写一条)
(4)鉴别黄铜和黄金有多种方法,用灼烧法鉴别产生的现象及结论是 。
【答案】 大 置换反应 CO 做燃料或做还原剂冶炼金属 将样品灼烧,表面变黑色的是黄铜,不变色的是黄金
8.科学探测发现,月球贮存有一定数量的甲烷和钛铁矿(主要成分FeTiO3)。人类有望利用月球上的资源,并通过一系列反应获取氢气为火箭提供燃料,获取氧气逐渐形成可供呼吸的大气层。如图是科学家设想的有关人类利用月球资源的操作流程:
(1)FeTiO3中铁元素的化合价为+2,则钛元素的化合价为 。
(2)写出水电解的化学反应方程式 。
(3)该流程中可循环利用的两种物质是H2和 。
【答案】(1)+4价
(2)2H2O2H2↑+O2↑
(3)甲烷/CH4
9.下列流程可用于制备硫酸铵。
步骤1.制硫酸:
(1)反应①的化学方程式为 。
(2)反应②为 ,其中X是 (填化学式)。
步骤2.合成氨:
(3)“原料气”中N2的制备:N2约占空气体积的五分之四,可通过分离液态空气的方法得到。
(4)“原料气”中H2的制备:高温时,CH4和水蒸气在催化剂作用下反应得到H2和CO2,该反应的化学方程式为 。
(5)反应③为,属于 反应(填基本反应类型)。
(6)NH3溶于水时形成氨水。
步骤3.制备硫酸铵:将NH3通入稀释后的硫酸溶液中,得到硫酸铵。
【答案】 H2O 化合
10.工业上可以用食盐和石灰石做原料制取纯碱(Na2CO3) , 生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能地转化成 NaHCO3 (固体沉淀物)和 NH4Cl(溶液) ,主要生产流程如下图所示。
(1)纯碱的水溶液呈 (填酸性、碱性或中性)。
(2)分离设备(Ⅰ)中的混合物用到的操作的名称在实验室中称为 。
(3)在煅烧炉中发生的化学方程式是 。
(4)对设备(Ⅱ)中的母液进行处理后,除水以外可在该工业流程中进行再利用的物质有 、 。
【答案】(1)碱性
(2)过滤
(3)CaCO3CaO+CO2↑
(4) 氯化钠或NaCl 氨气或NH3
11.铬是一种用途广泛的金属。工业上以铬铁矿[主要成分为Fe(CrO2)2]为原料冶炼铬(Cr),其工艺流程如下:
(1)实验室进行操作a,需要使用的玻璃仪器包括烧杯、玻璃棒和 。
(2)Fe(CrO2)2中铁元素为+2价,则铬元素为 价。
(3)反应Ⅱ的化学方程式是8Na2CrO4+3Na2S+20X=8Cr(OH)3↓+3Na2SO4+16NaOH,则物质X的化学式是 。
(4)反应Ⅲ中Cr(OH)3分解为两种氧化物,此反应的化学方程式是 。
【答案】(1)漏斗
(2)+3
(3)H2O
(4)
12.海洋是一个巨大的资源宝库。海水资源综合利用的部分途径如下图。
(1)为除去粗盐水中的CaCl2、MgCl2和Na2SO4杂质,加入下列3种过量试剂的顺序依次可以是_______(填字母序号);
A.Na2CO3、NaOH、BaCl2 B.BaCl2、Na2CO3、NaOH
C.NaOH、Na2CO3、BaCl2 D.NaOH、BaCl2、Na2CO3
(2)写出生成碳酸氢钠的化学方程式 ;在该流程中,是先向饱和食盐水中通入过量的氨气,然后再通入过量的二氧化碳,先通入过量氨气的目的是 ;
(3)写出反应③MgCl2电解生成Mg和Cl2的化学反应方程式 ;
(4)海水中本身就有氯化镁,请分析反应①、②转化过程的目的 。
【答案】(1)BD
(2) 使溶液显碱性,有利于吸收CO2
(3)
(4)富集并提纯氯化镁(MgCl2)
13.暴雨过后的河水浑浊不堪,康康同学收集到一瓶浑浊的河水,模拟自来水厂的净水过程,最终制成蒸馏水,其实验过程如下图所示:
(1)A 物质的名称是 。操作①是 。
(2)操作②主要是除去一些异味和色素,应选用下列装置中的 (填序号)。
(3)小刚取少量液体 D 于试管中,加入少量 区分硬水和软水,发现有较多浮渣产生,说明液体 D 是 水。所以康康同学在实验室进行了操作③,操作③应选用的装置是 (填序号)。
(4)康康同学的净化水过程和自来水厂净化水过程相比,缺少的操作名称是: ,多余的操作名称是: 。
【答案】(1) 明矾 过滤
(2)(Ⅱ)
(3) 肥皂水 硬水 (Ⅰ)
(4) 杀菌消毒 蒸馏
14.Li2CO3是制备锂电池的重要原料。实验室以锂辉石精矿(含Li2O·Al2O3·4SiO2和其它杂质)为原料制取Li2CO3的硫酸法生产工艺流程如图所示:
已知:
① ,
②K2SO4在水中的溶解度受温度变化影响不大。
③Li2CO3在热水中的溶解度很小。
(1)“研磨”的目的是 。
(2)“水浸”后的滤液中含有的主要离子有 。
(3)“沉锂”发生的复分解反应是 (写化学方程式),为了进一步回收滤液中的成分,可进行的操作有蒸发结晶、 (填作名称)、洗涤、干燥。
(4)使用热水“洗涤”,原因是 。为了检验产品是否洗涤干净,取洗涤后的溶液于试管,并滴入 (填名称)溶液,若观察到 ,则说明洗涤干净。
【答案】(1)增大反应物之间的接触面积,使反应更充分
(2)Li+、
(3) 过滤
(4) Li2CO3在热水中的溶解度很小,用“热水洗涤”可以减少碳酸锂的损失 氯化钡(合理即可) 无白色沉淀生成
15.海洋是巨大的资源宝库。学习小组模拟化工厂生产流程,利用海水制取纯减和金属镁,设计方案如图所示。请回答下列问题:
(1)流程I为海水“晒盐”:由海水获得粗盐的结晶方法是 。
(2)流程Ⅱ为粗盐精制:粗盐中通常含有泥沙等难溶性杂质和Ca2+、Mg2+、等可溶性杂质离子。为除去上述可溶性杂质离子,将粗盐溶解并依次加入下列试剂:过量NaOH溶液→过量BaCl2溶液→a→适量稀盐酸。
①上述除杂过程中,a是 。
③ 加入过量BaCl2溶液的目的是 。
③加入稀盐酸之前应进行的操作是 。
(3)流程Ⅲ为海水“制碱”:滤液A中碳酸氢钠是否饱和? (填“是”或“否”),流程Ⅲ中循环利用的物质X是 (填写化学式)。
(4)流程Ⅳ为海水提镁:氢氧化镁和盐酸反应的化学方程式为 ,母液中本来就有氯化镁,不直接进行电解来制取金属镁,而是经过了加石灰乳、盐酸等过程,这样做的目的是 。
【答案】(1)蒸发结晶
(2) 过量碳酸钠溶液 除去硫酸根离子 过滤
(3) 是 CO2
(4) Mg(OH)2+2HCl=MgCl2+2H2O 富集提纯镁盐
16.海水中蕴藏着丰富的化学资源。
(1)海水含有的氯、钠、镁、硫、钙、钾元素中属于金属元素的有 种。
(2)从海水中可获取食盐。
①海水晒盐的过程如图1所示。 池中的NaCl溶液一定是饱和溶液。
②实验室里去除粗盐中难溶性杂质的一般步骤为溶解、过滤、蒸发,这三种操作都要使用的玻璃仪器是 。
(3)淡化海水可采用图2所示膜分离技术。装置左侧的海水浓度会 (选填 “变大”“变小”或“不变”)。从海水中获得淡水,还可以采用的操作有 。
(4)海洋是地球上最大的“氢矿”,开发海洋“氢矿”是未来氢能发展的重要方向。
①直接电解海水制氢气,发生主要反应,则X为 。
②科学家研究的新型技术,可以直接电解海水中的水获得氢气,写出反应的化学方程式: 。
【答案】(1)4/四
(2) 结晶 玻璃棒
(3) 变大 蒸馏
(4) NaOH 略
17.绿矾(FeSO4·7H2O)的 种综合利用,其工艺流程如图(主要是生产还原铁粉):
已知: 隔绝空气进行“焙烧”时,FeCO3会分解生成氧化亚铁和 氧化碳,
(1)绿矾溶解后,溶液中大量存在的金属阳离子是 (填离子符号)。按照 般的物质分类方法,绿矾(FeSO4·7H2O)属于 (填“氧化物”、“酸”、“碱”或“盐”)。
(2)转化步骤中, 般控制温度不能超过 30℃,其原因是 。
(3)在焙烧过程中作为还原剂的是 氧化碳。产生还原剂 氧化碳的反应化学方程式是 ;该工艺得到的粗还原铁粉往往含有的杂质是 (填化学式)。
(4)在焙烧过程中需加入 CaCO3进行脱硫处理.如图 1 为加 CaCO3和未加 CaCO3对还原铁粉产率的影响,据图分析 CaCO3的另 作用为 。
(5)粗还原铁粉经加工处理后制得较为纯净的还原铁粉, 纯还原铁粉和水蒸气在高温条件下,可制得四氧化三铁( 种常用的磁性材料)同时 成 种气体,其装置如图 2 所示:SAP 材料吸水性强,湿润的 SAP 材料能为该反应持续提供水蒸气,实验开始 段时间后,观察到肥皂液中有大量的气泡产 ,此气泡用火柴即能点燃,同时有肥皂泡飘到空中, 试写出纯还原铁粉和水蒸气反应的化学方程式 ,干燥的 SAP 材料的作用是 。
【答案】(1) Fe2+ 盐
(2)碳酸氢铵受热易分解(或可防 碳酸氢铵分解)
(3) C
(4)增 还原铁粉的产率(或提 产率、或 温分解产 CO2、或可 成较多的 CO)
(5) 干燥剂或吸水作
18.一水合硫酸锰(·)是白色或浅粉红色的晶体,易溶于水,不溶于乙醇,是重要的微量元素肥料,也可用作饲料添加剂,合成脂肪酸的催化剂。工业上可用软锰矿(主要成分为MnO2,还含有少量MgO、Al2O3,及Fe2O3等杂质)与化工厂含SO2的废气制备一水合硫酸锰,生产工艺流程如下图所示。
【查阅资料】
Ⅰ.不溶于水,不与酸反应。
Ⅱ. 酸浸过程中MnO2发生的主要反应为:
Ⅲ. 部分金属阳离子生成氢氧化物沉淀的pH范围如下(开始沉淀~完全沉淀);
Fe3+:1.8~3.2 Al3+:4.1~5.0 Mn2+:8.3~9.8 Mg2+:9.4~12.4
(1)生产中将软锰矿粉碎的目的是 。
(2)酸浸时MgO与酸发生反应的化学方程式是 。
(3)酸浸时SO2的吸收效率与pH、温度的关系如下图所示。为提高SO2的吸收效率,酸浸时溶液pH和温度应控制在 最适宜。
(4)加入石灰浆调节pH,可将浸出液中杂质离子形成氢氧化物沉淀而除去。沉淀完全后,滤液中含有的金属离子是 (填离子符号)。
(5)从滤液中得到纯净的MnSO4·H2O,需要洗涤晶体。为减少晶体损失,可选用的洗涤液为 (填字母序号)
a. 乙醇 b. 水(常温) c.饱和MnSO4溶液
【答案】(1)增大反应物的接触面积,加快反应速率,提高浸取率
(2)
(3)溶液的pH为3,温度为40°C
(4)和
(5)ac/ca
19.纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。然后再焙烧NaHCO3制得纯碱(Na2CO3)。生产纯碱的工艺流程示意图如下:
请回答下列问题:
①操作A的名称为 。
②可用 方法获得物质B固体
③向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,其原因是 。
④析出NaHCO3晶体中可能含有少量氯离子杂质,实验室确定NaHCO3晶体表面杂质洗净的方法
(2)常温下在10mL10.6g·L-1Na2CO3溶液中逐滴加入3.65g·L-1HCl溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如图所示。
根据图示回答下列问题:
①在同一溶液中,、、H2CO3 (填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为 (填化学式)。
(3)浓盐酸的溶质质量分数为36%,密度是1.18g/cm3,现要配制0.365%的稀盐酸(该稀盐酸密度近似为水的密度)200ml,需要该浓盐酸 毫升, 配制时还应加入 毫升水。(水的密度为1.00g/cm3)(保留2位小数)
【答案】(1) 过滤 降温结晶 碳酸钠溶解度比碳酸氢钠大 取最后一次洗涤液,加稀硝酸酸化,再滴加AgNO3溶液,若不产生白色沉淀,该晶体洗净
(2) 不能 、H2CO3
(3) 1.72ml 198.28ml
同课章节目录
