7.3.1乙醇课件(共36张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 7.3.1乙醇课件(共36张ppt)化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 24.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-24 00:00:00 | ||
图片预览







文档简介
(共36张PPT)
第七章 有机化合物
第二节 生活中两种常见的有机物
第1课时 乙醇
【核心素养】
1.宏观辨识与微观探析:能从元素和原子、分子水平认识乙醇的组成、结构、性质和变化,形成“结构决定性质”的观念
2.证据推理与模型认知:能依据乙醇的组成、结构,预测其化学性质,并能设计实验进行验证,能解释有关实验现象。
3.科学探究与创新意识:能在教师的指导下,通过与他人的讨论,对自己的学习活动进一步反思,发展善于合作、勤于思考、严谨求实的科学精神。
4.科学态度与社会责任:了解乙醇在人体内的变化,培养学生良好的生活习惯;强调酒后驾驶的危险性,深化学生的安全意识。
【教学重难点】
重点:乙醇的分子组成、结构和化学性质
难点:乙醇与钠及催化氧化反应原理的理解
“花间一壶酒,独酌无相亲。举杯邀明月,对影成三人”
“劝君更尽一杯酒,西出阳关无故人”
“借问酒家何处有,牧童遥指杏花村”
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深
4.白酒的主要成分是乙醇和水
5.酒精灯用完后为什么要盖上灯帽
6.用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(乙醇易溶于水)
(易挥发)
(良好的有机溶剂)
观察乙醇并联系生活归纳乙醇的物理性质
一、乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
酒精 无色 特殊香味 78.5℃易挥发 液体 与水以任意比互溶
比水小
医用酒精——75%(体积分数)
工业酒精——约含乙醇96%以上(体积分数)
无水乙醇—— 99.5%以上
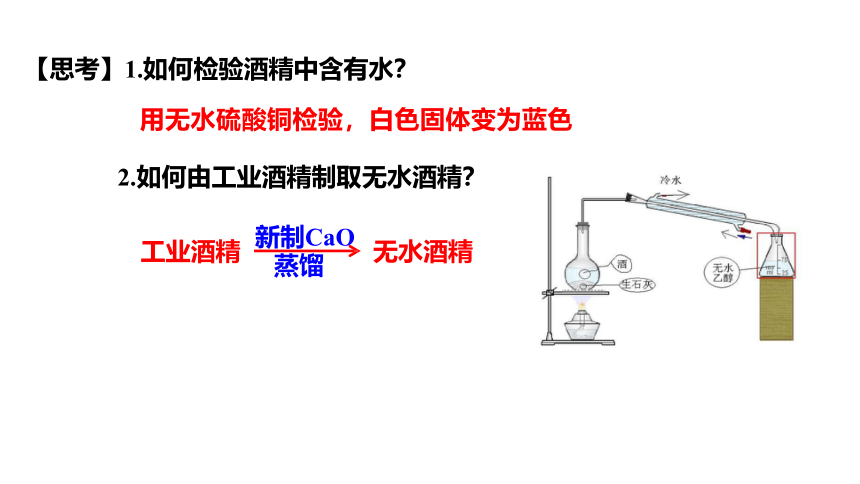
【思考】1.如何检验酒精中含有水?
2.如何由工业酒精制取无水酒精?
工业酒精 无水酒精
新制CaO
蒸馏
用无水硫酸铜检验,白色固体变为蓝色
【课堂练习】
李时珍在《本草纲目》中写到“烧酒非古法也,自元时始创其法。
用浓酒精和糟入甑,蒸令气上,用器承取滴露。”文中涉及的操
作方法是( )
A.分液 B.萃取 C.过滤 D.蒸馏
D
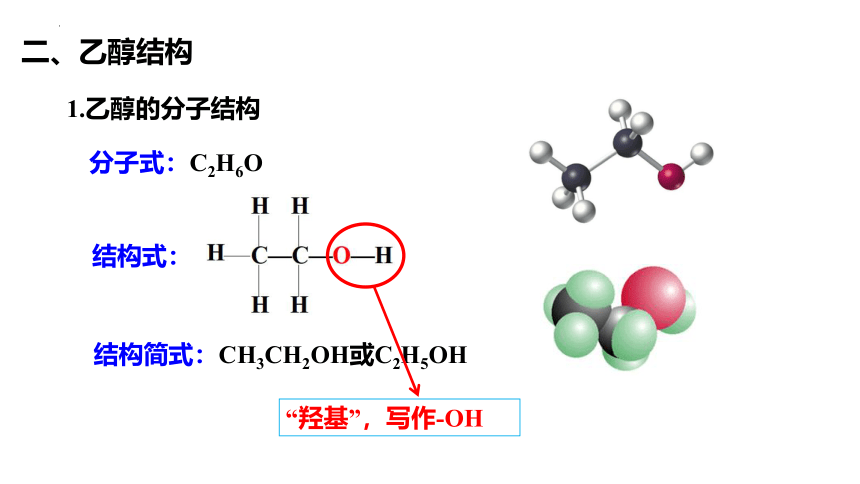
结构式:
分子式:C2H6O
二、乙醇结构
结构简式:CH3CH2OH或C2H5OH
1.乙醇的分子结构
“羟基”,写作-OH
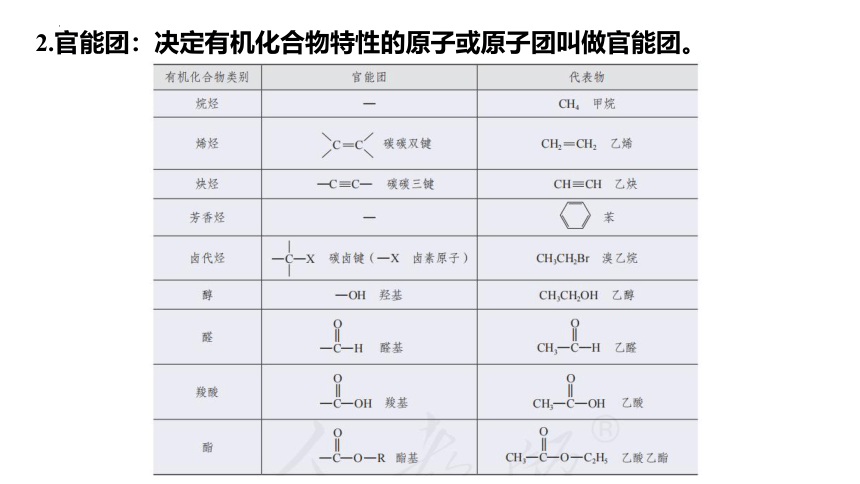
2.官能团:决定有机化合物特性的原子或原子团叫做官能团。
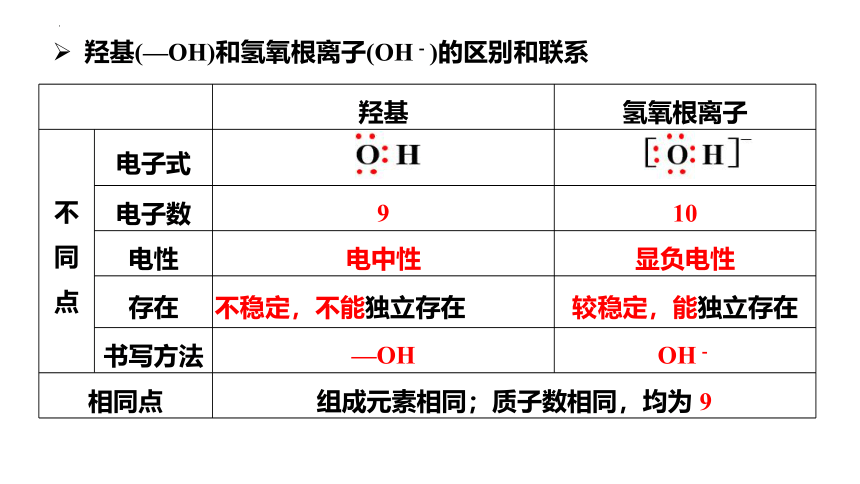
羟基 氢氧根离子
不 同 点 电子式
电子数 9 10
电性 电中性 显负电性
存在 不稳定,不能独立存在 较稳定,能独立存在
书写方法 —OH OH-
相同点 组成元素相同;质子数相同,均为 9 羟基(—OH)和氢氧根离子(OH-)的区别和联系
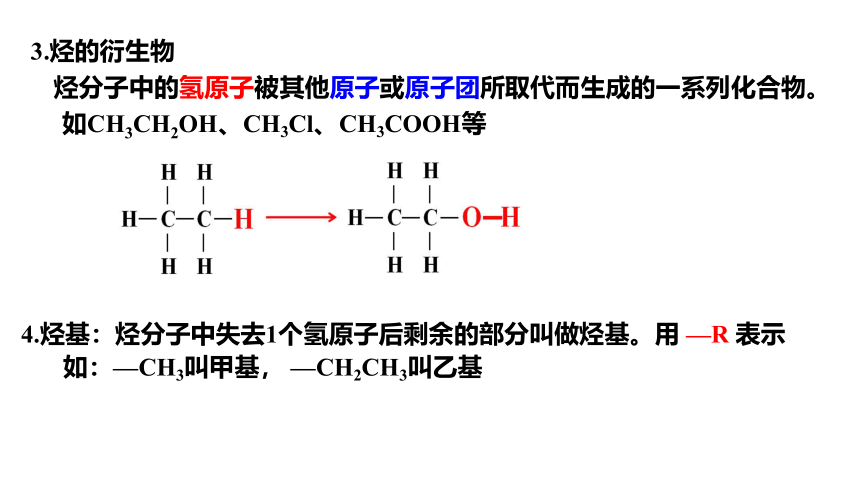
3.烃的衍生物
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
如CH3CH2OH、CH3Cl、CH3COOH等
4.烃基:烃分子中失去1个氢原子后剩余的部分叫做烃基。用 —R 表示
如:—CH3叫甲基, —CH2CH3叫乙基
(1)乙醇的官能团是OH-( )(2)乙醇的结构简式为C2H5OH,说明乙醇分子中共有两种氢原子( )
(3)乙烯的官能团是碳碳双键,乙烷的官能团是碳碳单键( )
(4)乙醇分子是由乙基和羟基构成的( )
【课堂练习】
1.判断正误
×
×
×
√
2.下列物质属于烃的衍生物的有_____________(填序号)。
⑤CH3CHO ⑥CH3CH2CH2OH⑦CH3COOH
②④⑤⑥⑦
1.钠下沉,最终慢慢消失
2.产生无色无味气体
3.点燃生成的气体,产生淡蓝色火焰
4.烧杯内壁有水珠产生
5.向烧杯中加入澄清石灰水不变浑浊
【实验现象】
三、乙醇的化学性质
1.乙醇与金属钠的反应
2CH3CH2OH +2Na →2CH3CH2ONa + H2↑
原理:Na置换出羟基中的H
规律:1 mol —OH ~ 1 mol Na ~ 0.5 mol H2
【思考】反应时断裂的是哪根键?
断 O—H 键
置换反应,不是取代反应
反应物水与钠乙醇与钠现象“浮、熔、游、响”“沉、不熔、不游、不响”结论:①密度:水>钠>乙醇②剧烈程度:钠与水反应比与乙醇反应更剧烈③乙醇羟基中的氢原子不如水分子中的氢原子活泼比较乙醇与水中H的活泼性强弱1.其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H2
请写出镁与乙醇反应的化学方程式。
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
【课堂练习】
2.写出乙二醇CH2OH-CH2OH和钠反应的化学方程式。
CH2-OH
CH2-OH
+2Na
CH2-ONa
CH2-ONa
+ H2↑
3.下列物质,都能与Na反应放出H2,其产生H2的速率排列顺序正确
的是( ) ①C2H5OH ②H2CO3溶液 ③H2O A.①>②>③ B.②>①>③ C.③>①>② D.②>③>①
4.甲醇 乙二醇 丙三醇中分别加入足量的金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是( )
A.2∶3∶6 B.3∶2∶1
C.4∶3∶1 D.6∶3∶2
D
D
2CO2 +3H2O
C2H5OH + 3O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
(1)燃烧反应(完全燃烧)
2.氧化反应
【思考】反应时断裂的是哪根键?
断①②③④⑤键
乙醇的催化氧化
加热
插入乙醇
有刺激性气味
铜丝红
Δ
变黑
插入乙醇溶液中
又变红
乙醛CH3CHO
Cu
CuO
Cu
2Cu + O2 = 2CuO
C2H5OH+ CuO CH3CHO+ H2O+ Cu
黑色
红色
2
2
2
2
2
相加
工业上利用该反应制取乙醛
2C2H5OH + O2
Cu
2CH3CHO + 2H2O
【思考】乙醇的催化氧化反应,断键发生在哪个位置呢?
2C2H5OH + O2
Cu
2CH3CHO + 2H2O
同时断 ①③ 键
(2)催化氧化
【拓展】醇的催化氧化反应规律
【规律】羟基碳(α—C) 1H成酮,2H成醛,无H不催。
H—C—C—O—H
H H
H H
焊接银器时,表面会生成发黑的氧化膜;银匠都是先把银在火上烧热,马上蘸一下酒精,银会光亮如初! 这是何原理?2C2H5OH + O2Ag2CH3CHO + 2H2O 【课堂练习】
1.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断键的说法不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂键①和③
C.在铜催化共热下与O2反应时断裂键①和⑤
D.在空气中完全燃烧时断裂键①②③④⑤
C
2.下列关于乙醇的说法正确的是( ) A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-而显碱性 B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性 C.乙醇与钠反应可以产生氢气,所以乙醇显酸性 D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
D
3.下列说法不正确的是( ) A.乙醇与金属钠反应时,是乙醇分子中羟基上的O—H键断裂 B.检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 C.乙醇在一定条件下可被氧化成CH3COOH D.除去乙醇中含有的微量水可加入金属钠,使其完全反应
D
4.判断下列物质是否发生羟基的催化氧化
CH3-CH-CH3
①
OH
-
CH3-CH-CH2-OH
-
CH3
②
CH3-C-OH
-
CH3
-
CH3
③
5.下列四种有机物不能被氧化为醛的是( )
① ②
③ ④
D
A.①和② B.②和③ C.③和④ D.①和④
(3)被酸性KMnO4 、K2Cr2O7 溶液氧化为乙酸
①能使酸性高锰酸钾褪色
②使酸性重铬酸钾由橙色变为绿色
或K2Cr2O7(H+)
KMnO4(H+)
CH3CH2OH CH3COOH
检验酒驾
酸性K2Cr2O7溶液
橙色
Cr3+
绿色
3.消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几
个小分子(如H2O、HX等),而生成含不饱和键的化合物的化学反应
原理:断—OH键和β—C上的C—H键
浓硫酸的作用:催化剂和脱水剂
条件:①外部:浓硫酸,加热(170℃)
②分子结构: β—C上有H
①CH3CH2CH2OH
②CH3CHCH2CH3
OH
【课堂练习】写出下列醇发生消去反应的化学反应方程式
CH3CH2CH2OH
浓H2SO4
170°C
CH3CH=CH2+H2O
浓H2SO4
170°C
CH3CH=CHCH3+H2O
CH3CHCH2CH3
OH
浓H2SO4
170°C
CH2=CHCH2CH3+H2O
CH3CHCH2CH3
OH
(1) 用作酒精灯、火锅、内燃机等的燃料。
(2) 用作化工原料、香料、化妆品、涂料等。
(3) 医疗上常用体积分数为75%的乙醇溶液作消毒剂。
四、用途
①
①③
【课堂小结】
①②③④⑤
乙醇的性质 键的断裂
与活泼金属反应
燃烧反应
催化氧化
消去反应
②⑤
第七章 有机化合物
第二节 生活中两种常见的有机物
第1课时 乙醇
【核心素养】
1.宏观辨识与微观探析:能从元素和原子、分子水平认识乙醇的组成、结构、性质和变化,形成“结构决定性质”的观念
2.证据推理与模型认知:能依据乙醇的组成、结构,预测其化学性质,并能设计实验进行验证,能解释有关实验现象。
3.科学探究与创新意识:能在教师的指导下,通过与他人的讨论,对自己的学习活动进一步反思,发展善于合作、勤于思考、严谨求实的科学精神。
4.科学态度与社会责任:了解乙醇在人体内的变化,培养学生良好的生活习惯;强调酒后驾驶的危险性,深化学生的安全意识。
【教学重难点】
重点:乙醇的分子组成、结构和化学性质
难点:乙醇与钠及催化氧化反应原理的理解
“花间一壶酒,独酌无相亲。举杯邀明月,对影成三人”
“劝君更尽一杯酒,西出阳关无故人”
“借问酒家何处有,牧童遥指杏花村”
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深
4.白酒的主要成分是乙醇和水
5.酒精灯用完后为什么要盖上灯帽
6.用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(乙醇易溶于水)
(易挥发)
(良好的有机溶剂)
观察乙醇并联系生活归纳乙醇的物理性质
一、乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
酒精 无色 特殊香味 78.5℃易挥发 液体 与水以任意比互溶
比水小
医用酒精——75%(体积分数)
工业酒精——约含乙醇96%以上(体积分数)
无水乙醇—— 99.5%以上
【思考】1.如何检验酒精中含有水?
2.如何由工业酒精制取无水酒精?
工业酒精 无水酒精
新制CaO
蒸馏
用无水硫酸铜检验,白色固体变为蓝色
【课堂练习】
李时珍在《本草纲目》中写到“烧酒非古法也,自元时始创其法。
用浓酒精和糟入甑,蒸令气上,用器承取滴露。”文中涉及的操
作方法是( )
A.分液 B.萃取 C.过滤 D.蒸馏
D
结构式:
分子式:C2H6O
二、乙醇结构
结构简式:CH3CH2OH或C2H5OH
1.乙醇的分子结构
“羟基”,写作-OH
2.官能团:决定有机化合物特性的原子或原子团叫做官能团。
羟基 氢氧根离子
不 同 点 电子式
电子数 9 10
电性 电中性 显负电性
存在 不稳定,不能独立存在 较稳定,能独立存在
书写方法 —OH OH-
相同点 组成元素相同;质子数相同,均为 9 羟基(—OH)和氢氧根离子(OH-)的区别和联系
3.烃的衍生物
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
如CH3CH2OH、CH3Cl、CH3COOH等
4.烃基:烃分子中失去1个氢原子后剩余的部分叫做烃基。用 —R 表示
如:—CH3叫甲基, —CH2CH3叫乙基
(1)乙醇的官能团是OH-( )(2)乙醇的结构简式为C2H5OH,说明乙醇分子中共有两种氢原子( )
(3)乙烯的官能团是碳碳双键,乙烷的官能团是碳碳单键( )
(4)乙醇分子是由乙基和羟基构成的( )
【课堂练习】
1.判断正误
×
×
×
√
2.下列物质属于烃的衍生物的有_____________(填序号)。
⑤CH3CHO ⑥CH3CH2CH2OH⑦CH3COOH
②④⑤⑥⑦
1.钠下沉,最终慢慢消失
2.产生无色无味气体
3.点燃生成的气体,产生淡蓝色火焰
4.烧杯内壁有水珠产生
5.向烧杯中加入澄清石灰水不变浑浊
【实验现象】
三、乙醇的化学性质
1.乙醇与金属钠的反应
2CH3CH2OH +2Na →2CH3CH2ONa + H2↑
原理:Na置换出羟基中的H
规律:1 mol —OH ~ 1 mol Na ~ 0.5 mol H2
【思考】反应时断裂的是哪根键?
断 O—H 键
置换反应,不是取代反应
反应物水与钠乙醇与钠现象“浮、熔、游、响”“沉、不熔、不游、不响”结论:①密度:水>钠>乙醇②剧烈程度:钠与水反应比与乙醇反应更剧烈③乙醇羟基中的氢原子不如水分子中的氢原子活泼比较乙醇与水中H的活泼性强弱1.其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H2
请写出镁与乙醇反应的化学方程式。
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
【课堂练习】
2.写出乙二醇CH2OH-CH2OH和钠反应的化学方程式。
CH2-OH
CH2-OH
+2Na
CH2-ONa
CH2-ONa
+ H2↑
3.下列物质,都能与Na反应放出H2,其产生H2的速率排列顺序正确
的是( ) ①C2H5OH ②H2CO3溶液 ③H2O A.①>②>③ B.②>①>③ C.③>①>② D.②>③>①
4.甲醇 乙二醇 丙三醇中分别加入足量的金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是( )
A.2∶3∶6 B.3∶2∶1
C.4∶3∶1 D.6∶3∶2
D
D
2CO2 +3H2O
C2H5OH + 3O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
(1)燃烧反应(完全燃烧)
2.氧化反应
【思考】反应时断裂的是哪根键?
断①②③④⑤键
乙醇的催化氧化
加热
插入乙醇
有刺激性气味
铜丝红
Δ
变黑
插入乙醇溶液中
又变红
乙醛CH3CHO
Cu
CuO
Cu
2Cu + O2 = 2CuO
C2H5OH+ CuO CH3CHO+ H2O+ Cu
黑色
红色
2
2
2
2
2
相加
工业上利用该反应制取乙醛
2C2H5OH + O2
Cu
2CH3CHO + 2H2O
【思考】乙醇的催化氧化反应,断键发生在哪个位置呢?
2C2H5OH + O2
Cu
2CH3CHO + 2H2O
同时断 ①③ 键
(2)催化氧化
【拓展】醇的催化氧化反应规律
【规律】羟基碳(α—C) 1H成酮,2H成醛,无H不催。
H—C—C—O—H
H H
H H
焊接银器时,表面会生成发黑的氧化膜;银匠都是先把银在火上烧热,马上蘸一下酒精,银会光亮如初! 这是何原理?2C2H5OH + O2Ag2CH3CHO + 2H2O 【课堂练习】
1.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断键的说法不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂键①和③
C.在铜催化共热下与O2反应时断裂键①和⑤
D.在空气中完全燃烧时断裂键①②③④⑤
C
2.下列关于乙醇的说法正确的是( ) A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-而显碱性 B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性 C.乙醇与钠反应可以产生氢气,所以乙醇显酸性 D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
D
3.下列说法不正确的是( ) A.乙醇与金属钠反应时,是乙醇分子中羟基上的O—H键断裂 B.检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 C.乙醇在一定条件下可被氧化成CH3COOH D.除去乙醇中含有的微量水可加入金属钠,使其完全反应
D
4.判断下列物质是否发生羟基的催化氧化
CH3-CH-CH3
①
OH
-
CH3-CH-CH2-OH
-
CH3
②
CH3-C-OH
-
CH3
-
CH3
③
5.下列四种有机物不能被氧化为醛的是( )
① ②
③ ④
D
A.①和② B.②和③ C.③和④ D.①和④
(3)被酸性KMnO4 、K2Cr2O7 溶液氧化为乙酸
①能使酸性高锰酸钾褪色
②使酸性重铬酸钾由橙色变为绿色
或K2Cr2O7(H+)
KMnO4(H+)
CH3CH2OH CH3COOH
检验酒驾
酸性K2Cr2O7溶液
橙色
Cr3+
绿色
3.消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几
个小分子(如H2O、HX等),而生成含不饱和键的化合物的化学反应
原理:断—OH键和β—C上的C—H键
浓硫酸的作用:催化剂和脱水剂
条件:①外部:浓硫酸,加热(170℃)
②分子结构: β—C上有H
①CH3CH2CH2OH
②CH3CHCH2CH3
OH
【课堂练习】写出下列醇发生消去反应的化学反应方程式
CH3CH2CH2OH
浓H2SO4
170°C
CH3CH=CH2+H2O
浓H2SO4
170°C
CH3CH=CHCH3+H2O
CH3CHCH2CH3
OH
浓H2SO4
170°C
CH2=CHCH2CH3+H2O
CH3CHCH2CH3
OH
(1) 用作酒精灯、火锅、内燃机等的燃料。
(2) 用作化工原料、香料、化妆品、涂料等。
(3) 医疗上常用体积分数为75%的乙醇溶液作消毒剂。
四、用途
①
①③
【课堂小结】
①②③④⑤
乙醇的性质 键的断裂
与活泼金属反应
燃烧反应
催化氧化
消去反应
②⑤
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
