2024年化学中考模拟试卷(贵州省)2(含答案)
文档属性
| 名称 | 2024年化学中考模拟试卷(贵州省)2(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 838.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-24 10:31:13 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024年化学中考模拟试卷(贵州省)
一、选择题(共7题;共14分)
1.(2分)下列有关“水循环”的说法中不正确的是( )
A.水的天然循环是通过其三态变化实现的
B.太阳为水分子提供了能量
C.天然循环实现了水资源的重新分配
D.水在循环过程中发生了化学变化
2.(2分)小科通过微信公众号“胜哥课程”观看了《pH试纸的使用》科学视频,对相关知识有了深刻的理解。用pH试纸测定白醋的酸碱度时.如果先将试纸用蒸馏水润湿,再把白醋滴在试纸上,则测得的结果与白醋实际的pH比较( )
A.偏低 B.偏高 C.相等 D.无法比较
3.(2分)下列选项中,没有涉及化学变化的是( )
A.植物光合作用 B.钻木取火
C.民间剪纸 D.叶脉书签的制作
4.(2分)下列物质的名称(或俗称)与化学式对应错误的是( )
A.氖气—Ne2 B.纯碱—Na2CO3
C.甲烷—CH4 D.乙醇—C2H5OH
5.(2分)某种催化剂可将汽车尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分。根据该反应的微观示意图,分析下列说法正确的是( )
A.四种物质均属于化合物
B.生成丙和丁的质量比为 22:7
C.参加反应的甲和乙的分子个数比为 1:2
D.物质丙由原子构成
6.(2分)下列实验操作对应的现象和结论正确的是( )
实验操作 现象 结论
A 某待测液中加氯化钙溶液 有白色沉淀生成 该溶液为AgNO3溶液
B 将CO通入氧化铁粉末中 粉末由黑色变为红色 CO有还原性
C 将2根铜丝分别放入硫酸铝溶液和硝酸银溶液中,观察现象 硫酸铝溶液没有明显现象,硝酸银溶液逐渐变蓝,其中铜丝表面有银色物质析出 金属活动性顺序:Al>Cu>Ag
D 将铜片和黄铜片相互刻画 铜片上留下划痕,黄铜片无明显现象 合金硬度比组成它的纯金属硬度小
A.A B.B C.C D.D
7.(2分)如图,甲、乙是初中化学常见的物质,图中“—”表示相连的物质可以反应,“→”表示由某种物质转化为另一种物质(部分反应物、生成、反应条件已略去),下列说法中正确的是( )
A.甲一定是Fe;乙一定是NaOH
B.丙物质可以是非金属氧化物或铵盐
C.H2SO4→CuSO4可通过稀硫酸与铜发生置换反应实现
D.图中提供的物质无法配成具有杀菌作用的波尔多液
二、非选择题(共7题;共46分)
8.(7分)请根据表回答有关问题:
序号
物质 醋酸 水 熟石灰 纯碱
化学式
(1)(3分)表中的物质属于氧化物的是 属于碱的是 ;属于盐的是 .
(2)(2分)利用表中的物质作为反应物,写出符合下列要求的化学方程式.
电解水 .
熟石灰和纯碱反应 .
(3)(1分)若要测定纯碱溶液的酸碱度,可选用下列选项中的 .
无色酚酞试液 紫色石蕊试液 试纸
(4)(1分)槟榔芋皮上含有一种碱性的物质--皂角素,皮肤沾上它会奇痒难忍.你认为可选用下列 来涂抹止痒.
食醋含醋酸 熟石灰 纯碱.
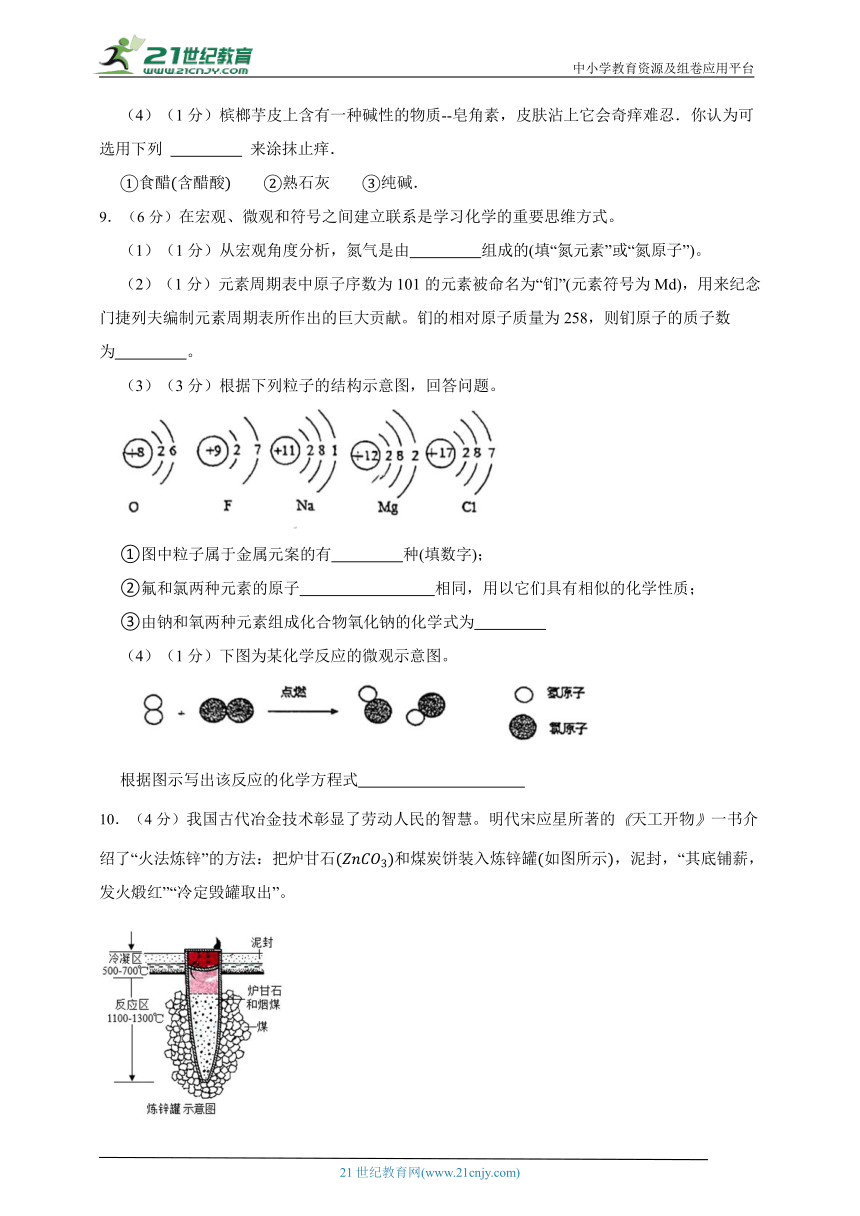
9.(6分)在宏观、微观和符号之间建立联系是学习化学的重要思维方式。
(1)(1分)从宏观角度分析,氮气是由 组成的(填“氮元素”或“氮原子”)。
(2)(1分)元素周期表中原子序数为101的元素被命名为“钔”(元素符号为Md),用来纪念门捷列夫编制元素周期表所作出的巨大贡献。钔的相对原子质量为258,则钔原子的质子数为 。
(3)(3分)根据下列粒子的结构示意图,回答问题。
①图中粒子属于金属元案的有 种(填数字);
②氟和氯两种元素的原子 相同,用以它们具有相似的化学性质;
③由钠和氧两种元素组成化合物氧化钠的化学式为
(4)(1分)下图为某化学反应的微观示意图。
根据图示写出该反应的化学方程式
10.(4分)我国古代冶金技术彰显了劳动人民的智慧。明代宋应星所著的天工开物一书介绍了“火法炼锌”的方法:把炉甘石和煤炭饼装入炼锌罐如图所示,泥封,“其底铺薪,发火煅红”“冷定毁罐取出”。
(1)(1分)炉甘石加入炼锌罐之前,先将其粉碎的目的是 合理即可。
(2)(1分)反应区中,炉甘石在高温下分解生成二氧化碳和另一种氧化物,该氧化物的化学式是 。
(3)(1分)反应区中,煤炭中的碳与氧化锌反应生成锌和二氧化碳,写出反应的化学方程式: 。
(4)(1分)向硝酸镁和硝酸铜的混合溶液中,加入一定量的锌粉,充分反应后过滤,得到滤渣和蓝色滤液。则滤渣中一定含有 。
11.(4分)小科通过微信公众号“胜哥课程”学习了溶解度曲线的课程后,对相关知识有了深刻的理解。图1是KNO3和NaCl的溶解度曲线。回答下列问题:
(1)(1分)将T2℃时KNO3和NaCl的饱和溶液各100g,降温至T1℃,所得溶液的溶质质量分数:KNO3 (填“>”、“<”或“=”)NaCl。
(2)(1分)图2试管底部有未溶解的KNO3固体,向烧杯的水中加入物质M后,试管中的固体增加,则加入的物质M可能是____(填字母)。
A.氯化钠固体 B.氢氧化钠固体
C.冰块 D.生石灰
(3)(2分)60℃时,向装有100g水的烧杯中加入一定量KNO3形成溶液,再降温至20℃,析出固体的质量变化如图3。
①ts时,烧杯中的溶液为 (填“饱和”或“不饱和”)溶液。
②60℃时,烧杯中溶液的质量为 g。
12.(6分)下表是日常生活中常见的用品及其有效成分:
用品 发酵粉 炉具清洁剂 洁瓷净
有效成分 碳酸氢钠 氢氧化钠 盐酸
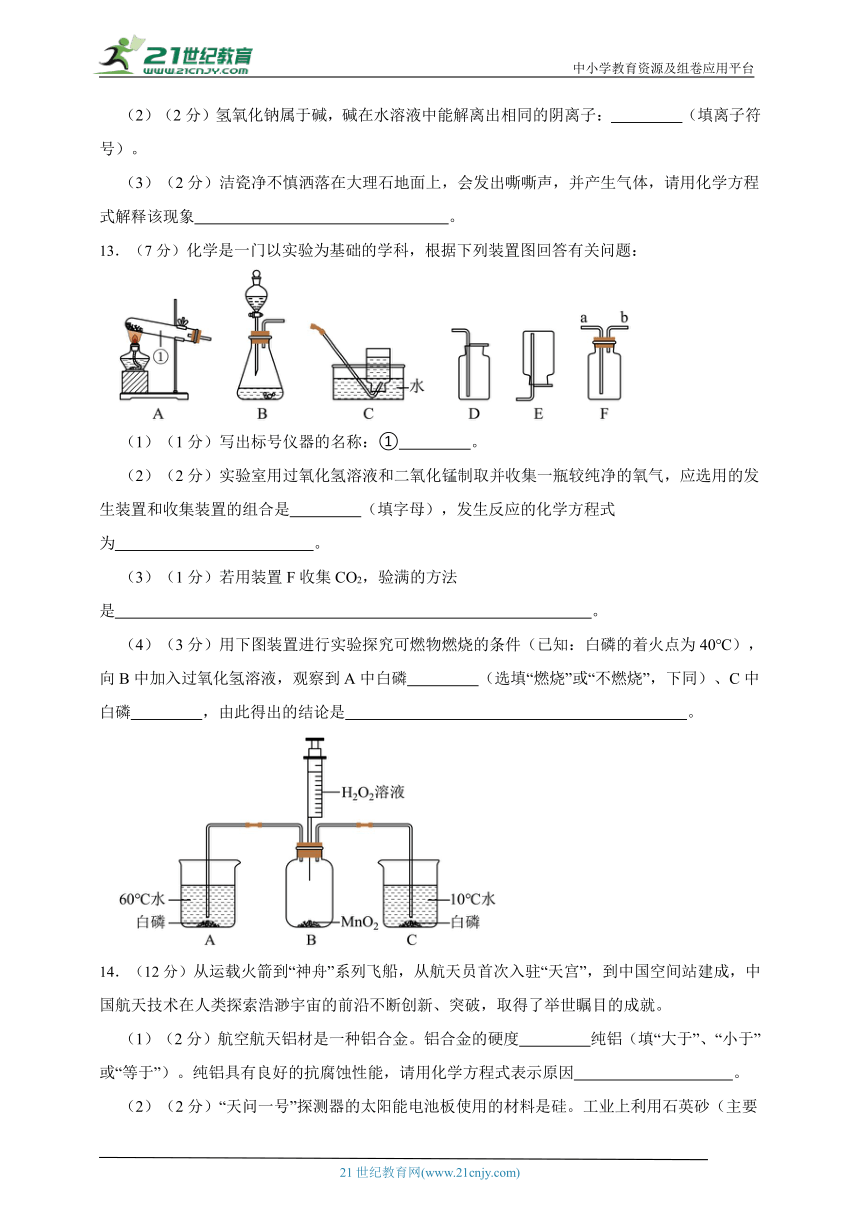
(1)(2分)碳酸氢钠的化学式为 。
(2)(2分)氢氧化钠属于碱,碱在水溶液中能解离出相同的阴离子: (填离子符号)。
(3)(2分)洁瓷净不慎洒落在大理石地面上,会发出嘶嘶声,并产生气体,请用化学方程式解释该现象 。
13.(7分)化学是一门以实验为基础的学科,根据下列装置图回答有关问题:
(1)(1分)写出标号仪器的名称:① 。
(2)(2分)实验室用过氧化氢溶液和二氧化锰制取并收集一瓶较纯净的氧气,应选用的发生装置和收集装置的组合是 (填字母),发生反应的化学方程式为 。
(3)(1分)若用装置F收集CO2,验满的方法是 。
(4)(3分)用下图装置进行实验探究可燃物燃烧的条件(已知:白磷的着火点为40℃),向B中加入过氧化氢溶液,观察到A中白磷 (选填“燃烧”或“不燃烧”,下同)、C中白磷 ,由此得出的结论是 。
14.(12分)从运载火箭到“神舟”系列飞船,从航天员首次入驻“天宫”,到中国空间站建成,中国航天技术在人类探索浩渺宇宙的前沿不断创新、突破,取得了举世瞩目的成就。
(1)(2分)航空航天铝材是一种铝合金。铝合金的硬度 纯铝(填“大于”、“小于”或“等于”)。纯铝具有良好的抗腐蚀性能,请用化学方程式表示原因 。
(2)(2分)“天问一号”探测器的太阳能电池板使用的材料是硅。工业上利用石英砂(主要成分为)制取粗硅的反应原理是,则生成的Si与X物质的质量比为 ,反应属于基本反应类型中的 反应。
(3)(2分)航天员在空间站生活,呼出的二氧化碳需要及时处理,否则会影响航天员的健康和安全。以下是空间站中处理的其中两种方式:
方式1:采用氢氧化锂(LiOH)吸收航天员排入舱内的二氧化碳,生成物是碳酸锂()和水。写出此反应的化学方程式 。
方式2:利用特种反应器实现对二氧化碳的转化,使之生成水,再对水进行电解,产生的氧气重复供人呼吸使用。下图是二氧化碳转化为水的微观反应示意图,则此化学反应中甲和乙的分子个数比为 。
(4)(3分)以上两种太空中处理二氧化碳的方式,哪一种更适合长期飞行的载人航天器?试简述理由?
(5)(3分)宇航员通过一种叫做“环保型生命保障系统”的设备,利用通电分解水来获取氧气。如果宇航员每天消耗氧气的质量为2.8kg,需要的氧气全部由电解水提供,理论上计算每天需要通电分解水的质量是多少?
答案解析部分
1.【答案】D
【知识点】自然界中的物质循环;物质发生化学变化时的能量变化;物质的三态及其转化
【解析】【解答】A、水的天然循环一般包括降水、径流、蒸发三个阶段,通过水的三态变化实验的,故A不符合题意;
B、太阳为水分子提供了能量,实现了天然循环,故B不符合题意;
C、天然循环实现了水资源的重新分配,故C不符合题意;
D、水在循环过程中,没有新的物质产生,故没有发生化学变化,故D符合题意;
故答案为:D。
【分析】根据水的天然循环进行分析解答。
2.【答案】B
【知识点】溶液的酸碱度测定
【解析】【解答】 用pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴在试纸上,会使白醋酸性变弱,测得的结果与白醋实际的pH比较高。
故答案为: B。
【分析】根据pH试纸测定溶液pH时试纸用水润湿,会使酸性变弱,pH偏大分析。
3.【答案】C
【知识点】物理变化、化学变化的特点及其判别
【解析】【解答】A. 植物光合作用,有新物质生成,属于化学变化,故不符合题意;
B. 钻木取火,有新物质生成,属于化学变化,故不符合题意;
C. 民间剪纸,没有新物质生成,属于物理变化,故符合题意;
D. 叶脉书签的制作,有新物质生成,属于化学变化,故不符合题意;
故答案为:C。
【分析】变化时没有生成其它物质的变化,叫物理变化。
变化时都生成新物质的变化,叫做化学变化。
4.【答案】A
【知识点】化学式的书写及意义;物质的名称与俗名
【解析】【解答】A. 氖气的化学式为Ne,故错误,符合题意;
B. 纯碱,为碳酸钠的俗称,化学式为Na2CO3,故正确,不符合题意;
C. 甲烷的化学式为CH4,故正确,不符合题意;
D. 乙醇的化学式为C2H5OH,故正确,不符合题意;
故答案为:A。
【分析】根据物质的俗称,化学式分析。
5.【答案】C
【知识点】分子、原子、离子、元素与物质之间的关系;微粒观点及模型图的应用;根据化学反应方程式的计算;单质和化合物
【解析】【解答】由图分析可知,甲为二氧化氮,乙为一氧化碳,丙为二氧化碳,丁为氮气,该反应的化学方程式为:2NO2+4CO4CO2+N2。
A、由微观示意图分析可知,丁为氮气,属于单质,选项错误;
B、由微观示意图分析及化学方程式可知,生成丙和丁的质量比=(44×4):(14×2)=44:7,选项错误;
C、由图中分析可知,参加反应的甲和乙的分子个数比为2:4=1:2,选项正确;
D、由图中分析可知,丙为二氧化碳,二氧化碳是由二氧化碳分子构成的,选项错误;
故选:C。
【分析】由图分析可知,甲为二氧化氮,乙为一氧化碳,丙为二氧化碳,丁为氮气,该反应的化学方程式为:2NO2+4CO4CO2+N2。
A、根据微观示意图分析可得; 单质由同种原子构成的纯净物,化合物由不同种原子构成的纯净物 ;
B、根据物质的质量比为(相对分子质量×系数):(相对分子质量×系数);
C、根据微观示意图分析,反应的分子数之比为:化学计量数:化学计量数;
D、丙是二氧化碳,由分子构成。
6.【答案】C
【知识点】合金与合金的性质;金属活动性顺序及其应用;酸碱盐的溶解性;一氧化碳的化学性质;化学实验方案设计与评价
【解析】【解答】A、由于氯化钙能和硝酸银反应生成氯化银沉淀和硝酸钙,氯化钙也能和碳酸钠等反应生成碳酸钙沉淀,因此只根据有白色沉淀生成判断一定是硝酸银,结论错误,故选项错误;
B、一氧化碳和氧化铁在高温的条件下反应,但题干未指明条件,现象错误,故选项错误;
C、活泼金属能将不活泼金属从其盐溶液中置换出来,硫酸铝不和铜反应,活动性Al>Cu; 硝酸银和铜反应生成银和硝酸铜,现象为溶液逐渐变蓝,铜丝表面出现银色物质,证明活动性Cu>Ag,可以得出活动性Al>Cu>Ag的结论;故选项正确;
D、黄铜是铜的合金,互相刻画, 由于合金比其组成金属的硬度大,铜片上留下划痕,黄铜片无明显现象 ,结论错误,故选项错误;
故选:C
【分析】A、根据盐的性质以及常见碱盐的溶解性分析;
B、根据一氧化碳的化学性质分析;
C、根据金属活动性顺序的应用分析;
D、根据合金的性质分析。
7.【答案】B
【知识点】酸的化学性质;碱的化学性质;盐的化学性质;物质的相互转化和制备;铵态氮肥的检验
【解析】【解答】A、甲为铁,铁与硫酸铜和硫酸都可以反应,其他活泼金属也可以发生类似反应,所以甲不一定是铁,乙与硫酸铜反应,则乙含有氢氧根离子,则乙可以是氢氧化钠,也可以是氢氧化钾,氢氧化钙与碳酸钠或者碳酸钾反应就可以制得乙,丙可以酸,也可以是二氧化碳,选项A错误;
B、氢氧化钙可与二氧化碳或者氯化铵等反应,生成碳酸钙或者氨气,选项B正确;
C、铜的金属活动性排在氢之后,不会与铜反应,选项C错误;
D、硫酸铜溶液和氢氧化钙溶液可以配制波尔多液,选项D错误;
故选:B。
【分析】根据选项给出信息内容,结合逻辑框图关系分析回答此题。
8.【答案】(1)②;③;④
(2);
(3)③
(4)①
【知识点】中和反应及其应用;溶液的酸碱性与pH值的关系;化学方程式的书写与配平;物质的简单分类;从组成上识别氧化物
【解析】【解答】(1)水是由两种元素组成的且有一种是氧元素的化合物,属于氧化物;熟石灰是由钙离子和氢氧根离子组成的化合物,属于碱;碳酸钠是由钠离子和碳酸根离子组成的化合物,属于盐;
(2)水通电分解生成氢气和氧气,反应的化学方程式为:,酸钠溶液与氢氧化钙溶液反应生成碳酸钙沉和氢氧化钠,可用于制取氢氧化钠,反应的化学方程式为:;
(3)若要测定纯碱溶液的酸碱度应用pH试纸,酚酞或石蕊只能测溶液酸碱性;
(4)槟榔芋皮上含有一种碱性的物质—皂角素,沾上它会使皮肤奇痒难忍,因为皂角素显碱性,所以应该选用显酸性的物质来与它反应,①②③这三种物质中只有①显酸性,而②③显碱性。
【分析】(1)氧化物是只含有两种元素且其中一种元素是氧元素的化合物,碱是电离产生的阴离子全部为氢氧根离子的化合物,盐是由金属离子(或铵根离子)和酸根离子组成的化合物,据此进行分析解答;
(2)首先根据反应原理找出反应物、生成物反应条件,根据化学方程式的书写方法、步骤进行书写即可;
(3)测定溶液的酸碱度最简便的方法是使用H试纸;
(4)由题意,槟榔芋皮上含有一种碱性的物质--皂角素,故所选的物质应该能与碱反应且对皮肤无副作用。
9.【答案】(1)氮元素
(2)101
(3)2;最外层电子数;Na2O
(4)
【知识点】原子结构示意图与离子结构示意图;元素周期表的特点及其应用;物质的元素组成;微粒观点及模型图的应用
【解析】【解答】(1)物质是由元素组成的,氮气是由氮元素组成的;
(2)原子序数等于核内质子数,钔原子的质子数为101;
(3)①金属元素的最外层电子数一般小于4,图中属于金属元素的有钠和镁两种;
②最外层电子数决定元素的化学性质,氟和氯两种元素的原子的最外层电子数相同,具有相似的化学性质;
③钠原子的最外层电子数为1,氧原子的最外层电子数为6,由钠和氧两种元素组成化合物氧化钠的化学式为Na2O;
(4)氢气和氯气点燃生成氯化氢,反应的化学方程式为。
【分析】(1)根据物质是由元素组成的分析;
(2)根据原子序数等于核内质子数分析;
(3)根据金属元素的最外层电子数一般小于4,最外层电子数决定元素的化学性质分析;
(5)根据氢气和氯气点燃生成氯化氢分析。
10.【答案】(1)增大反应物间的接触面积,使反应更充分
(2)
(3)
(4)铜
【知识点】金属活动性顺序及其应用;常见金属的冶炼方法;完全燃烧与不完全燃烧
【解析】【解答】(1)增大反应物间的接触面积,使反应更充分
(2)
(3)
(4)铜
【分析】炉甘石(ZnCO3)加入锌罐之前,先将其粉碎的目的是增大反应物接触面积,使反应更快更充分。
炉甘石(ZnCO3)在高温下分解生成二氧化碳和另一种氧化物,根据原子守恒可知另一种化合物是氧化锌。
碳与氧化锌反应生成锌和二氧化,该反应的化学方程式
碳夺取氧化锌中的氧原子生成二氧化碳,体现碳原子还原性。
镁、铜、锌的金属活动性顺序为:镁 锌 铜。故将锌粉加入到硝酸镁和硝酸铜的混合溶液中,锌可以和硝酸铜发生反应生成硝酸锌和铜,锌和硝酸镁不发生反应。反应完成后溶液依旧为蓝色,表明溶液中还有硝酸铜,证明硝酸铜过量。锌粉不足,所以滤渣中一定有铜。
11.【答案】(1)=
(2)C
(3)饱和;141.6
【知识点】固体溶解度曲线及其作用
【解析】【解答】(1) 将T2℃时KNO3和NaCl的饱和溶液各100g,降温至T1℃,如图所示,二者的溶解度都减小,会析出晶体则形成T1℃时的饱和溶液,根据此时二者的溶解度相等,由饱和溶液溶质质量分数=,则二者的溶质质量分数相等,故填:=;
(2)如图所示,硝酸钾的溶解度随温度的升高而变大,则加入M后固体的治疗增加说明此时硝酸钾的溶解度在减小,则说明M加入后使水温降低;
A、氯化钠溶于水水温不变,不符合题意;
B、氢氧化钠固体溶于水水温升高,不符合题意;
C、冰块放入水中会使水温降低,符合题意;
D、生石灰与水反应放热,不符合题意;
故选:C;
(3)①由图可知,ts时, 析出固体质量为0,继续降温,会析出固体,说明此时烧杯中的溶液恰好饱和,为饱和溶液;
②20℃时,硝酸钾的溶解度为31.6g,即该温度下,100g水中最多溶解31.6g硝酸钾,析出固体的质量为10g,则60℃时,烧杯中溶液的质量为: 100g+31.6g+10g=141.6g。
【分析】(1)根据饱和溶液中溶质质量分数与溶解度的关系分析;
(2)根据硝酸钾降温其会析晶分析
(3)根据溶解度的定义分析。
12.【答案】(1)NaHCO3
(2)
(3)CaCO3+2HCl=CaCl2+H2O+ CO2↑
【知识点】化学式的书写及意义;化合价与离子表示方法上的异同点;二氧化碳的实验室制法
【解析】【解答】(1)碳酸氢钠中钠元素显+1价,碳酸氢根显-1价,化学式为NaHCO3。
(2)氢氧化钠属于碱,碱在水溶液中能解离出相同的阴离子是氢氧根离子,离子符号为OH-。
(3)洁瓷净不慎洒落在大理石地面上,会发出嘶嘶声,并产生气体,解释该现象是碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式CaCO3+2HCl=CaCl2+H2O+ CO2↑。
【分析】(1)在化合物中元素的正负化合价的代数和为零。
(2)碱在水溶液中能解离出相同的阴离子是氢氧根离子。
(3)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳。
13.【答案】(1)试管
(2)BC;
(3)将带火星的小木条放在b导管口,若木条复燃,证明氧气已集满
(4)燃烧;不燃烧;温度达到可燃物的着火点,可燃物才会燃烧
【知识点】实验室常见的仪器及使用;气体反应装置的选取;化学方程式的书写与配平;燃烧与燃烧的条件
【解析】(1)【解答】由图可知,标号仪器的名称是试管。
【分析】认识基本的实验仪器。
(2)【解答】过氧化氢为液体,二氧化锰为固体,反应不需要加热,故发生装置为固液不加热型,发生装置选B,排水法收集到的氧气比较纯净,因为排空气法收集还会混有空气,故收集装置选C,故选用的发生和收集装置是BC;过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为
【分析】根据实验室制取氧气的原理,过氧化氢与二氧化锰的固液常温反应选择发生装置,根据氧气的性质选择收集装置。
(3)【解答】氧气密度比空气大,用集气瓶排空气收集时,应长进短出,故验满的方法为将带火星的小木条放在b号管口,若木条复燃,证明氧气已集满;
【分析】结合氧气的密度、具有助燃性的性质解答。
(4)【解答】白磷的着火点为40℃,A烧杯中水的温度为60℃,温度能达到白磷的着火点,所以A中白磷燃烧,C烧杯中水的温度为10℃,温度达不到白磷的着火点,所以C中白磷不燃烧,由此可得出温度达到可燃物的着火点,可燃物才会燃烧。
【分析】根据白磷的燃烧来探究燃烧的条件,结合实验现象解答。
14.【答案】(1)大于;
(2)1:2;置换
(3);4:1
(4)方式2更适合长期飞行的载人航天器,因为对于长期飞行来说,大量的消耗品均由地面带上或送上天,其运行成本是十分昂贵的,所以通过方式2能够实现水的循环、氧气的循环,帮助维持宇航员日常生活
(5)解:设理论上每天需要通电分解水的质量为x,
x=3.15kg
答:每天需要电解水的质量为3.15kg
【知识点】合金与合金的性质;微粒观点及模型图的应用;质量守恒定律及其应用;根据化学反应方程式的计算;置换反应及其应用
【解析】【解答】(1) 铝合金的硬度大于纯铝,铝具有良好抗腐蚀性能是由于常温下铝与氧气反应生成氧化铝,反应方程式为 。
(2)由反应前后原子种类和个数不变可知,X化学式为CO,则生成 Si与X物质的质量比为 28:56=1:2,该反应中反应物和生成物都一种单质和一种化合物,发生的置换反应。
(3)由题中所给信息可知, 氢氧化锂与二氧化碳反应生成物是碳酸锂和水 ,反应方程式为 。由所给图示可知,该反应方程式为4H2+CO22H2O+CH4,反应中甲和乙的分子个数比为4:1.
(4) 因为对于长期飞行来说,大量的消耗品均由地面带上或送上天,其运行成本是十分昂贵的,所以通过方式2能够实现水的循环、氧气的循环,帮助维持宇航员日常生活 。
【分析】(1)根据合金的硬度大于纯金属,常温下铝与氧气反应生成氧化铝分析;
(2)根据化学反应前后原子种类和个数不变,反应中一种单质和一种化合物属于置换反应分析;
(3)根据氢氧化锂与二氧化碳反应生成物是碳酸锂和水,由微观图示确定反应方程式,由此确定反应的分子个数比分析;
(4)根据两个方案的成本及转化方式分析;
(5)根据生成氧气的质量及方程式中物质间质量关系计算水的质量分析。
试题分析部分
1、试卷总体分布分析
总分:60分
分值分布 客观题(占比) 14.0(23.3%)
主观题(占比) 46.0(76.7%)
题量分布 客观题(占比) 7(50.0%)
主观题(占比) 7(50.0%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 7(50.0%) 14.0(23.3%)
非选择题 7(50.0%) 46.0(76.7%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (64.3%)
2 容易 (14.3%)
3 困难 (21.4%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 单质和化合物 2.0(3.3%) 5
2 化学实验方案设计与评价 2.0(3.3%) 6
3 酸的化学性质 2.0(3.3%) 7
4 化学方程式的书写与配平 14.0(23.3%) 8,13
5 物质的名称与俗名 2.0(3.3%) 4
6 溶液的酸碱度测定 2.0(3.3%) 2
7 铵态氮肥的检验 2.0(3.3%) 7
8 化学式的书写及意义 8.0(13.3%) 4,12
9 物质的相互转化和制备 2.0(3.3%) 7
10 合金与合金的性质 14.0(23.3%) 6,14
11 完全燃烧与不完全燃烧 4.0(6.7%) 10
12 物理变化、化学变化的特点及其判别 2.0(3.3%) 3
13 物质发生化学变化时的能量变化 2.0(3.3%) 1
14 元素周期表的特点及其应用 6.0(10.0%) 9
15 物质的元素组成 6.0(10.0%) 9
16 二氧化碳的实验室制法 6.0(10.0%) 12
17 微粒观点及模型图的应用 20.0(33.3%) 5,9,14
18 气体反应装置的选取 7.0(11.7%) 13
19 根据化学反应方程式的计算 14.0(23.3%) 5,14
20 置换反应及其应用 12.0(20.0%) 14
21 从组成上识别氧化物 7.0(11.7%) 8
22 中和反应及其应用 7.0(11.7%) 8
23 质量守恒定律及其应用 12.0(20.0%) 14
24 酸碱盐的溶解性 2.0(3.3%) 6
25 自然界中的物质循环 2.0(3.3%) 1
26 常见金属的冶炼方法 4.0(6.7%) 10
27 物质的简单分类 7.0(11.7%) 8
28 金属活动性顺序及其应用 6.0(10.0%) 6,10
29 原子结构示意图与离子结构示意图 6.0(10.0%) 9
30 盐的化学性质 2.0(3.3%) 7
31 燃烧与燃烧的条件 7.0(11.7%) 13
32 分子、原子、离子、元素与物质之间的关系 2.0(3.3%) 5
33 碱的化学性质 2.0(3.3%) 7
34 化合价与离子表示方法上的异同点 6.0(10.0%) 12
35 物质的三态及其转化 2.0(3.3%) 1
36 溶液的酸碱性与pH值的关系 7.0(11.7%) 8
37 实验室常见的仪器及使用 7.0(11.7%) 13
38 一氧化碳的化学性质 2.0(3.3%) 6
39 固体溶解度曲线及其作用 4.0(6.7%) 11
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年化学中考模拟试卷(贵州省)
一、选择题(共7题;共14分)
1.(2分)下列有关“水循环”的说法中不正确的是( )
A.水的天然循环是通过其三态变化实现的
B.太阳为水分子提供了能量
C.天然循环实现了水资源的重新分配
D.水在循环过程中发生了化学变化
2.(2分)小科通过微信公众号“胜哥课程”观看了《pH试纸的使用》科学视频,对相关知识有了深刻的理解。用pH试纸测定白醋的酸碱度时.如果先将试纸用蒸馏水润湿,再把白醋滴在试纸上,则测得的结果与白醋实际的pH比较( )
A.偏低 B.偏高 C.相等 D.无法比较
3.(2分)下列选项中,没有涉及化学变化的是( )
A.植物光合作用 B.钻木取火
C.民间剪纸 D.叶脉书签的制作
4.(2分)下列物质的名称(或俗称)与化学式对应错误的是( )
A.氖气—Ne2 B.纯碱—Na2CO3
C.甲烷—CH4 D.乙醇—C2H5OH
5.(2分)某种催化剂可将汽车尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分。根据该反应的微观示意图,分析下列说法正确的是( )
A.四种物质均属于化合物
B.生成丙和丁的质量比为 22:7
C.参加反应的甲和乙的分子个数比为 1:2
D.物质丙由原子构成
6.(2分)下列实验操作对应的现象和结论正确的是( )
实验操作 现象 结论
A 某待测液中加氯化钙溶液 有白色沉淀生成 该溶液为AgNO3溶液
B 将CO通入氧化铁粉末中 粉末由黑色变为红色 CO有还原性
C 将2根铜丝分别放入硫酸铝溶液和硝酸银溶液中,观察现象 硫酸铝溶液没有明显现象,硝酸银溶液逐渐变蓝,其中铜丝表面有银色物质析出 金属活动性顺序:Al>Cu>Ag
D 将铜片和黄铜片相互刻画 铜片上留下划痕,黄铜片无明显现象 合金硬度比组成它的纯金属硬度小
A.A B.B C.C D.D
7.(2分)如图,甲、乙是初中化学常见的物质,图中“—”表示相连的物质可以反应,“→”表示由某种物质转化为另一种物质(部分反应物、生成、反应条件已略去),下列说法中正确的是( )
A.甲一定是Fe;乙一定是NaOH
B.丙物质可以是非金属氧化物或铵盐
C.H2SO4→CuSO4可通过稀硫酸与铜发生置换反应实现
D.图中提供的物质无法配成具有杀菌作用的波尔多液
二、非选择题(共7题;共46分)
8.(7分)请根据表回答有关问题:
序号
物质 醋酸 水 熟石灰 纯碱
化学式
(1)(3分)表中的物质属于氧化物的是 属于碱的是 ;属于盐的是 .
(2)(2分)利用表中的物质作为反应物,写出符合下列要求的化学方程式.
电解水 .
熟石灰和纯碱反应 .
(3)(1分)若要测定纯碱溶液的酸碱度,可选用下列选项中的 .
无色酚酞试液 紫色石蕊试液 试纸
(4)(1分)槟榔芋皮上含有一种碱性的物质--皂角素,皮肤沾上它会奇痒难忍.你认为可选用下列 来涂抹止痒.
食醋含醋酸 熟石灰 纯碱.
9.(6分)在宏观、微观和符号之间建立联系是学习化学的重要思维方式。
(1)(1分)从宏观角度分析,氮气是由 组成的(填“氮元素”或“氮原子”)。
(2)(1分)元素周期表中原子序数为101的元素被命名为“钔”(元素符号为Md),用来纪念门捷列夫编制元素周期表所作出的巨大贡献。钔的相对原子质量为258,则钔原子的质子数为 。
(3)(3分)根据下列粒子的结构示意图,回答问题。
①图中粒子属于金属元案的有 种(填数字);
②氟和氯两种元素的原子 相同,用以它们具有相似的化学性质;
③由钠和氧两种元素组成化合物氧化钠的化学式为
(4)(1分)下图为某化学反应的微观示意图。
根据图示写出该反应的化学方程式
10.(4分)我国古代冶金技术彰显了劳动人民的智慧。明代宋应星所著的天工开物一书介绍了“火法炼锌”的方法:把炉甘石和煤炭饼装入炼锌罐如图所示,泥封,“其底铺薪,发火煅红”“冷定毁罐取出”。
(1)(1分)炉甘石加入炼锌罐之前,先将其粉碎的目的是 合理即可。
(2)(1分)反应区中,炉甘石在高温下分解生成二氧化碳和另一种氧化物,该氧化物的化学式是 。
(3)(1分)反应区中,煤炭中的碳与氧化锌反应生成锌和二氧化碳,写出反应的化学方程式: 。
(4)(1分)向硝酸镁和硝酸铜的混合溶液中,加入一定量的锌粉,充分反应后过滤,得到滤渣和蓝色滤液。则滤渣中一定含有 。
11.(4分)小科通过微信公众号“胜哥课程”学习了溶解度曲线的课程后,对相关知识有了深刻的理解。图1是KNO3和NaCl的溶解度曲线。回答下列问题:
(1)(1分)将T2℃时KNO3和NaCl的饱和溶液各100g,降温至T1℃,所得溶液的溶质质量分数:KNO3 (填“>”、“<”或“=”)NaCl。
(2)(1分)图2试管底部有未溶解的KNO3固体,向烧杯的水中加入物质M后,试管中的固体增加,则加入的物质M可能是____(填字母)。
A.氯化钠固体 B.氢氧化钠固体
C.冰块 D.生石灰
(3)(2分)60℃时,向装有100g水的烧杯中加入一定量KNO3形成溶液,再降温至20℃,析出固体的质量变化如图3。
①ts时,烧杯中的溶液为 (填“饱和”或“不饱和”)溶液。
②60℃时,烧杯中溶液的质量为 g。
12.(6分)下表是日常生活中常见的用品及其有效成分:
用品 发酵粉 炉具清洁剂 洁瓷净
有效成分 碳酸氢钠 氢氧化钠 盐酸
(1)(2分)碳酸氢钠的化学式为 。
(2)(2分)氢氧化钠属于碱,碱在水溶液中能解离出相同的阴离子: (填离子符号)。
(3)(2分)洁瓷净不慎洒落在大理石地面上,会发出嘶嘶声,并产生气体,请用化学方程式解释该现象 。
13.(7分)化学是一门以实验为基础的学科,根据下列装置图回答有关问题:
(1)(1分)写出标号仪器的名称:① 。
(2)(2分)实验室用过氧化氢溶液和二氧化锰制取并收集一瓶较纯净的氧气,应选用的发生装置和收集装置的组合是 (填字母),发生反应的化学方程式为 。
(3)(1分)若用装置F收集CO2,验满的方法是 。
(4)(3分)用下图装置进行实验探究可燃物燃烧的条件(已知:白磷的着火点为40℃),向B中加入过氧化氢溶液,观察到A中白磷 (选填“燃烧”或“不燃烧”,下同)、C中白磷 ,由此得出的结论是 。
14.(12分)从运载火箭到“神舟”系列飞船,从航天员首次入驻“天宫”,到中国空间站建成,中国航天技术在人类探索浩渺宇宙的前沿不断创新、突破,取得了举世瞩目的成就。
(1)(2分)航空航天铝材是一种铝合金。铝合金的硬度 纯铝(填“大于”、“小于”或“等于”)。纯铝具有良好的抗腐蚀性能,请用化学方程式表示原因 。
(2)(2分)“天问一号”探测器的太阳能电池板使用的材料是硅。工业上利用石英砂(主要成分为)制取粗硅的反应原理是,则生成的Si与X物质的质量比为 ,反应属于基本反应类型中的 反应。
(3)(2分)航天员在空间站生活,呼出的二氧化碳需要及时处理,否则会影响航天员的健康和安全。以下是空间站中处理的其中两种方式:
方式1:采用氢氧化锂(LiOH)吸收航天员排入舱内的二氧化碳,生成物是碳酸锂()和水。写出此反应的化学方程式 。
方式2:利用特种反应器实现对二氧化碳的转化,使之生成水,再对水进行电解,产生的氧气重复供人呼吸使用。下图是二氧化碳转化为水的微观反应示意图,则此化学反应中甲和乙的分子个数比为 。
(4)(3分)以上两种太空中处理二氧化碳的方式,哪一种更适合长期飞行的载人航天器?试简述理由?
(5)(3分)宇航员通过一种叫做“环保型生命保障系统”的设备,利用通电分解水来获取氧气。如果宇航员每天消耗氧气的质量为2.8kg,需要的氧气全部由电解水提供,理论上计算每天需要通电分解水的质量是多少?
答案解析部分
1.【答案】D
【知识点】自然界中的物质循环;物质发生化学变化时的能量变化;物质的三态及其转化
【解析】【解答】A、水的天然循环一般包括降水、径流、蒸发三个阶段,通过水的三态变化实验的,故A不符合题意;
B、太阳为水分子提供了能量,实现了天然循环,故B不符合题意;
C、天然循环实现了水资源的重新分配,故C不符合题意;
D、水在循环过程中,没有新的物质产生,故没有发生化学变化,故D符合题意;
故答案为:D。
【分析】根据水的天然循环进行分析解答。
2.【答案】B
【知识点】溶液的酸碱度测定
【解析】【解答】 用pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴在试纸上,会使白醋酸性变弱,测得的结果与白醋实际的pH比较高。
故答案为: B。
【分析】根据pH试纸测定溶液pH时试纸用水润湿,会使酸性变弱,pH偏大分析。
3.【答案】C
【知识点】物理变化、化学变化的特点及其判别
【解析】【解答】A. 植物光合作用,有新物质生成,属于化学变化,故不符合题意;
B. 钻木取火,有新物质生成,属于化学变化,故不符合题意;
C. 民间剪纸,没有新物质生成,属于物理变化,故符合题意;
D. 叶脉书签的制作,有新物质生成,属于化学变化,故不符合题意;
故答案为:C。
【分析】变化时没有生成其它物质的变化,叫物理变化。
变化时都生成新物质的变化,叫做化学变化。
4.【答案】A
【知识点】化学式的书写及意义;物质的名称与俗名
【解析】【解答】A. 氖气的化学式为Ne,故错误,符合题意;
B. 纯碱,为碳酸钠的俗称,化学式为Na2CO3,故正确,不符合题意;
C. 甲烷的化学式为CH4,故正确,不符合题意;
D. 乙醇的化学式为C2H5OH,故正确,不符合题意;
故答案为:A。
【分析】根据物质的俗称,化学式分析。
5.【答案】C
【知识点】分子、原子、离子、元素与物质之间的关系;微粒观点及模型图的应用;根据化学反应方程式的计算;单质和化合物
【解析】【解答】由图分析可知,甲为二氧化氮,乙为一氧化碳,丙为二氧化碳,丁为氮气,该反应的化学方程式为:2NO2+4CO4CO2+N2。
A、由微观示意图分析可知,丁为氮气,属于单质,选项错误;
B、由微观示意图分析及化学方程式可知,生成丙和丁的质量比=(44×4):(14×2)=44:7,选项错误;
C、由图中分析可知,参加反应的甲和乙的分子个数比为2:4=1:2,选项正确;
D、由图中分析可知,丙为二氧化碳,二氧化碳是由二氧化碳分子构成的,选项错误;
故选:C。
【分析】由图分析可知,甲为二氧化氮,乙为一氧化碳,丙为二氧化碳,丁为氮气,该反应的化学方程式为:2NO2+4CO4CO2+N2。
A、根据微观示意图分析可得; 单质由同种原子构成的纯净物,化合物由不同种原子构成的纯净物 ;
B、根据物质的质量比为(相对分子质量×系数):(相对分子质量×系数);
C、根据微观示意图分析,反应的分子数之比为:化学计量数:化学计量数;
D、丙是二氧化碳,由分子构成。
6.【答案】C
【知识点】合金与合金的性质;金属活动性顺序及其应用;酸碱盐的溶解性;一氧化碳的化学性质;化学实验方案设计与评价
【解析】【解答】A、由于氯化钙能和硝酸银反应生成氯化银沉淀和硝酸钙,氯化钙也能和碳酸钠等反应生成碳酸钙沉淀,因此只根据有白色沉淀生成判断一定是硝酸银,结论错误,故选项错误;
B、一氧化碳和氧化铁在高温的条件下反应,但题干未指明条件,现象错误,故选项错误;
C、活泼金属能将不活泼金属从其盐溶液中置换出来,硫酸铝不和铜反应,活动性Al>Cu; 硝酸银和铜反应生成银和硝酸铜,现象为溶液逐渐变蓝,铜丝表面出现银色物质,证明活动性Cu>Ag,可以得出活动性Al>Cu>Ag的结论;故选项正确;
D、黄铜是铜的合金,互相刻画, 由于合金比其组成金属的硬度大,铜片上留下划痕,黄铜片无明显现象 ,结论错误,故选项错误;
故选:C
【分析】A、根据盐的性质以及常见碱盐的溶解性分析;
B、根据一氧化碳的化学性质分析;
C、根据金属活动性顺序的应用分析;
D、根据合金的性质分析。
7.【答案】B
【知识点】酸的化学性质;碱的化学性质;盐的化学性质;物质的相互转化和制备;铵态氮肥的检验
【解析】【解答】A、甲为铁,铁与硫酸铜和硫酸都可以反应,其他活泼金属也可以发生类似反应,所以甲不一定是铁,乙与硫酸铜反应,则乙含有氢氧根离子,则乙可以是氢氧化钠,也可以是氢氧化钾,氢氧化钙与碳酸钠或者碳酸钾反应就可以制得乙,丙可以酸,也可以是二氧化碳,选项A错误;
B、氢氧化钙可与二氧化碳或者氯化铵等反应,生成碳酸钙或者氨气,选项B正确;
C、铜的金属活动性排在氢之后,不会与铜反应,选项C错误;
D、硫酸铜溶液和氢氧化钙溶液可以配制波尔多液,选项D错误;
故选:B。
【分析】根据选项给出信息内容,结合逻辑框图关系分析回答此题。
8.【答案】(1)②;③;④
(2);
(3)③
(4)①
【知识点】中和反应及其应用;溶液的酸碱性与pH值的关系;化学方程式的书写与配平;物质的简单分类;从组成上识别氧化物
【解析】【解答】(1)水是由两种元素组成的且有一种是氧元素的化合物,属于氧化物;熟石灰是由钙离子和氢氧根离子组成的化合物,属于碱;碳酸钠是由钠离子和碳酸根离子组成的化合物,属于盐;
(2)水通电分解生成氢气和氧气,反应的化学方程式为:,酸钠溶液与氢氧化钙溶液反应生成碳酸钙沉和氢氧化钠,可用于制取氢氧化钠,反应的化学方程式为:;
(3)若要测定纯碱溶液的酸碱度应用pH试纸,酚酞或石蕊只能测溶液酸碱性;
(4)槟榔芋皮上含有一种碱性的物质—皂角素,沾上它会使皮肤奇痒难忍,因为皂角素显碱性,所以应该选用显酸性的物质来与它反应,①②③这三种物质中只有①显酸性,而②③显碱性。
【分析】(1)氧化物是只含有两种元素且其中一种元素是氧元素的化合物,碱是电离产生的阴离子全部为氢氧根离子的化合物,盐是由金属离子(或铵根离子)和酸根离子组成的化合物,据此进行分析解答;
(2)首先根据反应原理找出反应物、生成物反应条件,根据化学方程式的书写方法、步骤进行书写即可;
(3)测定溶液的酸碱度最简便的方法是使用H试纸;
(4)由题意,槟榔芋皮上含有一种碱性的物质--皂角素,故所选的物质应该能与碱反应且对皮肤无副作用。
9.【答案】(1)氮元素
(2)101
(3)2;最外层电子数;Na2O
(4)
【知识点】原子结构示意图与离子结构示意图;元素周期表的特点及其应用;物质的元素组成;微粒观点及模型图的应用
【解析】【解答】(1)物质是由元素组成的,氮气是由氮元素组成的;
(2)原子序数等于核内质子数,钔原子的质子数为101;
(3)①金属元素的最外层电子数一般小于4,图中属于金属元素的有钠和镁两种;
②最外层电子数决定元素的化学性质,氟和氯两种元素的原子的最外层电子数相同,具有相似的化学性质;
③钠原子的最外层电子数为1,氧原子的最外层电子数为6,由钠和氧两种元素组成化合物氧化钠的化学式为Na2O;
(4)氢气和氯气点燃生成氯化氢,反应的化学方程式为。
【分析】(1)根据物质是由元素组成的分析;
(2)根据原子序数等于核内质子数分析;
(3)根据金属元素的最外层电子数一般小于4,最外层电子数决定元素的化学性质分析;
(5)根据氢气和氯气点燃生成氯化氢分析。
10.【答案】(1)增大反应物间的接触面积,使反应更充分
(2)
(3)
(4)铜
【知识点】金属活动性顺序及其应用;常见金属的冶炼方法;完全燃烧与不完全燃烧
【解析】【解答】(1)增大反应物间的接触面积,使反应更充分
(2)
(3)
(4)铜
【分析】炉甘石(ZnCO3)加入锌罐之前,先将其粉碎的目的是增大反应物接触面积,使反应更快更充分。
炉甘石(ZnCO3)在高温下分解生成二氧化碳和另一种氧化物,根据原子守恒可知另一种化合物是氧化锌。
碳与氧化锌反应生成锌和二氧化,该反应的化学方程式
碳夺取氧化锌中的氧原子生成二氧化碳,体现碳原子还原性。
镁、铜、锌的金属活动性顺序为:镁 锌 铜。故将锌粉加入到硝酸镁和硝酸铜的混合溶液中,锌可以和硝酸铜发生反应生成硝酸锌和铜,锌和硝酸镁不发生反应。反应完成后溶液依旧为蓝色,表明溶液中还有硝酸铜,证明硝酸铜过量。锌粉不足,所以滤渣中一定有铜。
11.【答案】(1)=
(2)C
(3)饱和;141.6
【知识点】固体溶解度曲线及其作用
【解析】【解答】(1) 将T2℃时KNO3和NaCl的饱和溶液各100g,降温至T1℃,如图所示,二者的溶解度都减小,会析出晶体则形成T1℃时的饱和溶液,根据此时二者的溶解度相等,由饱和溶液溶质质量分数=,则二者的溶质质量分数相等,故填:=;
(2)如图所示,硝酸钾的溶解度随温度的升高而变大,则加入M后固体的治疗增加说明此时硝酸钾的溶解度在减小,则说明M加入后使水温降低;
A、氯化钠溶于水水温不变,不符合题意;
B、氢氧化钠固体溶于水水温升高,不符合题意;
C、冰块放入水中会使水温降低,符合题意;
D、生石灰与水反应放热,不符合题意;
故选:C;
(3)①由图可知,ts时, 析出固体质量为0,继续降温,会析出固体,说明此时烧杯中的溶液恰好饱和,为饱和溶液;
②20℃时,硝酸钾的溶解度为31.6g,即该温度下,100g水中最多溶解31.6g硝酸钾,析出固体的质量为10g,则60℃时,烧杯中溶液的质量为: 100g+31.6g+10g=141.6g。
【分析】(1)根据饱和溶液中溶质质量分数与溶解度的关系分析;
(2)根据硝酸钾降温其会析晶分析
(3)根据溶解度的定义分析。
12.【答案】(1)NaHCO3
(2)
(3)CaCO3+2HCl=CaCl2+H2O+ CO2↑
【知识点】化学式的书写及意义;化合价与离子表示方法上的异同点;二氧化碳的实验室制法
【解析】【解答】(1)碳酸氢钠中钠元素显+1价,碳酸氢根显-1价,化学式为NaHCO3。
(2)氢氧化钠属于碱,碱在水溶液中能解离出相同的阴离子是氢氧根离子,离子符号为OH-。
(3)洁瓷净不慎洒落在大理石地面上,会发出嘶嘶声,并产生气体,解释该现象是碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式CaCO3+2HCl=CaCl2+H2O+ CO2↑。
【分析】(1)在化合物中元素的正负化合价的代数和为零。
(2)碱在水溶液中能解离出相同的阴离子是氢氧根离子。
(3)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳。
13.【答案】(1)试管
(2)BC;
(3)将带火星的小木条放在b导管口,若木条复燃,证明氧气已集满
(4)燃烧;不燃烧;温度达到可燃物的着火点,可燃物才会燃烧
【知识点】实验室常见的仪器及使用;气体反应装置的选取;化学方程式的书写与配平;燃烧与燃烧的条件
【解析】(1)【解答】由图可知,标号仪器的名称是试管。
【分析】认识基本的实验仪器。
(2)【解答】过氧化氢为液体,二氧化锰为固体,反应不需要加热,故发生装置为固液不加热型,发生装置选B,排水法收集到的氧气比较纯净,因为排空气法收集还会混有空气,故收集装置选C,故选用的发生和收集装置是BC;过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为
【分析】根据实验室制取氧气的原理,过氧化氢与二氧化锰的固液常温反应选择发生装置,根据氧气的性质选择收集装置。
(3)【解答】氧气密度比空气大,用集气瓶排空气收集时,应长进短出,故验满的方法为将带火星的小木条放在b号管口,若木条复燃,证明氧气已集满;
【分析】结合氧气的密度、具有助燃性的性质解答。
(4)【解答】白磷的着火点为40℃,A烧杯中水的温度为60℃,温度能达到白磷的着火点,所以A中白磷燃烧,C烧杯中水的温度为10℃,温度达不到白磷的着火点,所以C中白磷不燃烧,由此可得出温度达到可燃物的着火点,可燃物才会燃烧。
【分析】根据白磷的燃烧来探究燃烧的条件,结合实验现象解答。
14.【答案】(1)大于;
(2)1:2;置换
(3);4:1
(4)方式2更适合长期飞行的载人航天器,因为对于长期飞行来说,大量的消耗品均由地面带上或送上天,其运行成本是十分昂贵的,所以通过方式2能够实现水的循环、氧气的循环,帮助维持宇航员日常生活
(5)解:设理论上每天需要通电分解水的质量为x,
x=3.15kg
答:每天需要电解水的质量为3.15kg
【知识点】合金与合金的性质;微粒观点及模型图的应用;质量守恒定律及其应用;根据化学反应方程式的计算;置换反应及其应用
【解析】【解答】(1) 铝合金的硬度大于纯铝,铝具有良好抗腐蚀性能是由于常温下铝与氧气反应生成氧化铝,反应方程式为 。
(2)由反应前后原子种类和个数不变可知,X化学式为CO,则生成 Si与X物质的质量比为 28:56=1:2,该反应中反应物和生成物都一种单质和一种化合物,发生的置换反应。
(3)由题中所给信息可知, 氢氧化锂与二氧化碳反应生成物是碳酸锂和水 ,反应方程式为 。由所给图示可知,该反应方程式为4H2+CO22H2O+CH4,反应中甲和乙的分子个数比为4:1.
(4) 因为对于长期飞行来说,大量的消耗品均由地面带上或送上天,其运行成本是十分昂贵的,所以通过方式2能够实现水的循环、氧气的循环,帮助维持宇航员日常生活 。
【分析】(1)根据合金的硬度大于纯金属,常温下铝与氧气反应生成氧化铝分析;
(2)根据化学反应前后原子种类和个数不变,反应中一种单质和一种化合物属于置换反应分析;
(3)根据氢氧化锂与二氧化碳反应生成物是碳酸锂和水,由微观图示确定反应方程式,由此确定反应的分子个数比分析;
(4)根据两个方案的成本及转化方式分析;
(5)根据生成氧气的质量及方程式中物质间质量关系计算水的质量分析。
试题分析部分
1、试卷总体分布分析
总分:60分
分值分布 客观题(占比) 14.0(23.3%)
主观题(占比) 46.0(76.7%)
题量分布 客观题(占比) 7(50.0%)
主观题(占比) 7(50.0%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 7(50.0%) 14.0(23.3%)
非选择题 7(50.0%) 46.0(76.7%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (64.3%)
2 容易 (14.3%)
3 困难 (21.4%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 单质和化合物 2.0(3.3%) 5
2 化学实验方案设计与评价 2.0(3.3%) 6
3 酸的化学性质 2.0(3.3%) 7
4 化学方程式的书写与配平 14.0(23.3%) 8,13
5 物质的名称与俗名 2.0(3.3%) 4
6 溶液的酸碱度测定 2.0(3.3%) 2
7 铵态氮肥的检验 2.0(3.3%) 7
8 化学式的书写及意义 8.0(13.3%) 4,12
9 物质的相互转化和制备 2.0(3.3%) 7
10 合金与合金的性质 14.0(23.3%) 6,14
11 完全燃烧与不完全燃烧 4.0(6.7%) 10
12 物理变化、化学变化的特点及其判别 2.0(3.3%) 3
13 物质发生化学变化时的能量变化 2.0(3.3%) 1
14 元素周期表的特点及其应用 6.0(10.0%) 9
15 物质的元素组成 6.0(10.0%) 9
16 二氧化碳的实验室制法 6.0(10.0%) 12
17 微粒观点及模型图的应用 20.0(33.3%) 5,9,14
18 气体反应装置的选取 7.0(11.7%) 13
19 根据化学反应方程式的计算 14.0(23.3%) 5,14
20 置换反应及其应用 12.0(20.0%) 14
21 从组成上识别氧化物 7.0(11.7%) 8
22 中和反应及其应用 7.0(11.7%) 8
23 质量守恒定律及其应用 12.0(20.0%) 14
24 酸碱盐的溶解性 2.0(3.3%) 6
25 自然界中的物质循环 2.0(3.3%) 1
26 常见金属的冶炼方法 4.0(6.7%) 10
27 物质的简单分类 7.0(11.7%) 8
28 金属活动性顺序及其应用 6.0(10.0%) 6,10
29 原子结构示意图与离子结构示意图 6.0(10.0%) 9
30 盐的化学性质 2.0(3.3%) 7
31 燃烧与燃烧的条件 7.0(11.7%) 13
32 分子、原子、离子、元素与物质之间的关系 2.0(3.3%) 5
33 碱的化学性质 2.0(3.3%) 7
34 化合价与离子表示方法上的异同点 6.0(10.0%) 12
35 物质的三态及其转化 2.0(3.3%) 1
36 溶液的酸碱性与pH值的关系 7.0(11.7%) 8
37 实验室常见的仪器及使用 7.0(11.7%) 13
38 一氧化碳的化学性质 2.0(3.3%) 6
39 固体溶解度曲线及其作用 4.0(6.7%) 11
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
