课题3二氧化碳和一氧化碳(复习) 课件
文档属性
| 名称 | 课题3二氧化碳和一氧化碳(复习) 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-03 00:00:00 | ||
图片预览









文档简介
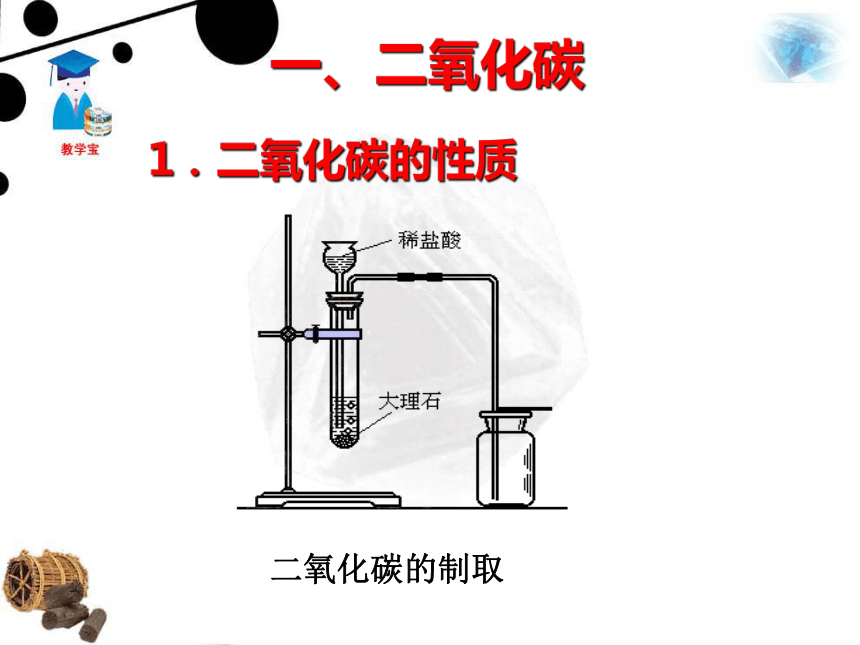
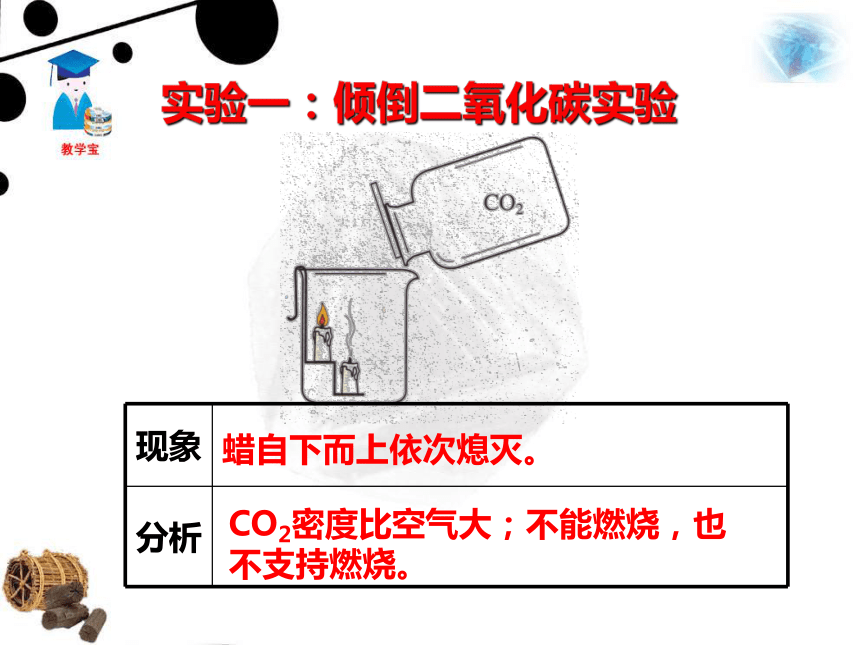
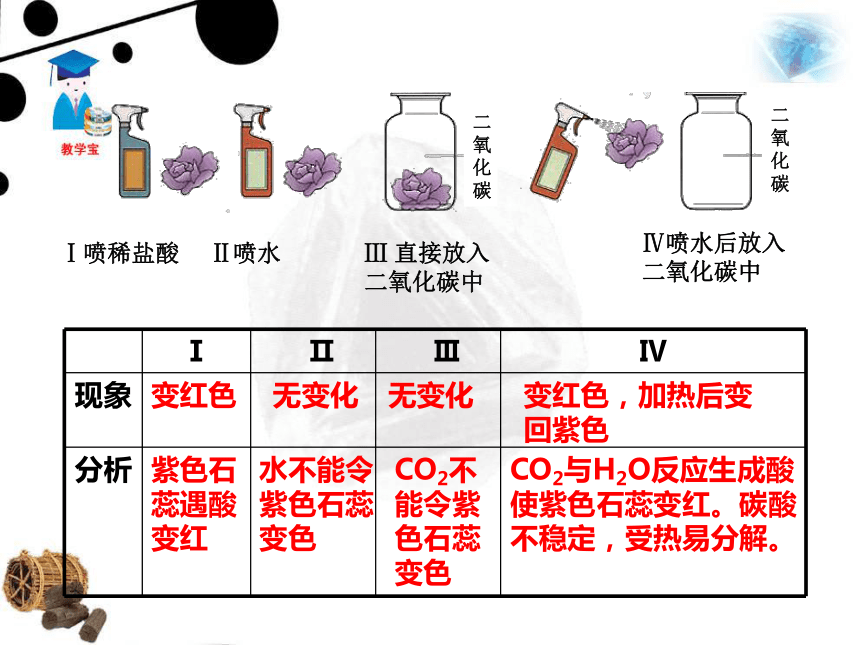
课件42张PPT。一、二氧化碳二氧化碳的制取1.二氧化碳的性质蜡自下而上依次熄灭。CO2密度比空气大;不能燃烧,也不支持燃烧。实验一:倾倒二氧化碳实验 向一个收集满二氧化碳气体的塑料瓶中加入一定体积的水,立即盖上瓶盖。 塑料瓶变瘪了。瓶里压强减小,证明二氧化碳溶于水。 思考:我们平时打开汽水或啤酒盖时,常有大量的气体产生,这是什么气体呢?这是利用哪一点性质呢? 气体是二氧化碳,在通常状况下,1体积的水大约能溶解1体积的二氧化碳,增大压强还会溶解得更多。生产汽水、可乐等碳酸型饮料就是利用了二氧化碳的这一性质。实验二:二氧化碳与水的反应实验 取四朵用石蕊溶液染成紫色的干燥的纸花,第一朵纸花喷上稀醋酸,第二朵纸花喷上水,第三朵纸花直接放入盛满二氧化碳的集气瓶中,第四朵纸花喷上水后,再放入盛满二氧化碳的集气瓶中,观察四朵纸花的颜色变化,将第四朵纸花取出,小心烘烤。变红色无变化紫色石蕊遇酸变红水不能令紫色石蕊变色无变化CO2不能令紫色石蕊变色变红色,加热后变回紫色CO2与H2O反应生成酸使紫色石蕊变红。碳酸不稳定,受热易分解。Ⅰ喷稀盐酸 Ⅱ喷水Ⅳ喷水后放入二氧化碳中Ⅲ 直接放入二氧化碳中CO2 + H2O == H2CO3 H2CO3 == H2O + CO2↑①二氧化碳与水生成碳酸。 ② 碳酸很不稳定,容易分解成二氧化碳和水。碳酸能使紫色的石蕊试液变成红色。 怎么证明人呼出的气体中含有CO2? 向澄清的石灰水中吹气,石灰水变浑浊。 CO2能与澄清石灰水中的氢氧化钙发生化学反应,生成白色的碳酸钙沉淀。
CO2+Ca(OH)2=CaCO3↓+H2O
(检验CO2的方法)干冰的介绍 在一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫 “干冰”。干冰奇妙的干冰干冰的作用③舞台烟幕
升华时产生大量的烟雾①人工降雨
升华时吸收大量的热量②保存食物
升华时使周围温度降低CO2气体无色液体雪花状固体干冰加压
降温降温压缩101kPa
-78.5℃升华二氧化碳和干冰的转化二氧化碳的物理性质 ①通常情况下,无色、无味的气体。
②能溶于水(1:1),增大压强还会溶解更多,不能用排水法收集。
③二氧化碳的密度比空气大,在标准状况下密度为1.977g/L,约是空气的1.5倍。
④二氧化碳无毒,但不能供给动物呼吸,是一种窒息性气体。
⑤二氧化碳的固体——干冰升华吸热。 ②与水反应生成不稳定的碳酸。 CO2+H2O=H2CO3 碳酸不稳定,易分解,加热时分解更快。
H2CO3=CO2↑+H2O③与石灰水的反应 CO2+Ca(OH)2=CaCO3↓+H2O(利用此反应可鉴定二氧化碳气体)①不能燃烧,也不支持燃烧。二氧化碳的化学性质二氧化碳的用途2.二氧化碳对生活和环境的影响 ①光合作用的原料。
②气体肥料。
③灭火: CO2不支持燃烧,不能燃烧,且比空气重,可用它来灭火。
④干冰升华时吸收大量热,可用它做致冷剂或用于人工降雨。
⑤化工原料:工业制纯碱和尿素等。⑥因为易溶于水,所以可制汽水等碳酸饮料。⑦可用来检验澄清的石灰水。光合作用大棚蔬菜的增长剂灭火器化工产品的原料CO2对人体健康的影响温室效应 大气中的二氧化碳气体能像温室的玻璃或塑料薄膜那样,使地面吸收的太阳光的能量不易散失,从而使全球变暖,这种现象叫“温室效应”。二氧化碳对环境的影响 温室效应的危害
全球变暖可能导致两极的冰川融化,海平面升高,淹没许多城市。
土地沙漠化,农业减产。能产生温室效应的气体 二氧化碳、臭氧、甲烷、氟氯代烷等。 减缓温室效应的措施 节约能源,减少使用煤、石油、天然气等化石燃料;更多地利用太阳能、风能、地热等;大力植树造林,严禁乱砍滥伐森林等。 1.一氧化碳的可燃性 一氧化碳与二氧化碳不同,一氧化碳在空气里能够燃烧生成二氧化碳,燃烧时发出蓝色的火焰。2CO+O2 2CO2二、一氧化碳 无色无味的气体,难溶于水,密度 1.25 g/L(空气的密度1.29g/L)。燃烧的煤炉2CO + O2 == 2CO2点燃CO2 + C == 2CO高温 2C + O2(不充足) == 2CO点燃 C + O2(充足) == CO2点燃 如图所示,向氧化铜中通入一氧化碳,黑色的氧化铜变成了红色的铜,澄清的石灰水变浑浊。CO+CuO Cu+CO22.一氧化碳的还原性一氧化碳的还原机理3.一氧化碳的毒性 一氧化碳有剧毒。这是因为一氧化碳吸进肺里很容易跟血液里的血红蛋白结合,使血红蛋白不能很好地跟氧气结合,造成生物体缺氧。如果吸入较多的一氧化碳,会因缺少氧气而死亡。 预防煤气中毒,应该注意通风排气。 CO和CO2的比较点燃△高温点燃高温无色无味,密度最小,难溶与水无色无味,密度比空气略小,难溶于水大多是黑色固体2H2+O2==
2H2O2CO+O2=2CO2C+O2== CO2CuO+H2==
Cu+H2OCuO+CO==Cu +CO22CuO+C==2Cu+CO2无有剧毒无点燃点燃 点燃点燃加热加热高温2C+O2==2CO CO和H2、C的比较 1.如何除去CO中混有的少量CO2?如何除去CO2中混有的少量CO? 除去CO中混有的少量CO2:通入石灰水或氢氧化钠溶液或通入灼热的碳粉。 除去CO2中混有的少量CO:通入灼热的氧化铜(不能燃烧)。 2.如何鉴别空气、氧气、二氧化碳、一氧化碳、氢气?空气、氧气、二氧化碳、一氧化碳、氢气插入燃着 的木条燃烧 更旺立即 熄灭无明 显变化气体燃烧氧气二氧化碳空气一氧化碳、氢气检验燃 烧产物生成二氧化碳生成水氢气一氧化碳1.二氧化碳的性质 通常情况下,是无色、无臭、无味的气体。能溶于水(1:1),密度比空气大,约是空气的1.5倍。
二氧化碳无毒,是一种窒息性气体,二氧化碳的固体——干冰升华吸热。 二氧化碳与水反应生成不稳定的碳酸。还可以与石灰水的反应用以检验二氧化碳。2.二氧化碳的用途 ①光合作用的原料。
②气体肥料。
③灭火 。
④做致冷剂或用于人工降雨。
⑤化工原料。⑥制汽水等碳酸饮料。⑦可用来检验澄清的石灰水。 3.一氧化碳的性质
物理性质:
无色无味的气体,难溶于水,密度 1.25 g/L(空气的密度1.29g/L)
化学性质:
(1)可燃性
(2)还原性
(3)有毒性2CO+O2 2CO2CO+CuO Cu+CO2 1.CO与H2在性质上的主要区别是( )
A.溶解性 B.可燃性
C.还原性 D.毒性
2.鉴别H2与CO应选择的合理方法是( )
A.闻气味试验毒性
B.点燃看火焰的颜色
C.检验燃烧的产物
D.看能否还原灼热的CuODC 3.水煤气的主要成分是CO与H2的混合气体,下列有关水煤气的说法不正确的是( )
A.可燃烧 B.具有还原性
C.它有毒 D.有特殊的气味
4.下列气体能降低血红蛋白输氧能力的是( )
A.CO2 B.N2 C.CO D.O2DC 1. (1)氧气 (2)二氧化碳 (3)一氧化碳 (4)二氧化碳 氧气
(5)一氧化碳 2CO+O2 2CO2
(6)二氧化碳
Ca(OH)2+CO2 CaCO3+H2O
(7)二氧化碳 CO2+H2O H2CO3
(8)一氧化碳
CuO + CO Cu+CO2
(9)二氧化碳加热点燃 2.CO
3.CO2
4.(1)充满二氧化碳气体的气球在空气中下落。
(2)一定体积二氧化碳与水混合体积减少。
5.收集汽水中的气体通入澄清石灰水,澄清石灰水变浑浊。6.不对 CO不溶于水
7.Ca(OH)2+CO2 CaCO3+H2O
8.CaCO3 CaO+CO2 ↑
CaO+H2O Ca(OH)2
Ca(OH)2+CO2 CaCO3↓+H2O
9.8.8g 高温
CO2+Ca(OH)2=CaCO3↓+H2O
(检验CO2的方法)干冰的介绍 在一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫 “干冰”。干冰奇妙的干冰干冰的作用③舞台烟幕
升华时产生大量的烟雾①人工降雨
升华时吸收大量的热量②保存食物
升华时使周围温度降低CO2气体无色液体雪花状固体干冰加压
降温降温压缩101kPa
-78.5℃升华二氧化碳和干冰的转化二氧化碳的物理性质 ①通常情况下,无色、无味的气体。
②能溶于水(1:1),增大压强还会溶解更多,不能用排水法收集。
③二氧化碳的密度比空气大,在标准状况下密度为1.977g/L,约是空气的1.5倍。
④二氧化碳无毒,但不能供给动物呼吸,是一种窒息性气体。
⑤二氧化碳的固体——干冰升华吸热。 ②与水反应生成不稳定的碳酸。 CO2+H2O=H2CO3 碳酸不稳定,易分解,加热时分解更快。
H2CO3=CO2↑+H2O③与石灰水的反应 CO2+Ca(OH)2=CaCO3↓+H2O(利用此反应可鉴定二氧化碳气体)①不能燃烧,也不支持燃烧。二氧化碳的化学性质二氧化碳的用途2.二氧化碳对生活和环境的影响 ①光合作用的原料。
②气体肥料。
③灭火: CO2不支持燃烧,不能燃烧,且比空气重,可用它来灭火。
④干冰升华时吸收大量热,可用它做致冷剂或用于人工降雨。
⑤化工原料:工业制纯碱和尿素等。⑥因为易溶于水,所以可制汽水等碳酸饮料。⑦可用来检验澄清的石灰水。光合作用大棚蔬菜的增长剂灭火器化工产品的原料CO2对人体健康的影响温室效应 大气中的二氧化碳气体能像温室的玻璃或塑料薄膜那样,使地面吸收的太阳光的能量不易散失,从而使全球变暖,这种现象叫“温室效应”。二氧化碳对环境的影响 温室效应的危害
全球变暖可能导致两极的冰川融化,海平面升高,淹没许多城市。
土地沙漠化,农业减产。能产生温室效应的气体 二氧化碳、臭氧、甲烷、氟氯代烷等。 减缓温室效应的措施 节约能源,减少使用煤、石油、天然气等化石燃料;更多地利用太阳能、风能、地热等;大力植树造林,严禁乱砍滥伐森林等。 1.一氧化碳的可燃性 一氧化碳与二氧化碳不同,一氧化碳在空气里能够燃烧生成二氧化碳,燃烧时发出蓝色的火焰。2CO+O2 2CO2二、一氧化碳 无色无味的气体,难溶于水,密度 1.25 g/L(空气的密度1.29g/L)。燃烧的煤炉2CO + O2 == 2CO2点燃CO2 + C == 2CO高温 2C + O2(不充足) == 2CO点燃 C + O2(充足) == CO2点燃 如图所示,向氧化铜中通入一氧化碳,黑色的氧化铜变成了红色的铜,澄清的石灰水变浑浊。CO+CuO Cu+CO22.一氧化碳的还原性一氧化碳的还原机理3.一氧化碳的毒性 一氧化碳有剧毒。这是因为一氧化碳吸进肺里很容易跟血液里的血红蛋白结合,使血红蛋白不能很好地跟氧气结合,造成生物体缺氧。如果吸入较多的一氧化碳,会因缺少氧气而死亡。 预防煤气中毒,应该注意通风排气。 CO和CO2的比较点燃△高温点燃高温无色无味,密度最小,难溶与水无色无味,密度比空气略小,难溶于水大多是黑色固体2H2+O2==
2H2O2CO+O2=2CO2C+O2== CO2CuO+H2==
Cu+H2OCuO+CO==Cu +CO22CuO+C==2Cu+CO2无有剧毒无点燃点燃 点燃点燃加热加热高温2C+O2==2CO CO和H2、C的比较 1.如何除去CO中混有的少量CO2?如何除去CO2中混有的少量CO? 除去CO中混有的少量CO2:通入石灰水或氢氧化钠溶液或通入灼热的碳粉。 除去CO2中混有的少量CO:通入灼热的氧化铜(不能燃烧)。 2.如何鉴别空气、氧气、二氧化碳、一氧化碳、氢气?空气、氧气、二氧化碳、一氧化碳、氢气插入燃着 的木条燃烧 更旺立即 熄灭无明 显变化气体燃烧氧气二氧化碳空气一氧化碳、氢气检验燃 烧产物生成二氧化碳生成水氢气一氧化碳1.二氧化碳的性质 通常情况下,是无色、无臭、无味的气体。能溶于水(1:1),密度比空气大,约是空气的1.5倍。
二氧化碳无毒,是一种窒息性气体,二氧化碳的固体——干冰升华吸热。 二氧化碳与水反应生成不稳定的碳酸。还可以与石灰水的反应用以检验二氧化碳。2.二氧化碳的用途 ①光合作用的原料。
②气体肥料。
③灭火 。
④做致冷剂或用于人工降雨。
⑤化工原料。⑥制汽水等碳酸饮料。⑦可用来检验澄清的石灰水。 3.一氧化碳的性质
物理性质:
无色无味的气体,难溶于水,密度 1.25 g/L(空气的密度1.29g/L)
化学性质:
(1)可燃性
(2)还原性
(3)有毒性2CO+O2 2CO2CO+CuO Cu+CO2 1.CO与H2在性质上的主要区别是( )
A.溶解性 B.可燃性
C.还原性 D.毒性
2.鉴别H2与CO应选择的合理方法是( )
A.闻气味试验毒性
B.点燃看火焰的颜色
C.检验燃烧的产物
D.看能否还原灼热的CuODC 3.水煤气的主要成分是CO与H2的混合气体,下列有关水煤气的说法不正确的是( )
A.可燃烧 B.具有还原性
C.它有毒 D.有特殊的气味
4.下列气体能降低血红蛋白输氧能力的是( )
A.CO2 B.N2 C.CO D.O2DC 1. (1)氧气 (2)二氧化碳 (3)一氧化碳 (4)二氧化碳 氧气
(5)一氧化碳 2CO+O2 2CO2
(6)二氧化碳
Ca(OH)2+CO2 CaCO3+H2O
(7)二氧化碳 CO2+H2O H2CO3
(8)一氧化碳
CuO + CO Cu+CO2
(9)二氧化碳加热点燃 2.CO
3.CO2
4.(1)充满二氧化碳气体的气球在空气中下落。
(2)一定体积二氧化碳与水混合体积减少。
5.收集汽水中的气体通入澄清石灰水,澄清石灰水变浑浊。6.不对 CO不溶于水
7.Ca(OH)2+CO2 CaCO3+H2O
8.CaCO3 CaO+CO2 ↑
CaO+H2O Ca(OH)2
Ca(OH)2+CO2 CaCO3↓+H2O
9.8.8g 高温
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
